N-(1-亚氨基乙基)乙脒铂配合物合成、结构和性质
2016-07-22朱龙观浙江大学化学系杭州310027
刘 靖 朱龙观(浙江大学化学系,杭州 310027)
N-(1-亚氨基乙基)乙脒铂配合物合成、结构和性质
刘靖朱龙观*
(浙江大学化学系,杭州310027)
摘要:四氯合铂酸钾分别与邻、间、对磺基苯甲酸在乙腈和水中利用水热合成获得了3个铂的N-(1-亚氨基乙基)乙脒配合物[Pt(NIA)2]·(2-sb)·2H2O(1),[Pt(NIA)2]·(3-sb)·3H2O(2)和[Pt(NIA)2]·(1,4-dsb)·2H2O(3)(NIA=N-(1-亚氨基乙基)乙脒,2-sb2-=2-磺基苯甲酸二价阴离子、3-sb2-=3-磺基苯甲酸二价阴离子、1,4-dsb2-=1,4-二磺基苯二价阴离子)。合成过程中发生了乙氰三聚以及4-sb2转变为1,4-dsb2-的反应。对配合物进行了元素分析、红外、紫外、荧光、热重和粉末X射线衍射表征,并利用单晶X射线衍射测定了配合物的晶体结构。3个配合物为阳离子-阴离子物种,阳离子为[Pt(NIA)2]2+,中心金属离子四配位平面构型;阴离子与阳离子、水形成氢键,组成一个三维网络结构,但3个配合物的氢键模式不同。配合物在热稳定性、荧光性质上有一定差异。
关键词:铂配合物;原位合成;晶体结构;N-(1-亚氨基乙基)乙脒;磺基苯甲酸
国家自然科学基金(No.21073157)资助项目。
*通信联系人。E-mail:chezlg@zju.edu.cn;会员登记号:S06N0578M1207。
0 引言
贵金属配合物在光电材料、催化、生物活性等领域有广泛与重要应用[1-3],因此一直吸引众多研究者的持续关注。磺基苯甲酸类(sb)配体具有2个不同功能基团,在配合物结构多样性、溶解性、功能性等方面显示出一些有趣特性,例如银/磺基苯甲酸配合物在常温下乙醇中溶解度较小,但升高到40~50℃具有较大溶解度,因此在催化硫醚氧化反应中形成均相催化,而催化剂可以回用[4]。贵金属磺基苯甲酸配合物在催化硫醚氧化反应方面表现出较大的活性差异,例如银、钌配合物具有优良催化活性[5-6],但钯的活性要差一些[7],铂磺基苯甲酸配合物的催化活性还要差,因此广泛探索贵金属磺基苯甲酸类配合物对于深入探讨结构与性质的关系有一定的意义。在铂磺基苯甲酸配合物的合成探索过程中,发现溶剂乙腈较为容易地发生水解聚合成N-(1-亚氨基乙基)乙脒(NIA);乙腈发生原位反应的例子已有报道(从CSD检索到5例),但贵金属配合物中乙腈原位反应还比较少,Pt的NIA配合物只报道过一例[8]。本文报道3个发生溶剂和酸性配体原位反应的铂配合物结构和性质,这些化合物为[Pt(NIA)2]· (2-sb)·2H2O(1),[Pt(NIA)2]·(3-sb)·3H2O(2)和[Pt(NIA)2]·(1,4-dsb)·2H2O(3),NIA为N-(1-亚氨基乙基)乙脒、2-sb2-为2-磺基苯甲酸二价阴离子、3-sb2-为3-磺基苯甲酸二价阴离子、1,4-dsb2-为1,4-二磺基苯二价阴离子。
1 实验部分
1.1试剂
2-磺基苯甲酸 (2-H2sb)、3-磺基苯甲酸钠(3-NaHsb)、4-磺基苯甲酸钾(4-KHsb)、四氯合铂酸钾、六次甲基四胺、甲醇、乙醇、乙腈和二甲基甲酰胺(DMF)均为分析纯。
1.2测试仪器
红外光谱测试使用Nicolet Nexus 470傅立叶变换红外光谱仪,KBr压片,扫描范围400~4 000 cm-1,分辨率1 cm-1。元素分析采用Perkin-Elmer 1110型元素分析仪。热重测试采用Delta TA-SDT Q600热分析仪,氮气气氛,升温速率为10℃·min-1,测试范围室温~800℃,Al2O3坩埚。紫外光谱测定使用SPECORD 2000光谱仪,室温测定。固体荧光测定使用岛津F-2500荧光波谱测定仪,室温测定。粉末X射线衍射实验使用UltimaⅣ型X射线衍射分析仪,Cu Kα射线,波长0.150 4 nm。晶体结构测定采用Gemini A Ultra单晶衍射仪。
1.3配合物合成
1.3.1[Pt(NIA)2]·(2-sb)·2H2O(1)的合成
将含四氯合铂酸钾 (0.026 g,0.063 mmol)、2-H2sb(0.05 g,0.250 mmol)、六次甲基四胺(0.017 g,0.125 mmol)、7.5 mL乙腈、7.5 mL H2O的混合物加入到容积为30 mL的特氟隆管中,密闭在不锈钢釜中,置于150℃的烘箱中,反应1 d;反应结束后冷却至室温过滤,得到浅黄色澄清液体;将溶液静置约30 d,获得浅棕色颗粒状晶体。溶解性:溶于水、甲醇,不溶于乙醇、乙腈和DMF。产率:32.8%。化学式:C30H52N12O14Pt2S2,元素分析理论计算值 (%):C,28.62;H,4.16;N,13.35。实验值(%):C,28.80;H,4.18;N,13.35。IR(KBr压片,cm-1):3 452(s),3 236(s),2 928 (s),1 666(s),1 577(s),1 547(s),1 395(m),1 273(m),1 209(m),1 185(s),1 087(m),1 019(s),776(w),732w (s),617(s)。
1.3.2[Pt(NIA)2]·(3-sb)·3H2O(2)的合成
2的合成与1类似,只是将2-H2sb换为3-NaHsb(0.056 g,0.250 mmol),四氯合铂酸钾用量改为0.052 g(0.125 mmol),得橙黄色棒状晶体。溶解性:溶于水、甲醇,不溶于乙醇、乙腈和DMF。产率:31.9%。化学式:PtC15H28O8N6S,元素分析理论计算值(%):C,27.82;H,4.36;N,12.98。实验值(%):C,27.74;H,4.46;N,13.01。IR(KBr压片,cm-1):3 436(s),3 224 (m),2 987(m),1 662(s),1 597(m),1 546(m),1 423(m),1 384(s),1 272(m),1 226(m),1 189(m),1 100(m),1 034(s),770(m),675(m),614(m)。
1.3.2[Pt(NIA)2]·(1,4-dsb)·2H2O(3)的合成
将含四氯合铂酸钾 (0.026 g,0.063 mmol),4-KHsb(0.045 g,0.188 mmol),10 mL乙腈,5 mL H2O的混合物加入到容积为30 mL的特氟隆管中,密闭在不锈钢釜中,置于150℃的烘箱中,反应1 d;反应结束后冷却至室温过滤,得到淡黄色澄清液体;将溶液静置约10 d,得淡黄色针状晶体。或者将液体密封在反应釜内冷却1 d,反应釜中会出现淡黄色针状晶体。溶解性:溶于水、甲醇,不溶于乙醇、乙腈和DMF。产率:37.9%。化学式:PtC14H26O8N6S2,元素分析理论计算值 (%):C,25.26;H,3.94;N,12.63。实验值(%):C,25.11;H,4.16;N,12.55。IR(KBr压片,cm-1):3 413(s),3 258(m),2 902(m),1 667(s),1 588(m),1 546(m),1 390(s),1 274(s),1 221(s),1 184(s),1 118(m),1 031(s),1 009(s),783(m),739(m),629(m)。
对配合物2和3进行了粉末X射线衍射测定(见补充材料),结果表明粉末衍射图与从单晶数据给出的模拟衍射图基本一致 (用Mercury软件计算模拟图),强度与衍射位置很小的差异是由于粉末样品的择优取向造成的。
1.4晶体结构测定
选取合适大小的单晶置于单晶衍射仪上,用经石墨单色器单色化的Mo Kα射线(λ=0.071 073 nm)、以φ~ω扫描方式于293(2)K下收集单晶衍射数据。数据还原采用SAINT软件[9],全部强度数据均经Lp因子校正,并进行了经验吸收校正,晶体结构解析采用SHELXTL-97[10]。用重原子法确定Pt,再通过差值Fourier方法确定其它非氢原子。非氢原子坐标和各向异性温度因子采用全矩阵最小二乘法修正。配合物1中溶剂与羧基有无序现象,利用PLATON软件[11]对数据进行了Squeeze处理。配合物2和3中水上的氢从Fourier图上找出;配合物1~3中其它氢均采用理论加氢。数据处理与画图采用WinGX和Ortep程序包[12]。详细晶体学数据见表1。
CCDC:1469755,1;1469756,2;1469757,3。

表1 配合物1的晶体学数据Table 1 Crystallographic data and refinement parameters for complexes 1~3

表2 配合物1~3中的键长(nm)及键角(°)Table 2 Bonds lengths(nm)and angles(°)for complexes 1~3

续表2
2 结果与讨论
2.1关于合成
对配合物合成进行了较为广泛的探索,但铂类配合物合成所能用的金属盐起始原料选择十分有限,空气条件下对溶剂的广泛实验只找到乙腈和H2O溶剂体系,使用其它溶剂要么得不到晶体产物、要么析出金属铂。在溶剂热合成过程中,乙腈在反应体系中既是溶剂也是反应物。反应过程中,含氮弱碱性配体有重要作用:对于配合物1,若不加入六次甲基四胺,只能生成白色棉絮状物质,六次甲基四胺的加入可获得质量较好的晶体产物;对于配合物2,不加入六次甲基四胺,无任何产物,加入六次甲基四胺可获得质量较好的晶体产物。

图1 配合物1中的阳离子[Pt(NIC)2]2+结构Fig.1 ORTEP view of the cation of[Pt(NIA)2]2+in complex 1

图2 配合物2的分子结构Fig.2 ORTEP view of the molecular structure of complex 2
2.2晶体结构描述
3个配合物都具有阳离子-阴离子特征,阳离子都为[Pt(NIA)2]2+。配合物1的不对称单元含有2个[Pt(NIA)2]2+,2个2-sb2-阴离子和4个水分子,但2个阳离子中的Pt-N键长接近,比已报道的一个Pt化合物中的Pt-N键长稍长[8],阳离子Pt2+均具有四配位平面构型;配合物中的NIA配体是由乙腈三聚形成(图1)。配合物2中的1个不对称单元含有1个阳离子[Pt(NIA)2]2+,1个3-sb2-阴离子和3个晶格水分子(图2)。配合物3的不对称单元含有半个[Pt(NIC)2]2+阳离子,半个1,4-dsb2-阴离子和一个晶格水分子(图3)。
3个配合物中出现的原位合成配体NIA易与金属形成螯合配位;而环状3,5-二甲基-4H-1,2,4-三唑的2个邻位氮由于距离过短无法采用与金属螯合型配位模式,一般与2个金属桥联或单齿配位(图4)。配合物3合成过程中4-sb2-在水热条件下转变为1,4-dsb2-,因此配合物3中的2个配体NIA和1,4-dsb2-都是原位合成的。4-sb2-在水热条件下有金属存在时转变为1,4-dsb2-最早由熊仁根等报道[13];我们在银磺基苯甲酸配合物合成过程中也出现过1,4-dsb2-的原位反应[14]。

图3 配合物3的分子结构Fig.3 ORTEP view of the molecular structure of complex 3
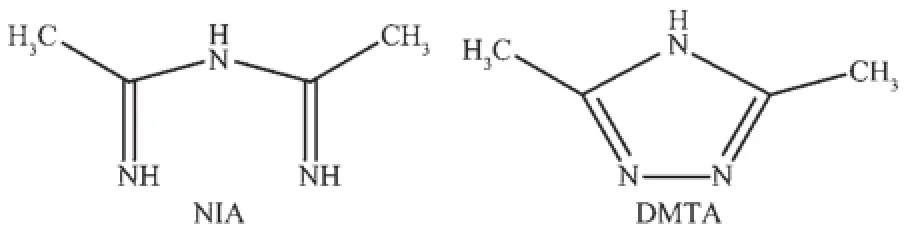
图4 配体N-(1-亚氨基乙基)乙脒和3,5-二甲基-4H-1,2,4-三唑的结构Fig.4 Structures of ligands of N-(1-iminoethyl)acetamidine and 3,5-dimethyl-4H-1,2,4-triazole
3个配合物中虽然没有芳环堆积效应,但都有丰富的氢键存在,这是因为磺基苯甲酸具有多个氢键受体与授体;N-(1-亚氨基乙基)乙脒亦有多个氢键授体,再加上晶格水分子的存在,使配合物形成大量氢键。在3个配合物中,阳离子与水、磺基苯甲酸(或1,4-二磺基苯)形成氢键,磺基苯甲酸(或1,4-二磺基苯)与水、阳离子形成氢键,扩展成三维结构。但具体模式有明显差异,配合物1中 (使用未Squeeze的结构),每个阳离子只与1个水分子形成氢键;配合物2中,每个阳离子与3个水分子形成氢键;而配合物3中,每个阳离子与2个水分子形成氢键。
2.3配合物的红外光谱
配合物1~3红外光谱中,2 900~3 500 cm-1区域出现了多个强、宽峰,对应乙腈三聚形成的N-(1-亚氨基乙基)乙脒配体中的N-H伸缩振动以及结晶水中的O-H伸缩振动吸收峰。3个配合物在1 700 cm-1附近均无吸收峰,表明配合物1~2中磺基苯甲酸的羧基完全脱氢,磺基苯甲酸作为负二价的抗衡离子存在于结构中;配合物3已不存在羧基,故没有相应吸收峰。配合物1中的1 547和1 395 cm-12中的1 546和1 384 cm-1吸收峰分别为羧基的对称和不对称伸缩振动吸收峰。磺酸基的不对称伸缩振动吸收峰,在配合物1中为1 209、1 185、1 087 cm-1;在配合物2中为1 226、1 189、1 100 cm-1;在配合物3中为1 221、1 184、1 118 cm-1;而磺酸基的对称伸缩振动吸收峰在配合物1,2和3中分别为1 019、1 034和1 031 cm-1。配合物1~3中都有与N (1-亚氨基乙基)乙脒配体的3个特征峰对应的吸收峰:~1 666、~1 273和~775 cm-1。
2.4配合物的热重分析
3个配合物的失重曲线类似(图5)。配合物1,从室温到120℃失重6.4%,与失去2个晶格水的理论计算值6.1%一致;338℃配合物开始分解。配合物2,从室温到127℃失重8.1%,与失去3个晶格水的理论计算值8.3%一致;301℃配合物2开始分解配合物3,从室温到152℃失重6.3%,与失去2个晶格水的理论计算值5.4%相符;308℃配合物开始分解。从热重分析看出,3个配合物失去晶格水的温度以配合物3为最高、配合物1最低;分解温度以配合物1最高、配合物2最低。
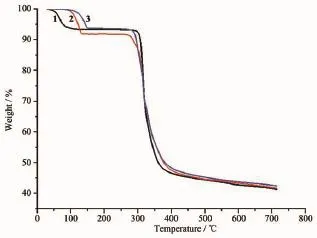
图5 配合物1~3的热重曲线Fig.5 TG curves of complexes 1~3
2.5配合物的紫外光谱分析
配合物1~3在水中的紫外光谱见图6,浓度110-5mol·L-1,数据列于表3。配合物1~3的最强紫外吸收波长都在约238 nm处,与磺基苯甲酸较弱的紫外光谱比较,配合物显示的紫外吸收明显与之不同,应该是配体N-(1-亚氨基乙基)乙脒的π-π*跃迁所致。摩尔吸收系数以配合物3为最大,配合物1为最小。

图6 配合物1~3的紫外可见光谱Fig.6 UV-Vis spectra of complexes 1~3

表3 配合物1~3在水中的紫外光谱数据Table 3 Data of UV-Vis spectra for complexes 1~3 in water
2.6配合物的荧光光谱
配合物与配体的固体荧光严格在相同实验条件下测定。从配合物1~3的发射光谱(图7)(λex=234 nm)可以看出,3个配合物在292 nm左右处都有比较弱的峰,这个弱峰与中性配体N-(1-亚氨基乙基)乙脒有关;最强发射波长都在420 nm左右,这主要由磺基苯甲酸或1,4-二磺基苯引起,与酸性配体的发射峰相比均有一定的位移。因实验条件严格保持一致,3个配合物的组成类似,阳离子组成相同,而3个配合物 420 nm左右的发射峰相对强度差异明显,表明不同的磺基苯甲酸对荧光有较大的影响。
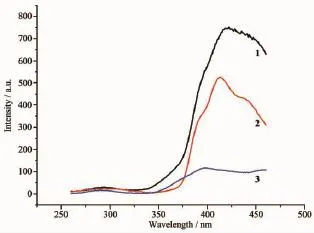
图7 配合物1~3的荧光光谱Fig.7 Fluorescence spectra of complexes 1~3
3 结论
合成了3个N-(1-亚氨基乙基)乙脒铂配合物,这些配合物具有阴离子-阳离子结构形式,存在丰富的氢键,氢键结构为三维。与金属配位的配体N-(1-亚氨基乙基)乙脒由溶剂乙腈三聚形成,配合物3中的1,4-二磺基苯在水热条件下由4-磺基苯甲酸转化而成。这些配合物虽然结构类似,阳离子组成相同,阴离子类似,但在氢键形成模式、热稳定性、荧光发射光谱等方面均有一定的差异。
Supporting information is available at http://www.wjhxxb.cn
参考文献:
[1]Yoshimura M,Tanaka S,Kitamura M.Tetrahedron Lett.,2014,55(27):3635-3640
[2]Ang W H,Khalaila I,Allardyce C S.J.Am.Chem.Soc.,2005,27:1382-1383
[3]Zheng X F,Zhu L G.CrystEngComm,2010,12(10):2878-2884
[4]Ma A Q,Zhu L G.RSC Adv.,2014,4(28):14691-14699
[5]Hu W T,Zhu L G.J.Coord.Chem.,2013,66(17):3045-3057
[6]HU Wen-Ting(胡文婷),ZHU Long-Guan(朱龙观).Chinese J.Inorg.Chem.(无机化学学报),2013,29(6):1109-1114
[7]Tang X L,Ma A Q,Cai G Q,et al.J.Coord.Chem.,2014,67:449-460
[8]Gushchin P V,Tyan M R,Bokach N A,et al.Inorg.Chem.,2008,47:11487-11500
[9]SAINT,version 6.02a,Bruker AXS Inc.,Madison,WI,2002.
[10]Sheldrick G M.SHELXL-97,Program for Crystal Structure Refinement,University of Göttingen,Göttingen,Germany,1997.
[11]Spek A L.Acta Crystallogr.,2009,D65:148-155
[12]Farrugia L.J.Appl.Crystallogr.,1999,32:837
[13]Yuan R X,Xiong R G,Xie Y L,et al.Inorg.Chem.Commun.,2001,4(8):384-387
[14]Zheng X F,Zhu L G.Polyhedron,2011,30(4):666-675
中图分类号:O614.82+6
文献标识码:A
文章编号:1001-4861(2016)05-0833-06
DOI:10.11862/CJIC.2016.110
收稿日期:2016-02-21。收修改稿日期:2016-03-30。
Syntheses,Crystal Structures and Properties of N-(1-iminoethyl)acetamidine Platinum Complexes
LIU JingZHU Long-Guan*
(Department of Chemistry,Zhejiang University,Hangzhou 310027,China)
Abstract:Three N-(1-iminoethyl)acetamidine platinum complexes,[Pt(NIA)2]·(2-sb)·2H2O(1),[Pt(NIA)2]·(3-sb)· 3H2O(2)and[Pt(NIA)2]·(1,4-dsb)·2H2O(3)(NIA=N-(1-iminoethyl)acetamidine,2-sb2-=2-sulfobenzoate,3-sb2-=3 sulfobenzoate,1,4-dsb2-=1,4-disulfobenzene),were synthesized in CH3CN and H2O under hydrothermal condition using K2PtCl4and sulfobenzoates(o-,m-,p-).During the synthetic process the CH3CN was polymerized into N-(1 iminoethyl)acetamidine and the 4-sulfobenzoate was converted into 1,4-disulfobenzene.These complexes were well characterized by elemental analysis,IR,UV-Vis,fluorescence spectra,thermal and powder X-ray analysis The single-crystal X-ray determination showed that complexes 1~3 have cation-anion species and the cation consists of[Pt(NIA)2]2+in which the Pt2+accepts a four-coordinated planar geometry.Abundant hydrogen bonds among cations,anions and lattice water molecules extend the structures into three-dimensional networks,while the pattern modes of hydrogen-bonding are different in complexes 1~3.Moreover,there are some differences in the thermal stability and fluorescence properties for three complexes.CCDC:1469755,1;1469756,2;1469757,3.
Keywords:platinum complex;in situ synthesis;crystal structure;N-(1-iminoethyl)acetamidine;sulfobenzoate
