MT01/PEN复合物对人成骨样细胞MG63表达骨保护蛋白和核因子κB受体活化因子配体的影响
2016-07-22崔野郑义申玉芹侯旭娄译心孙新华
崔野郑义申玉芹侯旭娄译心孙新华
1.吉林大学口腔医院正畸科;2.吉林省牙发育及颌骨重塑与再生重点实验室;3.吉林大学口腔医院牙周病科,长春 130021
MT01/PEN复合物对人成骨样细胞MG63表达骨保护蛋白和核因子κB受体活化因子配体的影响
崔野1,2郑义3申玉芹3侯旭1娄译心1孙新华1
1.吉林大学口腔医院正畸科;2.吉林省牙发育及颌骨重塑与再生重点实验室;3.吉林大学口腔医院牙周病科,长春 130021
[摘要]目的 应用聚乙烯亚胺阳离子聚合物(PEN)载体装载寡脱氧核苷酸MT01,制备MT01/PEN复合物,检测该复合物对人成骨样细胞MG63表达骨保护蛋白(OPG)和核因子κB受体活化因子配体(RANKL)的影响。方法制备3种不同配比的MT01/PEN(质量比分别为1∶2、1∶4、1∶6)复合物,以全硫代化修饰MT01(MT01-s)和未修饰的MT01作阳性对照,分别转染MG63细胞。采用酶联免疫吸附测定法和real-time聚合酶链反应法分别检测培养24、48、72 h时各组上清液及细胞内OPG和RANKL的表达水平。结果 经MT01/PEN复合物转染后,上清液及细胞内OPG表达水平均升高(P<0.05);多数组中RANKL表达水平降低,而OPG/RANKL比值呈升高趋势(P<0.05);不同质量配比的MT01/PEN均对MG63细胞的成骨具有影响,其中质量比为1∶6时作用最明显。结论 应用PEN作为基因载体装载MT01可增强MT01对MG63细胞的促成骨作用。
[关键词]人成骨样细胞MG63; 寡脱氧核苷酸MT01; 聚乙烯亚胺阳离子聚合物; 骨保护蛋白; 核因子κB受体活化因子配体
寡脱氧核苷酸(oligodeoxynucleotides,ODN)是一类单链DNA分子[1]。研究[2-4]发现,一种依据人线粒体DNA设计合成命名为MT01的ODN具有促进成骨细胞骨向分化的作用,并可促进骨髓间充质干细胞向成骨细胞分化[5];体内实验[6]发现,MT01对大鼠正畸牙移动具有抑制作用。
未经修饰的ODN易被核酸酶降解, 细胞摄取率低。为了增强ODN的稳定性,多采用硫代修饰的手段对其进行化学处理,但ODN表面的负电荷影响修饰效果且化学修饰具有毒副作用[1]。近年来,纳米技术的发展为解决ODN的传递问题提供了新策略。聚乙烯亚胺阳离子聚合物(N-isopropylacrylamidemodified polyethylenimines,PEN)是聚乙烯亚胺(polyethylenimine,PEI)的衍生物,具有毒性低且装载效率高等优势[7]。研究[8]证实,PEN能够有效装载MT01,构建MT01/PEN传输体系。本研究拟通过检测MT01/PEN复合物对人成骨样细胞MG63中骨保护蛋白(osteoprotegerin,OPG)和核因子κB受体活化因子配体(receptor activator of nuclear factor κB ligand,RANKL)表达水平的影响,探讨MT01/PEN传输体系在增强MT01成骨方面的作用机制。
1 材料和方法
1.1 主要试剂与设备
人成骨样细胞MG63(吉林大学口腔医院口腔生物医学工程重点实验室提供);MT01及全硫代修饰物MT01-s(5’-ACCCCCTCTACCCCCTCTACCCCCTCT-3’,吉林大学基础医学院分子生物学教研室设计,大连TaKaRa公司合成),PEN(吉林大学生命科学学院提供);高糖DMEM培养基(Hyclone公司,美国),胎牛血清(fetal bovine serum,FBS)(PAA公司,奥地利);OPG/RANKL酶联免疫吸附测定(enzyme-linked immunosorbent assay,ELISA)试剂盒(RD公司,美国),组织细胞总RNA抽提试剂盒(广州Magen公司),逆转录试剂盒(成都福际生物技术有限公司),real-time 聚合酶链反应(poly-merase chain reaction,PCR)试剂盒(大连TaKaRa公司)。CO2恒温细胞培养箱(Sanyo公司,日本),倒置相差显微镜(Olympus公司,日本),NanoDrop 2000 分光光度计(Thermo Scientific公司,美国),酶标检测仪(Rayto公司,美国)。
1.2 方法
1.2.1 MG63细胞培养 选用状态良好,融合度为80%~90%的MG63细胞,以每孔5×105个细胞的密度接种于6孔板,加高糖DMEM培养基(含10%FBS),在37 ℃,5%CO2恒温细胞培养箱中孵育24 h。
1.2.2 合成MT01/PEN载体复合物 将MT01和PEN分别用无菌PBS(pH值为7.4)溶解并稀释至0.1 g·L-1,分别按溶质质量比1∶2、1∶4、1∶6混合均匀,室温静置组装30 min,待用。
1.2.3 转染MT01/PEN载体复合物至MG63细胞 取孵育24 h的MG63细胞,弃液,PBS溶液冲洗2次,分别取PEN(0.1 g·L-1)60 µL、MT01(0.1 g·L-1)10 µL、MT01-s(0.1 g·L-1)10 µL、MT01/PEN载体复合物(溶质质量比1∶2、1∶4、1∶6)30、50、70 µL及PBS(空白对照),补齐至70 µL后分别加入6孔板中,加高糖DMEM培养基(不含FBS)补至2 mL(各孔MT01终质量浓度0.5 μg·mL-1),与MG63细胞共同孵育4 h,弃液,加高糖DMEM培养基(含10%FBS),继续孵育24、48和72 h。各实验组均设3复孔。
1.2.4 检测OPG和RANKL蛋白的表达水平 应用ELISA试剂盒,分别检测培养24、48和72 h的MG63细胞中OPG和RANKL蛋白的表达情况,加样如下(设3复孔):空白对照孔,不加任何试剂;标准品孔,加入标准品50 μL、链霉亲和素-辣根过氧化物酶50 μL;待测样品孔,加入各实验组上清液40 μL、抗OPG或RANKL抗体10 μL、链霉亲和素-辣根过氧化物酶50 μL。450 nm波长下检测各孔吸光度A值,根据标准品质量浓度及对应的A值计算标准曲线直线回归方程,依据样品A值计算对应样品的质量浓度。
1.2.5 检测OPG和RANKL mRNA的表达水平 吸弃6孔板中上清液,PBS冲洗,每孔加入300 μL胰酶消化,高糖DMEM培养基(含10%FBS)终止后离心收集细胞。采用HiPure Total RNA试剂盒提取各组细胞内的总RNA,通过NanoDrop 2000分光光度计对总RNA样品质量浓度和纯度进行检测,结果显示:RNA样品量充足,OD260/OD280值在1.8~2.1之间。采用RT EasyTMⅡ试剂盒行逆转录合成cDNA。应用real-time PCR试剂盒检测培养24、48、72 h的MG63细胞内OPG和RANKL的mRNA表达水平。引物序列见表1,以甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)作为内参照。

表 1 引物序列Tab 1 Primer sequences
1.2.6 统计学分析 采用SPSS 17.0统计软件进行分析,组间比较采用t检验,检验水准为双侧α=0.05。
2 结果
2.1 MT01/PEN复合物对MG63细胞上清液中OPG和RANKL蛋白表达的影响
MG63细胞上清液中OPG蛋白的表达水平见图1。PEN组OPG蛋白表达水平在各时间点与空白对照组相比均无明显差异(P>0.05)。培养24 h时,MT01-s组、MT01/PEN复合物1∶4和1∶6组的OPG蛋白表达水平较高,明显高于空白对照组(P<0.01),而MT01/PEN复合物1∶4和1∶6组亦高于MT01-s组(P<0.05)。培养48 h时,MT01-s组、MT01/PEN复合物1∶2组OPG蛋白表达水平较高,明显高于空白对照组(P<0.01);培养72 h时,MT01/PEN复合物1∶6组的OPG蛋白表达量降低,低于空白对照组(P<0.01)。
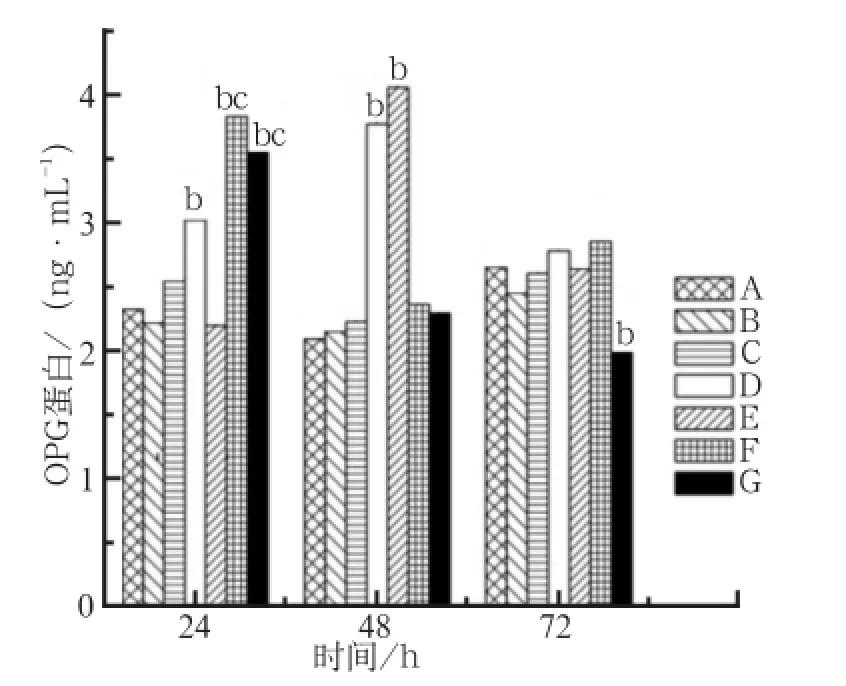
图 1 转染MG63细胞24、48、72 h后各组上清液中OPG蛋白的表达水平Fig 1 OPG protein expression levels of MG63 transfected for 24,48, 72 h in various groups
MG63细胞上清液中RANKL蛋白的表达水平见图2。培养24 h时,MT01-s组和MT01/PEN复合物1∶6组的RANKL蛋白表达水平较空白对照组降低(P<0.05),其中MT01/PEN复合物1∶6组明显低于MT01-s组(P<0.01)。培养48 h时,MT01/PEN复合物1∶2组的表达量降低,明显低于空白对照组(P<0.01)。培养72 h时,MT01组,MT01-s组,MT01/PEN复合物1∶2、1∶4、1∶6组的表达均低于空白对照组(P<0.01),其中MT01/PEN复合物1∶2组低于MT01-s组(P<0.05)。PEN组在各时间点的表达量均无明显变化(P>0.05)。
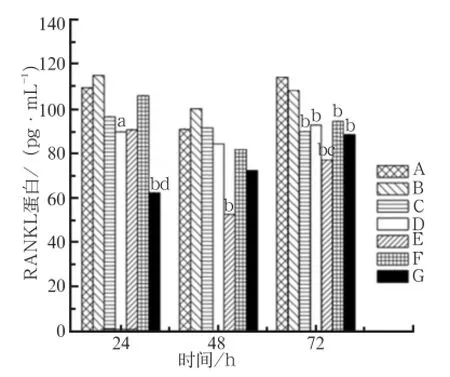
图 2 转染MG63细胞24、48、72 h后各组上清液中RANKL蛋白的表达水平Fig 2 RANKL protein expression levels of MG63 transfected for 24, 48, 72 h in various groups
将OPG/RANKL的比值进行比对,结果见图3。24 h时,MT01组,MT01-s组,MT01/PEN复合物1∶4和1∶6组的OPG/RANKL值较空白对照组升高,其中MT01/PEN复合物1∶6组明显高于MT01-s组(P<0.05)。培养48 h和72 h时,MT01-s组、MT01/ PEN复合物1∶2和1∶4组OPG/RANKL值较空白对照组明显升高,其中MT01/PEN复合物1∶2组在培养48 h时明显高于MT01-s组(P<0.05)。PEN组OPG/RANKL值在3个时间点均没有明显变化(P>0.05)。

图 3 各组OPG/RANKL值Fig 3 OPG/RANKL values in various groups
2.2 MT01/PEN复合物对MG63细胞内OPG和RANKL mRNA表达的影响
MG63细胞内OPG mRNA表达水平见图4。与空白对照组和MT01-s组相比,MT01/PEN复合物1∶2、1∶4、1∶6组在培养48、72 h时,除1∶2组在48 h 的OPG mRNA表达水平低于MT01-s组外,其余组别均升高(P<0.05),且随复合物中PEN配比增高,OPG mRNA表达呈增强趋势;而PEN组在各时间点与空白对照组比较均无明显差异(P>0.05)。
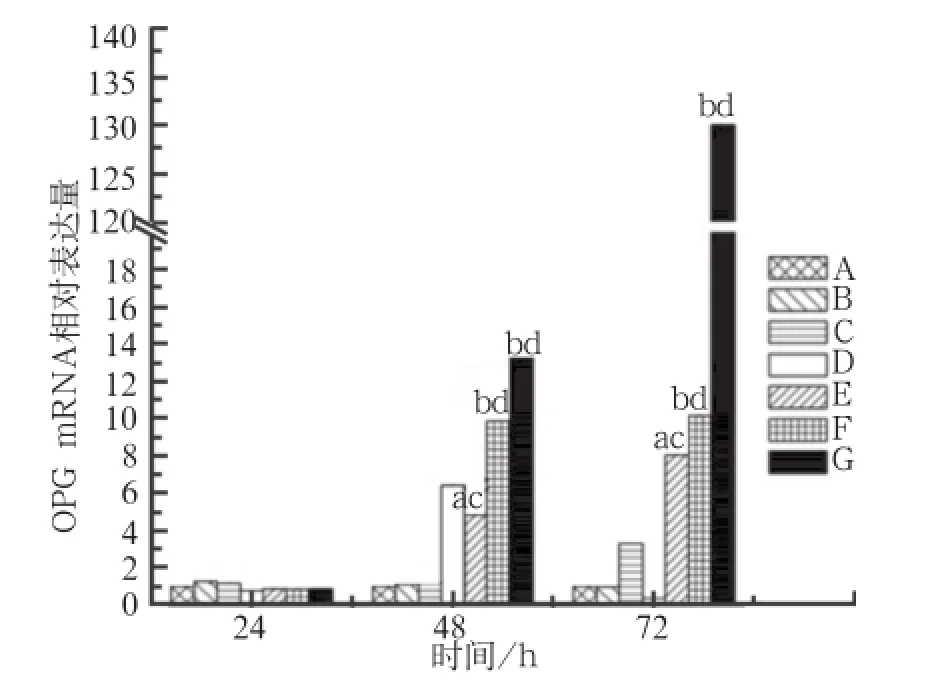
图 4 转染MG63细胞24、48、72 h后,细胞内OPG mRNA的表达水平Fig 4 OPG mRNA expression levels of MG63 transfected for 24,48, 72 h in various groups
MG63细胞内RANKL mRNA表达水平见图5。
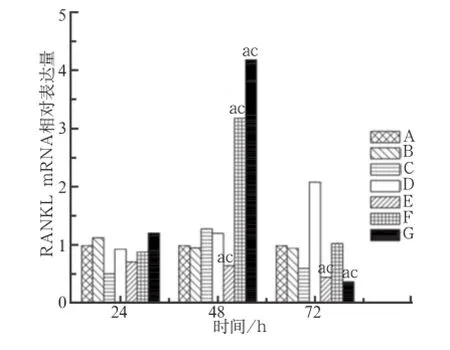
图 5 转染MG63细胞24、48、72 h后,细胞内RANKL mRNA的表达水平Fig 5 RANKL mRNA expression levels of MG63 transfected for 24, 48, 72 h in various groups
由图5可见,在培养48 h时,与空白对照组和MT01-s组相比,MT01/PEN复合物1∶2组表达较低,而1∶4和1∶6组表达较高。在培养72 h时,MT01/ PEN复合物1∶2和1∶6组的表达量较空白对照组和MT01-s组降低(P<0.05)。PEN组在各时间点与空白对照组的差异均无统计学意义(P>0.05)。
3 讨论
OPG是肿瘤坏死因子受体超家族成员,由成骨细胞分泌,作为可溶型诱饵受体,可竞争性地与RANKL结合[9-10]。RANKL是一种Ⅱ型跨膜蛋白,有可溶型和细胞膜整合型两种形式,前者表达于成骨细胞或基质细胞,后者见于T细胞[11]。本实验首先针对上清液中可溶型RANKL进行ELISA检测,评价MG63细胞RANKL蛋白表达水平。成骨细胞所表达的OPG与RANKL的比值决定其对破骨前体细胞的诱导分化能力,其比例协调是维持骨代谢平衡的关键[12]。未成熟的成骨细胞主导破骨形成,RANKL与OPG的比值高,随着成骨细胞的分化成熟,比值逐渐减小,而较成熟的成骨细胞拥有成骨表型,失去对破骨细胞的分化和激活作用[11,13]。本研究结果发现,PEN组中OPG和RANKL蛋白表达水平在3个培养时间点均无明显变化,而随着MT01/PEN复合物中载体PEN配比的增高,OPG/RANKL值出现变化的时间点提前,表明其促成骨作用依次增强。此外MT01-s也表现出了促进成骨的作用,这与本课题组前期研究[3]证实MT01具有促进成骨细胞分化的作用相一致。
为进一步证实在转录水平MT01/PEN复合物对MG63成骨作用的调控作用,本实验通过real-time PCR方法检测细胞内mRNA表达水平,结果表明,PEN组与空白对照组在mRNA表达水平上无明显差异,而随着复合物中PEN配比增高,OPG mRNA表达依次增强。另外本研究发现,两种检测方法的趋势并非在所有时间点都完全吻合,原因在于OPG和RANKL在转录和翻译的过程中,mRNA并不总是翻译成蛋白质,蛋白质的出现也不一定意味着都具有生物学活性,两者合成位置不同,且存在先后顺序及化学修饰的影响,这种空间和时间上的差异不能忽略[14]。虽然48 h时,RANKL mRNA在个别组呈高表达,但其与相应组别的OPG mRAN表达趋势相同,OPG/RANKL值仍较高,表明MG63细胞成骨作用增强。这与ELISA结果中表现出的趋势相一致。在本课题组的前期实验[8]中,已完成MT01/PEN复合物的转染效率和细胞毒性的研究,结果发现,质量比为1∶6的MT01/PEN复合物的转染效率最高,而细胞毒性相对较低,这可以解释1∶6组首先出现OPG 和RANKL表达水平的明显变化,而其他组别出现变化的时间相对较晚的现象。两种不同的检测手段分别在基因水平和蛋白质水平证实了MT01/PEN复合物对MG63细胞成骨作用的提高,且1∶6组对OPG 和RANKL的表达均产生了较强的影响。
本实验通过对OPG和RANKL蛋白和基因表达水平的检测,证实MT01通过与PEN构建传输体系可提高其对MG63细胞的促成骨作用。Tian等[7]利用N-异丙基丙烯酰胺通过Michael加成反应对PEI进行修饰,得到PEI衍生物PEN。PEN不仅保留了PEI原有的“质子海绵”效应[15],同时提高了转染效率,降低了细胞毒性,是一种理想的非病毒载体。应用PEN作为MT01载体,有助于实现MT01对细胞的高效转染和特定功能表达,增强MT01促进成骨的作用。
[参考文献]
[1]Hanagata N. Structure-dependent immunostimulatory effect of CpG oligodeoxynucleotides and their delivery system[J]. Int J Nanomedicine, 2012, 7:2181-2195.
[2]丁子清, 申玉芹, 周岳, 等. 牙周炎患者自身组织核酸刺激小鼠巨噬细胞后对破骨相关因子mRNA表达的影响[J]. 华西口腔医学杂志, 2015, 33(2):192-196. Ding ZQ, Shen YQ, Zhou Y, et al. Effects of periodontitis patient’s own tissue nucleic acid on the mRNA expression of osteoclast-related factors in murine macrophages[J]. West China J Stomatol, 2015, 33(2):192-196.
[3]Feng Z, Shen Y, Wang L, et al. An oligodeoxynucleotide with promising modulation activity for the proliferation and activation of osteoblast[J]. Int J Mol Sci, 2011, 12(4):2543-2555.
[4]Hou X, Shen Y, Zhang C, et al. A specific oligodeoxynucleotide promotes the differentiation of osteoblasts via ERK and p38 MAPK pathways[J]. Int J Mol Sci, 2012, 13(7): 7902-7914.
[5]Shen Y, Feng Z, Lin C, et al. An oligodeoxynucleotide that induces differentiation of bone marrow mesenchymal stem cells to osteoblasts in vitro and reduces alveolar bone loss in rats with periodontitis[J]. Int J Mol Sci, 2012, 13(3):2877-2892.
[6]冯志远. 寡核苷酸(ODN)促成骨细胞增殖活化的作用及机制研究[D]. 长春: 吉林大学, 2011. Feng ZY. Oligodeoxynucleotid induced the proliferation and activation of osteoblastic cells[D]. Changchun: Jilin University, 2011.
[7]Tian H, Li F, Chen J, et al. N-isopropylacrylamide-modified polyethylenimines as effective gene carriers[J]. Macromol Biosci, 2012, 12(12):1680-1688.
[8]王树平, 郑义, 申玉芹, 等. PEN载ODN MT01复合物性能检测及其对成骨细胞增殖的影响[J]. 口腔医学研究, 2015,31(6):580-583, 587. Wang SP, Zheng Y, Shen YQ, et al. Performance of complex PEN loading ODN MT01 and its effect on the proliferation of osteoblast[J]. J Oral Sci Res, 2015, 31(6):580-583,587.
[9]Martin TJ. Historically significant events in the discovery of RANK/RANKL/OPG[J]. World J Orthop, 2013, 4(4): 186-197.
[10]Martin TJ, Sims NA. RANKL/OPG; critical role in bone physiology[J]. Rev Endocr Metab Disord, 2015, 16(2):131-139.
[11]陈扬熙. 口腔正畸学——基础、技术与临床[M]. 北京:人民卫生出版社, 2012:102-113. Chen YX. Orthodontics—foundation, technology and clinical[M]. Beijing: People’s Medical Publishing House, 2012: 102-113.
[12]Walsh MC, Choi Y. Biology of the RANKL-RANK-OPG system in immunity, bone, and beyond[J]. Front Immunol,2014, 5:511.
[13]周文娟, 柳忠豪, 许胜, 等. 破骨细胞核因子κB受体活化因子配基和骨保护因子在种植体周围软组织及骨组织的表达[J]. 华西口腔医学杂志, 2012, 30(1):25-28. Zhou WJ, Liu ZH, Xu S, et al. Expression of receptor activator nuclear factor kappa B ligand and osteoprotegerin in peri-implant soft tissue and bone tissue[J]. West China J Stomatol, 2012, 30(1):25-28.
[14]查锡良. 生物化学[M]. 北京: 人民卫生出版社, 2010:324-325. Zha XL. Biochemistry[M]. Beijing: People’s Medical Publishing House, 2010:324-325.
[15]Jin L, Zeng X, Liu M, et al. Current progress in gene delivery technology based on chemical methods and nano-carriers [J]. Theranostics, 2014, 4(3):240-255.
(本文编辑 吴爱华)
[中图分类号]Q 51
[文献标志码]A [doi] 10.7518/hxkq.2016.01.007
[收稿日期]2015-08-25; [修回日期] 2015-11-13
[基金项目]白求恩前沿交叉学科创新基金(2013108031)
[作者简介]崔野,硕士,E-mail:279914375@qq.com
[通信作者]孙新华,教授,学士,E-mail:xinhuasun8@163.com
Effect of MT01/PEN complexes on the expression of osteoprotegerin and receptor activator of nuclear factor κB ligandin human osteoblast-like cell line MG63
Cui Ye1,2, Zheng Yi3, Shen Yuqin3, Hou Xu1, Lou Yixin1, Sun Xinhua1.
(1. Dept. of Orthodontics, School and Hospital of Stomatology, Jilin University, Changchun 130021, China; 2. Jilin Provincial Key Laboratory of Tooth Development and Bone Remodel, Changchun 130021, China; 3. Dept. of Periodontology, School and Hospital of Stomatology, Jilin University, Changchun 130021, China)
Supported by: Bethune Frontier Interdisciplinary Innovation Foundation (2013108031). Correspondence: Sun Xinhua, E-mail: xinhuasun8@163.com.
[Abstract]Objective This study aims to synthesize MT01 (a kind of oligodeoxynucleotides) and N-isopropylacrylamidemodified polyethylenimines (PEN) complexes (MT01/PEN) as well as to investigate the effect of the complexes on the expression of osteoprotegerin (OPG) and the receptor activator of nuclear factor κB ligand (RANKL) in the human osteoblast-like cell line MG63. Methods MG63 cells were transfected by MT01/PEN complexes formed with three different mass ratios (1∶2, 1∶4, 1∶6) of MT01 to PEN. MT01 and MT01-s were used as positive control. Enzyme-linked immunosorbent assay and real-time polymerase chain reaction were performed to estimate the amount of OPG and RANKL released into the culture media and in MG63 at 24, 48, 72 h. Results MG63 responded to the MT01/PEN complexes by significantly upregulating the OPG on the protein and mRNA levels (P<0.05). The protein and mRNA levels of RANKL were lower in most of the groups with complexes, and the OPG/RANKL ratio were higher (P<0.05). MG63 were affected by the MT01/PEN complexes with different mass ratios, particularly when the ratio was 1∶6. Conclusion MT01 can enhance the promotion of ossification by establishing the delivery system with PEN.
[Key words]human osteoblast-like cell line MG63; oligodeoxynucleotides MT01; N-isopropylacrylamide-modified polyethylenimines; osteoprotegerin; receptor activator of nuclear factor κB ligand
