半夏内生真菌所产β-葡萄糖苷酶的酶学特性研究
2016-07-22闫淑珍周林芳赵伯涛黄晓德朱羽尧
陈 斌,钱 骅,闫淑珍,周林芳,赵伯涛*,黄晓德,朱羽尧
(1. 南京野生植物综合利用研究院,江苏 南京 210042; 2. 南京师范大学 生命科学学院,江苏 南京 210009)
半夏内生真菌所产β-葡萄糖苷酶的酶学特性研究
陈 斌1,钱 骅1,闫淑珍2,周林芳2,赵伯涛1*,黄晓德1,朱羽尧1
(1. 南京野生植物综合利用研究院,江苏 南京 210042; 2. 南京师范大学 生命科学学院,江苏 南京 210009)
摘要从半夏中分离筛选得到一株植物内生真菌,提取培养液中的β-葡萄糖苷酶,研究其酶学特性。结果表明:该菌种所产β-葡萄糖苷酶的最适反应温度在45~50 ℃之间,最适pH 在7~8之间;在低于40 ℃条件下,pH 为6~9 时,酶活较稳定;其最适反应时间为40 min,金属离子和有机溶剂对酶活性影响都很大,在最适反应条件下其酶活为(77.83±0.42) U/mL。
关键词半夏;内生真菌;β-葡萄糖苷酶;酶学特性
β-葡萄糖苷酶(β-glucosidase,EC3.2.1.21),又称β-D-葡萄糖苷葡萄糖水解酶,它能够水解结合于末端非还原性的β-D-葡萄糖苷键,同时释放出β-D-葡萄糖和相应的配基,也是纤维素酶复合酶系发挥协同作的关键酶。自从1837 年,Liebig和Wohler首次在苦杏仁中发现β-葡萄糖苷酶,人们探索β-葡萄糖苷酶的脚步就从来没有停止过[1-2]。β-葡萄糖苷酶是纤维素酶的一个重要组成部分,在医疗、食品、生物质转化中有重要的应用价值。研究发现,β-葡萄糖苷酶存在于自然界许多植物、昆虫、酵母、曲霉、木霉及细菌体内[3-4]。对β-葡萄糖苷酶的研究已经成为热点,已由过去的研究从大豆、蚕豆、茶叶、香菇、微生物等材料中简单提取β-葡萄糖苷酶到现在微生物的培养条件优化、酶基因的克隆[5-10]以及粗酶液的纯化,但离β-葡萄糖苷酶的产品市场化还有一段距离。所以培养微生物,并从培养基或微生物中提取β-葡萄糖苷酶依然是解决β-葡萄糖苷酶来源的主要途径。
1材料、试剂与仪器
1.1材料
丝状植物内生真菌(南京师范大学微生物所闫淑珍老师分离提供)。
1.2试剂
3,5-二硝基水杨酸、乙酸、乙酸钠、酒石酸钾钠、结晶酚、亚硫酸钠等(国药集团化学试剂有限公司)。
1.3仪器
高速万能粉碎机(天津市泰斯特仪器有限公司);JA3103N电子天平(上海民桥精密科学仪器有限公司);旋转蒸发仪RE-52A(上海亚荣生化仪器厂);752紫外可见分光光度计(上海菁华科技仪器有限公司);20PR-520型高速冷冻离心机(日本日立公司);电热恒温水浴锅(江苏南通竹行电热恒温器厂);低速沉淀离心机(北京医用离心机厂)。
2实验方法
2.1β-葡萄糖苷酶的提取
2.1.1盐析
本实验采用在搅拌条件下,缓慢地向对数期种子液中加入硫酸铵粉末至35%饱和度,静置过夜,离心分离(8 000 r/min,20 min),弃去沉淀;再向上清液中加入硫酸铵粉末至80%饱和度,搅拌均匀后静置过夜,离心分离(8 000 r/min,20 min),收集沉淀。
2.1.2透析脱盐
将经由盐析收集到的沉淀用少量磷酸氢二钠.柠檬酸缓冲液溶解,放入透析袋中透析,4 ℃条件下,定时更换缓冲液直至无硫酸根离子。
2.2酶学特性研究
2.2.1酶活性测定
采用DNS 法测定酶反应产物—还原糖。取0.5 mL粗酶液加入1.5 mL缓冲液配置的0.5%的水杨酸苷溶液,放入50 ℃水浴锅中作用15 min,加入1.5 mL DNS,沸水浴5 min,冷却至室温后用蒸馏水稀释至20 mL,在波长540nm 处比色,记录吸光度(OD 540 nm)。活力定义为每1小时 产生1μg 还原糖所需的酶量为一个β-葡萄糖苷酶活力单位,用U表示。配制不同浓度的葡萄糖标准溶液,采用DNS法显色后测定吸光度,绘制标准曲线。
2.2.2酶的最适反应温度及热稳定性
在25、30、35、40、45、50、55、60、65 ℃和70 ℃的不同温度下,按上述测定酶活力方法,确定温度对酶活力的影响,然后酶在4 ℃和上述各温度下各保温10 h 后,在最适反应温度下测酶活,确定其热稳定性。
2.2.3酶的最适pH及pH稳定性
用pH 值为3~12 的缓冲液配制水杨苷溶液,按上述酶活测定方法,确定最适pH;又以不同pH 缓冲液1.50 mL 中加0.50 mL粗酶液,在最适温度下保温10 h后,最适温度下测酶活,以自然状态下的酶活为100%。
2.2.4反应时间对酶活性的影响
在最适温度,最适pH下,分别测反应时间为5、10、15、20、25、30、35、40、45、50、55 min和60 min,按上述酶活测定方法测定不同的酶活力。
2.2.5金属离子对酶活性的影响
配制各种金属离子浓度为200 mmol/L,使其反应终浓度为40 mmol/L, 在最适温度下保温10 h 后,按上述方法测定酶活,以未添加金属离子的酶活为100%。
2.2.6有机溶剂对酶活性的影响
在酶用量和底物浓度均相同的反应体系中,添加不同的有机溶剂, 使其终浓度为10%、20%、30%、40%、50%和60%,并以未添加有机溶剂为空白对照,在最适温度,最适pH下按上述方法测定酶活。
3实验结果
3.1酶活力测定
采用DNS 法测定酶反应产物—还原糖。绘制葡萄糖标准曲线其线性回归方程为y=0.013 1x-0.014 7,线性范围20~100μg/mL,R2=0.999 3。该粗酶液的活力为(77.83±0.42)U/mL。
3.2酶学特性研究
3.2.1酶的最适反应温度及热稳定性
该酶的最适反应温度在45~50 ℃之间,当温度超过60 ℃时,酶活力迅速下降,而当温度低于最适温度时随温度的升高酶活力逐渐上升(见图1)。该酶在 5~40 ℃条件下储藏,其酶活较稳定(见图2),提示该酶可以在常温下储藏。
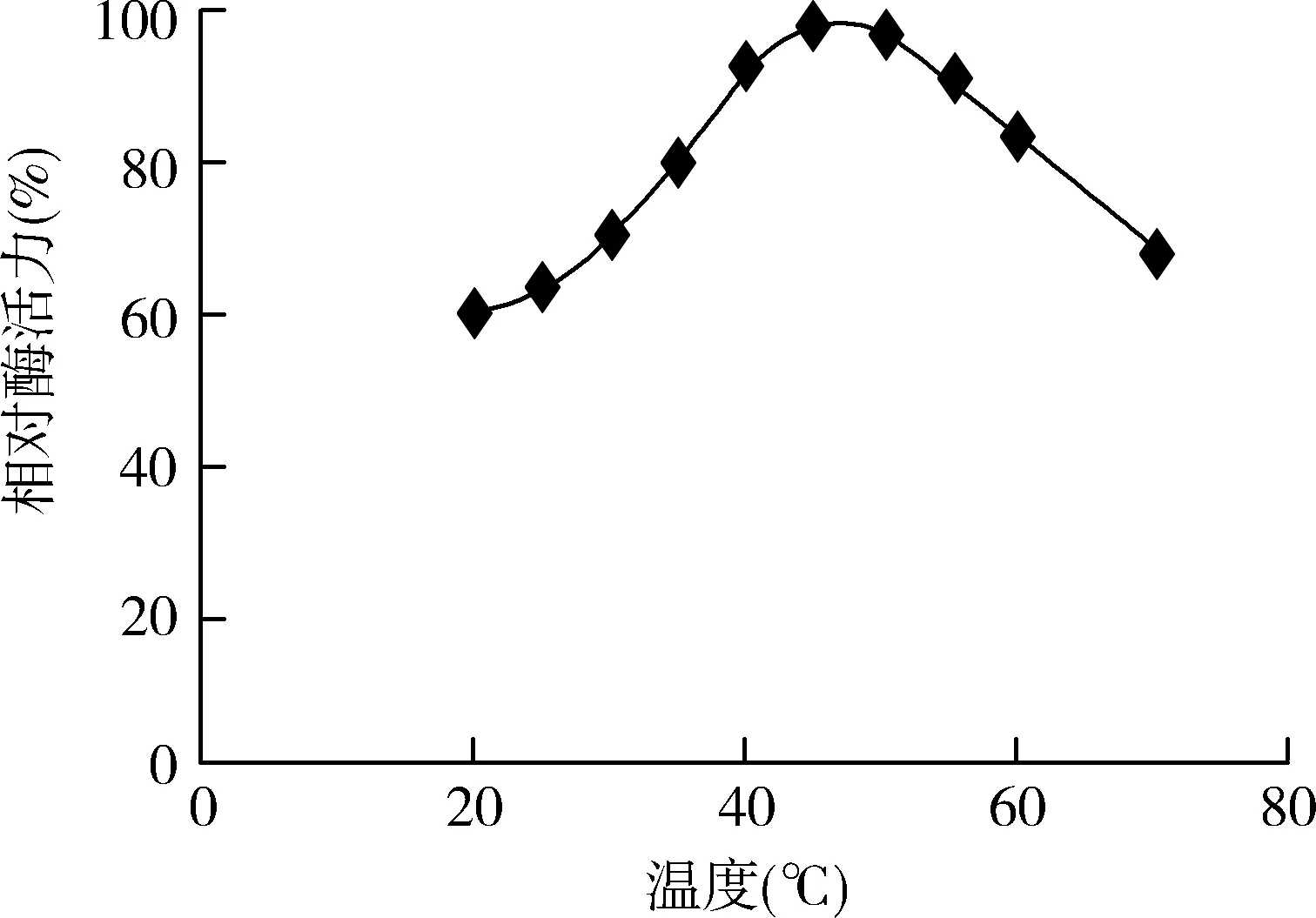
图1 温度对酶活力的影响

图2 酶的热稳定性
3.2.2酶的最适pH及pH稳定性
该β-葡萄糖苷酶的最适pH在7~8 之间, pH 超过8时, 相对酶活明显下降;pH 为6~9 时,β-葡萄糖苷酶的活力较高,达70%以上(见图3)。该酶的pH稳定性较差,在pH小于5和大于11的条件下酶活力均下降超50%(见图4)。
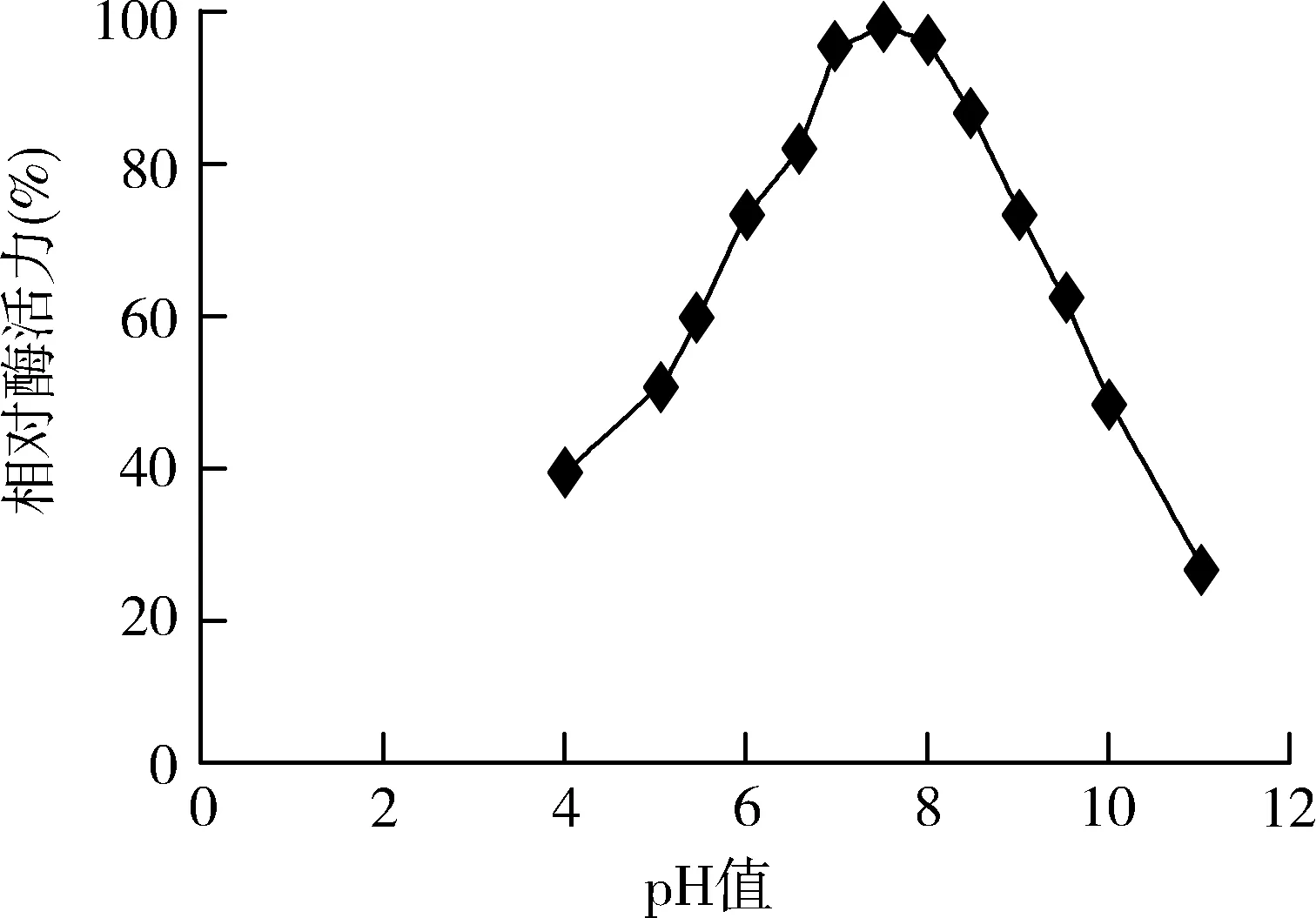
图3 pH对酶活力的影响

图4 酶的pH稳定性
3.2.3反应时间对酶活性的影响
该酶反应时间40 min时酶活力达到最大值。反应时间少于40 min,随着反应时间的增加,酶活力逐渐增加。反应时间多于40 min,随着反应时间的增加酶活力维持在最大活力的97%左右(见图5)。
3.2.4金属离子对酶活性的影响
以未添加金属离子的酶活为100%,0.001mg/mL的Zn2+、Fe2+、Sn2+、Mn2+、Cu2+和Ba2+均可使该酶的活力提高50%以上,其中Ba2+可使酶活力提高300%; Al3+、K+和Cr3+会使该酶的活力损失50%以上,其中Al3+使该酶活力的损失达70%以上(见图6)。

图5 反应时间对酶活力的影响

图6 金属离子对酶活力的影响
3.2.5有机溶剂对酶活性的影响
以未添加有机溶剂的酶活为100%,各有机溶剂对该菌种所产的β- 葡萄糖苷酶的活性均具有明显的抑制作用,在体积分数为0%~60%范围内随着浓度的升高,酶活性也呈下降趋势。当体积分数达到60%时乙酸乙酯、甲醇可使酶活力损失近50%,乙醇、乙腈、丙酮使酶活力损失超过60%(见图7)。
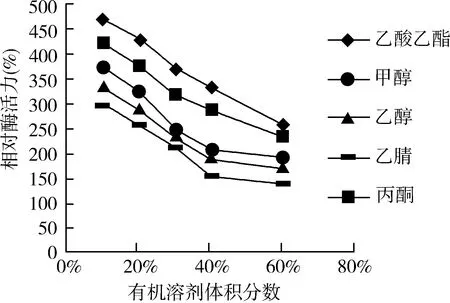
图7 有机溶剂对酶活力的影响
4结论
目前已知的菌种产β-葡萄糖苷酶的酶活普遍偏低,若利用基因工程技术对这些菌种进行分子改造则耗时耗力且耗资。所以最直接、有效的方法就是直接从自然界中筛选出产β-葡萄糖苷酶的酶活较高的菌种。本文从半夏植株中分离获得高产β- 葡萄糖苷酶植物内生真菌,提取发酵液中的β-葡萄糖苷酶制成粗酶液,并研究其酶学特性,为该酶的产业化应用打下基础。该菌株最大特点是产酶时间短,且所产酶:可以常温保存,具有很好的热稳定性;pH 作用范围6~9,较广泛;在实际应用中具有很大的优越性。
参考文献:
[1]潘利华,罗建平.葡萄糖苷酶的研究及应用进展[J].食品科学, 2006, 27(12):803-807.
[2]顾卫民.葡萄糖苷酶的特性及其在食品工业中的用[J].江苏食品与发酵, 2003, 112(1):5-7.
[3]GONZALEZ,POMBO P,FARINA L,CARRAU F.A novel extracellular glucosidase from Issatchenkia terricola,isolation,immobilization and application for aroma enhancement of white Muscat wine[J]. Process Biochemistry,2011,46(1):385-389.
[4]BAFFl M A,TOBAL T,LAGO J H G.A novel glucosidase from Sporidiobolus pararoseus,characterization and application in wine making[J].Journal of Food Science,2011,76(7):997-1002.
[5]申佩弘, 蒋承建, 杨 霞, 等.厌氧菌株的筛选及其β-葡萄糖苷酶基因的克隆[J].化学与生物工程,2011, 1(1):21-25.
[6]郭 鸿, 封 毅, 莫新春, 等.水牛瘤胃宏基因组的一个新的β-葡萄糖苷酶基因umcel3G的克隆、表达及其表达产物的酶学特性[J].生物工程学报,2008, 24(2):232-238.
[7]赵云, 伟丰, 毛爱军, 等.多粘芽孢杆菌 β-葡萄糖苷酶基因在大肠杆菌中的表达、纯化及酶学性质分析[J].生物工程学报, 2004, 20(5):741-744
[8]李远华,江昌俊,余有本.茶树葡萄糖苷酶基因的表达[J].南京农业大学学报,2005, 28(2):103-106.
[9]SHU Guang,YANG Yan. Trichoderma reesei beta-glycosidase by Sac-Charomyces cerevisiae[J].Current Genetic, 1996, 2(9): 227-233.
[10]赵云, 伟丰, 毛爱军, 等.多粘芽孢杆菌 β-葡萄糖苷酶基因在大肠杆菌中的表达、纯化及酶学性质分析[J].生物工程学报, 2004, 20(5):741-744.
doi:10.3969/j.issn.1006-9690.2016.02.004
收稿日期:2015-08-12
基金项目:国家科技支撑项目(2011BAD33B03)。
作者简介:陈斌(1986—),男,研究实习员,主要从事植物资源与化学的研究。E-mail: njcb3391@sina.com *通讯作者:赵伯涛(1962—),男,研究员,主要从事植物资源与化学的研究。E-mail:zbt_nj@163.com
中图分类号:Q55
文献标识码:A
文章编号:1006-9690(2016)-02-0007-03
Enzyme Properties of β-Glucosidase of Endophytic Fungi Isolated fromPinelliaternata
Chen Bin1, Qian Hua1,Yan Suzhen2, Zhou Linfang2, Zhao Botao1, Huang Xiaode1, Zhu Yuyao1
(1. Nanjing Institute for Comprehensive Utilization of Wild Plants, Nanjing 210042,China;2. College of Life Sciences, Nanjing Normal University,Nanjing 210009,China)
AbstractAfter separation and selection from Pinellia ternata , we obtained a strain production of β-glucosidase. Some properties of β-glucosidase produced by this strain have been analyzed. Results showed the optimal activity temperature is between 45℃-50℃ and the optimum pH for reaction is 7-8. Besides, the β-glucosidase enzyme activity was relatively stable at pH 6-9 below 40 ℃ for around 40 min. Metal ion and organic solvent would influence the β-glucosidase enzyme activity a lot and the β-glucosidase enzyme activity was up to 77.83±0.42 U/mL under the optimum reaction conditions.
Key wordsPinellia ternata;endophytic fungi; β-glucosidase;enzymatic properties
