高寒草甸退化对土壤昆虫多样性的影响
2016-07-21高艳美吴鹏飞
高艳美,吴鹏飞
西南民族大学生命科学与技术学院,成都 610041
高寒草甸退化对土壤昆虫多样性的影响
高艳美,吴鹏飞*
西南民族大学生命科学与技术学院,成都610041
摘要:土壤昆虫是陆地生态系统的重要组成部分,在物质循环和能量转化过程中起着重要的作用。为了查明高寒草甸生态系统退化对土壤昆虫群落的影响,于2011年的4、5、7和10月份别对青藏东缘的若尔盖高寒草甸的沼泽草甸、草原草甸、中度退化草甸和重度退化草甸的土壤昆虫群落进行了调查。共捕获土壤昆虫4172只,隶属于8目35科,共46类。优势类群有尖眼蕈蚊科幼虫(Sciaridae larvae)、摇蚊科幼虫(Chironomidae larvae)和象甲科幼虫(Curculionidae larvae),其中尖眼蕈蚊科幼虫为各退化阶段的共同优势类群。重度退化草甸的土壤昆虫密度和多样性指数均显著低于其它退化阶段(P<0.01)。各退化阶段间的Sorenson相似性和Morisita-Horn相似性指数变化趋势表明退化对土壤昆虫的类群组和优势类群的个体数量影响较大。而土壤昆虫的群落密度和多样性指数的季节动态在不同退化阶段间也存在差异。此外,高寒草甸的退化还可影响昆虫群落优势类群的时空分布,但不同类群间存在差异。相关分析结果表明土壤昆虫多样性与土壤pH值呈显著负相关(P<0.01),与地下生物量和磷含量呈显著正相关(P<0.01),而密度仅与pH值呈显著负相关(P<0.01)。研究结果表明高寒草甸退化可通过改变植物群落及土壤等环境因子影响土壤昆虫群落组成和多样性的空间分布和季节动态。
关键词:土壤昆虫;多样性;高寒草甸;退化;若尔盖
昆虫种类多,数量巨大,适应性较强,是生态系统的重要组成部分[1- 2],在草地生态系统的物质循环和能量流动过程中起着重要的调控作用。与脊椎动物相比,昆虫对气候、植被、土壤等环境因子的变化具有高度敏感性,能在一定程度上能指示环境变化[3- 4],在生态恢复和环境监测方面,昆虫作为生物指标之一正在得到更多地关注和应用[5- 6]。
青藏高原上的高寒草地面积约为1.2×108hm2,占全国草地总面积的1/3[7]。位于青藏东缘的若尔盖草地总面积为7.08×l04km2,是我国重要的畜牧业基地之一,也是黄河的发源地和我国重要的生态屏障[8]。自20世纪70年代以来,在全球变化和放牧干扰的综合作用下,若尔盖草地也呈现出明显的退化趋势[9],沙化草地面积也逐渐扩大[10]。高寒草地退化后,植物群落[11]、土壤理化性质[12]都发生明显变化。昆虫群落与赖以生存的植物群落之间有着极其密切的联系,植物群落的组成及变化决定着昆虫群落的特征[13- 14]。
目前关于高寒草甸生态系统昆虫的研究非常少[15],因此对高寒草甸退化过程中土壤昆虫群落组成及变化趋势等基本情况都不清楚,查明这些问题对揭示高寒草甸生态系统结构和功能的变化趋势具有重要的科学意义。本文以若尔盖高寒草甸不同退化阶段土壤昆虫为研究对象,目的是查明:高寒草甸不同退化阶段土壤昆虫群落组成特征和高寒草甸退化对土壤昆虫群落多样性的影响。研究结果不仅可以提供高寒草甸生态系统土壤昆虫多样性方面的基础资料,还能为高寒草甸生态系统的病虫害防治提供科学依据。
1研究区概况
若尔盖县位于青藏高原东部边缘,地理坐标东经102°08′—103°39′、北纬 32°56′—34°19′,地处四川省阿坝藏族羌族自治州北部。海拔在2400—4500 m之间,平均海拔3500 m。该区属于大陆性季风高原型气候,具有寒温带气候特征。日照充足,昼夜温差大,年日照2507 h。年平均气温0.612 ℃,极端最高温度24.6 ℃,极端最低温度-29.5 ℃。最大冻土深72 cm,无绝对无霜期。年平均降水量约为600—750 mm,蒸发量1212.7 mm,相对湿度68%。区域内主要地貌类型有高原、丘陵、山原和高山峡谷,主要土壤类型有草甸土、沼泽土和泥炭土。
2研究方法
2.1样地设置
在若尔盖县境内根据植物的盖度、群落组成和土壤类型选取沼泽草甸、草原草甸、中度退化草甸和重度退化草甸4种典型生境作为固定样地,样地面积为50 m×50 m。各个样地的土壤类型分别为沼泽土、草甸土、草甸土和风沙土。沼泽草甸的主要植物种类有:垂穗披碱草(Elymusnutans)、高原毛茛(Ranunculustanguticus)、火绒草(Leontopodiumleontopodioides)、珠芽蓼(Polygonumviviparum)、蒲公英(Taraxacummaurocarpum)、紫菀(Astertataricus)、毛莨状金莲花(Trolliusranunculoides)、报春花(Primulamalacoides)、老鹳草(Herbaerodii)等,高度10—30 cm,盖度90%以上。草原草甸的主要植物种类有:藏羊茅(Festucawallichanica)、四川嵩草(Kobresiasetchwanensis)、高原毛茛、葛缕子(Carumcarvi)、狼毒(Stellerachamaejasme)、乳白香青(Anaphalislactea)、条叶银莲花(Anemonetrullifolia)、矮金莲花(Trolliusfarreri)、垂穗披碱草、草地早熟禾(Poapratensis)、棘豆(OxytropisKansuensis)等,高度20—40 cm,盖度90%以上。中度退化草甸主要植物种类有:鹅绒委陵菜(Potentillaansrina)、嵩草(Kobresiabellardii)、黄帚橐吾(Ligu1ariavirgaurea)、蒲公英、高原毛莨、棘豆等,高度0—5 cm,盖度50%—70%以上。重度退化草甸的主要植物种类有:垂穗披碱草,葛缕子,高度0—20 cm,盖度10%以下[15]。不同退化阶段的植物种类、地上生物量、地下生物量、土壤容重、pH、含水量、有机质、全氮、全磷、全钾、速效氮、有效磷和速效钾共13个环境因子的基本情况见文献[15]。
2.2土壤昆虫调查及鉴定
2011年的4、5、7月和10月,对若尔盖高寒草甸进行4次采样,共采集96个土样(4个阶段×4次调查×6个重复)。在每种样地内随机选取6个50 cm×50 cm的样方,每个样方之间距离为5 m以上,采取0—15 cm高度范围内的土壤。体长在2 mm以上的土壤昆虫采用手拣法获取,并用75%酒精溶液保存。另取土样1份,在实验室内用干漏斗法(Tullgren法)分离横截面直径为2 mm以下的昆虫,温度控制在37 ℃左右,分离时间为48 h。
土壤昆虫的鉴定,把收集到的土壤昆虫在实验室内依据《中国土壤动物检索图鉴》[16]、《昆虫分类检索》[17]和《幼虫分类学》[18]等在体式镜(Olympus SZX16)和光学显微镜(Leica DM4000B)下对土壤昆虫进行鉴定,除部分鉴定到属外其余均鉴定到科,统计个体数量,并换算成个/m2。
2.3数据处理
(1)多度划分
个体数占总捕获量10%以上的为优势类群,个体数占总捕获量1%—10%之间的为常见类群,个体数占总捕获量的1%以下的为稀有类群[19]。
(2)群落多样性特征
采用丰富度、Shannon-Wiener多样性指数H′和Simpson优势度指数C来分析多样性。其中以土壤昆虫的类群数表示丰富度,而Shannon-Wiener多样性指数和Simpson优势度指数计算方法如下。
Shannon-Wiener多样性指数[20]:
Simpson优势度指数[21]:
式中,S为类群数,Pi为第i类群的百分比。
(3)土壤昆虫群落相似性分析
分别采用Sorensen相似性系数和Morisita-Horn相似性系数对群落相似性进行定性和定量分析[22]。
Sorensen相似性系数:
式中,c为A和B两种生境共有的类群数,a为A生境的总类群数,b为B生境的总类群数。该相似性指数主要反映群落组成类群的变化,即定性相似性。值在0.75—1.00之间为极相似,0.50—0.74之间为中等相似,0.25—0.49之间为中等不相似,0—0.24之间为极不相似。
Morisita-Horn 相似性系数:
式中,Na为群落A的物种数量,Nb为群落B的物种数量,ai和bi分别为A和B群落中第i个体数目。
(4)统计分析
对于服从正态分布的数据,利用单因素方差分析(One-Way ANOVA)和重复测量方差分析(Repeated measures ANOVA)分别对各退化阶段季节间和不同退化阶段间土壤昆虫群落密度和多样性的差异显著性进行检验。如果差异显著则用Tukey HSD法(方差齐性)和Tamhane′s T2(M)法(方差不齐)。对于不服从正态分布的数据,则用log(x+1)转换,如若转换后仍不服从正态分布的数据则利用 Kruskal-Wallis Test (H)和Mann-Whitney进行非参检验。土壤昆虫群落与环境因子间的相关性用回归分析进行检验。用SPSS 20.0对数据进行统计分析。
3结果与分析
3.1土壤昆虫群落组成特征
2011年4、5、7、10月4个月份在若尔盖高寒草甸共捕获土壤昆虫4172个,隶属于8目,35科,共46类(表1)。优势类群有尖眼蕈蚊科幼虫(Sciaridae larvae)、摇蚊科幼虫(Chironomidae larvae)和象甲科幼虫(Curculionidae larvae ),分别占总捕获量的35.84%、13.04%和13.09%;常见类群共15类,共占总捕获量的34.24%。稀有类群共28类,仅占总捕获量的3.80%。
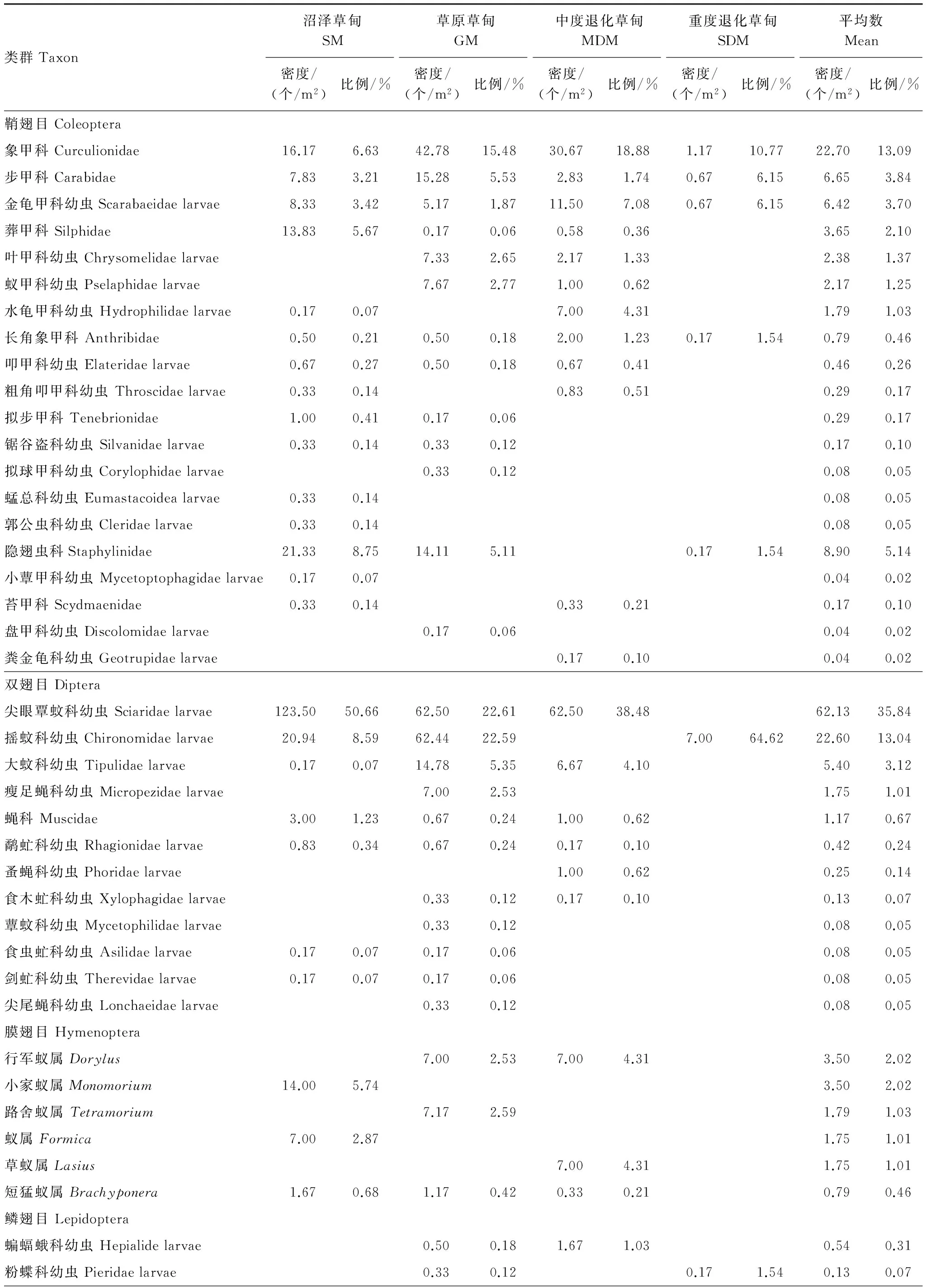
表1 若尔盖高寒草甸不同退化阶段土壤昆虫群落组成
SM、GM、MDM、SDM分别代表沼泽草甸、草原草甸、中度退化草甸和重度退化草甸
土壤昆虫类群数和密度高底顺序均为沼泽草甸、草原草甸、中度退化草甸和重度退化草甸,类群数分别为27、31、26类和8类,密度分别为243.77、276.39、163.41、10.83 m2。不同退化阶段,各类群的个体数在群落中所占比例存在一定的差异。沼泽草甸优势种为尖眼蕈蚊科幼虫(Sciaridae larvae),占其总个体数的50.66%,常见种共8类占其总个体数的37.37%,稀有种共18类占其总个体数的11.96%;草原草甸优势种有摇蚊科幼虫(Chironomidae larvae)、尖眼蕈蚊科幼虫和象甲科幼虫(Curculionidae larvae),占其总个体数的60.68%,常见种共有10类,占其总个体数的36.78%,稀有种共18类,占其总个体数2.53%;中度退化的优势种有尖眼蕈蚊科幼虫(Sciaridae larvae)和象甲科幼虫(Curculionidae larvae ),占其总个体数的57.36%,常见种共10类,占其总个体数38.28%,稀有种共14类占其总个体数4.36%;重度退化优势种有摇蚊科幼虫(Chironomidae larvae )和象甲科幼虫(Curculionidae larvae),共占其总个体数的75.38%,常见种共6类占其总个体数24.62%,没有稀有类群。 以上分析表明草原草甸适宜较多类群的土壤昆虫生存,群落结构复杂;重度退化仅有少数类群土壤昆虫生存,群落结构较简单。
3.2土壤动物群落相似性
不同退化阶段间土壤昆虫群落Morisita-Horn相似性系数变化范围在0.10—0.86之间,而Sorenson相似性系数的变化范围在0.27—0.57之间(表2),表明退化对群落的组成类群和优势类群的相对个体数量影响均较大。其中,重度退化草甸与其它3个阶段间的Morisita-Horn相似性系数平均值为0.29(范围在0.10—0.58),而Sorenson相似性系数的平均值0.31(0.27—0.35之间),表明重度退化对土壤昆虫群落的组成类群及各类群的个体数量均有较大影响。沼泽草甸、草原草甸和中度退化草甸三者间Morisita-Horn相似性系数在0.71—0.86之间,而Sorenson相似性系数在0.50—0.57之间,表明中度退化前土壤昆虫群落的组成类群和优势类群的相对个体数量差异较小。
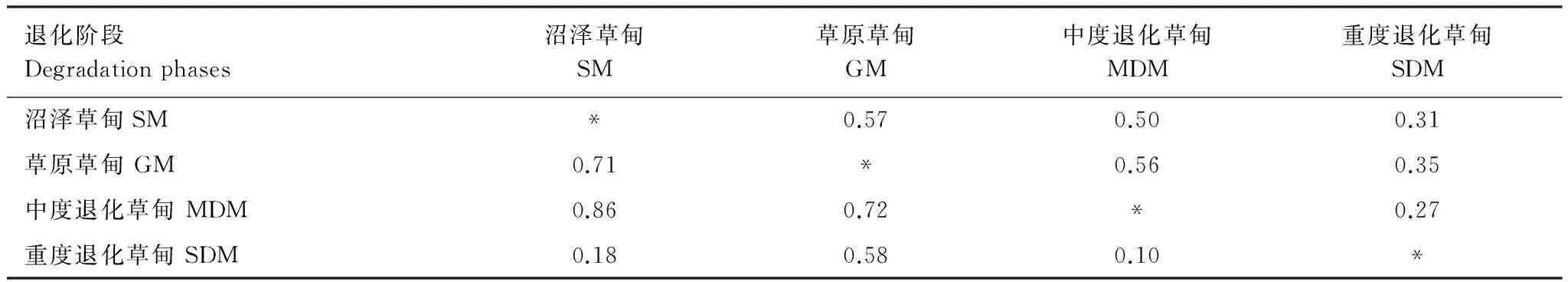
表2 各退化阶段间土壤昆虫群落相似性
对角线之上为Sorenson相似性系数,对角线之下为Morisita-Horn相似性系数
3.3土壤昆虫的密度及多样性动态
若尔盖高寒草甸4种阶段中的草原草甸、沼泽草甸和中度退化草甸的土壤昆虫密度变化无显著差异但其均显著高于重度退化草甸(图1和表3)。重复测量分析结果表明高寒草甸的土壤昆虫密度有显著的季节变化(表3),但进一步的分析表明仅有沼泽草甸的土壤昆虫密度有显著季节差异(图1),其它阶段的季节变化均不显著(图1),表明高寒草甸的退化可以影响土壤昆虫密度的季节动态。以上结果表明高寒草甸的退化对土壤昆虫群落的密度及其季节动态均有显著影响。
草原草甸、沼泽草甸和中度退化草甸的土壤昆虫的类群数(丰富度)、Shannon-Wiener多样性指数和Simpson优势度指数亦均无显著差异,但均显著高于重度退化草甸(图1和表3)。季节变化对4个阶段的土壤昆虫类群数均有显著的影响(图1),而生境×季节交互作用对土壤昆虫类群数也有显著影响(表3)。重复测量结果表明Shannon-Wiener多样性指数和Simpson优势度指数有显著季节变化(表3),但单因素方差分析表明仅有中度退化草甸和重度退化草甸中的Shannon-Wiener多样性指数和Simpson优势度指数的季节变化显著(图1)。以上结果表明高寒草甸的退化不仅可显著降低土壤昆虫群落多样性,还可影响其季节变化。

图1 不同退化阶段土壤昆虫群落多样性(平均值±标准误)Fig.1 Diversity index of soil insect communities at different degradation phases (Mean±S.E.)不同大写字母表示不同生境间差异显著(P<0.05),不同小写字母代表同一生境不同季节间的显著差异(P<0.05)
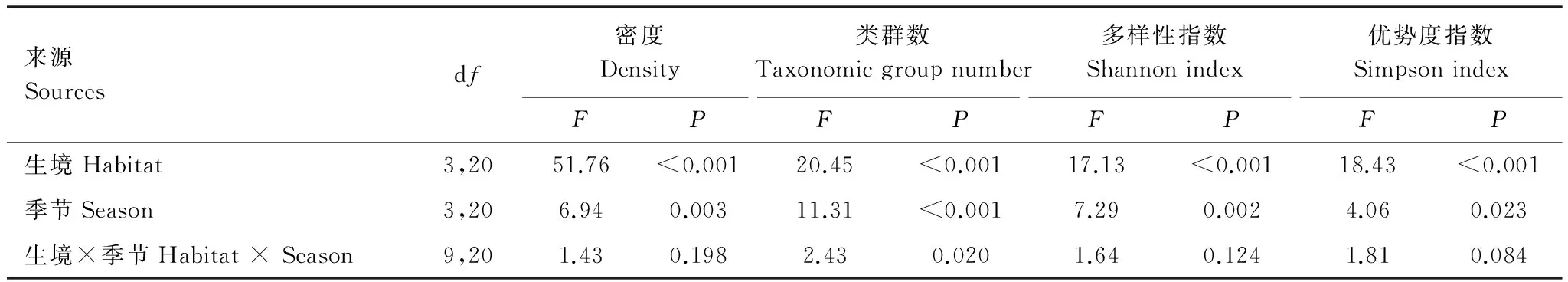
来源Sourcesdf密度Density类群数Taxonomicgroupnumber多样性指数Shannonindex优势度指数SimpsonindexFPFPFPFP生境Habitat3,2051.76<0.00120.45<0.00117.13<0.00118.43<0.001季节Season3,206.940.00311.31<0.0017.290.0024.060.023生境×季节Habitat×Season9,201.430.1982.430.0201.640.1241.810.084
3.4主要类群动态
若尔盖高寒草甸土壤昆虫主要类群为双翅目和鞘翅目昆虫,两者的密度的变化顺序均为草原草甸>沼泽草甸>中度退化草甸>重度退化草甸(图2)。统计分析结果表明双翅目昆虫密度在不同退化阶段间无显著差异,而鞘翅目昆虫密度在不同退化阶段间存在显著差异,且重度退化草甸鞘翅目昆虫密度显著低于其它退化阶段(图2和表4)。

图2 不同退化阶段间双翅目和鞘翅目的密度(平均值±标准误)Fig.2 Densities of Diptera and Coleoptera at different degradation phases of Zoigê alpine (Mean±S.E.)

来源Sourcesdf双翅目Diptera鞘翅目ColeopteraFPFP生境Habitat3,202.130.12833.66<0.001季节Season3,203.680.0318.010.001生境×季节Habitat×Season9,201.710.1070.920.51
此外,重复测量方差分析结果表明双翅目和鞘翅目昆虫密度均有显著的季节变化(表4),但单因素方差分析表明双翅目密度仅在沼泽草甸有显著季节差异(F=6.08,P<0.01),鞘翅目密度仅在中度退化阶段有显著季节差异(F=3.28,P<0.05)。表明高寒草甸的退化还可影响昆虫群落的优势类群的空间分布及季节动态,但对不同类群的影响存在差异。
3.5土壤昆虫群落与环境因子的关系
土壤昆虫群落各参数与环境因子的回归分析结果如表5。在13个环境因子中,仅有地下生物量、pH值、全磷和有效磷对土壤昆虫有显著影响(表5)。其中,地下生物量仅与鞘翅目密度呈显著正相关(P<0.01);pH值与土壤昆虫群落的密度、类群数、Shannon-Wiener指数以及双翅目昆虫密度呈显著负相关(P<0.01或P<0.05);全磷含量仅与土壤昆虫优势度指数有著正相关性(P<0.01),而有效磷含量则与类群数、Shannon-Wiener指数及鞘翅目昆虫密度呈显著正相关性(P<0.01或P<0.05)。回归分析结果表明土壤pH值的增加将会降低土壤昆虫群落密度和多样性,而土壤磷含量的增加则能提高其多样性。

表5 土壤昆虫与环境因子间的关系
括号内为非标准化系数;*表示显著性水平为P<0.05;**表示P<0.01,双尾检验
4讨论
4.1高寒草甸退化对土壤昆虫群落组成和多样性的影响
土壤昆虫群落组成具有鲜明的空间异质性特征。随着若尔盖高寒草甸退化的加剧,土壤昆虫群落组成也随之发生变化(表2),尤其是重度退化草甸的土壤昆虫密度显著低于其它草甸。已有研究表明植被和土壤理化性状与土壤昆虫密度有密切的关系[23],且在本文研究发现土壤昆虫密度与pH值呈显著性负相关。在高寒草甸退化过程中,植物群落密度、盖度和高度明显下降,且pH值呈显著增加趋势[24- 25]。因此,随着高寒草甸退化程度的加剧,土壤昆虫密度随之降低。在各退化阶段间,土壤昆虫稀有类群的组成差异较大,且个体数量在群落中所占比例均在6%以下,而优势类群的个体数量在50%以上。由于Morisita-Horn大小主要由优势类群的数量决定,Sorenson则主要由相同类群的个数决定[25],因此4个退化阶段间的Morisita-Horn相似性相对较高,而Sorenson相似性相对较低。
多样性指数、优势度指数以及丰富度指数(类群数)作为衡量群落多样性的重要指标被广泛应用[27]。若尔盖高寒草甸的4个退化阶段中,重度退化草甸土壤昆虫的丰富度指数、Shannon指数和Simpson优势度指数均显著小于其它退化阶段,表明重度退化可显著降低土壤昆虫群落多样性。有关研究表明土壤环境是引起土壤昆虫多样性变化的重要因素[28],其中磷含量及pH值分别对土壤昆虫多样性有正、负影响[29- 30]。本文的研究结果发现土壤昆虫的类群数和Shannon指数与土壤pH值呈显著负相关,与磷含量呈显著正相关,说明在高寒草甸生态系统中土壤pH值及磷含量与土壤昆虫多样性有间也存在密切的关系。
双翅目和鞘翅目昆虫密度在各种生境中占有量均较大,且双翅目为4个退化阶段的共同优势类群,可能是因为若尔盖是黄河流域的多雨区,其潮湿多水的环境为双翅目昆虫的生长发育提供了优越的条件[26]。
已有研究表明双翅目幼虫中的尖眼蕈蚊科幼虫和摇蚊科幼虫受水分影响较大[31- 32]。此外,本研究还发现双翅目昆虫密度仅与pH值呈显著负相关性。随着退化程度的加重,土壤pH值逐渐升高,这也会对双翅目产生不利的影响。本文中数量较大的鞘翅目幼虫,如象甲科幼虫、金龟甲科幼虫及叶甲科幼虫均为植食性昆虫[32],因此他们易受植物群落的影响。而本文的研究表明鞘翅目密度与地下生物量和有效磷含量呈显著正相关(表5),表明鞘翅目昆虫除了受植物群落的影响外,还受土壤环境的影响。在重度退化草甸中植被种类、盖度及生物量等均显著低于其他退化阶段[15],因此重度退化草甸的鞘翅目昆虫密度显著低于其他退化阶段。
4.2高寒草甸退化对土壤昆虫季节动态的影响
在高寒草甸不同退化阶段土壤昆虫密度、类群数和多样性均有显著的季节变化,但不同退化阶段间的季节动态不同。草原草甸和中度退化草甸土壤昆虫的密度和类群数均以5月份最高,10月最低,与内蒙古草原土壤昆虫的季节动态相似[33]。但沼泽草甸的土壤昆虫密度和类群数则以4月份最高,可能是因为沼泽草甸地势低洼、地表聚集较多水分,尤其是在5至9月间该区降雨较多[34],土壤水分处于饱和状态,造成一些土壤昆虫直接淹没死亡或因土壤空气缺氧窒息死亡[30]。在本文的研究中,重度退化草甸实际上是已经沙化了的草甸,其土壤有机质及养分含量非常低,而且长期干燥,地上基本没有植物,无法为土壤昆虫提供食物资源。所以该退化阶段的土壤昆虫个体数量非常少,以至于观察不到明显的季节变化。
致谢:西南民族大学崔丽巍、张洪芝、何先进、于晓飞、李占洋、师方等同学参与野外采样及室内工作。
参考文献(References):
[1]Fu S L, Zou X M, Coleman D. Highlights and perspectives of soil biology and ecology research in China. Soil Biology & Biochemistry, 2009, 41(5): 868- 876.
[2]Biaggini M, Consorti R, Dapporto L, Dellacasa M, Paggetti E, Corti C. The taxonomic level order as a possible tool for rapid assessment of arthropod diversity in agricultural landscapes. Agriculture Ecosystems & Environment, 2007, 122(2): 183- 191.
[3]陈瑜, 马春森. 气候变暖对昆虫影响研究进展. 生态学报, 2010, 30(8): 2159- 2172.
[4]Nahmani J, Lavelle P, Rossi J P. Does changing the taxonomical resolution alter the value of soil macroinvertebrates as bioindicators of metal pollution?. Soil Biology & Biochemistry, 2006, 38(2): 385- 396.
[5]欧晓红, 秦瑞豪, 王林. 滇池李居山生态恢复区昆虫多样性调查与分析. 云南环境科学, 2004, 23(增刊): 129- 131.
[6]王义平, 吴鸿, 徐华潮. 以昆虫作为指示生物评估森林健康的生物学与生态学基础. 应用生态学报, 2008, 19(7): 1625- 1630.
[7]孙鸿烈. 青藏高原的形成演化. 上海: 上海科学技术出版社, 1996.
[8]丁明军, 张镱锂, 刘林山, 王兆峰. 1982—2009年青藏高原草地覆盖度时空变化特征. 自然资源学报, 2010, 25(12): 2114- 2122.
[9]雍国玮, 石承苍, 邱鹏飞. 川西北高原若尔盖草地沙化及湿地萎缩动态遥感监测. 山地学报, 2003, 21(6): 758- 762.
[10]胡光印, 董治宝, 魏振海, 逯军峰, 颜长珍. 近30a来若尔盖盆地沙漠化时空演变过程及成因分析. 地球科学进展, 2009, 24(8): 908- 916.
[11]王乾, 包维楷, 晏兆莉, Timo K, Alfred C, Angela M. 若尔盖西部草甸的基本类型、特点及近几十年来的变化. 应用与环境生物学报, 2002, 8(2): 133- 141.
[12]田应兵, 熊明标, 宋光煜. 若尔盖高原湿地土壤的恢复演替及其水分与养分变化. 生态学杂志, 2005, 24(1): 21- 25.
[13]Stacey D A. The effects of climate change on invasive insect pests in the UK. Antenna, 1999, 23(4): 254- 256.
[14]Gray D R. The relationship between climate and outbreak characteristics of the spruce budworm in eastern Canada. Climatic Change, 2008, 87(3/4): 361- 383.
[15]吴鹏飞, 张洪芝, 崔丽巍, 钟红梅, 王永. 大型土壤动物群落对高寒草甸退化的响应. 土壤学报, 2013, 50(4): 786- 799.
[16]尹文英. 中国土壤动物检索图鉴. 北京: 科学出版社, 1998.
[17]李鸿兴, 隋敬之, 周士秀, 周勤, 孙洪国. 昆虫分类检索. 北京: 农业出版社, 1987.
[18]钟觉民. 幼虫分类学. 北京: 农业出版社, 1990.
[19]刘任涛, 赵哈林, 赵学勇. 半干旱区草地土壤动物多样性的季节变化及其与温湿度的关系. 干旱区资源与环境, 2013, 27(1): 98- 101.
[20]Shannon C E, Weaver W. The Mathematical Theory of Communication. Urbana: University of Illinois Press, 1949.
[21]Simpson E H. Measurement of diversity. Nature, 1949, 163(4148): 688- 689.
[22]Rempala G A, Seweryn M. Methods for diversity overlap analysis in T-cell receptor populations. Journal of Mathematical Biology, 2013, 67(6/7): 1339- 1368.
[23]Koehler H. Secondary succession of soil mesofauna: A thirteen year study. Applied Soil Ecology, 1998, 9(1/3): 81- 86.
[24]吴鹏飞, 华翠, 魏雪. 若尔盖高寒草甸不同功能群植物数量特征对退化演替的响应. 西南民族大学学报, 2014, 40(3): 1- 9.
[25]吴鹏飞, 杨大星. 若尔盖高寒草甸退化对中小型土壤动物群落的影响. 生态学报, 2011, 31(13): 3745- 3757.
[26]顾伟, 马玲, 丁新华, 张静, 韩争伟. 扎龙湿地不同生境的昆虫多样性. 应用生态学报, 2011, 22(9): 2405- 2412.
[27]傅必谦, 陈卫, 董晓晖, 邢忠民, 高武. 北京松山四种大型土壤动物群落组成和结构. 生态学报, 2002, 22(2): 215- 223.
[28]谷艳芳, 张莉, 丁圣彦, 钦绳武. 长期施肥对麦田大型土壤动物群落结构的影响. 生态学报, 2011, 31(17): 4900- 4906.
[29]肖能文, 刘向辉, 戈峰, 欧阳志云. 高黎贡山自然保护区大型土壤动物群落特征. 生态学报, 2009, 29(7): 3576- 3584.
[30]李娜, 张雪萍, 张利敏. 三种温带森林大型土壤动物群落结构的时空动态. 生态学报, 2013, 33(19): 6236- 6245.
[31]苏兰, 黄俊浩, 吴明, 吴鸿. 湿地植被演替中昆虫多样性变化研究进展. 生态学杂志, 2012, 31(6): 1577- 1584.
[32]林琳, 邬天媛, 李景科, 张雪萍. 大庆草甸草原区大型土壤动物功能类群. 地理研究, 2013, 32(1): 41- 54.
[33]兴安, 罗瑞芳, 刘新民. 内蒙古典型草原大型土壤动物群落特征. 内蒙古师范大学学报: 自然科学汉文版, 2011, 40(6): 622- 628.
[34]郭洁, 李国平. 若尔盖气候变化及其对湿地退化的影响. 高原气象, 2007, 26(2): 422- 428.
Effects of alpine meadow degradation on soil insect diversity in the Qinghai-Tibetan Plateau
GAO Yanmei, WU Pengfei*
CollegeofLifeScienceandTechnology,SouthwestUniversityforNationalities,Chengdu610041,China
Abstract:Soil insects are an important component and play a key role in the material cycling and energy flow processes in grassland ecosystems. However, soil insect populations are easily influenced by changes in environmental factors. The Qinghai-Tibetan Plateau is the highest and largest plateau in the world, and is mainly dominated by alpine meadow vegetation. Alpine meadow degradation has become an important, widespread, and growing ecological problem in the Qinghai-Tibetan Plateau due to the effects of climate change and increasing overgrazing. The Zoigê wetland, which is located on the eastern edge of the Qinghai-Tibetan Plateau, has also degraded due to climate change and increased overgrazing over the last 50 years. Currently, there are four typical habitats (swamp meadow, grassland meadow, moderately degraded meadow, and seriously degraded meadow) in this area. However, the changes in the structure and diversity of the soil insect community among the four habitats are unknown. Six plots of 50 cm × 50 cm were selected in each habitat to investigate the effects of alpine meadow degradation on the soil insect community in April, May, July, and October of 2011. A total of 4,172 insect individuals were captured and classified into 8 orders, 35 families, and 46 taxonomic groups. The Sciaridae larvae, Chironomidae larvae, and Curculionidae larvae were the dominant groups in soil insect communities, and Sciaridae larvae comprised the most dominant group at all four degradation phases. The density and diversity indices of the soil insects were significantly lower in the seriously degraded meadow compared with the other degradation phases (P < 0.01). The Sorenson and Morisita-Horn similarity indices in the different degradation stages indicated that degradation of the alpine meadow had a strong effect on the taxonomic composition and dominant group abundances of soil insect communities. Moreover, the seasonal dynamics in the density and diversity of soil insect communities also differed among the different degradation stages. Degradation of the alpine meadow also changed the spatio-temporal distributions of the dominant taxonomic groups of soil insect communities. Correlation analysis showed that the diversity indices of soil insect communities were negatively correlated to soil pH (P < 0.01) and were positively correlated to below-ground biomass and phosphorus contents (P < 0.01), while the community density was only negatively correlated to soil pH (P < 0.01). Our results indicated that degradation of the alpine meadow influenced the taxonomic composition and spatio-temporal distributions of the soil insect communities by altering plant communities and soil properties.
Key Words:soil insect; diversity; alpine meadow; degradation; Zoigê
基金项目:国家自然科学基金资助项目(41371270, 40801092);四川省教育厅创新团队资助项目(14TD0049);中央高校优秀团队及重大孵化项目(2014NZYTD01资助和西南民族大学研究生创新型科研项目(CX2014SZ114)
收稿日期:2014- 11- 04; 网络出版日期:2015- 05- 18
*通讯作者
Corresponding author.E-mail: wupf@swun.cn
DOI:10.5846/stxb201411042173
高艳美,吴鹏飞.高寒草甸退化对土壤昆虫多样性的影响.生态学报,2016,36(8):2327- 2336.
Gao Y M, Wu P F.Effects of alpine meadow degradation on soil insect diversity in the Qinghai-Tibetan Plateau.Acta Ecologica Sinica,2016,36(8):2327- 2336.
