氮添加对内蒙古温带典型草原生态系统碳交换的影响
2016-07-21游成铭胡中民干友民李凌浩白文明李胜功
游成铭,胡中民,郭 群,干友民,李凌浩,白文明,李胜功
1 四川农业大学动物科技学院, 成都 611731 2 中国科学院地理科学与资源研究所生态系统观测与模拟重点实验室, 北京 100101 3 中国科学院植物研究所植被与环境变化国家重点实验室, 北京 100093
氮添加对内蒙古温带典型草原生态系统碳交换的影响
游成铭1,2,胡中民2,郭群2,干友民1,*,李凌浩3,白文明3,李胜功2
1 四川农业大学动物科技学院, 成都611731 2 中国科学院地理科学与资源研究所生态系统观测与模拟重点实验室, 北京100101 3 中国科学院植物研究所植被与环境变化国家重点实验室, 北京100093
摘要:生态系统碳交换(NEE)是评估碳循环及平衡的重要指标,由生态系统总初级生产力(GPP)和生态系统呼吸(ER)共同决定。以往研究表明,N添加能显著促进草地生态系统植物的生长进而提高生态系统的生产力,但N添加如何影响生态系统碳交换的结论仍不明确。同时,对于不同剂量的N添加对生态系统碳交换影响有何差异也不清楚。于2012和2013年在内蒙古草原开展N添加控制实验,设置中等剂量(10 g N m-2a-1,N10)和高等剂量(40 g N m-2a-1,N40)两个N添加处理,并采用生态系统原位观测箱系统监测不同N处理条件下的NEE动态。结果表明:2年中等剂量N添加处理(N10)下GPP较对照分别增加了15.6%和20%,而ER的变化不显著,该处理下NEE较对照显著降低了230%和337% (即固碳能力增强)。与中等剂量N添加处理结果不同,高等剂量N添加处理下GPP和ER均有不显著的降低趋势,同时,尽管该处理下NEE有升高的趋势(即固碳能力降低),但并不显著。土壤水分改善、土壤温度下降以及叶片N浓度增加可能是中等剂量氮添加促进该生态系统固碳能力的重要机制,而土壤酸化和物种组成改变可能是导致高等剂量N添加下生态系统固碳能力低于中等剂量的重要原因。研究结果表明,不同剂量N添加对生态系统生产力与呼吸的作用机制存在差异,导致生态系统固碳能力有着明显区别。
关键词:氮添加;草原生态系统;生态系统碳交换;总初级生产力;生态系统呼吸
随着工业用氮和农业氮肥的使用,氮沉降在世界范围内显著增加[1]。中国现已成为继欧美之后的第三大主要氮沉降区域[2],且高氮沉降区逐渐从东南向西北蔓延。随经济和工业的发展,内蒙古N沉降正迅速增加[3]。氮沉降对生态系统结构与功能有着重要的影响[1],模拟氮沉降的实验表明,N添加可以提高草地生态系统的生产力[4- 5],通过改变光合或呼吸速率影响生态系统碳循环[6- 8],并且在干旱半干旱地区表现尤为明显[9]。内蒙古草原属于干旱半干旱地区,是欧亚草原的典型代表,地域辽阔,在中国和世界范围内都有重要的生态地位[3]。因此,研究N添加对内蒙古温带草原生态系统碳循环过程的影响具有重要意义。
生态系统碳交换(NEE)是评估碳循环及平衡的重要指标,由生态系统总初级生产力(GPP)和生态系统呼吸(ER)两个过程共同决定[10]。NEE为正表明生态系统净碳释放(即碳源),NEE为负则表明生态系统净碳吸收 (即碳汇)[10]。目前,针对氮添加对生态系统生产力[4- 5]、土壤呼吸[11- 12]、凋落物分解[13- 14]等碳循环关键过程的影响已经分别开展了大量研究。然而,当前多数研究仅关注碳循环某单一过程 (如生产力或土壤呼吸),缺乏N添加对GPP和ER影响机制的深入认识,致使人们对N添加对生态系统NEE的影响缺乏深入理解,N添加对NEE影响的结论仍不明确[15- 16]。例如,Niu等人[6,10,17- 19]研究表明N添加可以显著降低温带草原、草甸草原、沼泽的NEE (即固碳功能增强),但Saarnio等人[20- 23]研究发现N添加对沼泽、北方泥炭地、一年生草原、森林的NEE没有显著影响,而Mo等人[24]更是发现N添加显著提高了森林的NEE。 另外,当前研究大多关注N添加本身对生态系统NEE的影响,在实验过程中侧重于单一剂量N添加条件下NEE的动态[23]。由于生态系统所处的气候、土壤条件、群落结构本身的差异及不同剂量的N添加可能对NEE的影响有着截然的区别[19,21,23- 24]。因此,对于不同剂量的N添加对生态系统NEE的影响有何差异,目前对其的相关认识相当匮乏。再者,由于观测技术的限制,多数研究通过人工搬运观测箱,间断地手动观测N添加处理下生态系统NEE的动态特征。这种方法一方面耗费大量人力,另一方面由于未完全监测到不同气象条件下的NEE,可能导致评估N添加对NEE的影响造成一定偏差。开展动态箱原位自动连续观测则可以有效避免这一不足[25]。
大量研究表明,温度和水分是影响生态系统碳交换的关键因素[10,17,19]。在N添加条件下土壤微环境的改变是否利于生态系统碳固定具有诸多不确定。基于以往研究结果[26- 27],N添加促进植物生长,群落盖度和凋落物生物量增加,地表蒸发和光照辐射降低进而增加土壤含水量和降低土壤温度。从这个角度而言,N添加则可能促进生态系统生产力而降低生态系统呼吸,进而有利于生态系统碳固定。尽管如此,目前关于N添加对土壤微环境的影响研究仍较少,对于不同剂量N添加是否影响微环境的土壤温度和含水量进而影响NEE目前也不清楚。
基于上述研究不足,本研究以内蒙古温带典型草原为研究对象,依托人为添加中等剂量(10 g N m-2a-1)和高等剂量(40 g N m-2a-1)N素的控制实验,通过多通道自动原位监测箱系统连续监测这两个N添加剂量下生态系统NEE及相关环境因子。本研究拟回答3个科学问题:(1)N添加是否能促进该草地生态系统的固碳能力(即降低NEE)?N添加对NEE的影响主要是通过影响GPP实现还是通过ER实现?(2)中等剂量和高等剂量N添加对内蒙古温带草地NEE的影响是否一致,若存在差异,其主要原因在于?(3) N添加是否影响土壤微环境进而影响NEE?本研究将为深入认识N添加对草地生态系统碳收支的影响机理提供理论基础。
1材料与方法
1.1实验地概况
实验地位于内蒙古自治区锡林郭勒盟多伦县中国科学院植物研究所恢复生态学实验示范研究站(42°02′N, 116°17′E, 1324 m),属于温带典型草原。年均降水量为385.5mm,集中分布在6—9月 (大约占全年降水量的80%),年季波动较大;年蒸发量为1600—1800 mm,平均蒸发量约为1748.0 mm,是降水量的4—5倍。年均温大约为2.1℃,最低和最高的月平均气温为1月的-17.5℃和7月的18.9℃。依据中国土壤分类方法,土壤类型为栗钙土,土壤pH值为7.12,有机质含量为12.28g/Kg,容重为1.31gcm-3,土壤N、P含量分别为0.17%和0.28 g/Kg。群落主要植被优势种为克氏针茅(Stipakrylovii)、冰草(Agropyroncristatum)和冷蒿(Artemisiafrigida),生长期约150d,生长旺季,植物群落高度约为0.5 m[10, 17]。
1.2实验设计
实验采用随机区组设计,共设置4个区组。为揭示不同剂量N添加对生态系统碳交换影响的差异。实验设置3个处理:对照(0 g N m-2a-1, N0),中等剂量N添加(10 g N m-2a-1, N10),高等剂量N添加(40g N m-2a-1, N40),每个处理4个重复,共12个样方。每个样方大小均为4m×3m,区组间距3m,样方间距2m。氮肥选择尿素(CO(NH2)2),于2012、2013年的5—6月分两次选择强降雨来临前一天撒施。
1.3观测系统
实验采用日本国立环境研究所研发的自动多通道监控系统测定生态系统NEE[28]。该系统由12个透明的自动观测气室和一个控制系统组成[26]。气室体积为100cm×100cm×50cm,生长季初期,同时把12个气室分别放入N添加处理样方和对照样方内,每个处理4次重复,并密封土壤与气室的接触口,保证每个气室监测时均处于密闭状态。每个气室安装两个风扇以保证测定时空气充分混合,气室顶部的两个盖子由控制系统控制开闭,侧面开两扇窗户保证空气对流,以减小箱体对地表的增温效果(非测定期间上盖及侧窗均处于敞开状态)。
控制系统的核心部件是一个红外线气体分析仪(IRGA)和一个数据采集器。测量过程中,观测气室上盖与侧窗关闭,气室内的空气经微型气泵(CM-50, Enomoto. Ltd.,Tokyo, Japan)通过封闭腔室的红外气体分析仪(IRGA)之后返回观测气室。IRGA每秒输出信号,数据采集器 (CR3000,Campbell Scientific, Inc., Logan, UT, USA)每10s记录1次数据,每个气室每半小时测定1次,每次测定时间为150s。为避免气路污染和压力影响,测定期间前后10s做无效数据剔除。生态系统碳交换通过测定时段(即130s)CO2浓度变化计算得到:
NEE= (VP (1-W)/RST)× (uc/ut)
(1)
式中,V为气室体积大小(m3),P为气室压力大小(Pa),W为气室水蒸汽摩尔数,R为气体常数(8.314 Pa m3K-1),S为气室面积大小(m2),T是腔室温度(k),uc/ut为二氧化碳摩尔分数的增加率(μmol mol-1s-1)。系统在夜间只有呼吸作用,夜间测得的NEE值即为夜间生态系统呼吸(ER)。根据实时测定的土壤温度和水分与ER建立指数方程进而计算白天的ER。根据GPP、ER和NEE三者之间关系计算GPP,计算公式如下:
GPP=ER-NEE
(2)
式中,NEE负值代表生态系统碳固定,而NEE正值代表生态系统碳排放。
土壤温度(地表0—5 cm)由各室中自制的热电偶温度计实时测定。土壤含水量(0—10cm)在7、8月份每3d测定1次,每次均在14:00—15:00用Diviner 2000测定 (Sentek Pty. Ltd, Australia)。植物地上生物量测定采用传统的收获法,在8月中旬草原地上生物量最大时采样,在每个样方内设置1m×1m的小样方,分种齐地刈割植物,分别装入编号信封。105℃杀青2h后在 65℃下烘干至恒重用电子天平(精度为 0.01g)称量,最后用每个小样方内各个种的干重之和数据计算群落地上生物量(g/m2)。植物地上部分及凋落物C、N含量测定采用PE-2400 CHN analyzer (Perkin-Elmer, Foster City, USA)测定,土壤pH(0—10cm)采用Russell RL060P portable pH meter (Thermo Electron Corporation 166 Cummings Center, USA)测定。
1.4数据处理
用单因素方差分析(One-way ANOVA)确定中等剂量和高等计量N添加对内蒙古温带典型草原GPP、ER、NEE、地上生物量、凋落物生物量、叶片碳氮含量、土壤pH、土壤温度和含水量的影响,用Duncan多重比较法进行显著性检验。数据均采用SPSS 17.0(SPSS, Chicago, USA)进行统计分析,统计图形在Origin(version 8.0)中绘制,图中数据均为平均值(mean)±标准误(SE)。
2结果
2.1氮添加对GPP、ER和NEE的影响。
与对照相比,两年N10处理均不同程度使GPP升高,2012年差异不显著,2013年显著增加了20% (图1)。N10处理对ER的影响较小,2012与2013年N10处理下的ER与对照的差异均不显著(图1)。与N10处理不同的是,N40处理对GPP和ER的影响均较小,两年的实验结果显示N40处理对GPP的影响不显著,而对ER的影响仅在2013年显著降低 (9.3%) (图1)。由于N添加对GPP的促进作用,N10处理使NEE显著下降 (即固碳能力增强)。由于N40处理并未显著促进GPP,而对ER的降低效果较弱,导致该处理下NEE与对照相比无显著差异(图1)。逐月的分析表明,在生长季最重要的3个月份(6—8月),GPP和ER均在7月最大,生态系统固碳能力在6月明显弱于7月和8月(图2)。在各月份,N10处理均促进GPP增加进而使NEE下降,相比而言, 7月份的变化最大。相反,N40处理下,6—8月均未促进GPP增长,甚至使GPP低于对照(图2)。
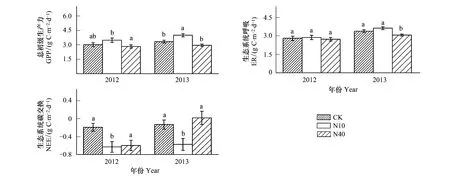
图1 氮添加对草原生态系统碳交换的影响Fig.1 Effects of the grassland ecosystem carbon exchange by N additionGPP:总初级生产力 gross primary productivity;ER:生态系统呼吸 ecosystem respiration;NEE:生态系统碳交换 net ecosystem carbon exchange;CK:对照处理 0 g N m-2a-1 添加;N10:中等剂量氮添加 10 g N m-2a-1添加;N40:高等剂量氮添加 40 g N m-2a-1添加

图2 氮添加对GPP、ER、NEE月动态的影响Fig.2 Effects on the dynamic of GPP, ER, NEE by N addition
2.2氮添加对地上、凋落物生物量及叶片氮含量、凋落物碳氮比的影响
两年实验期间,N10、N40处理分别较对照显著提高了地上生物量(26.2%, 39.75%)、(125.3%, 136.2%),但N10与N40之间无显著差异(图3)。N10、N40处理分别较对照显著提高了凋落物生物量(37.6%, 61.01%)、(73.94%,111.65%),但N10与N40之间无显著差异(图3)。N10处理较对照显著提高了植物叶片氮含量(64.76%);虽然N40处理使叶片氮含量有所提高,但差异不显著(表1)。较对照,N10处理对凋落物C/N无显著影响,而N40处理显著降低了凋落物的C/N (表1)。
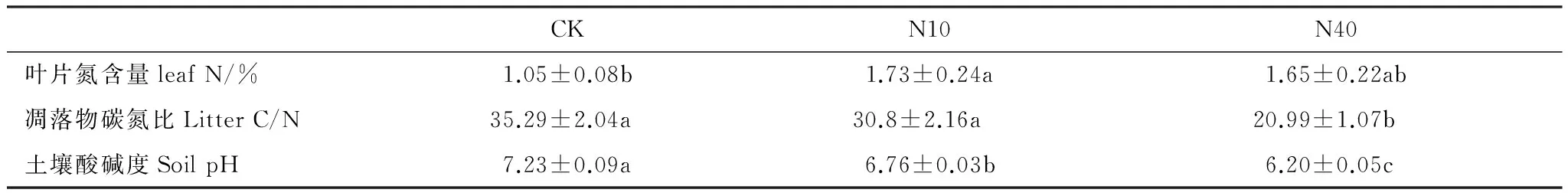
表1 氮添加对草原植物叶片N、凋落物 C/N、土壤pH的影响 (平均值±标准误差)
小写字母表示处理间差异显著 (P< 0.05);CK: 对照;N10: 10 g N m-2a-1;N40: 40 g N m-2a-1
2.3氮添加对微环境土壤温度、含水量及pH的影响
本研究结果表明,尽管差异并不显著,N10、N40处理均有降低土壤温度的趋势。尤其是实验的第2年(2013),N10处理下土壤温度明显低于对照处理(图4)。相比而言,N40处理对土壤温度的降低效果不明显。研究还表明,两个剂量的N添加处理均有增加土壤含水量的趋势,并且N40处理的增加趋势明显高于N10处理(图5)。另外,N10和N40处理均显著降低了土壤pH,且N10和N40处理之间差异显著,N40处理最显著(表1)。

图3 氮添加对草地地上生物量和凋落物生物量的影响Fig.3 Effect of the grassland aboveground biomass and litter biomass by N addition
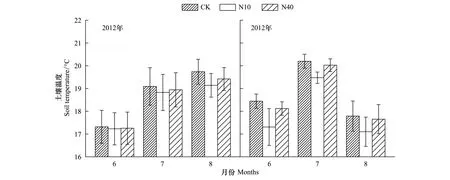
图4 氮添加对土壤温度的影响Fig.4 Effects on soil temperature by N addition
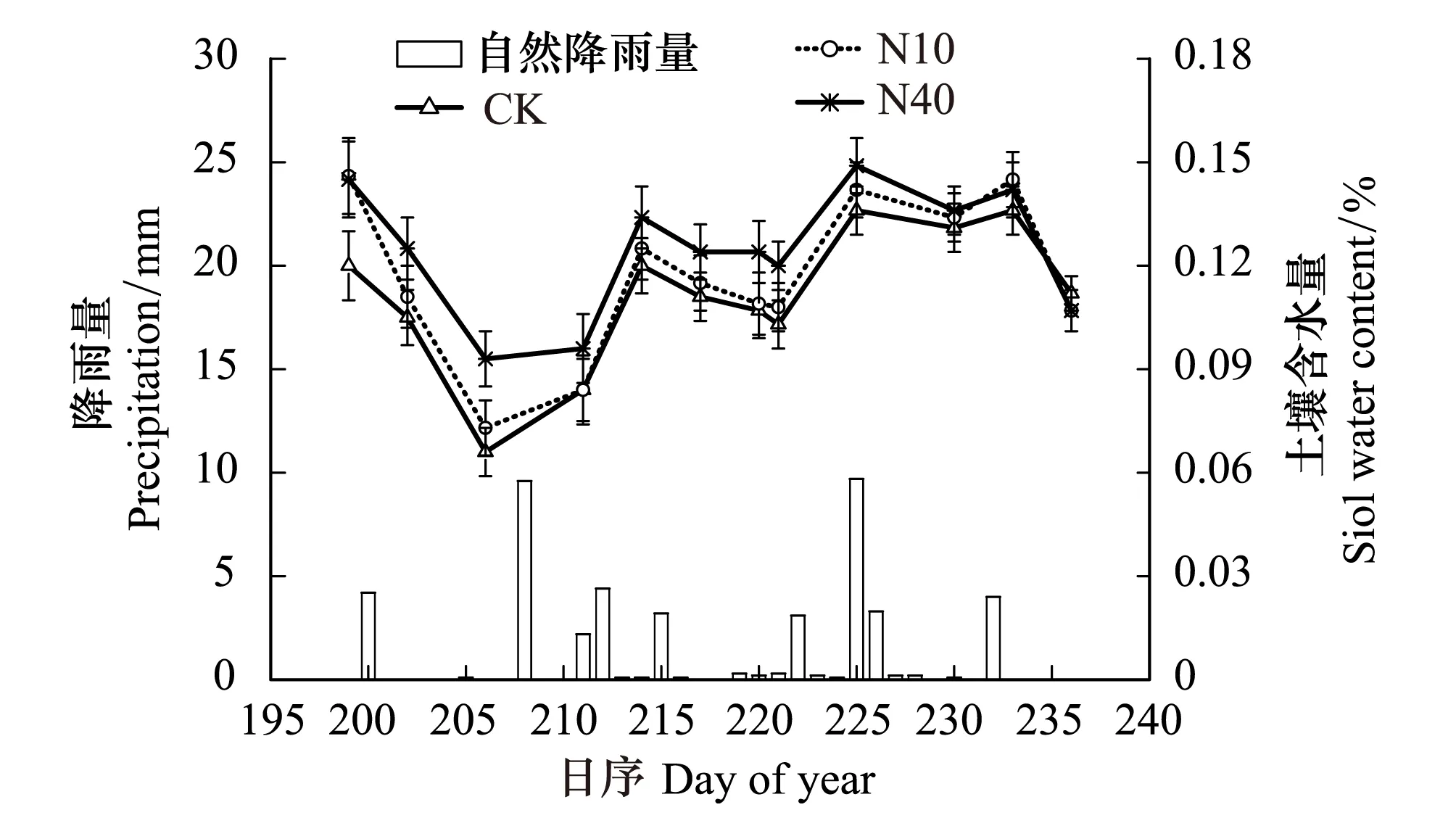
图5 氮添加对土壤含水量的影响Fig.5 Effects on soil water content by N addition
3讨论
本研究通过采用自动多通道监控系统连续监测NEE结果表明,中等剂量的N添加处理(10 g N m-2a-1)显著增加了GPP (较对照增加15.6%和20%),而对ER的影响微弱,因而导致NEE显著降低,即生态系统固碳能力增强。这一结果与6400便携式光合仪断点或短期监测草原生态系统碳交换结果相似[10,17- 19]。但由于土壤状况、物种组成等原因,N添加对GPP的增加幅度有所差异。例如,Niu和Li等人[10,19]在温带草原、草甸草原研究均发现,N添加促进植物的生长,提高叶片光合作用和叶面积指数,从而显著提高GPP (15%—59%)。Xia等人[17]的研究则发现在湿润季节,N添加主要促进杂类草的生长从而提高GPP (16%),而在干旱季节主要促进禾草的生长从而提高GPP (11.4%)。由于GPP的提高大于ER,所以在不同水文条件下N添加均显著降低了NEE。本研究也发现生态系统植被盖度及叶面积较大(利于提高光合能力)的7、8月份GPP增长幅度也较大,这也证明了N添加是通过提高光合作用而使生态系统固碳能力增强[10]。研究证明,N添加可以通过提高叶片N浓度而增强植被光合能力,如彭琴等人研究发现植物叶片氮浓度与光合能力呈线性正相关关系[29]。本实验研究也发现中等剂量N添加处理较对照使叶片氮浓度提高了64.76%,这可能是中等剂量N添加处理显著提高GPP的一个重要原因。另一方面,本研究还发现中等剂量N添加处理条件下土壤温度降低而土壤含水量升高。大量研究表明,生态系统呼吸与土壤温度呈正相关关系[11- 12],因此土壤温度的降低减少了土壤呼吸。同时,本研究区域处于干旱半干旱区,土壤水分是主要的限制因素,所以土壤水分的提高缓解了生态系统的水分限制,促进了植被生长进而使GPP增加,最终导致NEE的降低。
本实验结果还表明,高等剂量N添加处理(40 g N m-2a-1)的GPP不仅没有增加,反而出现降低趋势,同时由于ER降低幅度较GPP小,最终导致NEE增加,即生态系统固碳能力下降。但本实验高等剂量N添加处理的地上生物量虽较中等剂量N添加处理无显著差异,但较对照显著增加。这种差异可能是由于不同观测手段所导致的。收割法是草地生态系统地上净初级生产力传统的观测手段,该方法将样方中地上生物量视为当年的地上净初级生产力,但由于草地生态系统中仍存在一定比例的多年生植被(如冷蒿),这些植被中部分茎秆并不是当年生长,所以收割法在一定情况下会高估地上净初级生产力。同在本实验样地的研究发现,高等剂量N添加处理显著促进了菊科植被的生长(主要是冷蒿) (出版中),所以收获法在一定程度上高估了高等剂量N添加处理的地上净初级生产力,而连续监测系统只观测生态系统CO2的净交换,生产力估算较为准确。进一步分析发现,本实验高等剂量N添加处理叶片N含量以及土壤水分较对照有所提高,但与中等剂量N添加处理相比差异不显著。叶片N含量和土壤水分的增加本应提高GPP,但由于大量外源N输入使土壤pH显著降低 (低至6.2),严重酸化的土壤并不利于一年生植被的生长发育,从而导致GPP的降低。另一方面,外源氮输入早期可以促进凋落物的分解,但随氮输入与凋落物形成更多酚类物质,进而阻碍微生物的呼吸[13,30- 31]。Knorr等人[14]通过对凋落物整合分析也表明,高等剂量的N添加会抑制微生物的呼吸进而抑制凋落物的分解。同时,高等剂量N添加处理的土壤温度降低幅度较小,共同导致ER降低不明显,所以本研究中高等剂量N添加处理的NEE不但没有降低,反而较对照有升高的趋势。
N添加后不仅改变了叶片N含量等植被属性,本研究结果还表明,N添加改变了生态系统的微环境,即土壤温度和含水量发生改变。不同剂量N添加处理的土壤温度均有降低趋势,而土壤含水量均有增加趋势。这可能是由于N添加后植被盖度增加,减少了光照辐射而降低土壤温度。温度的降低减少了地表蒸发而进一步减少水分散失[32],提高土壤水分含量。另外,本研究结果显示N添加处理的凋落物量显著增加,而凋落物积累增强了土壤的持水能力,进而增加土壤含水量[27]。本研究结果与前人研究相似,如Fang等人[27]经过8年研究发现,中等剂量和高等剂量N添加均可以显著增加土壤含水量;Bai等人[26]研究也发现植被盖度和凋落物的增加可以增加土壤含水量。由于处于干旱半干旱区的内蒙古温带草原主要受水分的限制[22,26,33],如前所述,土壤微环境的改变对生态系统碳循环具有重要意义。一方面土壤含水量的提高缓解水分的限制,促进GPP的增加,另一方面土壤温度的降低促使生态系统呼吸减弱,共同导致NEE的降低。但本实验时间相对较短,N添加对土壤水分的升高和土壤温度的降低较对照处理在统计上无显著差异,因此N添加是否通过改变植被盖度和凋落物生物量引起微环境土壤温度和含水量的显著变化进而影响NEE需要更长的时间及进一步的深入研究。
4结论
本研究以内蒙古温带草原为研究对象,开展不同剂量N添加控制实验,探讨了中等剂量N添加(10 g N m-2a-1)和高等剂量N添加(40 g N m-2a-1)对草地生态系统碳交换的影响。经过两年实验,主要得到以下结论:(1)中等剂量N添加处理显著增加了GPP,对ER影响较小,从而显著降低了NEE(即固碳能力增强)。(2)高等剂量N添加处理的GPP和ER均有一定程度的降低趋势,但GPP降低幅度较ER大,所以NEE有升高的趋势,但差异不显著。 (3)土壤水分改善、土壤温度降低及叶片N浓度增加可能是中等剂量氮添加促进该生态系统固碳能力的重要机制,而土壤酸化和物种组成改变可能是导致高等剂量N添加下生态系统固碳能力低于中等剂量的重要原因。本研究结果表明,不同的N添加剂量对生态系统生产力与呼吸的作用机制存在差异,导致生态系统固碳能力有着明显区别,对生态系统过程模型改进有着一定参考意义。
参考文献(References):
[1]James N Galloway, Alan R Townsend, Jan Willem Erisman, Mateete Bekunda, Zucong Cai, John R Freney, Luiz A Martinelli, Sybil P Seitzinger, Mark A Sutton. Transformation of the nitrogen cycle: recent trends, questions, and potential solutions. Science, 2008, 320(5878): 889- 892.
[2]Dentener F, Drevet J, Lamarque J F, Bey I, Eickhout B, Fiore A M, Hauglustaine D, Horowitz L W, Krol M, Kulshrestha U C, Lawrence M, Galy- Lacaux C, Rast S, Shindell D, Stevenson D, Van Noije T, Atherton C, Bell N, Bergman D, Butler T, Cofala J, Collins B, Doherty R, Ellingsen K, Galloway J, Gauss M, Montanaro V, Müller J F, Pitari G, Rodriguez J, Sanderson M, Solmon F, Strahan S, Schultz M, Sudo K, Szopa S, Wild O. Nitrogen and sulfur deposition on regional and global scales: a multimodel evaluation. Global Biogeochemical Cycles, 2006, 20(4): GB4003.
[3]Lü C Q, Tian H Q. Spatial and temporal patterns of nitrogen deposition in China: Synthesis of observational data. Journal of Geophysical Research: Atmospheres (1984- 2012), 2007, 112: D22S05.
[4]David S LeBauer, Kathleen K Treseder. Nitrogen limitation of net primary productivity in terrestrial ecosystems is globally distributed. Ecology, 2008, 89: 371- 379.
[5]Xia J Y, Wan S Q. Global response patterns of terrestrial plant species to nitrogen addition. New Phytologist, 2008, 179(2): 428- 439.
[6]Luca Bragazza, Chris Freeman, Timothy Jones, Håkan Rydin, Juul Limpens, Nathalie Fenner, Tim Ellis, Renato Gerdol, Michal Hájek, Tomáš Hájek, Paola Iacumin, Lado Kutnar, Teemu Tahvanainen, Hannah Toberman. Atmospheric nitrogen deposition promotes carbon loss from peat bogs. Proceedings of the National Academy of Sciences of the United States of America, 2006, 103(51): 19386- 19389.
[7]Cory C Cleveland, Alan R Townsend. Nutrient additions to a tropical rain forest drive substantial soil carbon dioxide losses to the atmosphere. Proceedings of the National Academy of Sciences of the United States of America, 2006, 103(27): 10316- 10321.
[8]Xu W H, Wan S Q. Water-and plant-mediated responses of soil respiration to topography, fire, and nitrogen fertilization in a semiarid grassland in northern China. Soil Biology and Biochemistry, 2008, 40(3): 679- 687.
[9]Lindsey Christensen, Michael B Coughenour, James E Ellis, Chen ZZ. Vulnerability of the Asian typical steppe to grazing and climate change. Climatic Change, 2004, 63(3): 351- 368.
[10]Niu S L, Wu M Y, Han Y, Xia J Y, Zhang Z, Yang H J, Wan S Q. Nitrogen effects on net ecosystem carbon exchange in a temperate steppe. Global Change Biology, 2010, 16(1): 144- 155.
[11]Yan L M, Chen S P, Huang J H, Lin G H. Differential responses of auto- and heterotrophic soil respiration to water and nitrogen addition in a semiarid temperate steppe. Global Change Biology, 2010, 16(8): 2345- 2357.
[12]Zhou X H, Wan S Q, Luo Y Q. Source components and interannual variability of soil CO2efflux under experimental warming and clipping in a grassland ecosystem. Global Change Biology, 2007, 13(4): 761- 775.
[13]Kathleen K Treseder. Nitrogen additions and microbial biomass: A meta-analysis of ecosystem studies. Ecology Letters, 2008, 11(10): 1111- 1120.
[14]Knorr M, Frey S D, Curtis P S. Nitrogen additions and litter decomposition: a meta-analysis. Ecology, 2005, 86: 3252- 3257.
[15]Mark A Bradford, Noah Fierer, Robert B Jackson, Thomas R Maddox, James F Reynolds. Nonlinear root-derived carbon sequestration across a gradient of nitrogen and phosphorous deposition in experimental mesocosms. Global Change Biology, 2008, 14(5): 1113- 1124.
[16]Dave S Reay, Frank Dentener, Pete Smith, John Grace, Richard A Feely. Global nitrogen deposition and carbon sinks. Nature Geoscience, 2008, 1: 430- 437.
[17]Xia J Y, Niu S L, Wan S Q. Response of ecosystem carbon exchange to warming and nitrogen addition during two hydrologically contrasting growing seasons in a temperate steppe. Global Change Biology, 2009, 15(6): 1544- 1556.
[18]Niu S L, Yang H J, Zhang Z, Wu M Y, Lu Q, Li L H, Han X G, Wan S Q. Non-additive effects of water and nitrogen addition on ecosystem carbon exchange in a temperate steppe. Ecosystems, 2009, 12(6): 915- 926.
[19]Li J, Guo R, Zhu T C, Niu X D, Guo J X, Sun W. Water-and plant-mediated responses of ecosystem carbon fluxes to warming and nitrogen addition on the Songnen grassland in northeast China. Plos One, 2012, 7(9): e45205.
[20]Sanna Saarnio, Sanna Järviö, Timo Saarinen, Harri Vasander, Jouko Silvola. Minor changes in vegetation and carbon gas balance in a boreal mire under a raised CO2or NH4NO3supply. Ecosystems, 2003, 6(1): 46- 60.
[21]Jill L Bubier, Tim R Moore, Leszek A Bledzki. Effects of nutrient addition on vegetation and carbon cycling in an ombrotrophic bog. Global Change Biology, 2007, 13(6): 1168- 1186.
[22]W Stanley Harpole, Daniel L Potts, Katharine N Suding. Ecosystem responses to water and nitrogen amendment in a California grassland. Global Change Biology, 2007, 13(11): 2341- 2348.
[23]Steven D Allison, Claudia I Czimczik, Kathleen K Treseder. Microbial activity and soil respiration under nitrogen addition in Alaskan boreal forest. Global Change Biology, 2008, 14(5): 1156- 1168.
[24]Mo J M, Zhang W, Zhu W X, Gundersen Per, Fang Y T, Li D J, Wang H. Nitrogen addition reduces soil respiration in a mature tropical forest in southern China. Global Change Biology, 2008, 14(2): 403- 412.
[25]Tan Z H, Zhang Y P, Liang N S, Song Q H, Liu Y H, You G Y, Li L H, Yu L, Wu C S, Lu Z Y, Wen H D, Zhao J F, Gao F, Yang L Y, Song L, Zhang Y J, Teramoto Munemasa, Sha L Q. Soil respiration in an old-growth subtropical forest: Patterns, components, and controls. Journal of Geophysical Research: Atmosphere, 2013, 118(7): 2981- 2990.
[26]Bai Y F, Wu J G, Christopher M Clark, Shahid Naeem, Pan Q M, Huang J H, Zhang L X, Han X G. Tradeoffs and thresholds in the effects of nitrogen addition on biodiversity and ecosystem functioning: evidence from inner Mongolia Grasslands. Global Change Biology, 2010, 16(1): 358- 372.
[27]Fang Y, Xun F, Bai W M, Zhang W H, Li L H. Long-Term nitrogen addition leads to loss of species richness due to litter accumulation and soil acidification in a temperate steppe. Plos One, 2013, 7(10): e47369.
[28]Liang N S, Gen Inoue, Yasumi Fujinuma. A multichannel automated chamber system for continuous measurement of forest soil CO2efflux. Tree Physiology, 2003, 23(12): 825- 832.
[29]彭琴, 董云社, 齐玉春. 氮输入对陆地生态系统碳循环关键过程的影响. 地球科学进展, 2008, 23(8): 874- 883.
[30]王纳纳, 陈颖, 应娇妍, 高勇生, 白永飞. 内蒙古草原典型植物对土壤微生物群落的影响. 植物生态学报, 2014, 38(2): 201- 208.
[31]施瑶, 王忠强, 张心昱, 孙晓敏, 刘希玉, 何念鹏, 庾强. 氮磷添加对内蒙古温带典型草原土壤微生物群落结构的影响. 生态学报, 2014, 34(17): 4943- 4949.
[32]E S Deutsch, E W Bork, W D Willms. Soil moisture and plant growth responses to litter and defoliation impacts in Parkland grasslands. Agriculture, Ecosystems & Environment, 2010, 135(1/2): 1- 9.
[33]Niu S L, Wu M Y, Han Y, Xia J Y, Li L H, Wan S Q. Water- mediated responses of ecosystem carbon fluxes to climatic change in a temperate steppe. New Phytologist, 2008, 177(1): 209- 219.
Effects of nitrogen addition on carbon exchange in a typical steppe in Inner Mongolia
YOU Chengming1,2,HU Zhongmin2,GUO Qun2,GAN Youmin1,*,LI Linghao3,BAI Wenming3,LI Shenggong2
1CollegeofAnimalScienceandTechnology,SichuanAgriculturalUniversity,Chengdu611731,China2KeyLaboratoryofEcosystemNetworkObservationandModeling,InstituteofGeographicalSciencesandNaturalResourcesResearch,ChineseAcademyofSciences,Beijing100101,China3StateKeyLaboratoryofVegetationandEnvironmentalChange,InstituteofBotany,ChineseAcademyofScience,Xiangshan,Beijing100093,China
Abstract:Net ecosystem carbon exchange (NEE), an important indicator of the carbon cycle and carbon balance, is determined by gross primary productivity (GPP) and ecosystem respiration (ER). With the increased use of nitrogen (N) in industry and agriculture, N deposition has significantly increased globally. It has been widely documented that N enrichment stimulates plant growth, and thereby enhances productivity in grassland ecosystems. However, little is known about how N addition affects NEE and what are the differences in the conditions between various N addition levels. To address these questions, we conducted a manipulative experiment of N addition in a typical steppe in Inner Mongolia, China, in 2012 and 2013. Two treatments and a control (0 g N m-2a-1) were set up: a moderate (10 g N m-2a-1) and a high (40 g N m-2a-1) level of N addition. NEE was observed continuously in high time-resolution using a dynamic chamber system. Our results showed that the GPP of moderate N addition increased by 15.6% and 20% in 2012 and 2013, respectively, whereas there was no significant effect on ER. As a result of GPP enhancement, NEE significantly decreased (i.e., enhanced carbon sequestration capacity) by 230% and 337% in 2012 and 2013, respectively. In contrast, high N addition did not significantly affect GPP, ER, or NEE. Our results also showed that the enhanced carbon sequestration capacity was mainly attributable to increased soil water content and N concentration of plant leaves, and a decrease in soil temperature in the moderate N addition treatment. However, enhanced soil acidity and changes in species composition could have resulted in lower carbon sequestration capacities of the high N addition treatment. Our results indicated that the effects of N addition on GPP and ER depend on the amount of N added, which leads to remarkably different carbon sequestration capacities. The findings of this study could be used to improve process models for grassland ecosystems.
Key Words:nitrogen addition; grassland ecological system; net ecosystem carbon exchange; gross primary production; ecosystem respiration
基金项目:国家自然科学基金项目(31570437, 41301043, 31400425);中国科学院地理科学与资源研究所青年人才项目(2013RC203);科技部科技支撑项目(2013BAC03B03)
收稿日期:2014- 10- 04;
修订日期:2015- 06- 03
*通讯作者
Corresponding author.E-mail: ganyoumin1954@163.com
DOI:10.5846/stxb201410041955
游成铭,胡中民,郭群,干友民,李凌浩,白文明,李胜功.氮添加对内蒙古温带典型草原生态系统碳交换的影响.生态学报,2016,36(8):2142- 2150.
You C M,Hu Z M,Guo Q,Gan Y M,Li L H,Bai W M,Li S G.Effects of nitrogen addition on carbon exchange in a typical steppe in Inner Mongolia.Acta Ecologica Sinica,2016,36(8):2142- 2150.
