微生物混合对纤维素酶活的影响
2016-07-21郝建宇侯红萍郑渊洁
郝建宇,侯红萍,郑渊洁
(山西农业大学 食品科学与工程学院,山西 太谷 030801)
微生物混合对纤维素酶活的影响
郝建宇,侯红萍*,郑渊洁
(山西农业大学 食品科学与工程学院,山西 太谷 030801)
摘要:[目的]研究微生物共存及优化纤维素酶酶系种类和比例搭配。[方法]分别把里氏木霉、黑曲霉和两者1∶1混合菌系以总接种量8 mL接入产酶培养基中,10 d内每天测定3种纤维素酶组分酶活和滤纸酶活,以此分析其混合菌系与单菌株的生长关系和三种组分酶活的比例。[结果]混合菌系的内切葡聚糖酶活力在第7 d达到峰值,外切葡聚糖酶活力和β-葡萄糖苷酶活力分别在在第4 d、5 d达到峰值后,在第7 d、6 d又有上升趋势,但这3种组分酶活不同程度低于单菌株,而总酶活力滤纸酶活却高于单菌株。[结论]3种组分酶活力的比例不同,决定着纤维素酶系的完整与否,从而决定了纤维素酶对纤维素的降解程度。
关键词:里氏木霉; 黑曲霉; 纤维素酶活
木质纤维素包括木质素、纤维素和半纤维素,结构复杂很难降解。作为可再生资源,木质纤维素产量巨大且未得到充分利用,故国内外对微生物分解转化纤维素的研究极为重视。自20世纪70年代起,利用混合发酵提高纤维素酶产率和活性,克服酶系不完全已引起广泛关注。其中,混合发酵是指两种或两种以上的微生物在同一培养基中进行的发酵,在一定程度上有利于微生物间协调生长,进而发挥各酶之间的协同作用,使纤维素酶活性较高,从而达到提高产物的生产效率或降低培养基要求等效果[1,2]。目前,微生物的混合发酵培养已广泛应用于木质纤维素类物质的降解与转化,不断加强对纤维素类物质混合发酵的理论和优化发酵工艺,具有重要的现实意义[3]。
纤维素酶是一类能分解纤维素的复杂酶系,主要由外切β-1,4-葡聚糖纤维二糖水解酶(C1酶)、内切β-1,4葡聚糖水解酶(Cx酶)和β-葡萄糖苷酶(Cb酶)构成[4,5]。C1酶主要作用于纤维素线状分子末端,为Cx酶和Cb酶创造酶切位点;Cx酶随机水解纤维素内部的非结晶区;Cb酶将纤维二糖水解成葡萄糖分子[6],这样纤维素的整个降解过程就完成了[4]。作为复杂的多酶复合体,纤维素酶的酶解过程呈多相的复杂性。因此,对纤维素酶的认识不应仅仅着眼于酶活力值的高低,还须结合其酶系种类和比例搭配[4]。
刘云云等[7]采用响应面法对里氏木霉和斜卧青霉固态混合发酵条件进行优化,得到最优条件下发酵3d滤纸酶活达到峰值101.825FPU·g-1。周广麟等[8]发现食用菌香菇和酵母菌混合发酵葡萄渣和麸皮生产纤维素酶,表明香菇可分泌纤维素酶,且可与酵母共生。蔡晶晶等[9]发现白腐菌、黑曲霉和絮凝酵母三菌混合发酵固态发酵稻草粉产纤维素酶的酶活力明显高于白腐菌和黑曲霉双菌混合培养,且Cx酶和Cb酶酶活比白腐菌和黑曲霉两者发酵产酶分别提高了68.2%和143.3%。Thomas等[10]研究了尖孢镰孢和啤酒酵母共培养的同步糖化发酵小麦秸秆生产乙醇,发现尖孢镰刀菌的酶系统对底物水解影响显著,乙醇终浓度为58g·L-1,比啤酒酵母单独发酵产乙醇提高了19%。
因为里氏木霉是目前产纤维素酶能力最强,活力最高的微生物[4],在生产纤维素酶方面有稳定性好、产酶效率高、生长环境粗放和纤维素酶的各组分结构较为合理等诸多优点[11]。黑曲霉相比木霉,安全无毒且Cb酶糖化能力较强以及分泌的胞外纤维素酶便于提纯[12,13]。另外目前研究主要集中在不同微生物的相互混合及其基因水平的研究,对组分酶活的搭配比例及其变化研究较少。本文从经典组合里氏木霉和黑曲霉的混合入手,以3种纤维素酶组分酶活(内切葡聚糖酶活、外切葡聚糖酶活、β-葡聚糖酶活)和滤纸酶活为指标,分析了混合菌系对不同纤维素酶活力的影响,为两单菌株的生长关系及纤维素酶系的研究提供参考,从而为高效降解纤维素的微生物联合共培养提供理论依据,对秸秆降解与转化具有现实意义。
1材料和方法
1.1试验材料
1.1.1试验试剂
DNS溶液:称取3.15g的3,5-二硝基水杨酸,加蒸馏水500mL。搅拌5s,水浴至45 ℃。然后逐步加入100mL0.2g·mL-1的氢氧化钠溶液,同时不断搅拌。直至溶液清澈透明(在加入NaOH溶液过程中,保持温度不超过48 ℃)。继续45 ℃水浴加热,逐步加入91.0g四水酒石酸钾钠、2.50g苯酚和2.50g无水亚硫酸钠。同时补加水300mL,不断搅拌,直至加入的物质完全溶解,停止加热。冷却至室温后,定容至1 000mL。用烧结玻璃过滤器过滤。滤液储存在棕色瓶中,避光保存。室温下存放7d后使用,有效期6个月。
pH4.8的磷酸氢二钠-柠檬酸缓冲液:参考文献[14]。
1%羧甲基纤维素悬浮液:1g羧甲基纤维素溶于100mLpH4.8的磷酸氢二钠-柠檬酸缓冲液中。相同的方法配制1%微晶纤维素悬浮液和1%水杨苷悬浮液。
1.1.2试验菌株
里氏木霉(Trichoderma reesei)和黑曲霉(Aspergillus nige)均由山西农业大学生物工程实验室保藏。
1.1.3培养基
马铃薯培养基:参考文献[15]。
液体摇瓶发酵培养基(产酶培养基):麸皮1%,玉米芯4%,蛋白胨0.3%,硫酸铵0.2%,磷酸二氢钾0.4%,氯化钙0.03%,酵母膏0.05%,硫酸镁0.03%,吐温-80 0.02%,加热使各成分溶解,自然pH。250mL三角瓶分装,121 ℃灭菌20min。
1.2试验方法
1.2.1孢子悬浮液的制备
从里氏木霉或黑曲霉的试管斜面上刮取孢子于带玻璃珠的生理盐水中。在30 ℃,200r·min-1摇床中振荡分散孢子1.5~2h,用血球计数板测定孢子浓度,达10-6~10-7个·mL-1。
1.2.2试验设计
先分别吸取8mL里氏木霉和黑曲霉的孢子悬浮液接入各自产酶培养基中,在30 ℃ 140r·min-1的摇床培养,以灭活的酶液为对照组,原酶液为处理组,分别测定10d内上述4种酶活的变化。以8mL为总接种量,两者比例1∶1混合发酵,再按上述方法测定10d内四种酶活变化。进而分析里氏木霉和黑曲霉的单菌株与混合菌系对纤维素酶活的影响。
1.3试验指标
1.3.1葡萄糖标准曲线的建立
无水葡萄糖在105℃下烘干至恒重,配成1.0mmol·L-1的葡萄糖标准溶液,分别取此标准溶液0、0.2、0.4、0.6、0.8、1.0、1.2mL于刻度试管中,补水至2.0mL,加入4.0mLDNS溶液,具塞沸水浴5min后,立即冷却,终止反应,定容至25mL。溶液摇匀后在499nm处测定吸光值(OD值),每管重复3次,结果取平均值。以吸光值为纵坐标,葡萄糖毫摩尔数为横坐标绘制曲线图并建立回归方程。
1.3.2纤维素酶活力的测定[16,17]
内切葡聚糖酶活的测定:用移液枪分别吸取0.5mL澄清酶液和1.0mL1%(w/v)羧甲基纤维素悬浮液,加入25mL具塞比色管,50 ℃水浴保温30min,取出后立刻加入4mLDNS溶液,紧接着沸水浴5min,立即冷却后用蒸馏水定容至 25mL摇匀,在499nm处测定其吸光度值,根据葡萄糖标准方程求得反应生成的葡萄糖,再计算出内切葡聚糖酶酶活。
外切葡聚糖酶活的测定:将内切葡聚糖酶活测定中1.0mL羧甲基纤维素悬浮液换成微晶纤维素悬浮液,其他与内切葡聚糖酶活的测定一致。
β-葡萄糖苷酶活力的测定:将内切葡聚糖酶活测定中1.0mL羧甲基纤维素悬浮液换成水杨苷悬浮液,其他与内切葡聚糖酶活的测定一致。
因其聚合度和结晶度适中且能反应三类酶的协同作用,所以以滤纸为底物经纤维素酶系水解生成的还原糖量来表征纤维素酶系总糖化力的方法称为滤纸酶活[18,19]。滤纸酶活的测定:将内切葡聚糖酶活测定中1.0mL1%(w/v)羧甲基纤维素悬浮液换成1.0mLpH4.8磷酸氢二钠-柠檬酸缓冲液并加入1cm×6cm的滤纸条,其他与内切葡聚糖酶活的测定一致。
1.4数据处理
1.4.1数据计算
酶活定义:在一定pH和温度下,1mL底物溶液中1min产生1μg还原糖所需要的酶量即一个酶活单位,简称为U·mL-1[18,20,21]。
1.4.2数据处理
实验数据采用Origin70处理。
2结果与分析
2.1葡萄糖标准曲线结果
由1.3.1建立葡萄糖标准曲线,如图1,得回归方程:Y=1.037 7X-0.062 5,相关系数R2=0.992 1。

图1 葡萄糖标准曲线Fig.1 Standard curve of glucose
2.2内切葡聚糖酶活的比较
由图2可以看出,黑曲霉的内切葡聚糖酶活力起点较低,但增长速率相对较缓慢,在第7d达到峰值29.026U·mL-1;而里氏木霉的内切葡聚糖酶活起点较高,但增长也较平缓,在第5d达到峰值为25.046U·mL-1;相对两单菌株而言,两者的混合菌系在第1d的内切酶活最低,在前7d按较高的速率稳定增长,直至峰值26.568U·mL-1,此值介于两单菌株的峰值之间。
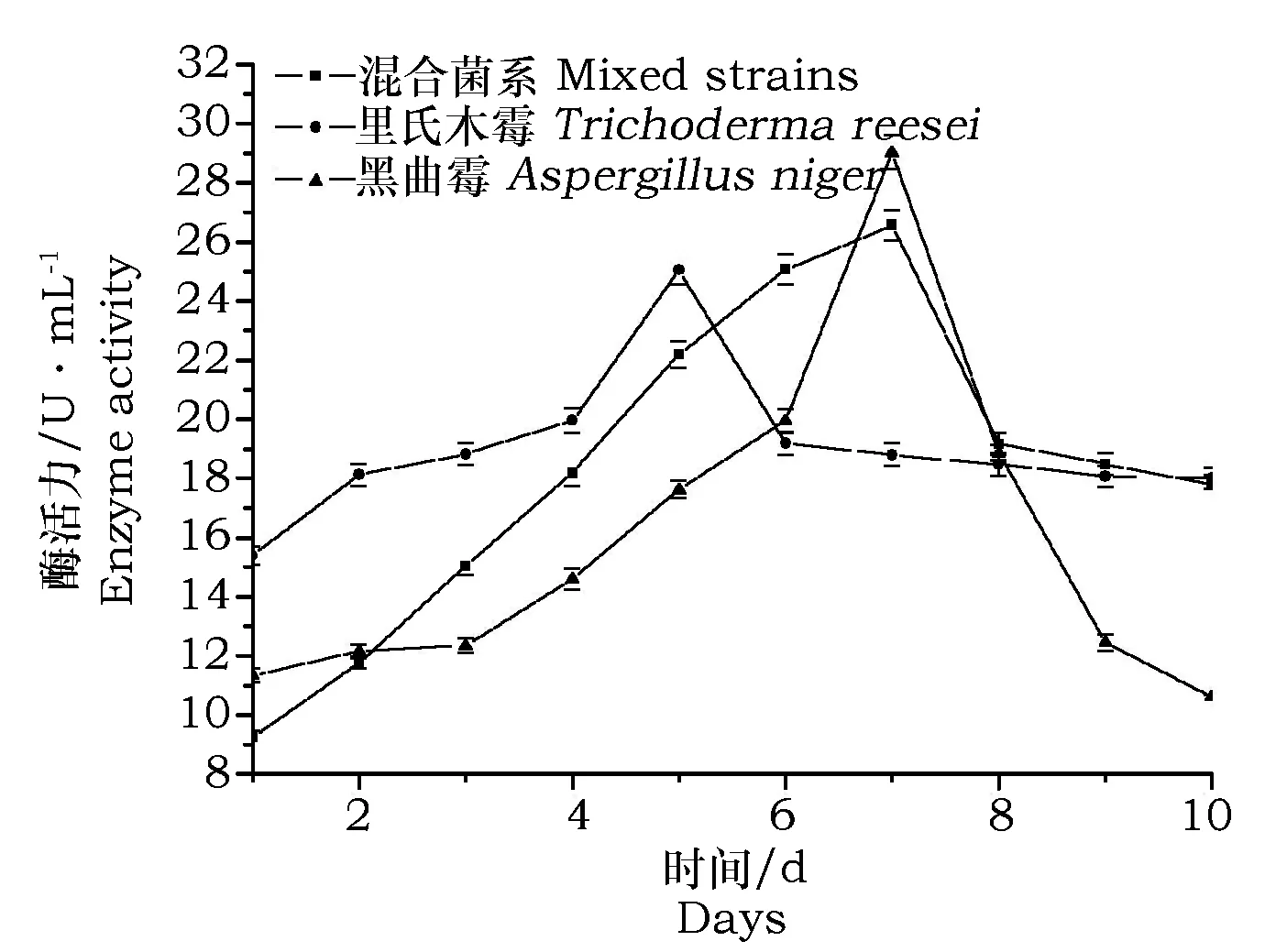
图2 内切葡聚糖酶活的比较Fig.2 The comparison of endoglucanase activity
2.3外切葡聚糖酶活的比较
由图3可以看出,里氏木霉的外切葡聚糖酶活显著高于黑曲霉和两者混合菌系,而黑曲霉的在10d内整体较低且无明显的变化,而混合菌系的外切葡聚糖酶活先增加后降低而后二次增加,可能因为在前期两者相互适应,后期才能发挥两者的协同作用。

图3 外切葡聚糖酶活的比较Fig.3 The comparison of exoglucanase activity

图4 β-葡萄糖苷酶活力的比较Fig.4 The comparison of β-glucosidase activity
2.4β-葡萄糖苷酶活力的比较
在降解纤维素的微生物中,曲霉的主要作用是分泌β-葡萄糖苷酶,从图4中可以验证这一点,黑曲霉的β-葡萄糖苷酶处于较高水平,里氏木霉在这一方面作用不明显,两者的混合菌系介于两者之间且基本和黑曲霉的趋势贴合。
2.5滤纸酶活的比较
由图5可以看出,在10d内,里氏木霉的滤纸酶活先升高后降低且在第5d出现峰值;黑曲霉的滤纸酶活一直以缓慢的速度增加,在最后趋于平缓;而两者的混合菌系滤纸酶活的变化趋势是先升高后降低再升高,第一次的峰值是在第5d出现,且在第二次的增长过程中以较高的速率增长,其变化原因可能是在前6d,两种霉菌处于适应阶段,从第6d起,两者协同降解滤纸。
另外,在第8d前,混合菌系的滤纸酶活高于黑曲霉,低于里氏木霉,但从第8d起,混合菌系的滤纸酶活显著高于里氏木霉,且高于里氏木霉的峰值,所以两株霉菌的混合比单菌株的降解效果好。

图5 滤纸酶活的比较Fig.5 The comparison of filter paper activity
3结论与讨论
4种纤维素酶活力呈先增长后降低的趋势,是因为前期在纤维素分解菌分泌的胞外纤维素酶的作用下,纤维素分解成的还原糖不断累积的结果,但在后期,因为营养物质的消耗,微生物开始利用还原糖为碳源,致使体系中还原糖降低。
在里氏木霉和黑曲霉混合菌系的共发酵产纤维素酶研究中,混合菌系的3种组分酶活(内切葡聚糖酶活、外切葡聚糖酶活以及β-葡萄糖苷酶活)的变化趋势不尽相同,但都介于两单菌株的活力之间,而表征纤维素酶系总糖化能力的滤纸酶活虽然在前8d也介于两者之间,但在第二次增长过程中以较高的速率增长,在第9d超过单菌株的酶活,还有继续增长的潜力。说明混合菌系(黑曲霉和里氏木霉)协同互助,促进产酶,虽然单一组分的酶活力不同程度低于单菌株,但纤维素酶系的总酶活力是提高的。
本文结果为研究产纤维素酶微生物混合发酵玉米秸秆中的生长关系和优化纤维素酶酶系种类和比例提供实验基础,但只对霉菌中的黑曲霉和里氏木霉进行了研究,进一步研究可以对细菌、放线菌以及霉菌进行混合研究,从而更广泛研究产纤维素酶混合菌系。
参考文献
[1]朱博,李强.工业微生物混合发酵的研究进展[J].绿色科技,2011(7):238-241.
[2]苏香萍,龚大春,陈国华,等.混合菌固态发酵产纤维素酶条件的研究[J].时珍国医国药,2010,21(12):3330-3332.
[3]赵明杰,陈耀宁,曾光明.平板混合培养木质纤维素降解菌初步研究[D].长沙:湖南大学,2012.
[4]司笑丁.纤维素酶在酒精生产中的应用探讨[J].酿酒科技,2004,126(6):61-62.
[5]高星星,潘丽军.里氏木霉与黑曲霉混合发酵产纤维素酶的研究[D].合肥:合肥工业大学,2012.
[6]胡奎娟,吴克,潘仁瑞,等.固态混合发酵提高木聚糖酶和纤维素酶[J].菌物学报,2007,26(2):273-278.
[7]刘云云,张宇,许敬亮,等.多菌混合固态发酵产纤维素酶的研究[J].化学工程,2014,42(5):6-9,34.
[8]周广麟,齐文茂,陈成,等.香菇与酵母共生发酵产纤维素酶[J].大连工业大学学报,2014,33(22):98-104.
[9]蔡晶晶,段学辉,谢亮,等.三菌混合固态发酵产纤维素酶研究[J].中国生物工程杂志,2013,33(7):57-63.
[10]ThomasPaschosa,CharilaosXirosb,PaulChristakopoulos.Simultaneoussaccharificationandfermentationbyco-culturesofFusariumoxysporumandSaccharomycescerevisiaeenhancesethanolproductionfromliquefiedwheatstrawathighsolidcontent[J].IndustrialCropsandProducts,2015,76(12):793-802.
[11]王芳,陈介南,张林,等.产纤维素酶里氏木霉的研究进展[J].中国酿造,2014,33(6):1-5.
[12]张欢,曹焱鑫,蒋林,等.黑曲霉(AS0006)产纤维素酶的纯化研究[J].生物技术通报,2014,36(6):187-192.
[13]AftabAhamed,PatrickVermette.EnhancedenzymeproductionfrommixedculturesofTrichodermareesiRUT-C30andAspergillusnigerLMAgrownasfedbatchinastirredtankbioreactor[J].BiochemicalEngineeringJournal,2008,42(1):41-46.
[14]蒋立科,杨婉身.现代生物化学实验技术[M].北京:中国农业出版社,2003:308.
[15]郝林.食品微生物学实验技术[M].北京:中国农业出版社,2001:146.
[16]张英,侯红萍. 黑曲霉和芽孢杆菌复合菌产纤维素酶的研究[J].中国酿造,2010,29(12):91-94.
[17]杨盛,侯红萍. 高效降解纤维素混合菌的筛选及其产酶条件的研究[J].中国酿造,2008,27(21):20-23.
[18]张英.酵母菌、霉菌与细菌混合发酵产纤维素酶的研究[D].太谷:山西农业大学,2011.
[19]刘洁,李宪臻,高培基.纤维素酶活力测定方法评述[J].工业微生物,1994,24(4):27-32.
[20]李兰晓,杜金华,李军训,等.CMC糖化力法测定纤维素酶活性条件的研究[J].饲料工业,2006,7(24):49-51.
[21]阎泊旭,齐飞,张颖舒,等.纤维素酶分子结构和功能研究进展[J].生物化学和生物物理进展,1999,26(3):233-237.
(编辑:马荣博)
Theinfluenceofmixedmicrobetocellulaseactivity
HaoJianyu,HouHongping*,ZhengYuanjie
(College of Food Science and Engineering, Shanxi Agricultural University, Taigu 030801, China)
Abstract:[Objective]In this paper,we mixed Aspergillus niger and Trichoderma reesei together,aimed at providing reference for the coexist of microbial species and the optimization of cellulase proportion .[Methods]Based on the total amount of inoculation 8 mL,we put Trichoderma reesei, Aspergillus niger, and mixed strains in 1∶1 into enzyme production medium respectively,then determined three-component cellulase activity and filter paper activity in the following ten days to analysis growth relationship of microbe and the proportion of components cellulase activity. [Results]It suggested that mixed strains’ endoglucanase,exogluconase and β-glucosidase activity meet the peak in 7 d,4 d and 5 d respectively. After that,exogluconase and β-glucosidase activity rose again.Nevertheless,the three components were lower than single strain in some degree, while the total activity of filter paper enzyme activity was higher than single strain.[Conclusion]In summary, the different proportions of the three components cellulase activity determine the complete cellulase system or not, which determines the degree of cellulose degradation.
Key words:Trichoderma reesei; Aspergillus nige; Cellulose enzyme activity
收稿日期:2016-03-10 修回日期:2016-04-12
作者简介:郝建宇(1990-),女(汉),硕士研究生,研究方向:农产品加工与贮藏工程 *通讯作者:侯红萍,教授,硕士生导师。Tel:15934425958;E-mail:sphhping@126.com
基金项目:山西省科技攻关项目(20140311019-2)
中图分类号:Q93-335
文献标识码:A
文章编号:1671-8151(2016)07-0510-04
