H2O2对黑曲霉氧化胁迫机理的研究
2018-05-07陈浩宇徐瑞涛程志翔高强张健
陈浩宇 徐瑞涛 程志翔 高强 张健
(工业发酵微生物教育部重点实验室 天津科技大学生物工程学院,天津 300457)
黑曲霉是一种重要的工业发酵微生物,可为人类创造价值[1];黑曲霉也是一种腐生真菌,可侵染农产品和食品,造成极大的经济损失。某些黑曲霉菌株还能够产生真菌毒素,直接威胁人类健康[2-3]。为了有效地控制黑曲霉的生长与产毒,有必要深入研究环境胁迫条件下黑曲霉的生长代谢情况。
在氧化胁迫条件下,黑曲霉会产生过多的活性氧自由基(Reaetive oxygen speeies,ROS),如超氧阴离子(·)、羟基自由基(·HO)和过氧化氢(H2O2),这会对菌体细胞的许多重要生物大分子发生不可逆转的氧化损伤,使核酸、蛋白质、膜多不饱和脂肪酸等出现交联或断裂,导致细胞结构和功能的破坏,甚至引起细胞死亡[4-7]。为了能在氧化胁迫下不受伤害,黑曲霉会通过表达抗氧化酶和产生小分子抗氧化物有效地清除活性氧自由基。抗氧化酶主要包括超氧化物歧化酶(SOD)、过氧化氢酶(CAT)和谷胱甘肽过氧化物酶(GPX);而小分子抗氧化物很多都是真菌次级代谢产物[8-10]。
真菌毒素是常见的次级代谢产物[11],关于“真菌为何要合成真菌毒素”有多种解释。真菌在氧化胁迫条件下通过产生真菌毒素来清除活性氧自由基,保持细胞内氧化平衡就是其中的一种,因为很多真菌毒素的合成都有大量氧原子的参与[12]。Cresposempere等[13]研究表明,氧化胁迫可抑制炭黑曲霉的生长并且刺激真菌毒素的产生,如在培养基中加入甲萘醌可以导致炭黑曲霉生长变缓,且产生更多的赭曲霉毒素A(Ochratoxin A,OTA);Fountain等[14]发现在培养基中加入H2O2可以导致黄曲霉生长变缓,且产生更多的黄曲霉毒素。这些研究均表明氧化胁迫确实能够促进真菌毒素的合成。
黑曲霉在工业生产上有重要价值,在农业生产中也可能造成巨大危害[15]。然而,关于氧胁迫对黑曲霉生长和OTA生物合成的影响却鲜有报道。为了探究黑曲霉合成OTA的目的,也为了控制黑曲霉的侵染和产毒。本研究以H2O2作为外源活性氧来源,探究黑曲霉的氧化应激响应,主要包括菌体的生长、OTA的合成,胞内活性氧和脂质过氧化,以及抗氧化酶活性的变化,旨在为黑曲霉侵染和产毒的控制奠定理论基础。
1 材料与方法
1.1 材料
1.1.1 菌株与培养基 黑曲霉1062(具有产OTA的能力)为实验室保存菌株。培养黑曲霉所用的PDA培养基,察氏酵母膏琼脂培养基(CYA)的配制参考文献[16]。
1.1.2 主要试剂与仪器 OTA标品购于Fermentas公司,色谱甲醇,色谱乙腈购于Fisher公司,冰乙酸(分析纯)购于天津市北方天医化学试剂厂,H2O2(30%),硫代巴比妥酸(TBA),考马斯亮蓝G-250,氮蓝四唑(NBT),核黄素等购于北京索莱宝科技有限公司;GPX酶试剂盒购于南京建成生物试剂有限公司;高效液相色谱仪Agilent1100,购自美国安捷伦科技有限公司;恒温式电热水浴锅H1650-W购于天津市中环实验电炉有限公司;高速离心机5418购于美国Eppendorf公司。
1.2 方法
1.2.1 H2O2对黑曲霉1062生长影响 将PDA斜面上生长5 d的黑曲霉1062孢子利用无菌水洗下,并通过血球计数板计数,得到105个/mL的孢悬液,取5 μL分别加到含有0 mmol/L,5 mmol/L,10 mmol/L H2O2的CYA固体培养基上(H2O2过膜后在培养基未凝之前添加)。25℃培养7 d,观察菌落生长情况并测定菌落直径。
1.2.2 HPLC-FLD检测黑曲霉1062 OTA产量 25℃培养箱中取出0 mmol/L,5 mmol/L,10 mmol/L H2O2的CYA平板上生长3-7 d黑曲霉菌株,使用直径为6 mm的打孔器从菌落边缘到中心依次取出3块含有菌体的琼脂块,加入500 μL甲醇,避光静置2 h,使用孔径为2 μm有机滤膜过滤,HPLC-FLD进行检测OTA。HPLC-FLD检测OTA条件见文献[17]。
1.2.3 粗提液的制备及蛋白含量的测定 将平板上生长3-7 d的菌体刮下,称取0.5 g,液氮研磨至粉末状,使用5 mL 0.05 mol/L磷酸缓冲液(pH7.0)提取;4℃ 12 000 r/min离心15 min,取上清液,用于测定·产生速率,H2O2及MDA含量和SOD,CAT,GPX酶活性。蛋白质含量参照Bradford法测定,以牛血清蛋白为标准。
1.2.4 黑曲霉胞内活性氧指标测定 (1)H2O2含量测定:取粗提液1 mL,加1 mL预冷的丙酮,0.1 mL 5%硫酸化钛和0.2 mL的浓氨水溶液,混匀后静置5 min,4℃ 12 000 r/ min离心5 min,弃上清留沉淀。加入2 mL 2 mol/L硫酸溶解沉淀,沉淀完全溶解后在412 nm下测定吸光度。同时利用H2O2制作标准曲线,根据回归方程计算样品中HO的含量。(2)·22产生速率的测定:取1.0 mL粗提液加1.0 mL盐酸羟胺,混匀后30℃水浴30 min,再加入1.0 mL对氨基苯磺酸和1.0 mL α-萘胺,30℃水浴15 min,12 000 r/min离心10 min,在530 nm下测定吸光度。以NaNO2制备标准曲线,通过测定反应液中生成浓度从而得出·的产生速率,具体参照王爱国等[18]的方法。
1.2.5 丙二醛(MDA)含量的测定 取1 mL待测液,加入3 mL 0.5% TBA,沸水浴20 min,迅速冷却,12 000 r/min,离心10 min,分别测定上清液A450、A532和A600;按照如下公式进行计算MDA含量:c(μmol/L)= 6.45 ×(A532-A600)-0.56×A450。 其 中A450,A532,A600分别为在 450,532,600 nm 下吸光值。1.2.6 黑曲霉胞内抗氧化酶活性测定 (1)SOD 活性的测定:采用氮蓝四唑比色法。酶活性单位采用抑制光化还原NBT 50%为一个酶活性单位。(2)CAT 活性测定:参照Aebi法[19],略加改进。反应体系包括:50 mmol /L 磷酸缓冲液(pH 7.0)、20 mmol/L H2O2和100 μL酶提取液。以缓冲液作对照,加酶液后立即测定1 min内A240。以1 min内A240减少0.1的酶量为1个酶活单位。(3)GPX活性测定参照“谷胱甘肽过氧化物酶(GPX)试剂盒”的方法。
2 结果
2.1 H2O2对黑曲霉1062生长的影响
为了研究H2O2对黑曲霉生长的影响,采用5 mmol/L和10 mmol/L的 H2O2对黑曲霉进行胁迫培养。通过测定菌落生长直径发现5 mmol/L、10 mmol/L H2O2处理下的黑曲霉菌株在1-7 d菌落直径明显小于对照组(0 mmol/L H2O2),且10 mmol/L处理下的黑曲霉菌株菌落直径总体小于5 mmol/L;另外,10 mmol/L处理下的黑曲霉在1-2 d内无菌落产生,5 mmol/L处理下的黑曲霉在第1天无菌落产生,说明随着H2O2含量的增加,对黑曲霉菌落生长的抑制作用愈加明显(图1)。
2.2 H2O2对黑曲霉产OTA的影响
为了验证OTA的生物合成是否与氧胁迫有关,本研究对不同浓度H2O2胁迫下的黑曲霉合成OTA的水平进行了测定。结果如图2所示,总体上菌体产OTA在第4天达到最大值,此后逐渐减少,原因可能是由于OTA被降解。H2O2的添加促进了菌体合成OTA,尤其是第4天,10 mmol/L H2O2处理组OTA产量达到3.64 ng/mm2,是对照组OTA产量的2.3倍;5 mmol/L H2O2处理组OTA产量达到2.42 ng/mm2,是对照组OTA产量的1.55倍。这说明过氧化氢能够刺激菌体产毒。

图1 H2O2的添加对黑曲霉1062生长的影响

图2 H2O2的添加对黑曲霉1062 OTA产量的影响
2.3 H2O2胁迫下黑曲霉1062胞内活性氧水平分析
2.3.1 H2O2对黑曲霉1062胞内H2O2含量的影响 H2O2是反应胞内活性氧的重要指标,通过测定黑曲霉胞内H2O2含量发现对照组在黑曲霉生长的3-7 d过程中整体趋于稳定态势,而处理组胞内H2O2波动较大,图3显示在第3天时处理组明显高于正常生长的对照组,此时经5 mmol/L H2O2胁迫生长的黑曲霉胞内H2O2含量为对照组的3.67倍,经10 mmol/L H2O2胁迫生长的黑曲霉胞内H2O2含量为对照组的4.19倍;这说明H2O2的添加明显提高了胞内H2O2的含量,此后呈现降低并趋于稳定的趋势,这可能是由于胞内抗氧化酶的作用降低了胞内H2O2的含量。

图3 外源H2O2的添加对黑曲霉1062胞内H2O2含量的影响
22响 图4显示处理组在生长的3-7 d中,胞内·产生速率呈现波动状态,且整体高于对照组,其中在生长第3 天时最为显著,经5 mmol/L H2O2胁迫生长的处理组·产生速率是对照组的1.62 倍,10 mmol/L H2O2胁迫生长的处理组·产生速率是对照组的1.89 倍;以上结果可知由于外源H2O2胁迫作用,造成内源性活性氧物质H2O2以及·的产生在菌体生长前期均有明显升高。

图4 外源H2O2的添加对黑曲霉1062·产生速率的影响
2.4 H2O2对黑曲霉胞内脂质过氧化的影响
图5反映了不同浓度H2O2胁迫下,黑曲霉胞内MDA的变化情况。对照组MDA含量呈现逐渐升高并在生长第7天略有减少的态势,这可能与菌体胞内抗氧化酶活性及菌体生长代谢状态相关;黑曲霉胞内MDA含量测定结果显示处理组在生长第3 天显著高于对照组,此时5 mmol/L H2O2胁迫生长的黑曲霉胞内MDA在第3 天为对照组的2.37 倍,10 mmol/L H2O2胁迫生长的黑曲霉胞内MDA为对照组的2.71倍,此后与对照组的差异逐渐减小。

图5 外源H2O2的添加对黑曲霉1062胞内MDA含量的影响
2.5 H2O2胁迫下黑曲霉胞内抗氧化酶活性分析
2.5.1 H2O2对CAT酶活性的影响 H2O2胁迫生长7 d测定胞内CAT活性结果(图6)显示处理组CAT活性均高于对照组,随着生长时间的延长,黑曲霉酶活整体呈现出先增长,后期降低的趋势,且在第5 d CAT酶活达到最高,此时5 mmol/L H2O2胁迫生长的黑曲霉的CAT酶活是对照组约1.53倍,10 mmol/L H2O2胁迫生长的黑曲霉的CAT酶活是对照组约1.83倍。可见在H2O2的胁迫下,黑曲霉为了适应生存而提升了CAT酶活性来平衡胞内过多的H2O2。

图6 外源H2O2的添加对黑曲霉1062 CAT酶活的影响
2.5.2 H2O2对SOD酶活性的影响 黑曲霉菌体生长的3-7 d过程中,胞内SOD的酶活呈现与CAT酶活相似的变化趋势,即:前期增长,后期降低,且在第5 天达到最大值;但是5 mmol/L和10 mmol/L H2O2处理的黑曲霉与对照组相比,整体差异不大(图7);以上结果表明对于外源H2O2来说,黑曲霉CAT对氧化胁迫响应表现的更为强烈,而胞内的SOD酶的活性升高较为缓慢。

图7 外源H2O2的添加对黑曲霉1062 SOD酶活的影响
2.5.3 H2O2对GPX酶活性的影响 在整个黑曲霉生长过程,经H2O2处理的黑曲霉GPX酶活性整体高于对照组。且在第6 天达到最高值,此时5 mmol/L H2O2胁迫生长的黑曲霉GPX酶活为对照组的1.51倍,经10 mmol/L H2O2胁迫生长的黑曲霉GPX酶活为对照组的1.57倍(图8);CAT酶虽能将H2O2转变为H2O和O2,但是胞质中的O2如果超过一定量后,会产生过氧化物,所以仍需GPX协助才能彻底清除H2O2。
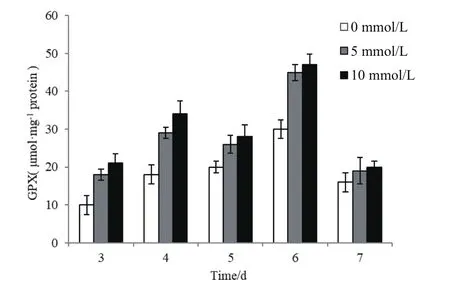
图8 外源H2O2的添加对黑曲霉1062 GPX酶活的影响
GPX 酶活性的升高有助于清除 H2O2以及由ROS诱发的脂类过氧化物,从而减轻对细胞的损伤。
3 讨论
黑曲霉是一种重要的真核微生物,它在生长过程中会面临各种各样的胁迫,氧化胁迫是最主要的胁迫之一[20-21]。H2O2作为强氧化剂,能够穿过细胞膜在细胞内自由移动,并且能够透过细胞器膜,使其在细胞内的毒性扩展,进而会导致自由基的产生与积累,造成细胞内的氧化损伤,甚至引起细胞死亡[22]。本文以H2O2来创造氧胁迫条件,系统地研究了黑曲霉在此条件下的应激响应。从表型看,氧胁迫会抑制菌体生长,且具有显著的剂量依赖性;氧胁迫会促进黑曲霉合成OTA,且OTA的合成与氧胁迫程度具有相关性,但是氧胁迫不会造成OTA合成与代谢的动力学趋势变化。分析胞内的H2O2水平,可以看出其与外部的H2O2添加水平是一致的,明显高于对照组,证明其可以渗透进细胞膜,且H2O2添加剂量尚未完全氧化破坏细胞膜。胞内·O2-的含量在氧胁迫条件下有显著增加,但由于其代谢途径复杂,其含量与H2O2添加量的相关性并不明显,尤其是黑曲霉生长5 d以后,添加5 mmol/L 和10 mmol/L的H2O2对胞内·O2-含量的影响趋于一致。H2O2胁迫下·O2
-产生速率的加快和黑曲霉胞内H2O2含量的增加是导致MDA水平增加的主要原因[23-24]。在黑曲霉生长7 d的过程中,外部的H2O2添加对MDA水平的影响与对照组相比逐渐趋于一致。这说明黑曲霉在随着生长时间的延长,遭受氧化胁迫损伤程度在逐渐减弱直至与对照组一致。SOD是特异清除·O2
-的抗氧化酶,而CAT能以H2O2为底物催化其分解[25],GPX则能催化H2O2以及脂质过氧化物[26-27]。CAT,SOD及GPX相互配合能够有效清除过量的有毒活性氧,是黑曲霉抗氧化防御体系的主要抗氧化酶[28]。在H2O2胁迫生长7 d过程中,抗氧化酶均有不同程度的升高,是黑曲霉胞内ROS含量在生长5-7 d过程中逐渐趋于对照组的主要原因。黑曲霉OTA合成在ROS含量增加期间明显升高说明次级代谢也是排泄胞内活性氧的有效途径。
Fountain等[29]通过体外添加H2O2诱导氧化胁迫研究其对黄曲霉次级代谢生物合成及抗氧化酶的影响,经转录组测序结果发现黄曲霉毒素生物合成基因及抗氧化酶基因等均有不同程度的上调,这说明真菌产毒及抗氧化基因的表达与菌体遭受氧化胁迫有很大的相关性,这与本研究结果显示的OTA产量和抗氧化酶如CAT,SOD以及GPX酶活的升高相吻合。Jayashree等[30]通过比较寄生曲霉产毒菌株与不产毒菌株对氧的需求以及体内氧化胁迫和抗氧化酶状态,发现产毒菌株在显示出更高的需氧量的同时,抗氧化酶酶活及氧化胁迫程度均高于不产毒菌株,由此得出毒素的产生可能是氧化胁迫的增加提升了脂质过氧化及ROS的结果。本研究通过增加H2O2加入量来提升氧化胁迫的程度,结果显示毒素的产量与氧化胁迫的程度成正相关,较好阐述了氧化胁迫可能是毒素产生的主要原因,这也与Zaccaria等[31]研究的结论一致。这些研究报道都说明了氧化胁迫在提升菌体抗氧化防御能力的同时也影响了菌体的生长及次级代谢,本研究也很好的证实了这一点。
正常生物体内的自由基的产生和清除是处在动态平衡状态,当各种外源或内源性因素引起的ROS超过体内的清除能力时,就会导致ROS水平升高,引起氧化应激,氧化细胞内不饱和脂、蛋白质和DNA等大分子结构,从而破坏他们的生物学功能[32]。体外H2O2可透过细胞膜进入胞内,使胞内H2O2含量增加的同时提高了·O2-的含量,造成脂质过氧化和多种氧化损伤;为了减轻和修复氧化损伤,细胞通过自身抗氧化系统和增强次级代谢来对体内多余的活性氧自由基进行“解毒”与“排泄”[33-34]。
本研究的结果较好地解释了上述现象,抗氧化酶的表达和次级代谢物OTA的合成可能都是黑曲霉在氧胁迫条件下生存的应激响应。为了排除H2O2对黑曲霉菌体除氧化胁迫外的其它影响,可以通过采用除H2O2外其他氧胁迫试剂来创造氧化胁迫的环境,从而验证黑曲霉的应激响应。本研究结果对控制黑曲霉的侵染和OTA的合成提供了新的思路,对以黑曲霉为细胞工厂的工业生产和以黑曲霉为主要侵染菌的农业生产的健康发展有重要意义。
4 结论
通过5 mmol/L 和10 mmol/L H2O2对黑曲霉1062胁迫生长7 d过程中,随着H2O2浓度增加,菌体胞内ROS及 MDA含量在生长前期明显升高,菌体生长亦随之迟缓,菌落直径减少,这说明H2O2能够加重黑曲霉胞内氧化胁迫水平从而抑制菌体的生长;菌体在氧胁迫下,通过提升抗氧化酶活性,增加毒素的合成来有效的缓解活性氧的毒害,这也与 ROS及 MDA含量在生长5-7 d逐渐与对照组趋于一致相符合。
[1] 郭艳梅, 郑平, 孙纪宾. 黑曲霉作为细胞工厂:知识准备与技术基础[J]. 生物工程学报, 2010, 26(10):1410-1418.
[2] Andrade PD, Caldas ED. Aflatoxins in cereals:worldwide Occurrence and dietary risk assessment[J]. World Mycotoxin Journal, 2015, 8(4):415-431.
[3] 梁志宏, 黄昆仑, 何云龙, 等. 黑曲霉及其食品安全领域的赭曲霉毒素问题[J]. 食品科技, 2008(10):191-194.
[4] Aguirre J, Rı'osMomberg M, Hewitt D, et al. Reactive oxygen species and development in microbial eukaryotes[J]. Trends in Microbiology, 2005, 13(3):111-118.
[5] Kültz D. Molecular and evolutionary basis of the cellular stress response[J]. Annu Review Physiology, 2005, 67(1):225-257.
[6] Herrero E, Ros J, Bellí G, et al. Redox control and oxidative stress in yeast cells[J]. Biochimica Et Biophysical Acta General Subjects,2008, 1780(11):1217-1235.
[7] Aguirre J, Hansberg W, Navarro R. Fungal responses to reactive oxygen species[J]. Medical Mycology, 2006, 44 :101-107.
[8] Reverberi M, Zjalic S, Ricelli A, et al. Oxidant/antioxidant balance inAspergillus parasiticusaffects aflatoxin biosynthesis[J].Mycotoxin Research, 2006, 22(1):39-47.
[9] Moyerowley WS. Regulation of transcriptional response to oxidative stress in fungi:similarities and differences[J]. Eukaryotic Cell,2003, 2(3):381-389.
[10] Ayarkayali H, Ozer N, Tarhan L. Intracellular superoxide dismutase, catalase, and glutathione peroxidase activities and membrane lipid peroxide levels inFusarium acuminatumupon environmental changes in a defined medium[J]. Archives of Biochemistry and Biophysics, 2002, 400(2):265-272.
[11] Calvo AM, Wilson RA, Bok JW, et al. Relationship between Secondary Metabolism and Fungal Development[J]. Microbiol Mol Biol Rev, 2002, 66(3):447-459.
[12]Finkel T. Oxidant signals and oxidative stress[J]. Current Opinion in Biology, 2003, 15(2):247-254.
[13] Cresposempere A, SelmaLázaro C, Palumbo JD, et al. Effect of oxidant stressors and phenolic antioxidants on theochratoxigenicfungusAspergillus carbonarius[J]. Journal of the Science of Food&Agriculture, 2015, 96(1):169-177.
[14] Fountain JC, Scully BT, Chen ZY, et al. Effects of hydrogen peroxide on different toxigenic and atoxigenic isolates ofAspergillus flavus[J]. Toxins, 2015, 7(8):2985-2999.
[15] Krijgsheld P, Bleichrodt R, Van VGJ, et al. Development inAspergillus[J]. Studies in Mycology, 2013, 74(1):1- 29.
[16] Romero SM, Patriarca A, Fernández PV, et al. Effect of water activity and temperature on growth of ochratoxigenic strains ofAspergillus carbonariusisolated from Argentinean dried vine fruits[J]. International Journal of Food Microbiology, 2007, 115(2):140-143.
[17] Zhang J, Zhu LY, Chen HY, et al. A polyketide synthase encoded by the gene An15g07920 is involved in the biosynthesis of ochratoxin A inAspergillus niger[J]. Journal of Agricultural &Food Chemistry, 2016, 64(51):9680-9688.
[18] 王爱国, 罗广华. 植物的超氧物自由基与羟胺反应的定量关系[J]. 植物生理学报, 1990(6):55-57.
[19] Acbi H. Catalase in vitro[J]. Methods in Enzymology, 1984, 105(C):121-126.
[20] Emri T, Szarvas V, Orosz E, et al. Core oxidative stress response inAspergillus nidulans[J]. BMC Genomics, 2015, 16(1):478.
[21] Campos EG, Jesuino RS, Dantas AS, et al. Oxidative stress response inParacoccidioides brasiliensis[J]. Genetics & Molecular Research Gmr. 2005, 4(1):409-429.
[22] Diezmann S. Oxidative stress response and adaptation to H2O2in the model eukaryoteSaccharomyces cerevisiaeand its human pathogenic relativesCandida albicansandCandida glabrata[J].Fungal Biology Reviews, 2014, 28(4):126-136.
[23] Janero DR. Malondialdehyde and thiobarbituric acid-reactivity as diagnostic indices of lipid peroxidation and peroxidative tissue injury[J]. Free Radical Biology & Medicine Biol, 1990, 9(6):515-540.
[24] Sun Q, Shang B, Wang L, et al. Cinnamaldehyde inhibits fungal growth and aflatoxin B1 biosynthesis by modulating the oxidative stress responseofAspergillus flavus[J]. Applied Microbiology &Biotechnology, 2016, 100(3):1-10.
[25] Narasaiah KV, Sashidhar RB, Subramanyam C. Biochemical analysis of oxidative stress in the production of aflatoxin and its precursor intermediates[J]. Mycopathologia, 2006, 162(3):179-189.
[26] Li Y, Hugenholtz J, Abee T, et al. Glutathione protectsLactococcus lactisagainst oxidative stress[J]. Applied and Environment Microbiology, 2003, 69(10):5739-5745.
[27] Pallardò FV, Markovic J, Garcìa JL, et al. Role of nuclear glutathione as a key regulator of cell proliferation[J]. Molecular As pects of Medicine, 2009, 30(1-2):77-85.
[28] Bienert GP, Schjoerring JK, Jahn TP. Membrane transport of hydrogen peroxide[J]. Biochim Biophys Acta, 2006, 1758(8):994-1003.
[29] Fountain JC, Bajaj P, Nayak SN, et al. Responses ofAspergillus flavusto oxidative stress are related to fungal development regulator, antioxidant enzyme, and secondary metabolite biosynthetic gene expression[J]. Frontiers in Microbiology,2016, 7:2048.
[30] Jayashree T, Subramanyam C. Oxidative stress as a prerequisite for aflatoxin production byAspergillus parasiticus[J]. Free Radical Biology & Medicine, 2000, 29(10):981-985.
[31] Zaccaria M, Ludovici M, Sanzani SM, et al. Menadione-induced oxidative stress re-shapes the oxylipin profile ofAspergillus flavusand its lifestyle[J]. Toxins, 2015, 7(10):4315-4329.
[32] Rommel AA, Goetz E, Suzuki M, et al. Cellular stress responses to DNA damage:an intracellular balance between life, senescence,and death[J]. Encyclopedia of Environmental Health, 2011 :543-552.
[33] Hong SY, Roze LV, Linz JE. Oxidative stress-related transcription factors in the regulation of secondary metabolism[J]. Toxins,2013, 5(4):683-702.
[34] Passone MA, Resnik SL, Etcheverry MG, et al. In vitro effect of phenolic antioxidants on germination, growth and aflatoxin B1 accumulation by peanutAspergillus section Flavi[J]. Journal of Applied Microbiology, 2005, 99(3):682-691.
