甘蓝型油菜BnaSOT12a基因的抗性作用研究
2016-07-18欧阳宁陈东红
欧阳宁,金 璐,阮 颖,陈东红
(湖南农业大学生物科学技术学院,湖南 长沙410128)
甘蓝型油菜BnaSOT12a基因的抗性作用研究
欧阳宁,金璐,阮颖*,陈东红
(湖南农业大学生物科学技术学院,湖南 长沙410128)
摘 要:磺酸转移酶(SOT, EC 2.8.2.–)催化的磺酸化反应在植物的生长发育和植物抗逆过程中起着重要的作用。甘蓝型油菜BnaSOT12a基因是与拟南芥中AtSOT12基因同源的一个磺酸转移酶基因。为探寻BnaSOT12a基因的抗性相关功能,对其在油菜中不同部位的表达和在拟南芥中过表达情况下对转基因植株的影响进行了分析。结果显示:BnaSOT12a基因在甘蓝型油菜的根、叶、花芽和花中都有表达,其在花中的表达量最高,而在茎与果荚中没有表达;甘蓝型油菜BnaSOT12a基因在拟南芥中的过表达,能提高转基因植株在发芽和根生长方面对NaCl胁迫的耐受能力,但在盐胁迫下,BnaSOT12a的磺酸化作用并不影响拟南芥中抗病途径的信号传导,与抗病途径无关。
关 键 词:甘蓝型油菜;拟南芥;BnaSOT12a基因;半定量PCR;植物抗盐;基因表达
投稿网址:http://xb.ijournal.cn
作为一类复合蛋白家族,磺酸转移酶(SOT,EC 2.8.2.–)广泛存在于动物和植物组织中。该酶能够催化一系列的底物,使其发生磺酸化,介导一个磺酸基团转移到底物中合适的羟基或者氨基基团上,其中磺酸基团的供体为 3'–磷酸腺苷–5'–磷酰硫酸(PAPS)[1]。生物体内的磺酸化反应涉及到多方面的生物学过程,包括通信、生长、发育和防御反应[2]。磺酸转移酶催化的底物包括多种含有羟基和氨基的内源性和外源性分子[3–4]。磺酸化作用一方面通过将药物等外源物质转化成更易溶于水的形式,提高磺酸化物质的转运能力[5];另一方面,磺酸化作用也能够激活某些分子的活性[6]。
至今为止,根据序列的相似性,拟南芥磺酸转移酶家族(AtSOTs)被分为8个亚家族[2],其中,第1个被鉴定出的拟南芥SOT基因(RaR047、At2g03760)即是 AtSOT12[7],它能够被盐、渗透压和激素处理强烈诱导,其T–DNA插入突变体sot12,在种子发芽阶段对NaCl 和脱落酸(abscisic acid,ABA)以及在幼苗生长期对水杨酸(SA)表现出高度敏感性[8]。体外酶活性试验表明,AtSOT12蛋白能够磺酸化水杨酸,而水杨酸的磺酸化对水杨酸的产生具有正向调节作用[8]。在感染丁香假单孢菌病原菌的情况下,sot12突变体、AtSOT12过表达植株分别表现出对水杨酸的低积累、高积累[8]。与水杨酸水平的改变一致,sot12突变体更易感病,然而AtSOT12过表达植株对病原菌感染具有更强的抗性。此外,病原菌诱导的PR基因在AtSOT12过表达植株叶片中的表达也显著增强[8]。
目前,人们对油菜中的SOT基因仍鲜有研究。本研究中通过构建甘蓝型油菜 BnaSOT12a基因的过表达载体pFGC5941::35S:BnaSOT12a,并转化拟南芥野生型植株 Col–0,研究了甘蓝型油菜BnaSOT12a基因在抗盐方面的部分作用,旨在为提高甘蓝型油菜的抗逆性和遗传育种提供依据。
1 材料与方法
1.1 材料
拟南芥(Arabidopsis thaliana)哥伦比亚野生型Col–0、甘蓝型油菜湘油–15 (XY–15)、根癌农杆菌(Agrobacterium tumefaciens)GV3101菌株、大肠杆菌(Escherichia coli)DH5α菌株、克隆载体pEASY、表达载体 pFGC5941,均由湖南农业大学植物发育与表观遗传调控实验室提供;Marker为100 bp Plus II DNA ladder,购自北京全式金生物技术有限公司。
1.2 方法
1.2.1 拟南芥培养
将营养土和蛭石按体积比 2∶1加水混合,装入小钵,小钵置于盆中。拟南芥种子播种于混合土表面,喷洒少量水,并用保鲜膜覆盖。在4 ℃、避光处理3 d后转移至光照培养室内,揭膜。培养温度为23 ℃,长日照(16 h光照,8 h黑暗),相对湿度50%~60%。定期浇灌晾晒过的自来水。
1.2.2 BnaSOT12a表达的RT–PCR检测
搜索TAIR网站(http://www.arabidopsis. org/),检索得到拟南芥AtSOT12基因的DNA序列。利用甘蓝型油菜数据库(http://www.genoscope.cns. fr/brassicanapus/)的Blat序列比对工具,以AtSOT12基因DNA序列信息为源数据,得到比对结果中数据库所预测的基因,再根据序列的相似度以及基因结构的相似性,确定了总体相似度最高的BnaSOT12a(BnaC02g35150D)基因作为研究对象。
利用BnaSOT12a基因的CDS序列,通过NCBI (http://www.ncbi.nlm.nih.gov/)网站的Primer–BLAST设计RT–PCR检测引物RTBnST12a–F/RTBn ST12a–R。
RTBnST12a–F,5'–CGCACCTTCTCATACCCT TCTTG–3';RTBnST12a–R,5'–ACTTCACAATCCC TCCGACT–3'。预测PCR产物大小为459 bp。
分别取开花期的湘油–15(XY–15)植株的根、茎、莲座叶、茎生叶、花芽、花以及果荚,采用Trizol法[9]提取各组织的总RNA,反转录成cDNA。以该cDNA为模板,油菜Actin2.1表达为参照。用设计好的RTBnST12a–F/RTBnST12a–R引物进行PCR扩增;用1.5%琼脂糖凝胶电泳检测扩增产物条带。
1.2.3 pFGC5941: :35S:BnaSOT12a表达载体的构建
从甘蓝型油菜数据库中获得 BnaSOT12a (BnaC02g35150D)基因组序列全长为972 bp,不含内含子。设计PCR扩增引物PBnST12–F/PBnST12–R扩增该基因组序列全长,分别在上游和下游引物5'端加上 AscⅠ和 BamHⅠ酶切位点的序列及保护碱基,预期PCR扩增产物所得目的片段大小为989 bp。克隆引物序列如下:PBnST12–F,5'–GGCGCGCCA TGTCATCATCATCATCATC–3';PBnST12–R,5'–CG CGGATCCTCAACAAGAAAATTTGAGACC–3'。
采用改进的 CTAB法[10]提取甘蓝型油菜的总DNA。以该DNA为模板,PBnST12–F/PBnST12–R为引物,用高保真酶进行PCR扩增,回收目的片段,连接到全式金公司pEASY载体上,采用热激法转化大肠杆菌DH5α感受态细胞。在添加有卡那霉素的琼脂平板上筛选阳性菌,并用PCR方法确定转化株。挑取阳性单菌落液体培养,取菌液送博尚生物技术(上海)有限公司测序。对测序结果正确的菌株提取pEASY–BnaSOT12a质粒,用AscⅠ和BamHⅠ核酸酶对pEASY–BnaSOT12a质粒和pFGC5941载体进行酶切,回收目的片段和目的载体,最后将两者用T4连接酶连接。
1.2.4 拟南芥转化及发芽率和根长的测定
利用冻融法[11]将连接好的质粒 pFGC5941:: 35S:BnaSOT12a转化根癌农杆菌GV3101菌株,筛选阳性菌,进行菌落PCR鉴定和双酶切验证。阳性菌置于添加有利福平(50 mg/L)、庆大霉素(50 mg/L)和卡那霉素(100 mg/L)的 YEB液体培养基中,28℃、180 r/min培养至OD600=1.0~2.0。利用浸花法[12]转化拟南芥Col–0。收集F0代拟南芥种子,播种于营养土表面,待发芽后喷洒5 g/L的PPT,每天2次,连续6 d。将抗性苗移至新鲜蛭石小钵中,23 ℃、长日照(16 h/d光照)培养。
设计转化阳性植株检测引物。上游引物pFGC5941–35S–F在载体 35S区域,下游引物BnST12a–jcR在目的片段上。预期扩增片段大小为857 bp。引物序列:pFGC5941–35S–F,5'–ACCTCCT CGGATTCCATTGC–3';BnST12a–jcR,5'–CTCTTA ACGGACTCGGGC AG–3'。
提取抗性苗植株叶片DNA,以总DNA为模板,用上述引物进行PCR扩增,检测目的条带,获得转基因植株。分株收集F1代种子,播种后再次筛选与检测,直到获得稳定遗传的转基因植株。
将转基因拟南芥 Bnsot12a 和 Col–0的种子表面消毒,分别置于添加50 mmol/L NaCl的 1/2MS培养基上培养,每天统计发芽率,连续 8 d。在普通1/2MS培养基发芽3 d后,幼苗转移至添加有0、50、100 mmol/L NaCl的培养平板中竖直培养,7 d后测量根长。
1.2.5 抗性相关基因PR1、PR2、PR5及BnaSOT12a基因表达的RT–PCR检测
将在添加0、50、100 mmol/L NaCl的培养平板上生长10 d的拟南芥幼苗取出,采用Trizol法[9]提取植株的总 RNA,并反转成 cDNA。以拟南芥ACTIN2作为内参调节模板起始量。分别使用设计好的PR1、PR2、PR5及BnaSOT12a基因检测引物进行PCR扩增,用1.5%琼脂糖凝胶电泳检测目的条带。
PR1 基因检测引物(预期产物大小为335 bp):
PR1–F,5'–GGAGACTGTGGCGGTCTAAG–3';PR1–R,5'–TAGTCCGTGGGAGGACAAGT–3'。
PR2基因检测引物(预期产物大小为494 bp):
PR2–F,5'–GAGCTCATCCTCGACGTTCC–3';PR2–R,5'–CCGTGTCTCCCATGTAGCTG–3'。
PR5基因检测引物(预期产物大小为268 bp):
PR5–F,5'–AACAATTGCCCTACCACCGT–3';PR5–R,5'–CGCCATCGCCTACTAGAGTG–3'。
2 结果与分析
2.1 甘蓝型油菜不同组织中的 BnaSOT12a基因表达情况
对甘蓝型油菜XY–15不同部位的BnaSOT12a基因表达情况进行 RT–PCR检测,以甘蓝型油菜Actin2.1基因表达水平为参照,结果显示BnaSOT12a基因在根、叶、花芽和花中都有表达,其中在花中的表达量最高,而在茎和果荚中没有表达(图1)。

图1 BnaSOT12a基因在甘蓝型油菜不同组织中的表达Fig.1 Expression of BnaSOT12a gene in different tissues of Brassica napus
2.2 BnaSOT12a基因过表达质粒的构建、转化及鉴定
为了研究甘蓝型油菜 BnaSOT12a基因在植物中发挥的功能,采用PCR扩增克隆了该基因的全长序列,再采用 AscⅠ和 BamHⅠ核酸酶双酶切pEASY–BnaSOT12a及pFGC5941::35S质粒,最后通过连接酶将目的片段连接到pFGC5941载体上,构建成过表达质粒 pFGC5941::35S:BnaSOT12a(图2)。为了验证载体连接的正确性,对该过表达载体再次进行了AscⅠ和BamHⅠ酶双酶切(图3)。结果显示,目的片段与理论预期结果相符合,说明pFGC5941: :35S:BnaSOT12a载体构建成功。

图2 pFGC5941: :35S:BnaSOT12a质粒构建示意图Fig.2 Schematic diagram of pFGC5941: :35S:BnaSOT12a plasmid construction

图3 pFGC5941::35S:BnaSOT12a质粒双酶切电泳结果Fig.3 Electrophoresis image of pFGC5941::35S:BnaSOT12a plasmid digested by double restriction enzyme
将pFGC5941: :35S:BnaSOT12a质粒通过农杆菌介导的浸花法转化 Col–0,采用前述方法并通过PPT筛选得到抗性植株(图4)。将抗性植株转移至营养土中生长。提取拟南芥叶片总DNA,以此为模板,利用检测引物pFGC5941–35S–F/BnST12a–jcR进行PCR检测,表明目的片段成功导入拟南芥基因组中,获得3株转基因植株(图5)。

图4 PPT拟南芥抗性植株筛选结果Fig.4 Screening of PPT–resistant Arabidopsis seedlings
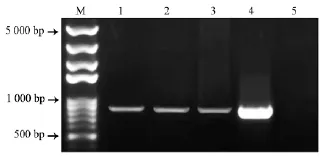
M Marker;1~3 抗性植株;4 质粒阳性对照;5 Col–0阴性对照。图5 抗性植株转基因PCR检测结果Fig.5 Transgenic PCR detection of resistant plants
2.3 转基因植株的发芽率及根长
以拟南芥 Col–0为对照,对稳定遗传的Bnsot12a转基因拟南芥种子的耐盐能力进行了检测。结果显示,在50 mmol/L NaCl 胁迫下,第1 天未观察到种子发芽,在胁迫2~4 d,2种材料的发芽率几乎没有差别;随着胁迫时间的延长,发芽率开始出现差异,Bnasot12a种子的发芽率逐渐比野生型拟南芥种子的发芽率高约10%,达到58%(图6)。而未受胁迫的情况下,2种拟南芥种子的发芽率都在 80%以上(数据待发表)。在盐胁迫下的根生长试验中,尽管野生型拟南芥和Bnasot12a的根长都受到NaCl胁迫的影响而变短,但随着NaCl浓度的增加,Bnasot12a的根长始终比Col–0的长0.3~0.6 cm。这种结果说明甘蓝型油菜 BnaSOT12a基因在拟南芥中的过表达,能提高转基因植株对NaCl胁迫的耐受能力(图7)。
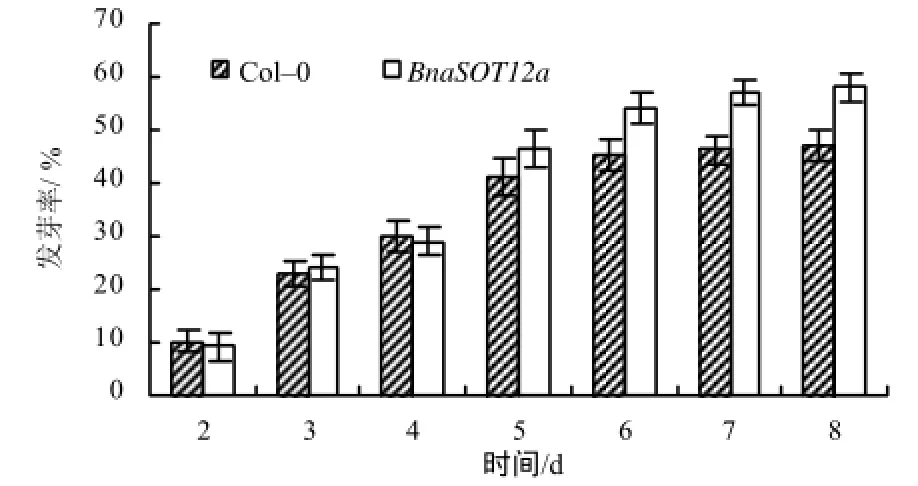
图6 NaCl 胁迫下拟南芥种子的发芽率Fig.6 Germination rate of Arabidopsis seed under NaCl stress

图7 不同浓度NaCl培养基中抗性植株的根长Fig.7 Root length in NaCl medium with different concentrations
2.4 抗性相关基因PR1、PR2、PR5及BnaSOT12a基因表达的RT–PCR检测
甘蓝型油菜BnaSOT12a具有催化磺酸化的作用,其催化的磺酸化作用是否影响水杨酸的磺酸化,进而影响植株的抗病性?为此,笔者检测了 BnaSOT12a过表达植株中的PR1、PR2、PR5 基因表达水平。研究显示,无论是否添加NaCl 处理,PR1、PR2、PR5的基因表达水平在Bnasot12a与Col–0中类似,说明甘蓝型油菜BnaSOT12a的磺酸化作用并不影响拟南芥中的抗病途径的信号传导,或者说BnaSOT12a可能不影响水杨酸的磺酸化(图8)。
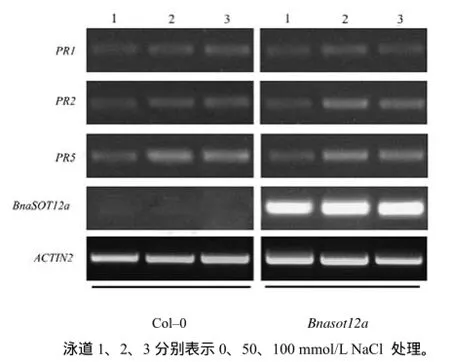
图8 PR1、PR2、PR5及BnaSOT12a基因表达的RT–PCR检测结果Fig.8 Gene expression detection of PR1, PR2, PR5 and BnaSOT12a genes in Col–0 and Bnasot12a mutant
3 讨论
盐胁迫会导致植物发生一系列的生理变化,进而抑制植物的生长。研究[13–14]表明,植物对盐胁迫的应答涉及到多种基因和各种复杂的生物信号途径。在拟南芥中,AtSOT12基因的表达能够被盐、渗透压和激素处理强烈诱导。本研究探索了甘蓝型油菜中 BnaSOT12a基因的特异性表达以及在植物抗性反应中的作用。结果表明,该基因在甘蓝型油菜中主要在花、叶以及根中表达,其中在花中表达量最高,而在茎与果荚中没有表达,说明BnaSOT12a是一个组织特异性表达的基因,这可能与它的作用功能的发挥有关。在拟南芥发芽率和根长试验中,BnaSOT12a基因过表达突变体对盐胁迫表现出一定的抗性,对盐胁迫的耐受性相较于野生型有一定增强,也就是说BnaSOT12a基因的磺酸化作用与盐胁迫相关,其过表达有利于提高植株对盐胁迫的耐受能力。在有或无盐胁迫下,拟南芥转基因植株与Col–0中的PR1、PR2、PR5基因表达均不受影响,表明甘蓝型油菜的BnaSOT12a基因的抗盐机理与水杨酸途径不同,与植物的抗病信号传导途径没有直接联系。
参考文献:
[1] Hirschmann F,Krause F,Papenbrock J.The multiprotein family of sulfotransferases in plants:composition,occurrence,substrate specificity,and functions[J]. Frontiers in Plant Science,2014,5(16):556.
[2] Klein M,Papenbrock J.Sulfotransferases and their tole in glucosinolate biosynthesis[C]//Khan N,Singh S,Umar S. Sulfur Assimilation and Abiotic Stress in Plants.Berlin:Springer-Verlag,2008:149–166.
[3] Klaassen C D,Boles J W.Sulfation and sulfotransferases 5:the importance of 3'–phosphoadenosine 5'–phosphorsulfate (PAPS) in the regulation of sulfation[J].The FASEB Journal,1997:11(6),404–418.
[4] James M O.Enzyme kinetics of conjugating enzymes:PAPS sulfotransferase[C]//Swati Nagar.Enzyme Kinetics in Drug Metabolism.New York:Humana Press,2014:187–201.
[5] Frederick C Kauffman.Conjugation Deconjugation Reactions in Drug Metabolism and Toxicity[M].New York:Springer-Verlag,1994:45–78.
[6] Weinshilboum R M,Otterness D M,Aksoy I A,et al. Sulphotransferase molecular biology: cDNAs and genes[J].The FASEB Journal,1997,11(1):3–14.
[7] Lacomme C,Roby D.Molecular cloning of a sulfotransferase in Arabidopsis thaliana and regulation during development and in response to infection with pathogenic bacteria[J].Plant Molecular Biology,1996,30(5):995–1008.
[8] Dongwon B,Presanth P,Jungsung C.A stress-inducible sulphotransferase sulphonates salicylic acid and confers pathogen resistance in Arabidopsis [J].Plant Cell and Environment,2010,33(8):1383–1392.
[9] 吴凯朝,黄诚梅,李杨瑞,等.Trizol试剂法快速高效提取 3种作物不同组织总 RNA[J].南方农业学报,2012,43(12):1934–1939.
[10] 李荣华,夏岩石,刘顺枝,等.改进的CTAB提取植物DNA方法[J].实验室研究与探讨,2009,28(9):14–16.
[11] Wang X Q,Shen X,Yun-Mian H,et al.An optimized freeze-thaw method for transformation of Agrobacterium tumefaciens EHA105 and LBA4404[J].Pharmaceutical Biotechnology,2011,18(5):382–386.
[12] Wiktorek-Smagur A,Hnatuszko-Konka K,Kononowicz A K.Flower bud dipping or vacuum infiltration-two methods of Arabidopsis thaliana transformation[J]. Russian Journal of Plant Physiology,2009,56(4):560–568.
[13] 蔡晓锋,胡体旭,叶杰,等.植物盐胁迫抗性的分子机制研究进展[J].华中农业大学学报,2015,34(3):134–141.
[14] Munns R,Tester M.Mechanisms of salinity tolerance[J]. Annual Review of Plant Biology,2008,59(1):651–681.
责任编辑:苏爱华
英文编辑:梁 和
Study on the resistance of BnaSOT12a gene in Brassica napus
Ouyang Ning,Jin Lu,Ruan Ying*,Chen Donghong
(College of Bioscience and Biotechnology, Hunan Agricultural University, Changsha 410128, China)
Abstract:Sulphonation reaction catalyzed by sulfotransferase (SOT, EC 2.8.2.–) plays a key role in plant growth and resistance. BnaSOT12a in Brassica nupus is a sulfotransferase gene, homologous to ATSOT12 in Arabidopsis. To seek BnaSOT12a gene functions associated with resistance, the gene expression level in various organs of Brassica nupus and the effect of overexpression on transgenic plant of Arabidopsis were analyzed. Results showed that BnaSOT12a could be expressed in leaves, buds and flowers. In flowers, the expression lever was the highest. However, no expression in stems and capsule. The endurable capability of NaCl was enhanced in root growth and germination in transgenic plant as BnaSOT12a overexpression in Arabidopsis. Nevertheless, sulphonation reaction catalyzed by BnaSOT12a did not affect disease-resistant signal transduction within Arabidopsis under salt stress. Hence, BnaSOT12a seems irrelevant with disease resistance pathway.
Keywords:Brassica napus; Arabidopsis thaliana; BnaSOT12a gene; semi-quantitative PCR(RT–PCR); salt resistance;gene expression
中图分类号:Q78
文献标志码:A
文章编号:1007−1032(2016)03−0251−05
收稿日期:2016–04–05 修回日期:2016–04–13
基金项目:湖南省高校创新平台开放基金项目(14K046)
作者简介:欧阳宁(1988—),男,湖南永州人,硕士研究生,主要从事植物抗逆性基因的研究,ouyang0901@qq.com;*通信作者,阮颖,博士,教授,主要从事植物发育与表观遗传调控研究,yingruan@hotmail.com
