Livin、Smac在婴幼儿增生期血管瘤中的表达及其意义
2016-07-18陈润芳李攀登张远贵
陈润芳, 李攀登, 张远贵, 张 莉
实验研究
Livin、Smac在婴幼儿增生期血管瘤中的表达及其意义
陈润芳, 李攀登, 张远贵, 张 莉
目的 研究婴幼儿增生期血管瘤组织中Livin和Smac的表达并进行相关性分析,初步探讨Livin和Smac在血管瘤发病机制中的作用。方法 采用RT-PCR和免疫组化分别检测LivinmRNA、SmacmRNA和蛋白在20例婴幼儿增生期血管瘤和15例正常皮肤组织中的表达。结果 以上2种组织中LivinmRNA、SmacmRNA和蛋白的表达,其差异均有统计学意义(P<0.05)。血管瘤中LivinmRNA的表达水平和蛋白的阳性表达率高于正常皮肤组织(P<0.05),血管瘤中SmacmRNA的表达水平和蛋白的阳性表达率低于正常皮肤组织(P<0.05);增生期血管瘤组织中Livin和Smac蛋白的表达呈负关联。结论Livin基因高表达可能抑制了Smac基因表达,从而导致了血管瘤内皮细胞增殖和凋亡的失衡,最终导致了血管瘤的形成。
血管瘤;Livin;Smac; 婴幼儿; 增生期
婴幼儿血管瘤是婴幼儿期较常见的良性肿瘤,发病率较高,严重危害着患儿的身心健康。血管瘤有其独特的自然病史:增生期和消退期。但其确切的发病机制目前尚未完全阐明。大量研究显示,血管瘤的增生和消退可能是由于血管内皮细胞的增殖和凋亡失衡所造成的。Livin、Smac是新近发现的凋亡相关蛋白,在恶性肿瘤中研究报道较多。自2013年8月至2014年12月,徐州医科大学附属医院采用RT-PCR和免疫组化方法,分别检测增生期血管瘤组织中LivinmRNA、SmacmRNA和蛋白的表达水平及其相关性,探讨二者在婴幼儿血管瘤形成过程中的作用和意义。
1 对象与方法
1.1 标本来源 由徐州医学院附属医院烧伤整形外科提供标本。婴幼儿增生期血管瘤20例(术后按 Mulliken 标准经病理证实为增生期血管瘤)。年龄1~36个月;男性8例,女性12例。瘤体周围正常皮肤组织15例。所有标本术前均未进行任何治疗。患儿家属对取材均知情同意。
1.2 主要试剂 兔抗人Livin、Smac多克隆抗体(美国SANTA CRUZ公司); SP 试剂盒、DAB 显色试剂盒(北京中杉金桥生物技术有限公司);Trizol Reagent(美国INVITROGEN 公司);RT 逆转录试剂盒、PCR 试剂盒(立陶宛MBI公司)。
1.3 RT-PCR 切取实验标本100 mg,按说明书提取总RNA并逆转录合成cDNA。应用Primer Premier 5.0并根据GenBank所提供的LivinmRNA、SmacmRNA序列设计引物,上海捷瑞公司合成(表1)。PCR反应体系:PCR Mix 25 μl、Forward Primer 1 μl、Reverse Primer 1 μl、cDNA 1 μl、Water,nuclear-free 22 μl。PCR反应条件:⑴Livin,94℃预变性3 min;变性:94℃,30 s;退火:60℃,30 s;延伸:72℃,45 s,共32循环;延伸:72℃ 7 min。⑵Smac,94℃预变性3 min,变性:94℃,40 s,退火:58℃,30 s,延伸:72℃,40 s,共32循环;延伸:72℃,5 min。⑶内参基因 β-actin, 94℃预变性3 min;变性:94℃,30 s;退火:65℃,30 s;延伸:72℃,45 s,共32循环;延伸:72℃,7 min。取 5 μl PCR 产物经琼脂糖凝胶电泳,凝胶成像系统(上海天能科技有限公司)成像并进行半定量分析,结果以目的条带荧光强度值同与之配对的内参照 β-actin 扩增条带的荧光强度值的比值(即β-actin校正值)表示。试验重复3次。
1.4 免疫组织化学染色 按照SP染色试剂盒说明书进行操作。分别按1∶100和1∶50稀释一抗:兔抗人Livin、Smac多克隆抗体。采用阳性系数(染色强度×阳性细胞百分比)判定染色结果。采用同一显微镜倍数(×40)观察并随机选择5个高倍视野。染色强度标准[1]:0分(基本不染色),1分(染色淡),2分(染色中等),3分(染色深)。阳性细胞百分率(表达阳性的病例/总病例数×100%)标准:0分(<5%),1分(6%~25%),2分(26%~50%),3分(>51%)。阳性系数标准:0~1分为阴性(-);2~9分为阳性,其中弱阳性(+):2~3分,中等阳性(++):4~6分,强阳性(+++):9分。

表1 RT-PCR所用引物及扩增片段长度
1.5 统计学处理 数据采用SPSS 17.0软件进行统计学分析。计量资料采用两样本t检验,计数资料采用Kuskal-WallisH检验。相关性采用Spearman等级相关分析,以P<0.05为有统计学意义。
2 结果
2.1 PCR结果 LivinmRNA在婴幼儿增生期血管瘤组织中高表达,与正常皮肤中LivinmRNA比较,差异具有统计学意义(P<0.05);SmacmRNA在婴幼儿增生期血管瘤组织中低表达,与正常皮肤中SmacmRNA比较,差异具有统计学意义(P<0.05)。见图1,2及表2。
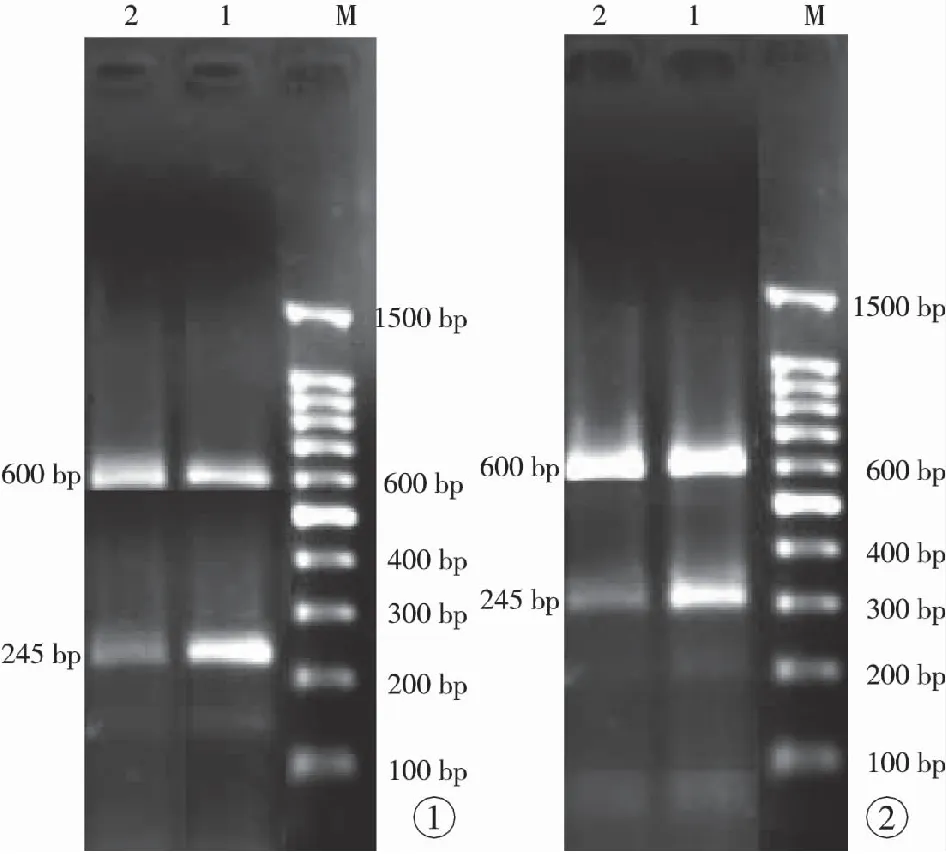
图1 2种组织LivinmRNA表达情况 (M:Marker;1:血管瘤;2:正常皮肤) 图2 2种组织SmacmRNA表达情况 (M:Marker;1:正常皮肤;2:血管瘤)
Fig 1 Expression of livin mRNA in 2 tissues (M:Marker. 1: hemangioma. 2: normal skin.). Fig 2 Expression of Smac mRNA in 2 tissues (M: marker. 1: normal skin. 2: hemangioma.).
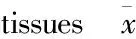
表2 2种组织中Livin和Smac mRNA的表达
注:﹡与正常皮肤比较P<0.05
2.2 免疫组化染色结果Livin在婴幼儿增生期血管瘤组织中主要表达于内皮细胞的胞质或胞核中,表现为棕黄色染色,阳性表达率为80%;正常皮肤组织中少量表达,阳性表达率为40%。Smac表达于正常皮肤上皮细胞的胞质中,亦表现为棕黄染色,阳性表达率高达93%;在婴幼儿增生期血管瘤组织中少量表达,阳性表达率为25%。见表3,4及图3。
2.3 婴幼儿增生期血管瘤组织中Livin和Smac蛋白表达的关联性 将血管瘤组织中Livin和Smac蛋白表达进行Spearman等级相关分析,r=-0.336,P<0.01,说明增生期血管瘤组织中Livin和Smac蛋白的表达呈负关联。
3 讨论
婴幼儿血管瘤发病率较高,男女比例为1∶3~1∶5。婴幼儿血管瘤是血管内皮细胞克隆性增生所形成的良性肿瘤,伴随着内皮细胞的异常增殖和快速大量的微血管形成。但血管瘤有其独特的自然病史:增生期、消退期和消退完成期。目前尚未完全阐明其确切的发病机制。血管瘤肉眼(宏观)所见的增生和消退可能就是血管瘤内皮细胞(微观)增生和凋亡的外在表现。而血管瘤内皮细胞增殖和凋亡的分子机制目前仍不完全明确。经典的细胞凋亡途径有2条,分别为细胞外途径(细胞表面死亡受体通路)和细胞内途径(线粒体通路)。细胞内途径主要与细胞色素C、Bcl-2、Bax和Caspase-9等相关,细胞外途径主要涉及Fas/FasL及Caspase-8等。
凋亡抑制蛋白家族(inhibitor of apoptosis proteins, IAPs)是在人类进化过程中相当保守的一类凋亡抑制蛋白。Livin又名肾脏凋亡蛋白抑制因子或黑色素细胞瘤凋亡蛋白抑制因子,是最新发现的IAPs的一名新成员,亦是到目前为止被发现的最强的凋亡抑制因子之一[2]。Livin拥有BIR和RING锌指结构域(lAPs家族所特有),其能通过多种途径完成对细胞的凋亡抑制作用。杨珊珊等[3]研究显示,Livin 能通过其特有的BIR 结构域与凋亡核心蛋
表3 2种组织中Livin的阳性表达例数
注:﹡与正常皮肤比较P<0.05

表4 2种组织种Smac的阳性表达例数
注:Kuskal-Wallis H检验,﹡与正常皮肤比较P<0.05
白Caspase-3结合,并导致其失活和降解,从而实现对细胞凋亡的抑制。肖维等[4]研究发现,Livin在多数恶性肿瘤组织中高表达,而在成人的正常组织中则表现为低表达或不表达。本研究表明,LivinmRNA和蛋白在婴幼儿增殖期血管瘤中阳性表达率高于正常皮肤组,差异具有统计学意义(P<0.05)。Livin基因在婴幼儿增殖期血管瘤中的表达上调, 我们推测其可能参与了血管瘤的形成、增殖过程,在血管瘤的发生发展过程中起了重要作用。
Smac第2个线粒体来源的胱氨酸酶激活剂,亦是最新被发现的促凋亡分子之一[5],也是迄今为止被发现的惟一能抑制多个IAPs家族成员活性的蛋白。 人类Smac基因位于第12号染色体的长臂是由7个外显子组成,其基因全长1.5kb。Smac是在细胞的胞质中合成,共计239个氨基酸组成,其中N-末端55个氨基酸残基为线粒体靶序列(mitochondrialtargetingsequence,MTS)以确保Smac移入线粒体。于线粒体内MTS被信号肽剪切,从而使Smac获得凋亡活性,成熟的Smac分子含有184个氨基酸。Smac可与Livin的BIR结构域特异性结合以解除IAP的抑制作用并释放有活性的Caspase-3,从而促进细胞凋亡的发生[6-9]。IAPs除了含有BIR结构域,还具有泛素连接酶活性的指环状结构区锌指结构域。有研究[10-11]称,IAPs中的E3泛素连接酶可以使与 BIR结合的SMAC泛素化,从而实现SMAC的降解而完成凋亡抑制作用。X线晶体衍射成像显示,Smac是通过N-端的丙氨酸-缬氨酸-脯氨酸-异亮氨酸与IAP家族中的BIR结构域表面凹槽相互结合,从而解除对Caspase-3抑制而发挥促凋亡的生物学作用。肖维和Verhagen等[4,12]发现,Smac广泛表达于人体正常组织,但在大多数恶性肿瘤中表达降低或缺失,而且表达量也因恶性肿瘤的不同而差异较大,提示在肿瘤的发生发展过程中Smac可能起着非常重要的作用。但Smac在婴幼儿增生期血管瘤的发生发展中的作用目前相关研究报道甚少。我们研究发现,婴幼儿增生期血管瘤组织中 SmacmRNA的表达水平和蛋白的阳性表达率低于正常皮肤组织。因Livin和Smac都与细胞凋亡密切相关,且在血管瘤中均表达异常,两者有无内在的相关性?为此我们进行了分析,发现婴幼儿增生期血管瘤中Livin和 Smac的表达呈负相关。我们推测两者在婴幼儿增生期血管瘤的发生发展中存在着相互拮抗或负反馈调节的关系。
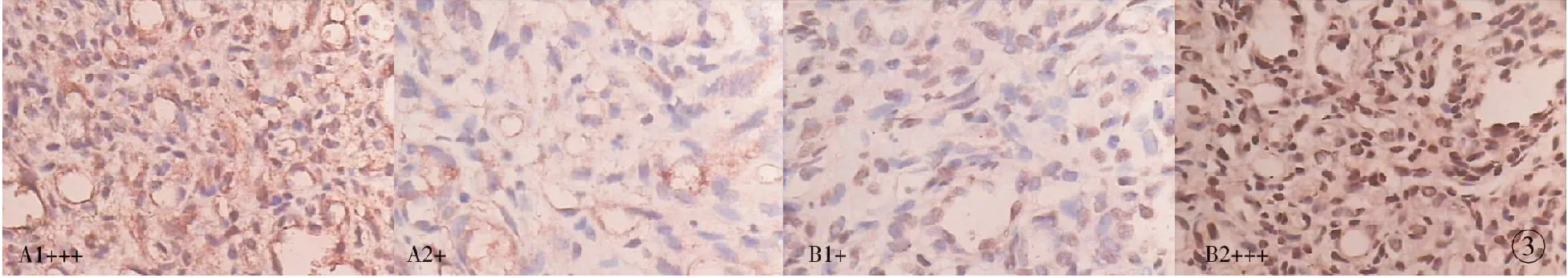
图3 2种组织中Livin(A)、Smac(B)蛋白的表达 (×400) (1:血管瘤 2:正常皮肤)
Fig 3 Livin (A), SMAC (B) protein expression in two kinds of tissues (×400) (1: hemangioma. 2: normal skin.)
综上所述,Livin基因的过度激活和Smac基因的低表达,可能在凋亡信号传导网络通路中起重要的作用。我们推测Livin基因的高表达,可能抑制了Smac基因表达或与Smac结合抑制了Smac的凋亡作用,从而导致细胞凋亡不足,并导致血管瘤内皮细胞增殖和凋亡的失衡,使增殖明显大于凋亡,因而血管瘤内皮细胞出现了过度增殖,最终导致血管瘤的形成,尚需进一步研究证实。Livin、Smac基因可能在婴幼儿血管瘤发生发展的过程中起了关键性作用。进一步深入探讨二者与婴幼儿血管瘤的关系,可能为婴幼儿血管瘤发病机制的研究提供新思路,为其临床防治提供新途径。
[1] 张 莉, 张成书, 李旭文, 等. Survivin、VEGF、Caspase-3在血管瘤不同时期的表达及其相关性研究[J]. 组织工程与重建外科杂志, 2010,6(2):89-92.
[2] 刘守洲, 林立强, 王 孝, 等. Livin和Bcl-2在喉鳞状细胞癌的表达及相关性研究[J]. 济宁医学院学报, 2011,34(2):90-92.
[3] 杨珊珊, 马 楠, 罗晓华. 凋亡抑制基因Livin在宫颈鳞癌组织中的表达及其与Bcl-2的关系[J]. 肿瘤基础与临床, 2009,22(2):116.
[4] 肖 维, 彭 健, 张阳德. mPEG-CS纳米粒介导livin shRNA基因纳米复合物的制备及转染效率[J]. 中国组织工程研究与临床康复, 2011,15(16):2920-2924.
[5] Du C, Fang M, Li Y, et al. Smac, a mitochondrial protein that promotes cytochrome c-dependent caspase activation by eliminating IAP inhibition[J]. Cell, 2000,102(1):33-42.
[6] Chun-Hua Dai, Jian Li, Shun-Bing Shi, et al. Survivin and Smac gene expressions but not livin are predictors of prognosis in non-small cell lung cancer patients treated with adjuvant chemotherapy following surgery[J]. Jpn J Clin Oncol, 2010,40(4):327-335.
[7] Darding M, Feltham R, Tenev T, et al. Molecular determinants of Smac mimetic induced degradation of cIAP1 and cIAP2[J]. Cell Death Differ, 2011,18(8):1376-1386.
[8] Hui KK, Kanungo AK, Elia AJ, et al. Caspase-3 deficiency reveals a physiologic role for Smac/DIABLO in regulating programmed cell death[J]. Cell Death Differ, 2011,18(11):1780-1790.
[9] 王金娜, 王锦光, 赵 磊. 凋亡抑制基因Livin对肺腺癌细胞A549增殖与耐药的作用[J]. 中国医科大学学报, 2015,44(2):114-118.
[10] Creagh EM, Murphy BM, Duriez PJ, et al. Smac/Diablo antagonizes ubiquitin ligase activity of inhibitor of apoptosis proteins[J]. J Bio Chem, 2004,279(26):26906-29614.
[11] Hu S, Yang X. Cellular inhibitor of apoptosis 1and 2 are ubiquitin ligases for the apoptosis inducer Smac/Diablo[J]. J Biol Chem, 2003,278(12):10055-10060.
[12] Verhagen AM, Ekert PG, Pakusch M, et al. Identification of DIABLO, a mammalian protein that promotes apoptosis by binding to and antagonizing IAP proteins[J]. Cell, 2000,102(1):43-53.
Research on the expression and significance of Livin and Smac in prolifer-ative infantile hemangioma
CHENRun-fang,LIPan-deng,ZHANGYuan-gui,ZHANGLi.
(DepartmentofClinicalLaboratory,BurnPlasticSurgery,AffiliatedHospitalofXuzhouMedicalUniversity,Xuzhou221002,China)
LIPan-deng,Email:climbli@qq.com
Objective To investigate the expression of Livin and Smac in proliferative infantile hemangioma and analyze their relationship. Preliminary study of the significance of Livin and Smac in the pathogenesis of hemangiomas. Methods RT-PCR and immunohistochemical methods were used to detect mRNA and protein expression of Livin and Smac in proliferative infantile hemangioma (20 cases) and normal skin tissue (15 cases). Results There are significant differences in the mRNA and protein expression of Livin and Smac in the two kinds of tissue. Compared with the normal skin tissue (P<0.05),themRNAandproteinpositiveexpressionlevelofLivinwashigher(P<0.05),whilethemRNAexpressionlevelandproteinpositiveexpressionrateofSmacwaslower(P<0.05).TherewasnegativeassociationbeweenLivinandSmacproteinexpressioninproliferativeinfantilehemangioma. Conclusion High expression of the Livin gene may inhibit the expression of the Smac gene and lead to the imbalance between proliferation and apoptosis of hemangioma endothelial cells, eventually leading to the formation of hemangiomata.
Hemangioma; Livin; Smac; Infantile; Prolifer-ative
221002 江苏 徐州,徐州医科大学附属医院(检验科:陈润芳;烧伤整形外科:李攀登,张远贵);蚌埠医学院第一附属医院 整形外科(张 莉) 第一作者:陈润芳(1990-),女,安徽蚌埠人,检验医师. 通信作者:李攀登,221002,徐州医科大学附属医院 烧伤整形外科,电子信箱:climbli@qq.com
10.3969/j.issn.1673-7040.2016.12.013
R
A
1673-7040(2016)12-0744-04
2016-07-08)
