氨烷基磷酸钠及其改性的羟基磷灰石对MG63细胞功能的影响*
2016-07-16孙富华江依柔谢兴益
刘 帅,孙富华,江依柔,谢兴益
(四川大学 高分子科学与工程学院, 成都 610065)
氨烷基磷酸钠及其改性的羟基磷灰石对MG63细胞功能的影响*
刘帅,孙富华,江依柔,谢兴益
(四川大学 高分子科学与工程学院, 成都 610065)
摘要:氨烷基磷酸钠(AAP-n-Na, n=2~6,为氨烷基的碳原子数)可用于制备羟基磷灰石(HA)胶体,是新型的HA表面改性剂,我们的前期研究已证实其无细胞毒性。进一步研究APP-n-Na及其改性HA(Cn-HA)对成骨样细胞MG63功能的影响。研究结果表明,在0.1%浓度下,n=3,4,5的APP-n-Na对MG63细胞的碱性磷酸酶(ALP)和骨钙素(OCP)的表达无不良影响,和阴性对照(空白培养基)的表达水平一致;所有APP-n-Na对矿化结节的形成无不良影响。Cn-HA的浸提液(0.1g/mL,以培养基为浸提介质)对ALP的表达和生物矿化均无不良影响,和对照样(未改性HA和空白培养基)相比无显著差异。研究预示APP-n-Na及其改性的HA用于骨修复材料是安全的。
关键词:氨烷基磷酸;羟基磷灰石;成骨细胞;碱性磷酸酶;骨钙素;钙化结节
0引言
天然骨含有60%~70%的无机成分,主要为羟基磷灰石(HA)。因此HA在骨替代和修复材料中得到了广泛的应用,比如作为人工髋关节的涂层来提高相容性[1],作为颌面外科修复用的支架材料[2],以及作为骨组织替代材料[3-4]等等。但单纯的HA性脆,不能用于承力骨的部位。为此,许多研究者开发了HA/聚合物纳米复合材料[5-8],期望模仿天然骨的力学和生物学性能。
HA纳米粒子在聚合物中的良好分散以及两相界面间强的相互作用力是得到性能优异的骨修复用纳米复合材料的关键[9-10]。迄今为止,这两个问题均未得到很好的解决,因为亲水性的HA很难均匀分散在疏水的聚合物材料中(如聚乳酸、聚己内酯等)。广大的研究者对HA进行表面改性,接上了烷基链[11-12]、聚乙二醇链[7,13]、聚酯齐聚物[14-16]等等。这些方法对改进HA在聚合物中的分散性有一定的作用,但所得的复合材料与天然骨相比,无论是力学还是生物学性能均有很大差距。
我们最近开发了一类氨烷基磷酸NH2-(CH2)n-OPO4H2(AAP-n)[17-19]及其盐,其磷酸根能够和HA纳米粒子表面的钙离子以离子键结合,其氨基能够电离成铵离子,使HA表面带上正电荷,从而得到在水中稳定分散的HA胶体[18]。其颗粒表面的可反应的官能团氨基,为HA的进一步改性提供了广阔的空间,有望制备性能优异的HA纳米复合材料。但AAP-n及其盐是一类新的HA改性剂,其对细胞功能的影响还未见报道。本文研究氨烷基磷酸钠[NH2-(CH2)n-OPO4HNa,AAP-n-Na]及其改性的HA(Cn-HA,n为改性剂中C原子个数)对类成骨细胞MG63功能的影响。这些研究对AAP-n-Na及其改性的HA在骨修复材料中的应用具有重要的意义。
1实验
1.1氨烷基磷酸钠(APP-n-Na)的合成
APP-n-Na(n=3~6,为结构中C原子数)的合成过程主要分为3步:首先,用芴甲氧羰酰氯(Fmoc-Cl)与氨基醇(H2N(CH2)nOH)上的氨基反应,生成Fmoc保护的氨基醇;其次,用POCl3将其磷酰化并水解,得到Fmoc保护的氨烷基磷酸单酯;最后,将该磷酸单酯用哌啶/N,N-二甲基甲酰胺混合液脱Fmoc保护基,用NaOH调pH值为8.6~8.9,在V(水)/V(乙醇)=3∶2中重结晶即得目标产物。具体合成方法已有文献报道[19]。
氨乙基磷酸NH2-CH2CH2-OPO4H2(AAP-2)购自Sigma-Aldrich公司,其钠盐(APP-2-Na)由AAP-2与NaOH(摩尔比1∶1)中和而得。
1.2APP-n-Na改性HA(Cn-HA)的合成
Cn-HA是通过含钙和磷的水溶液快速混合的湿化学过程制备的[18]。钙溶液由0.006molCaCl2溶于15mL水中制的;磷溶液由0.0021molNaH2PO4和0.0036molAAP-n-Na(n=2,3,4,5或6)也溶于15mL水中制得。两者混合后得白色沉淀,用NaOH调pH值为9~10,80 ℃陈化16h得浅蓝色水胶体。将水胶体用BeckmanL8-80M超高速离心机在50 000r/min下离心10min,得到凝胶状的半透明沉淀,用水清洗3遍以除去水溶性杂质。最后,将所有样品冷冻干燥(-50 ℃,10Pa)24h,并在60 ℃下干燥10h,最终制得粉末状Cn-HA(n=2~6)。元素分析表明所得HA的表面含有16%~30%的氨烷基磷酸钙NH2-(CH2)n-OPO4Ca[18]。
1.3用含APP-n-Na的培养基培养MG63细胞
1.3.1碱性磷酸酶(ALP)检测
将每种AAP-n-Na溶于PBS溶液中(1 %,质量分数),过滤除菌,然后用细胞培养液稀释到浓度0.1%,0.05%和0.01%作为待测液,其中细胞培养液是含10%胎牛血清和0.1%双抗(青、链霉素)的DMEM培养基(FisherScientific,北京)。采用24孔板培养细胞,每孔加入培养基1mL,种植2×104个MG63细胞(华西医学院,四川大学);阴性对照组为不含AAP-n-Na的空白培养液。每组4个复孔。接种细胞的孔板放入37 ℃的CO2培养箱中。6d后,吸出孔中液体,用PBS缓冲液洗涤一次,每孔加入100μL1%RIPA强裂解液(碧云天,上海),置于4 ℃裂解细胞膜30min。然后4 ℃ 14 000g离心15min,取上清液,用人碱性磷酸酶(ALP)酶联免疫分析(ELISA)试剂盒(碧云天,上海)来测量ALP含量。
用上述方法检测了含0.1%AAP-n-Na的培养基对MG63细胞的碱性磷酸酶活性影响。测试时间为6和12d。
1.3.2骨钙素含量及矿化结节染色
选取含0.1%AAP-n-Na的培养基作为待测液,用1.3.1节的方法培养细胞6、12d,裂解细胞膜,用人骨钙素(OCN)ELISA试剂盒(碧云天,上海)来测量OCN含量。
为了观察MG63细胞矿化结节的形成,将培养14d的细胞用PBS洗涤,再用10%福尔马林固定30min。用0.1%茜素红溶液(Solarbio,北京)染色30min,用去离子水洗涤3次,在OlympusIX71相差显微镜下(Olympus,日本)观察并拍照。
1.4Cn-HA浸提液用于MG63细胞的培养
将Cn-HA粉末用无菌PBS浸泡(pH值=7.4)4h,弃去液体。然后用三蒸水浸提Cn-HA1d(0.1g/mL),将浸提液用超滤离心管(截留分子量10 000,Minipore,美国)过滤,除去任何悬浮粒子(悬浮的纳米粒子有细胞毒性[20])。滤液用于溶解DMEM粉末(FisherScientific,北京),调pH值到7.2,然后用0.22μm滤膜过滤除菌,再加入0.1%双抗、10%胎牛血清,成为待测细胞培养液。商品HA(Aldrich,美国)的浸提液制备的培养基和空白培养基作为对照培养液。
按照1.3.1节的方法培养MG63细胞6、12d后,裂解细胞,测定ALP活性。按照1.3.2节中矿化结节染色的操作,观察培养了25d的MG63细胞的矿化结节。
2结果与讨论
2.1AAP-n-Na对MG63细胞功能的影响
MG63细胞为人骨肉瘤细胞,能够表达成骨细胞表型,是体外细胞培养常用的成骨样细胞[21]。图1(a)表明APP-n-Na的浓度在0.01%~0.1%范围内对MG63细胞表达ALP几乎没有什么影响,与不加APP-n-Na的空白培养基差别不大。部分样品与空白对照样相比有统计学上的差异,但其表达的ALP量仍有对照样的70%以上,显示所有样品在6d培养时间内均能正常表达ALP。为此,我们在较高的浓度下(0.1%),培养更长的时间,来观察MG63细胞功能蛋白的表达(图2(b)和(c))。ALP和OCP的表达是类似的,在第6d,两者的表达量和对照样无明显差异;而在第12d,含APP-2-Na和APP-6-Na的培养基培养的细胞ALP和OCP的表达量均低于对照样;而n=3,4,5的APP-n-Na的样品与对照样相比,ALP和OCP的表达量与对照样相比是相当的,其中APP-4-Na的骨钙素的表达甚至高于对照样。这些结果表明,n=3,4,5的APP-n-Na对MG63细胞功能蛋白的表达无不良影响。
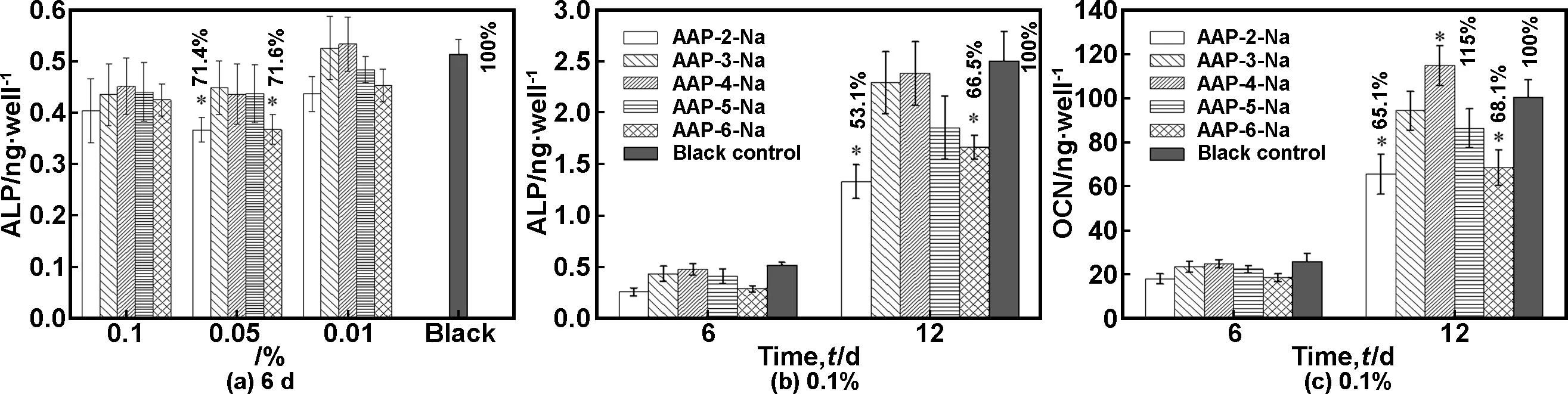
图1AAP-n-Na对MG63 细胞功能蛋白表达的影响。*: 和空白培养基相比有显著差异
Fig1TheeffectsofAAP-n-NaonproteinexpressionsinMG63cells. *: P<0.05,comparedwiththeblankmedium(Student’sttest)
成骨细胞在体内最重要的功能就是促进骨的钙化,其中ALP的作用是将有机磷转化为磷酸根,参与HA的形成[22];而骨钙素能与钙结合,直接参与钙结节的形成,是骨矿化的标志性蛋白[23]。虽然APP-2-Na和APP-6-Na对ALP和OCP的表达有一定的抑制,但矿化情况未见明显差异(图2),所有样品均显示明显的矿化钙结节;说明所有细胞释放的ALP和OCP对于矿化都是足够的。

图2MG63细胞在含0.1%AAP-n-Na的培养基中培养14d后茜素红染色照片。矿化钙结节染成红色。标尺:100μm
Fig2AlizarinredstainingofMG63cellsafter14daysofcultureinmediacontaining0.1%AAP-n-Na.Allthesamplesshowedcalciumnodulesthathavebeenstainedred.Scalebar: 100μm
2.2Cn-HA对MG63细胞功能的影响
图3进一步研究了Cn-HA的浸提液对成骨细胞MG63ALP表达的影响。
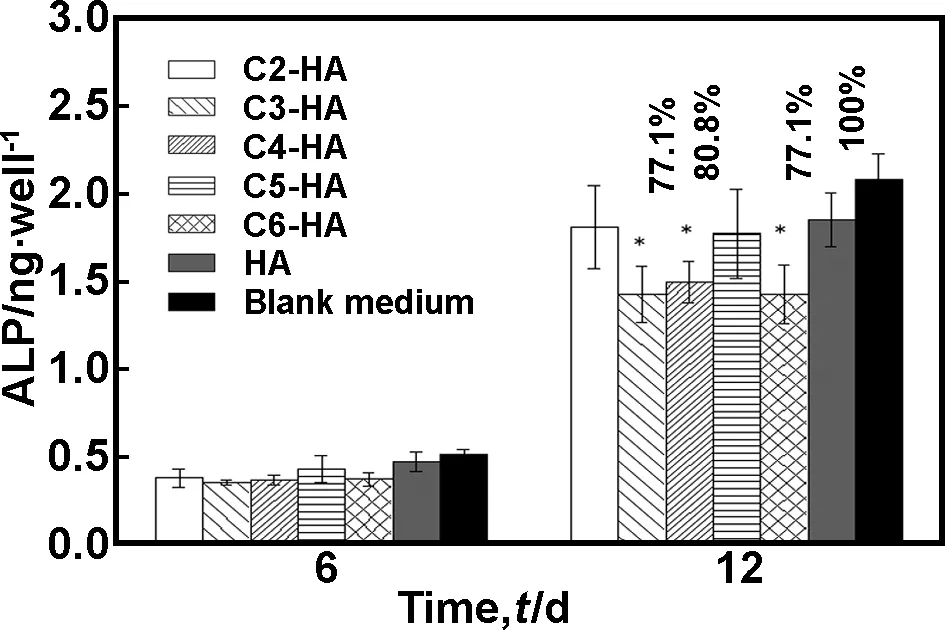
图3Cn-HA浸提液对MG63细胞ALP表达的影响。*:和未改性HA相比有显著差异
Fig3TheextractsfromCn-HAhadaminoreffectontheALPexpressioninMG63cells.
*: P<0.05,comparedwiththeHAcontrol(Student’sttest)
在6d时间内,所有样品对ALP的表达量无显著差异;第12d时,C2-HA和C5-HA和对照样HA相比,ALP表达无显著差异;其余样品C3-,C4-以及C6-HA虽与对照样相比有统计学差异,但ALP表达的量仍达到了HA的约80%。考虑到实验误差,可以说AAP-n-Na改性HA对MG63细胞表达ALP几乎没有什么影响。
值得注意的是,虽然在ALP的表达上不同样品有一定差异,但最终的矿化结果,不同样品均能正常矿化,说明MG63细胞的功能并未受到很大影响。虽然改性剂本身以及不同Cn-HA对功能蛋白的表达有一定的差异,但随着时间的增长,所有功能蛋白的表达都是增加的(图1和3),即长期看来,不同培养基培养的MG63细胞所表达的ALP对于钙化都是足够的,即不同样品对MG63生物矿化没有显著影响。
我们以前的研究已证实,AAP-n-Na及其改性HA对MG63细胞的增殖和形貌是没有影响的(即无细胞毒性)[19]。本研究经一步表明AAP-n-Na及其改性HA对MG63细胞的成骨功能也是没有影响的。因此APP-n-Na及其改性HA在骨修复材料中的使用是安全的。

图4MG63细胞在含Cn-HA浸提液的培养基中培养25d后茜素红染色照片。矿化钙结节染成红色。标尺:100μm
Fig4AlizarinredstainingofMG63cellsafter25dofcultureinmediacontainingCn-HAextracts.Allthesamplesshowedcalciumnodulesthathavebeenstainedred.Scalebar: 100μm
3结论
在0.1%浓度下,n=3,4,5的APP-n-Na对MG63细胞的ALP和OCP表达和对照样(空白培养基)相比无显著差异,所有样品(n=2~6)对MG63细胞矿化无不良影响。将APP-n-Na接枝到HA表面所得到的Cn-HA对MG63细胞的功能(ALP表达和矿化)无不良影响,预示APP-n-Na及其改性HA在骨修复材料中的使用是安全的。
参考文献:
[1]GeesinkRGT,HoefnagelsNHM.Six-yearresultsofhydroxyapatite-coatedtotalhipreplacement[J].JBoneJointSurg(Br), 1995, 77(4): 534-547.
[2]QiuHJ,YangJ,KodaliP,etal.Acitricacid-basedhydroxyapatitecompositefororthopedicimplants[J].Biomaterials, 2006, 27: 5845-5854.
[3]RathboneCR,GudaT,SingletonBM,etal.Effectofcell-seededhydroxyapatitescaffoldsonrabbitradiusboneregeneration[J].JBiomedMaterResPartA, 2014, 102: 1458-1466.
[4]GaraiS,SinhaA.Threedimensionalbiphasiccalciumphosphatenanocompositesforloadbearingbioactivebonegrafts[J].MaterSciEngC, 2016, 59: 375-383.
[5]GaraiS,SinhaA.Biomimeticnanocompositesofcarboxymethylcellulose-hydroxyapatite:novelthreedimensionalloadbearingbonegrafts[J].ColloidsSurfB:Biointerfaces, 2014, 115: 182-190.
[6]NiuYF,CaoLH,WeiJ,etal.Developmentofabioactivecompositeofnanofluorapatiteandpoly(butylenesuccinate)forbonetissueregeneration[J].JMaterChemB, 2014, 2:1174-1181.
[7]LuoJB,QiuSX,WangYL,etal.Preparationandphysicochemicalpropertiesofhydroxyapatite/polyurethanenanocomposites[J].ChinJPolymSci, 2014, 32(4): 467-475.
[8]BasileMA,d’AyalaGG,MalinconicoM,etal.FunctionalizedPCL/HAnanocompositesasmicroporousmembranesforboneregeneration[J].MaterSciEngC, 2015, 48: 457-468.
[10]ShokrollahiP,MehmanchiM,AtaiM,etal.EffectofinterfaceonmechanicalpropertiesandbiodegradationofPCLHApsupramolecularnano-composites[J].JMaterSciMaterMed, 2014, 25: 23-35.
[11]TanakaH,YasukawaA,KandoriK,etal.Surfacemodificationofcalciumhydroxyapatitewithhexylanddecylphosphates[J].ColloidSurfA1997, 125: 53-62.
[12]LiYB,WengWJ.Surfacemodificationofhydroxyapatitebystearicacid:characterizationandinvitrobehaviors[J].JMaterSciMaterMed, 2008, 19: 19-25.
[13]LuoJB,QiuSX,ZhouXY,etal.Insitugraftingpolyethyleneglycolchainsontoamorphouscalciumphosphatenanoparticlestoimprovethestoragestabilityandorganicsolventredispersibility[J].ColloidSurfA, 2014, 444: 81- 88.
[14]HuY,GuXY,YangY,etal.Facilefabricationofpoly(L-lacticacid)-graftedhydroxyapatite/poly(lactic-co-glycolicacid)scaffoldsbypickeringhighinternalphaseemulsiontemplates[J].ACSApplMaterInterfaces, 2014, 6: 17166-17175.
[15]TangYF,LiuJG,WangZL,etal.Invivodegradationbehaviorofporouscompositescaffoldsofpoly(lactide-co-glycolide)andnano-hydroxyapatitesurfacegraftedwithpoly(L-lactide) [J].ChinJPolymSci, 2014, 32(6), 805-816.
[16]PengWH,ZhengW,ShiK,etal.AninvivoevaluationofPLLA/PLLA-gHAnano-compositeforinternalfixationofmandibularbonefractures[J].BiomedMater, 2015, 10: 065007.
[17]KongWB,ZhouXY,YangY,etal.Afacilesynthesisofω-aminoalkylammoniumhydrogenphosphates[J].ChinChemLett, 2012, 23: 923-926.
[18]JiangYR,SunFH,ZhouXY,etal.Waterdispersiblehydroxyapatitenanoparticlesfunctionalizedbyafamilyofaminoalkylphosphates[J].ChinChemLett, 2015, 26: 1121-1128.
[19]SunFH,LongYZ,ZhouXY,etal.Aciddissociationconstantsandcytotoxicitytestofaseriesofomega-aminoalkylphosphates[J].ChinChemLett, 2016,accepted.
[20]MotskinM,WrightDM,MullerK,etal.Hydroxyapatitenanoandmicroparticles:correlationofparticlepropertieswithcytotoxicityandbiostability[J].Biomaterials, 2009, 30: 3307-3317.
[21]PautkeC,SchiekerM,TischerT,etal.CharacterizationofosteosarcomacelllinesMG-63,Saos-2andU-2OSincomparisontohumanosteoblasts[J].AnticancerRes, 2004, 24: 3743-3748.
[22]ColemanJE.Structureandmechanismofalkalinephosphatase[J].AnnuRevBiophysBiomolStruct, 1992, 21: 441-483.
[23]LianJB,SteinGS.Developmentoftheosteoblastphenotype:molecularmechanismsmediatingosteoblastgrowthanddifferentiation[J].LowaOrthopJ, 1995, 15: 118-140.
TheeffectsofaminoalkylphosphatesandtheirmodifiedhydroxyapatitesonMG63cellfunctions
LIUShuai,SUNFuhua,JIANGYirou,XIEXingyi
(CollegeofPolymerScienceandEngineering,SichuanUniversity,Chengdu610065,China)
Abstract:Omega-aminoalkylsodiumhydrogenphosphates(AAP-n-Na, n=2-6,representingthecarbonnumberinthealkylgroup)canbeusedtopreparehydroxyapatite(HA)hydrocolloids,whicharenewsurfacemodifiersforHAandhavenocytotoxicityasconfirmedpreviously.Inthisstudy,theeffectsofAAP-n-NaandtheirmodifiedHAs(Cn-HA, n=2-6)onthefunctionsofhumanosteoblast-likeMG63cellswerefurtherinvestigated.Theresultsshowedthatthealkalinephosphatase(ALP)andosteocalcin(OCN)expressionsincellstreatedwith0.1% (w/v)APP-n-Na(n=3, 4or5)intheculturemediawerecomparabletotheexpressionsintheblankmedium(DMEMsupplementedwith10%fetalbovineserum)asanegativecontrol;andallAAP-n-Na’s(n=2-6)didnotinhibitthecalciumnoduleformation.TheextractsfromcorrespondingCn-HAs(preparedat0.1g/mLinthecellculturemedium)didnotsignificantlyaltertheALPexpressionandcalciumnoduleformationinMG63cellsaswell,incomparisonwiththebareHAextractandtheblankmedium.TheseresultsimplythatAAP-n-Na’sandtheirmodifiedHAsaresafewhenusedinbonegraftingmaterials.
Keywords:Aminoalkylphosphates;hydroxyapatite;osteoblast;alkalinephosphatase;osteocalcin;calciumnodule
文章编号:1001-9731(2016)06-06108-05
* 基金项目:国家自然科学基金资助项目(50973069)
作者简介:刘帅(1989-),男,四川雅安人,在读硕士,师承谢兴益教授,从事生物材料研究。
中图分类号:R318;TQ132.3
文献标识码:A
DOI:10.3969/j.issn.1001-9731.2016.06.019
收到初稿日期:2016-03-21 收到修改稿日期:2016-05-13 通讯作者:谢兴益,E-mail:xiexingyi@263.net
