漆酶-TEMPO体系选择性氧化壳聚糖C-6伯羟基提高其抗氧化性能的研究*
2016-07-16裴继诚殷允北申正会张方东
裴继诚,殷允北,胡 稳,卜 鑫,申正会,张方东
(天津科技大学 造纸学院,天津市制浆造纸重点实验室,天津 300457)
漆酶-TEMPO体系选择性氧化壳聚糖C-6伯羟基提高其抗氧化性能的研究*
裴继诚,殷允北,胡稳,卜鑫,申正会,张方东
(天津科技大学 造纸学院,天津市制浆造纸重点实验室,天津 300457)
摘要:利用漆酶-TEMPO体系选择性地氧化壳聚糖C-6伯羟基,对氧化产物分别进行红外光谱、13C NMR、离子色谱和热失重分析,确定产物结构的变化,并进一步对其抗氧化性进行研究。结果表明,经漆酶-TEMPO体系氧化后,壳聚糖分子结构中的C-6伯羟基被选择性地氧化成羧基,其它结构基本不变,其产物为氧化壳聚糖钠盐;壳聚糖氧化产物与原样相比,热稳定性得到了提高;壳聚糖经漆酶-TEMPO体系氧化后的ABTS自由基清除率5 min后达到66.36%,抗氧化性能得到改善。
关键词:漆酶;TEMPO;壳聚糖;抗氧化性
0引言
壳聚糖(chitosan,CS)是由自然界广泛存在的几丁质(chitin)经过脱乙酰作用得到的,化学名称为聚葡萄糖胺(1-4)-2-氨基-β-D葡萄糖,自1859年,法国人Rouget首先得到壳聚糖后,这种天然高分子的生物官能性和相容性、血液相容性、安全性、微生物降解性等优良性能被各行各业广泛关注,在医药、食品、化妆品、水处理、金属提取及回收、生化和生物医学工程等诸多领域的应用研究取得了重大进展[1-4]。一些研究表明壳聚糖在体外具有一定的抗氧化性能[5-6],作为食品添加剂时,壳聚糖通过与金属离子的螯合[7-8]从而防止脂质氧化,是一种次要型抗氧化剂(secondary antioxidant)。而主要型抗氧化剂(primary anti- oxidant)为自由基提供电子或者氢质子使自由基转变为稳定的中间体,防止它们进一步发生自由基反应,从而有效地抑制氧化反应[9]。虽然壳聚糖的N原子有一对非共用电子对,可以潜在地提供电子,但是由于壳聚糖酸化后在溶液中的pKa约为6.3,氨基大多被质子化无法提供电子,从而导致其抗氧化性较差,限制了其在许多领域的应用。因此,对壳聚糖改性改善其抗氧化性成为近年来研究的热点。壳聚糖中含有的C-6伯羟基和C-2氨基反应活性较高,壳聚糖的改性方式主要在C-2氨基上通过酰基化、烷基化、季铵盐化、接枝共聚、Schiff碱反应、交联等消耗一定量的化学试剂与壳聚糖结合的方式引入新的基团[10],针对壳聚糖C-6伯羟基改性的方法主要有羧基化、烷基化、氧化。根据定量构效关系(QSAR),物质所在溶液pH值与物质的抗氧化性能正相关,溶液的pH值越高,越有利于物质易被氧化基团的去质子化,物质易被氧化基团的供电子能力得到提高,从而提高物质的抗氧化性能[11]。因此在不改变壳聚糖C-2氨基的基础上将其C-6伯羟基氧化成羧基并转变成羧酸盐形式,改性后的壳聚糖在溶液中通过羧酸根的电离提高溶液的pH值,从而抑制壳聚糖C-2氨基的质子化,提高氨基的供电子能力,改善产物的抗氧化性能。
2,2,6,6-四甲基哌啶氧自由基(TEMPO)是一种具有稳定氮氧自由基结构的环状化合物。De Nooy 等[12]在1995年首次发现TEMPO自由基形式经催化剂氧化后转变成 TEMPO+亚硝基形式可以选择性地将醇氧化成醛基或羧基,并利用NaBr-NaClO将TEMPO自由基形式氧化成TEMPO+亚硝基形式并选择性地将水溶性多聚糖如马铃薯淀粉、淀粉糊精和支链淀粉中吡喃糖基的C-6 伯羟基选择性氧化成醛基或羧基。后来Izumi shibata和Akira Isogai[13]利用13C NMR推测了TEMPO- NaBr-NaClO体系氧化纤维素的机理,即在NaBr和NaClO的作用下,TEMPO被氧化成TEMPO+,TEMPO+再选择性将伯羟基氧化成羧基,TEMPO+转变为TEMPOH,NaBr-NaClO再将TEMPOH氧化成TEMPO从而进行下一步反应。
Fabbrini等[14]在2001年发现了漆酶可以将TEMPO自由基形式氧化成TEMPO+亚硝基形式,并可将TEMPOH 羟胺形式氧化成TEMPO自由基形式。后来,Elisabetta Aracri等[15]证明了漆酶-TEMPO体系可以选择性地将剑麻纤维素C-6伯羟基氧化成羧基。Arends等[16]将漆酶与TEMPO组合用于催化分子氧对醇的氧化,反应在室温、常压和pH值为5的条件下进行。文献[17-18]已经证实TEMPO-NaBr-NaClO 体系可以将壳聚糖C-6伯羟基氧化成羧基,因此从理论上漆酶-TEMPO体系也可以将壳聚糖C-6伯羟基氧化成羧基。漆酶是一种环保型酵素,催化苯酚类、芳香胺和其它富含电子的底物单电子氧化,同时将氧分子还原成水[19]。
本文从环保的角度出发,采用漆酶-TEMPO体系选择性将壳聚糖C-6伯羟基氧化成羧基,生成壳聚糖羧酸盐,借助羧酸根在溶液中的电离抑制壳聚糖C-2氨基的质子化,提高氨基给电子能力,改善壳聚糖的抗氧化能力,扩宽壳聚糖应用领域。
1实验材料与方法
1.1材料与设备
漆酶:由诺维信公司提供,商品号NOVOZYME 51003,酶活1072 U/mL;壳聚糖:实验室自制,分子量2 729 Da,脱乙酰度≥97%;2,2,6,6-四甲基哌啶-1-氧基(TEMPO):购于Sigma-Aldrich公司。
傅立叶红外光谱仪(FT-IR):型号VERTEX 70,德国布鲁克公司;核磁共振谱仪(NMR):型号AVANCE III,瑞士布鲁克拜厄斯宾有限公司;离子色谱仪(HPIC):型号ICS1100,美国戴安公司;热重分析仪(TGA):型号Q500-V20.6,美国TA仪器公司;紫外分光光度计(UV):型号UV-2550,日本岛津公司。
1.2壳聚糖氧化方法
2 g壳聚糖和4% TEMPO溶于200 mL pH值=4.8的乙酸-乙酸钠缓冲溶液中,添加200 μL漆酶,30 ℃水浴锅中通氧反应18 h[15]。反应后滤去不溶物,调节溶液pH值至中性,旋转蒸发仪浓缩滤液后加入适量无水乙醇析出产物,微孔滤膜 (0.45 μm) 过滤。过滤所得固体溶于去离子水中,微孔滤膜 (0.45 μm) 过滤,旋转蒸发仪浓缩滤液后加入适量无水乙醇析出产物,重复2次,所得固体常温真空干燥,样品密封保存。不添加漆酶和TEMPO处理的样品表示为CS-control;只经漆酶处理的样品表示为CS-Laccase;经漆酶-TEMPO体系氧化产物表示为CS-Laccase-TEMPO。
1.3检测方法
1.3.1FT-IR检测
取1 mg样品和100 mg干燥的KBr,一起研磨5 min 后压片,然后用FT-IR测定,扫描范围为4 000~650 cm-1,分辨率为4 cm-1,扫描16次,以空气作为采样背景。
1.3.213C NMR检测
13C NMR采用瑞士布鲁克拜厄斯宾400M超导核磁共振仪进行测定。称取100 mg样品溶于0.6 mL的D2O中,采样条件为采用30°脉冲序列,采样时间1.36 s,弛豫时间1.89 s,累积扫描30 000次。
1.3.3离子色谱检测Na+含量
通过离子色谱仪检测Na+含量表征羧基含量。样品中的Na+来自羧基携带的Na+和样品纯化过程中残留在样品中的Na+。根据式(1)可计算出羧基含量
羧基含量=(T-T0)/23
(1)
T为经漆酶/TEMPO/O2处理样品钠离子含量,mg/L;T0为空白样钠离子含量,mg/L;23为钠元素相对分子质量。
离子色谱测试条件:色谱柱,IonPac CS16;淋洗液,30 mmol/L甲烷磺酸;柱温,40 ℃;池温,45 ℃;流速,1.0 mL/min;进样体积,25 μL;抑制器,CSRS (阳离子连续自动再生电解抑制器);电流,88 mA;检测器,电导检测器。
配置浓度分别为30,45,75,90,150 mg/L的Na+溶液标样,使用离子色谱仪检测标样Na+色谱图,记录各浓度对应的峰面积。以Na+浓度为横坐标,对应的峰面积为纵坐标绘制标准曲线。如图1所示。
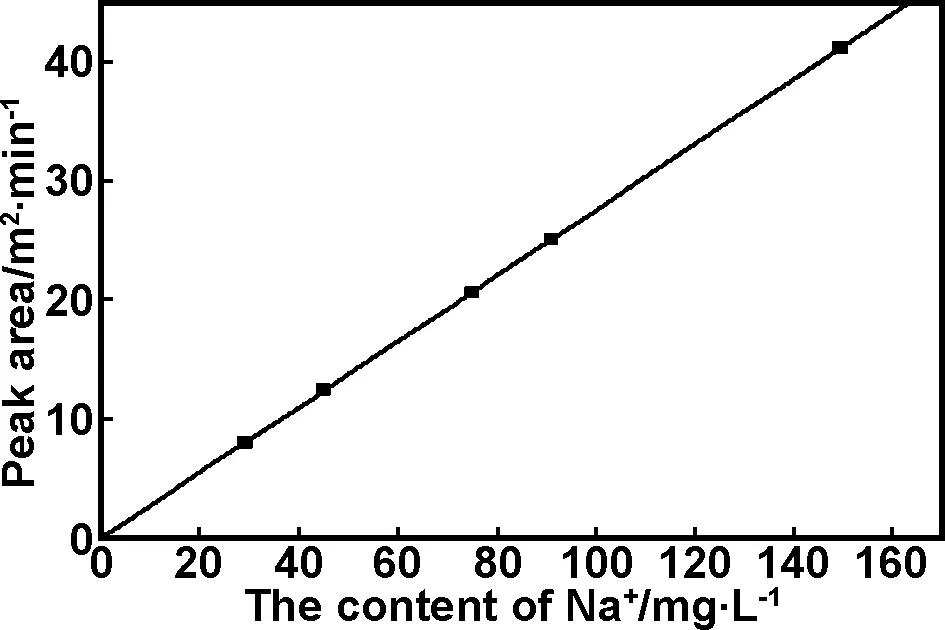
图1 Na+含量标准曲线
配置1 g/L的样品溶液,使用离子色谱仪检测Na+色谱图,记录峰面积,带入标准曲线计算Na+含量。
其中,r=0.9999,曲线回归方程为
y=0.2751x。
1.3.4TGA检测
使用Q500-V20.6热重分析仪对样品进行TGA分析,每个样品重2~5 mg,以氮气作为载体,流速为50 mL/min,实验温度从室温升至600 ℃,升温速率为10 ℃/min,得到热失重曲线。
1.3.5抗氧化性能检测[20]
配制浓度为2.6 mmol/L的过硫酸钾溶液与浓度为7.4 mmol/L的ABTS溶液,分别量取2 mL混合,在避光处储存12 h,制得ABTS自由基溶液,然后用无水乙醇稀释50~60倍至734 nm处吸光度为0.700±0.025。取2 mg试样溶于2 mL去离子水中,再与8 mL稀释后的自由基溶液发生反应,共进行40 min。反应每进行5 min对溶液在734 nm处的吸光度进行测定。另取2 mL去离子水与8 mL稀释后的自由基溶液混合,作为空白样。
利用式(2) 计算其自由基消除率,消除率越高,抗氧化性能越强。
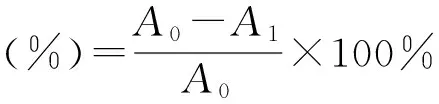
(2)
A0为空白样吸光度;A1为反应后吸光度。
2实验结果与讨论
2.1红外光谱分析
通过红外光谱分析壳聚糖氧化前后官能团的变化,CS-control和CS-Laccase-TEMPO的红外吸收光谱如图2所示。
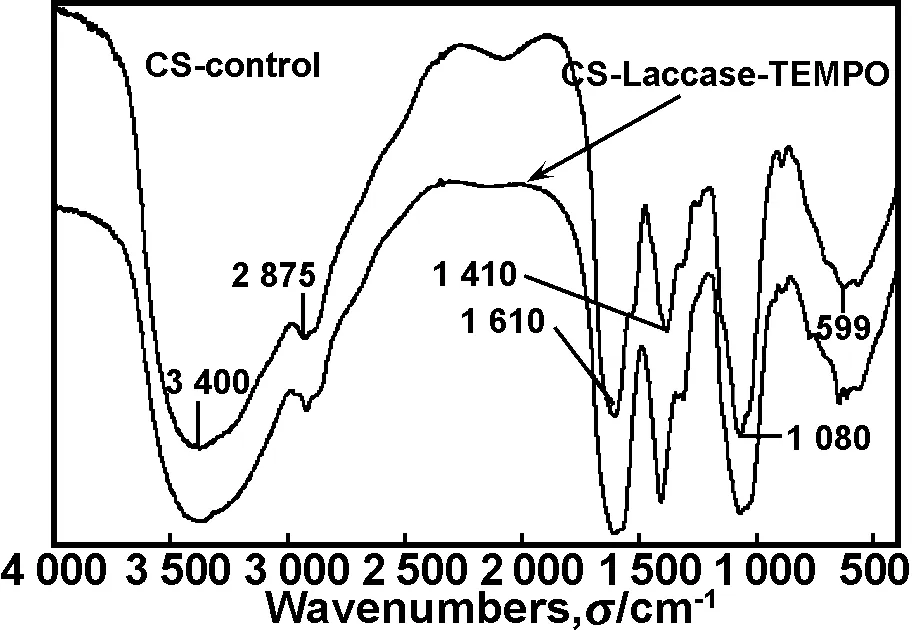
图2CS-control和CS-Laccase-TEMPO的FT-IR图
Fig 2 FT-IR spectra of CS-control and CS-Laccase-TEMPO

对比CS-control的红外光谱,CS-Laccase-TEMPO的红外光谱中的特征吸收峰与CS-control的极其相似,特别是1 610 cm-1对应酰胺Ⅱ(—NH2)谱带的吸收峰强度基本不变,表明了壳聚糖C-2氨基未被氧化。
2.213C NMR分析
通过13C NMR探究物质碳元素种类的变化及漆酶-TEMPO体系氧化壳聚糖机理。图3为CS-control,CS-Laccase和CS-Laccase-TEMPO的13C NMR谱图。
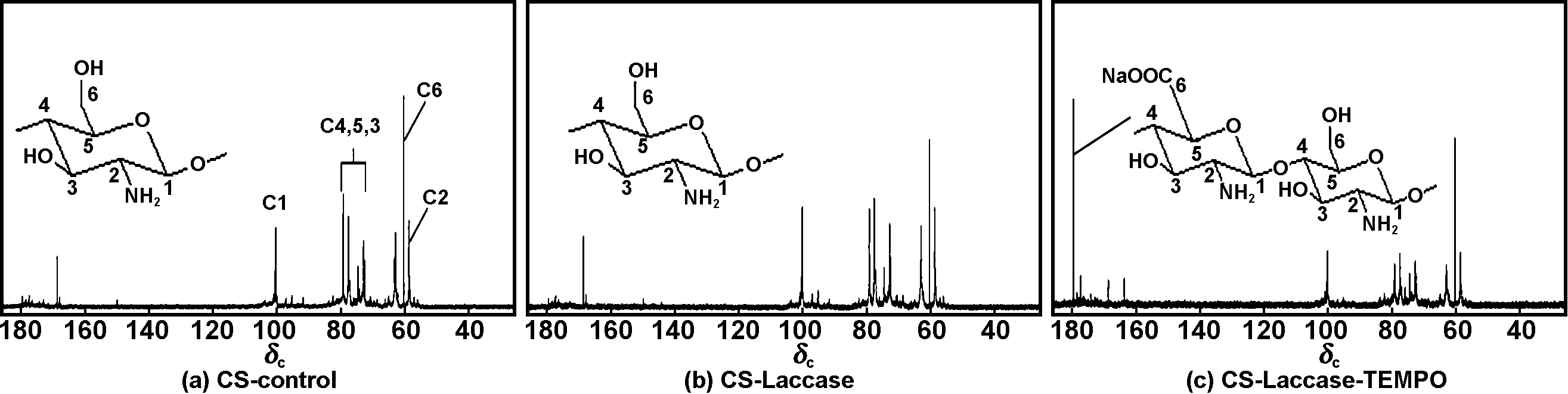
图3CS-control、CS-Laccase和CS-Laccase-TEMPO的13C NMR谱图
Fig 313C NMR spectra of CS-control,CS-Laccase and CS-Laccase-TEMPO
从图3可看出,CS-control、CS-Laccase和CS-Laccase-TEMPO的13C NMR谱图相比,只有CS-Laccase-TEMPO在δC=179处出现了新的共振峰,由文献[25- 27]可知该共振峰为—COO-的共振峰,其它信号源基本一致,由此可表明漆酶- TEMPO体系选择性将壳聚糖C-6伯羟基氧化成羧基,其它结构基本不变;CS-Laccase 的13C NMR谱图与CS-control相比无明显变化,表明了漆酶和TEMPO的协同作用才能将壳聚糖C-6伯羟基氧化成羧基。图3中,δC=58.7,60.3,79.1,77,74和101处的信号分别源于氨基葡糖糖环的C-2,C-6,C-4, C-5, C-3和C-1共振峰,此结果与已有文献一致[27- 28]。CS-Laccase-TEMPO在δC=60.32处的氨基葡糖糖环的C-6伯羟基共振峰依旧存在,表明仍有氨基葡糖糖环上的C-6伯羟基未被氧化。
2.3离子色谱(HPIC)分析
纯化后的产物中所含的Na+来自反应体系及反应产物的羧基携带的Na+。若样品CS-Laccase-TEMPO中Na+含量远远大于样品CS-control和CS-Laccase的Na+含量,可表明样品CS-Laccase-TEMPO中含有大量的羧基从而携带了大量的Na+,继而表明漆酶-TEMPO体系将壳聚糖C-6伯羟基氧化成羧基。经离子色谱仪检测样品CS-control,CS-Laccase和CS-Laccase-TEMPO的Na+含量如图4所示。
图4CS-control,CS-Laccase和CS-Laccase-TEMPO的Na+含量
Fig 4 The Na+content of CS-control,CS-Laccase and CS-Laccase-TEMPO
由图4可以看出,样品CS-Laccase-TEMPO中Na+含量远远大于样品CS-control和CS-Laccase的Na+含量,表明了漆酶-TEMPO体系将壳聚糖C-6伯羟基氧化成羧基;样品CS-control和CS-Laccase的Na+含量基本一致,表明了漆酶和TEMPO的协同作用才能将壳聚糖C-6伯羟基氧化成羧基。由式(1)可得出羧基含量为4.13 mmol/g。Na+含量分析结果验证了13C NMR的分析结果。
结合国内外研究成果及以上检测结果推测了漆酶-TEMPO体系选择性氧化壳聚糖C-6伯羟基的反应机理(图5),即漆酶-TEMPO体系选择性地将壳聚糖C-6伯羟基氧化成羧基的反应分为4个阶段:(1)Laccase与TEMPO自由基形式反应生成Laccaseox和TEMPO+亚硝基形式;(2)TEMPO+将壳聚糖上的C-6伯羟基氧化成羧基,而其被还原成TEMPOH羟胺形式。C-6羧基在 Na+存在下,转化为其钠盐状态;(3)TEMPOH与Laccase反应重新生成TEMPO自由基;(4)Laccaseox与O2反应生成水和Laccase,从而进而进行下一轮反应。
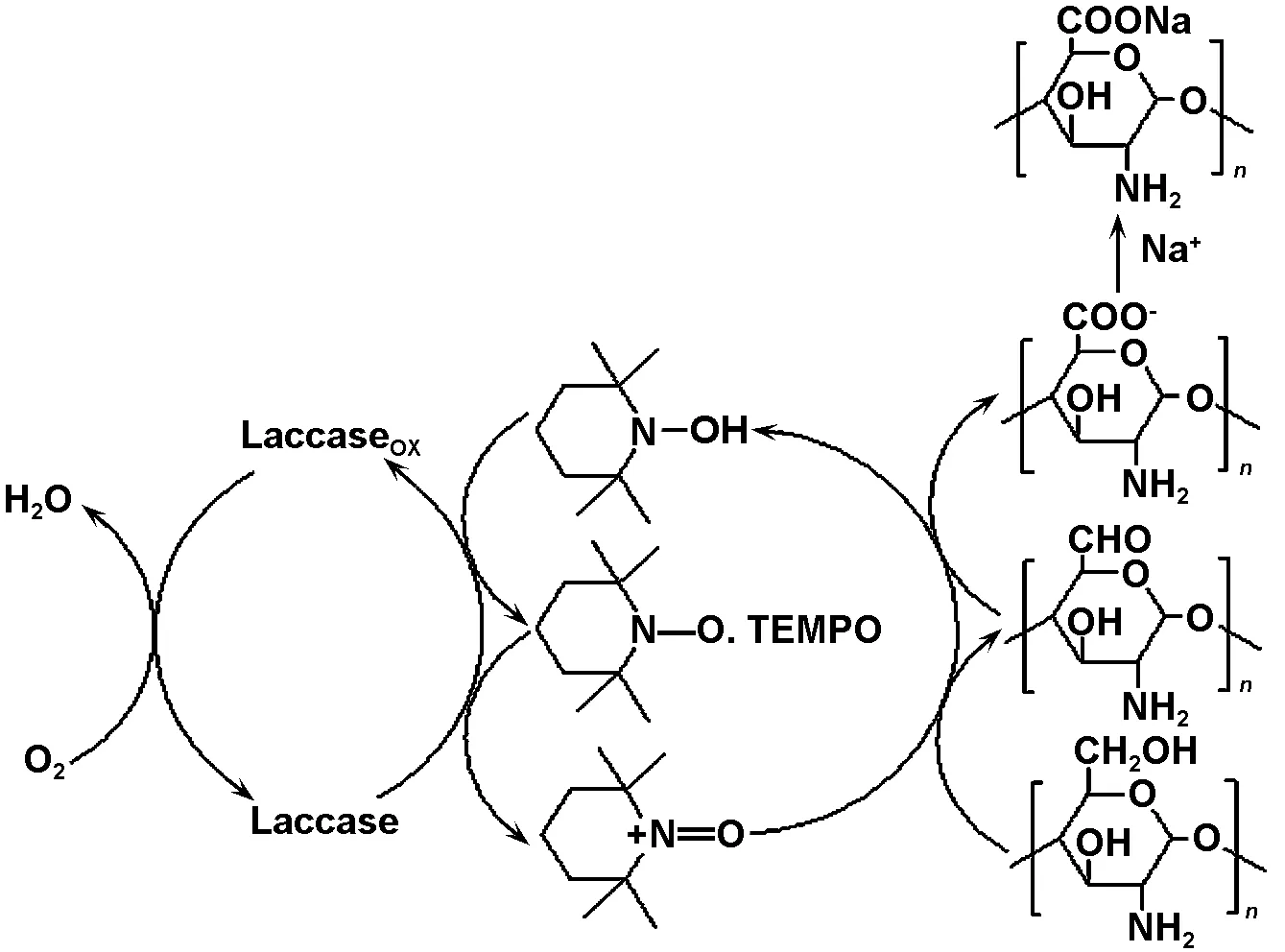
图5 漆酶-TEMPO体系氧化壳聚糖的推测机理图
Fig 5 A possible reaction mechanism for the laccase-TEMPO system oxidation of chitosan
2.4TGA分析
通过 TGA检测物质热稳定性,热稳定性越高,分子的化学结构越稳定。CS-Laccase-TEMPO和CS-control的TGA曲线如图6所示。
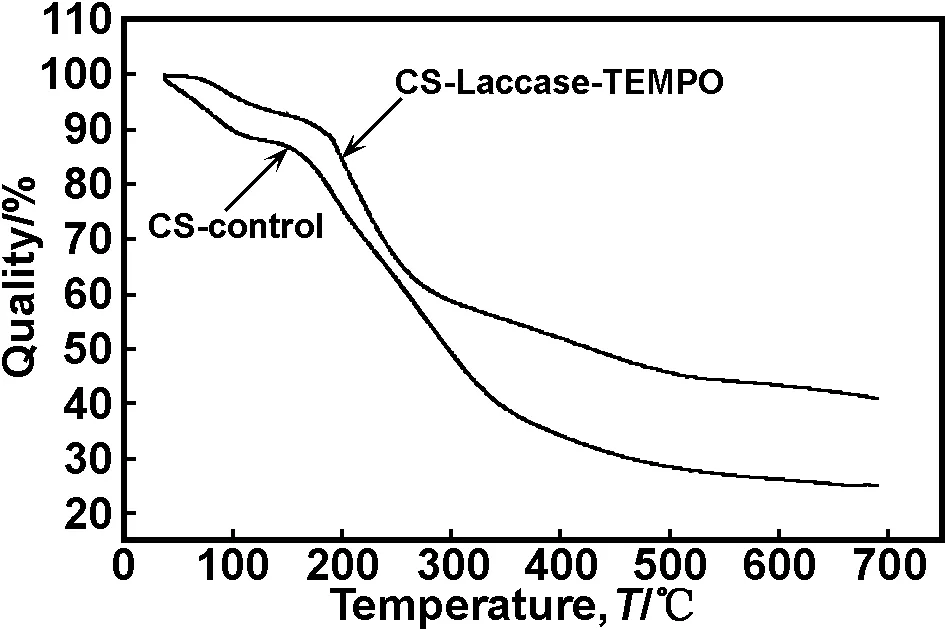
图6 CS-Laccase-TEMPO和CS-control的TGA曲线
Fig 6 TGA curve of CS-Laccase-TEMPO and CS-control
从图6可以看出,样品的热降解和热氧解可分为3个阶段。
第一阶段在140 ℃附近,伴随着吸热反应,两者在140 ℃前均有一个小的失重过程,这是由于多糖具有比较强的水亲和力和水化特性[29],样品中的结合水和结晶水热蒸发导致失重。CS-control和CS-Laccase-TEMPO相比,失重速率更快,质量下降更多。
第二阶段在160~400 ℃,为壳聚糖的主要降解阶段,主要发生主链的脱乙酰和糖苷键的断裂反应[30]。在这过程中,CS-Laccase-TEMPO和CS-control失重分别约为40.01%和52.71 %。
第三阶段在400~600 ℃,主要发生吡喃环的裂解以及碳化残渣的分解[31-33],分解速度较为缓慢,600 ℃时,CS-Laccase-TEMPO和CS-control失重分别约为56.49%和73.39%。

2.5抗氧化性能分析
实验通过检测物质的ABTS自由基清除率来评定物质的总抗氧化性能。在此反应体系中,ABTS经氧化后生成相对稳定的蓝绿色的ABTS·+溶液,且在734 nm处具有典型的特征吸收峰。抗氧化剂与ABTS·+反应后使其溶液褪色,特征吸光度值下降,下降越大表明物质的总抗氧化性能越强。 图7显示的是CS-Laccase-TEMPO和CS-control的ABTS自由基清除率。
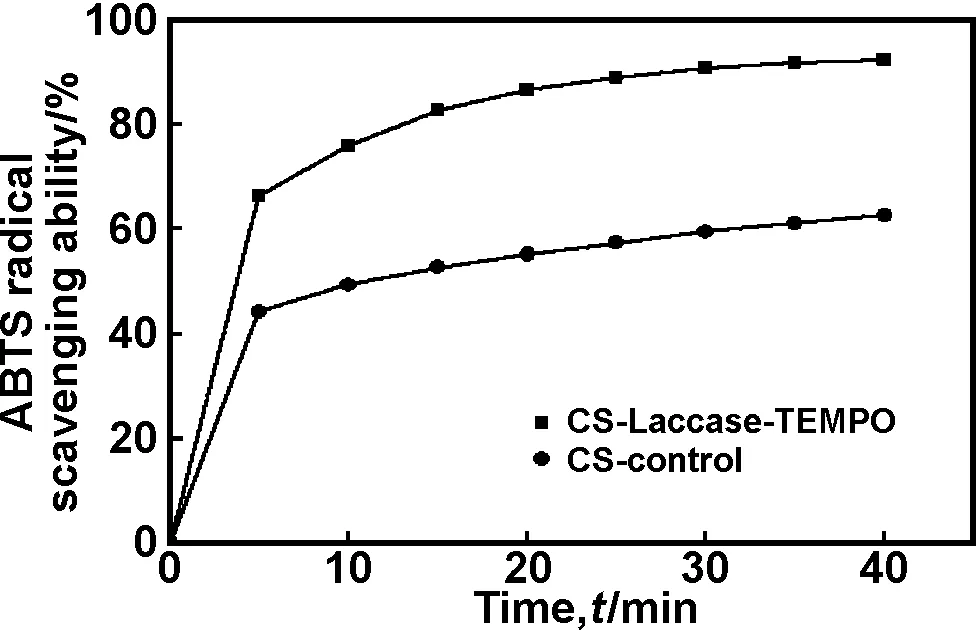
图7CS-Laccase-TEMPO和CS-control的ABTS自由基清除率
Fig 7 ABTS·+radical scavenging ability of CS-Laccase-TEMPO and CS-control
由图7可知,静置5 min后,CS-Laccase-TEMPO的自由基清除率已达到66.36%,具有较强的抗氧化性;CS-control的自由基清除率达到44.22%,具有较弱的抗氧化性。随着时间的增加,二者都缓慢增加,40 min时CS-Laccase-TEMPO的自由基清除率已达到92.37%,ABTS自由基溶液接近无色;CS-control的自由基清除率达到62.65%,2 h后,CS-control的ABTS自由基溶液接近无色。
3结论
漆酶-TEMPO体系可以选择性地将壳聚糖分子中的C-6伯羟基氧化成羧基,其产物为氧化壳聚糖钠盐;产物的热稳定性提高,化学结构稳定性增强;产物对ABTS自由基清除率达到66.36%,抗氧化能力得到改善,具有较强的抗氧化性。由于经漆酶-TEMPO体系氧化的壳聚糖较强的抗氧化性可以防止脂质被氧化,因此氧化后的壳聚糖在食品包装材料和食品添加剂方面具有很好的潜在应用价值。
参考文献:
[1]Roberts G A F. Chitin chemistry[M]. London: Macmillan Press, 1992:72.
[2]Goosen M F A. Applications of chitin and chitosan[M]. Lancaster PA: Technomic Publishing, 1997:7.
[3]Muzzarelli R A A, Peter M G. Chitin handbook[M]. Grottammare: Atec Edizioni, 1997:193.
[4]Pillai C K S, Paul W, Sharma C P. Chitin and chitosan polymers: chemistry, solubility and fiber formation[J]. Progress in Polymer Science, 2009, 34(7): 641-678.
[5]Park P J, Je J Y, Kim S K. Free radical scavenging activities of differently deacetylated chitosans using an ESR spectrometer[J]. Carbohydrate Polymers, 2004, 55(1): 17-22.
[6]Yen M T, Yang J H, Mau J L. Antioxidant propertiesof chitosan from crab shells[J]. Carbohydrate Polymers, 2008, 74(4): 840-844.
[7]Guibal E. Interactions of metal ions with chitosan-based sorbents: a review[J]. Separation and Purification Technology, 2004, 38(1): 43-74.
[8]Rhazi M, Desbrieres J, Tolaimate A, et al. Influence of the nature of the metal ions on the complexation with chitosan: application to the treatment of liquid waste[J]. European Polymer Journal, 2002, 38(8): 1523-1530.
[9]Shahidi F,Naczk M. Phenolics in food and nutraceuticals[M]. Boca Ra, FL: CRC Press, LLC, 2003.
[10]Pei Jicheng,Yu Chenghua,Zhang Fangdong,et al. Grafting of laccase-catalyzed oxidation of ferulic acid onto the chitosan to improve the antioxidant and antibacterial activity[J]. Journal of Functional Materials, 2014, 45(14): 14037-14042.
裴继诚,于成华,张方东,等.漆酶催化壳聚糖-阿魏酸接枝共聚提高产物抗氧化及抗菌性的研究[J].功能材料,2014,45(14):14037-14042.
[11]Lemanska K, Szymusiak H, Tyrakowska B, et al. The influence of pH on antioxidant properties and the mechanism of antioxidant action of hydroxyl-flavones [J]. Free Radical Biology and Medicine, 2001, 31(7): 869-881.
[12]De Nooy A E J, Besemer A C, Van Bekkum H. Highly selective nitroxyl radical-mediated oxidation of primary alcohol groups in water-soluble glucans[J]. Carbohydrate Research, 1995, 269(1): 89-98.
[13]Shibata I, Isogai A. Depolymerization of cellouronic acid during TEMPO-mediated oxidation[J]. Cellulose, 2003, 10(2): 151-158.
[14]Fabbrini M, Galli C, Gentili P, et al. An oxidation of alcohols by oxygen with the enzyme laccase and mediation by TEMPO[J]. Tetrahedron Letters, 2001, 42(43): 7551-7553.
[15]Aracri E, Vidal T, Ragauskas A J. Wet strength development in sisal cellulose fibers by effect of a laccase-TEMPO treatment[J]. Carbohydrate Polymers, 2011, 84(4): 1384-1390.
[16]Arends I W C E, Li Y X, Ausan R, et al. Comparison of TEMPO and its derivatives as mediators in laccase catalysed oxidation of alcohols[J]. Tetrahedrom, 2006, 62(28): 6569-6665.
[17]Kato Y, Kaminage J, Matsuo R, et al. TEMPO-mediated oxidation of chitin and N-acetylated chitosan[J]. Carbohydrate Polymers, 2004, 58(4): 421-426.
[18]Sun L P, Du Y M, Yang J H,et al. Conversion of crystal structure of the chitin to facilitate preparation of a 6-carboxychitin with moisture absorption-retention abilities[J]. Carbohydrate Polymers, 2006, 66(2): 168-175.
[19]Wan Yunyang, Du Yumin. Structure and catalytic mechanism of laccases[J]. Chemical Online, 2007, 70(9): 662-670.
万云洋,杜予民. 漆酶结构与催化机理[J]. 化学通报,2007,70(9):662-670.
[20]Li X, Lin J, Gao Y, et al. Antioxidant activity and mechanism of Rhizoma Cimicifugae[J]. Chemistry Central Journal, 2012, 6(1): 140.
[21]Brugnerotto J, Lizardi J, Goycoolea F M, et al. An infrared investigation in relation with chitin and chitosan characterization[J]. Polymer, 2001, 42(8): 3569-3580.
[22]Tian F, Liu Y, Hu K, et al.Study of the depolymerization behavior of chitosan by hydrogen peroxide[J]. Carbohydrate Polymers, 2001, 57(1): 31-37.
[23]Jiang T D. Chitosan[M]. Beijing: Chemical Industry Press, 2006.
蒋挺大. 壳聚糖[M].北京:化学工业出版社,2006.
[24]He Bing, Zhang Shujun, Xin Zhiqiang, et al. Degradation of chitosan by hydrodynamic cavitation and H2O2[J]. Journal of Chongqing University of Technology (Natural Science),2014,(11):52-56.
何冰,张淑君,信志强,等.水力空化联合H2O2降解壳聚糖的研究[J]. 重庆理工大学学报(自然科学版),2014,(11):52-56.
[25]Bociek S M, Darke A H, Welti D, et al. The13C-NMR spectra of hyaluronate and chondroitin sulphates. Further evidence on an Alkali-induced conformation change [J]. European Journal of Biochemistry, 1980, 109(2): 447-456.
[26]Saito H, Mamizuka T, Tabeta R, et al. High resolution13C-NMR spectra of chitin oligomers in aqueous solution[J]. Chemical Letters, 1981, 10(10), 1483-1484.
[27]Fukamizo T, Ohtakara A, Mitsutomi M, et al. NMR spectra of partially deacetylated chitotrisaccharides[J]. Agricultural and Biological Chemistry, 1991, 55(10), 2653-2655.
[28]Qin C, Wang W, Peng H, et al. Preparation and properties of reduced chitooligomers[J]. Carbohydrate Polymers, 2008, 72(4), 701-706.
[29]Kittur F S, Prashanth K V H, Sankar K U, et al. Characterization of chitin, chitosan and their carboxymethyl derivatives by differential scanning calorimetry[J]. Carbohydrate Polymers, 2002, 49(2): 185-193.
[30]de Britto D, Campana-Filho S P. A kinetic study on the thermal degradation of N, N, N-trimethylehitosan[J]. Polymer Degradation and Stability, 2004, 84(2):353-361.
[31]Heatley F, Scott J E, Jeanloz R W, et al. Secondary structure in glycosamino- glycuronans: NMR spectra in dimethyl sulphoxide of disaccharides related to hyaluronic acid and chondroitin sulphate[J]. Carbohydrate Research, 1982, 99(1): 1-11.
[32]Holme H K, Foros H, Pettersen H, et al. Thermal depolymerization of chitosan chloride[J]. Carbohydrate Polymers, 2001, 46(3): 287-294.
[33]Shi G, Yuan Y C, Chen B R, et al. Structure and adsorption property of crosslinked chitosan towards metal-Ions[J]. Chinese Journal of Applied Chemistry, 2005, 22(2): 195-199.
[34]Weng X C.Antioxidants and their antioxidation mechanism[J]. Journal of Zhengzhou Grain College, 1993, 3: 20-29.
翁新楚.抗氧化剂及其抗氧化机制[J].郑州粮食学院学报,1993,3:20-29.
Study on the selective oxidation of the C-6-hydroxyl of chitosan b laccase-TEMPO system to improve antioxidant capability of the product
PEI Jicheng, YIN Yunbei, HU Wen, BU Xin, SHEN Zhenghui, ZHANG Fangdong
(Tianjin Key Laboratory of Pulp & Paper, Tianjin University of Science & Technology,Tianjin 300457, China)
Abstract:Research adopting laccase-TEMPO system to selectively oxidise the C-6-hydroxyl of chitosan, the FT-IR,13C NMR, Na+chromatogram and TGA were used to characterize oxidation products, and further to study its antioxidant capability. Results showed that the C-6-hydroxyl of chitosan were selectively oxidised to carboxyl, and other basic structure unchanged, the product is sodium salt of oxidised chitosan; compared to the oxidation product of chitosan with the original, can improve the thermal stability; after standing for 5 min, the oxidation product of chitosan provided an ABTS·+radical scavenging ability of 66.36%, indicate that antioxidant capability of the oxidation product was improved.
Key words:laccase; TEMPO; chitosan; antioxidant capability
文章编号:1001-9731(2016)06-06010-06
* 基金项目:国家自然科学基金资助项目(31170548);国家级大学生创新创业训练计划资助项目(201510057099)
作者简介:裴继诚(1958-),男,教授,主要研究方向为清洁制浆与木质资源综合利用。
中图分类号:TB332
文献标识码:A
DOI:10.3969/j.issn.1001-9731.2016.06.003
收到初稿日期:2015-06-03 收到修改稿日期:2015-10-16 通讯作者:裴继诚,E-mail: jcpei@tust.edu.cn
