蛋白磷酸酶2A催化亚基α在小鼠胚胎成纤维细胞迁移中的作用研究
2016-07-16王庆华王生存吴刘成邵义祥
王庆华,王生存,李 斌,刘 春,吴刘成,王 旭,邵义祥*
(1.南通大学实验动物中心,江苏南通 226001; 2.南通大学附属医院儿科,江苏南通 226001)
蛋白磷酸酶2A催化亚基α在小鼠胚胎成纤维细胞迁移中的作用研究
王庆华1,王生存1,李斌2,刘春1,吴刘成1,王旭1,邵义祥1*
(1.南通大学实验动物中心,江苏南通 226001; 2.南通大学附属医院儿科,江苏南通 226001)
摘要:利用体外基因敲除技术检测小鼠胚胎成纤维细胞(mouse embryonic fibroblasts,MEFs)周期和迁移能力的变化,探究蛋白磷酸酶2A的Cα亚基在MEFs细胞迁移过程中的作用。用Cαfl/fl的纯合子雄鼠与雌鼠1∶2配对,取E12.5 d的胚胎制作小鼠胚胎成纤维细胞。利用表达Cre重组酶(Ad-Cre-EGFP)以及GFP荧光蛋白(Ad-EGFP)的腺病毒载体,对P3代MEFs进行感染,分别用PCR,RT-PCR和Western blot方法进行基因型鉴定。同时利用流式分选技术检测感染后MEFs的细胞周期的变化,利用细胞划痕试验检测了其细胞迁移能力的变化。结果显示,胰酶消化的方法成功获得了小鼠胚胎成纤维细胞,DNA,RNA和蛋白水平的鉴定获得了3对3的野生型和基因敲除MEFs。流式分选发现Ad-Cre处理的MEFs与Ad-EGFP处理的MEFs相比,处于G2期的细胞比例为30.8%±2.57%,高于Ad-EGFP MEFs的23.9%±2.46%,并且细胞碎片的比例也远高于后者。划痕试验表明,Cα亚基缺失后细胞迁移能力下降,12 h就显著低于对照组。结果表明,腺病毒携带的Cre重组酶能够在体外有效地敲除掉MEFs中的蛋白磷酸酶2A的Cα亚基,PP2A Cα亚基的缺失会导致MEFs细胞周期倾向于阻滞在G2期,并会降低细胞迁移的能力。
关键词:蛋白磷酸酶2A;小鼠胚胎成纤维细胞;细胞迁移;细胞周期
细胞迁移在多个生命过程中发挥着重要的作用,例如胚胎发育、血管生成、神经生长、组织修复、炎症反应、动脉粥样硬化、关节炎、骨质疏松症以及侵袭和转移过程。有很多信号通路参与其中的调节过程,磷酸化作为一个快速发生并且可逆的蛋白翻译后修饰的过程是其中重要的机制之一[1]。在T淋巴细胞中,蛋白磷酸酶I和蛋白磷酸酶2A(protein phosphatase 2A,PP2A)能够与cofilin结合并使之去磷酸化从而促进细胞的迁移过程[2]。PP2A通过B′亚基定位到细胞黏着点并与paxillin结合使之酪氨酸基团去磷酸化促进细胞迁移[3-4]。
PP2A是30多个丝/苏氨酸蛋白磷酸酶之一,其结构亚基A和催化亚基C各具有α和β异构体,其具有4种不同的调节亚基家族,可以组成100多种不同的全酶,能使众多底物去磷酸化,从而影响细胞的迁移、分化和凋亡[5]。其中Cα的表达量为Cβ的10倍。PP2A蛋白表达量高,在有的细胞中能达到总蛋白的1%[6]。PP2A的催化活性受到许多因素的调节,如调节亚基、翻译后修饰、抑制性蛋白质、第二信使和酶抑制剂等[7-8]。在Ahnak 敲除的小鼠胚胎成纤维细胞(mouse embryonic fibroblasts,MEFs)中,PMA(phorbol 12-myristate 13-acetate )刺激PKC-α和Raf的磷酸化程度上升的能力降低,主要是因为PP2A在Ahnak缺失的条件下对PKC-α和Raf的结合能力增强,从而促进其脱磷酸化[9]。PP2A-B55α和Cdc14B在MEFs中相互作用,进而影响DNA双链断裂后的修复过程[9]。PP2A能够与Pin1和AMPK互作,进而影响MEFs细胞周期[10]。本研究通过腺病毒载体表达的Cre重组酶在体外敲除MEFs的PP2A Cα亚基,通过流式细胞分选技术检测了其细胞周期以及细胞迁移能力的改变,探讨了Cα亚基在细胞迁移过程的作用。
1材料与方法
1.1材料
1.1.1主要试剂DAPI(D9542),Sigma-Aldrich公司产品;实时定量荧光定量PCR反应试剂盒,南京诺维赞公司产品;Trizol,TaKaRa公司产品;PI(Propidium iodide)染色液,Sigma公司产品;Western blot抗体PP2A-C(#80665),Santa Cruz 公司产品;引物由南京金斯瑞生物科技有限公司合成。
1.1.2实验动物PP2A Cα敲除鼠和同窝野生型对照鼠均来自于南京大学模式动物研究所,品系为C57BL/6J,共12只,其中雄鼠4只,雌鼠8只,10周龄,饲养于SPF级屏障环境中,自由采食,明暗周期为12 h/12 h。使用许可证号为SYXK(苏)2012-0031。
1.1.3腺病毒表达Cre重组酶(Ad-Cre-EGFP)以及GFP荧光蛋白(Ad-EGFP)的腺病毒载体由南京大学模式动物研究所馈赠,利用293A细胞进行扩增纯化后备用。
1.2方法
1.2.1小鼠胚胎成纤维细胞分离及腺病毒感染用Cαfl/fl的纯合子雄鼠与雌鼠(来自南京大学模式动物研究所)以1∶2比例配对,配2笼,每天8:00之前检查小鼠阴道栓,见栓当天胚龄记为0.5 d(0.5 days postcoitum,0.5 dpc)。取11.5 dpc胚胎,尾巴留作基因型鉴定用,去除头、内脏及四肢,剪碎后2.5 g/L的胰酶在37℃水浴中振荡消化20 min,3 000 r/min离心3 min,去上清后10% FBS的DMEM(高糖)重悬,均匀接种到6 cm培养皿中,次日换液。根据基因型鉴定结果留3对3野生型和敲除鼠胚胎成纤维细胞作为试验用,标记为P1代。本研究使用P3代细胞作为研究对象。用病毒数和细胞数1∶1的比例感染MEFs,每个10 cm培养中加入3 mL的5% FBS-DMEM,37℃、体积分数为5%的CO2培养箱中培养2 h后加入7 mL的全培养基继续感染过夜,次日换液并复染DAPI后进行检测GFP荧光,如果感染率较低则再次感染。
1.2.2流式细胞仪分选检测细胞周期和凋亡取P3代小鼠胚胎成纤维细胞,胰酶消化后收集,计数,以1×106cells/100 μL的量加入FACS分选管。加1 mL PBS清洗细胞,500 r/min离心5 min,去上清。重复洗一次后用100 μL流式细胞染色缓冲液重悬细胞,加入10 μL PI染色液,混匀,冰上或者室温避光孵育10 min~15 min。上机进行流式分析。
1.2.3细胞划痕试验检测细胞迁移能力先用Marker笔在6孔板背后均匀地划横线,每隔0.5 cm~1 cm一道,横穿过孔。每孔至少穿过5条线。每孔中加入约5×105个细胞。第2天用枪头沿着直尺划痕。用PBS洗细胞3次,去除划下的细胞,加入无血清培养基,37℃、体积分数为5%CO2的培养箱中培养。按0、6、12、24 h取样,拍照后用Imag J软件进行分析。
1.2.4基因型鉴定及基因表达检测用PCR和RT-PCR法进行基因型鉴定。常规酚氯仿法抽提小鼠胚胎成纤维细胞DNA,使用25 μL体系用引物P2 F/R进行PCR扩增,59℃退火,35个循环,产物用20 g/L的琼脂糖凝胶电泳鉴定。用Trizol抽取胚胎成纤维细胞RNA,去除基因组DNA后反转录为cDNA,以cDNA为模板用引物EXdel F/R进行PCR扩增,58℃退火,20个循环,产物用20 g/L琼脂糖凝胶电泳进行鉴定。荧光定量PCR检测以cDNA为模板用SYBR Premix EXTaq体系进行扩增,95℃ 5 s,60℃ 30 s,40个循环。引物为P4 F/R(表1)。 收集细胞后用RIPA裂解液提取蛋白,BCA法测定浓度后加入上样缓冲液煮沸变性5 min,80 g/L的SDS-PAGE胶电泳分离,100V电泳90 min,湿法转膜80 min后,50 g/L脱脂奶粉封闭1 h,一抗4℃过夜。TBST洗涤5 min,3次,二抗室温孵育1 h后ECL显影。
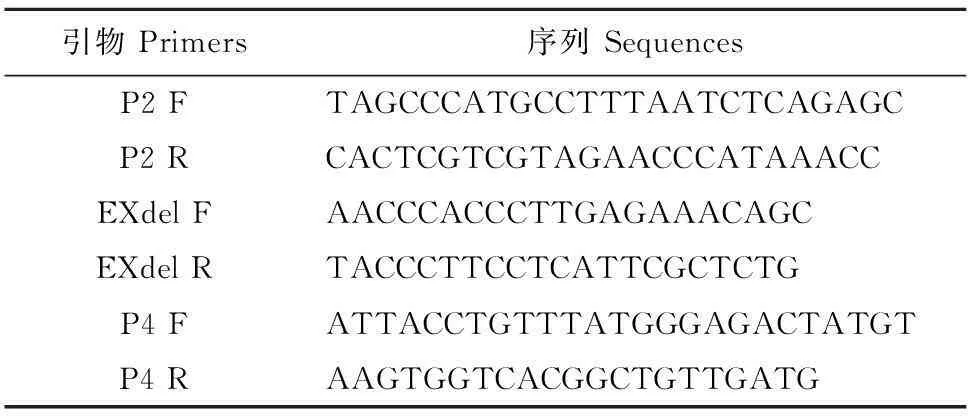
表1 引物序列
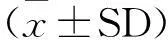
2结果
2.1MEFs制作和基因型鉴定
利用腺病毒表达系统构建了表达Cre-EGFP(Ad-Cre)的试验组病毒以及仅表达EGFP(Ad-EGFP)的对照病毒,用293A细胞进行大量扩增后超速离心纯化,分装冻存于-80℃备用。用来自E12.5的小鼠胚胎制作成小鼠胚胎成纤维细胞(mouse embryonic fibroblasts,MEFs),记为P1代。取P3代MEFs进行病毒感染,检测GFP荧光表达判断感染效率(图1),并取感染后细胞提取DNA,RNA和蛋白进行基因型鉴定。以DNA为模版,用引物P2 F/R进行PCR扩增分别检测5′端的LoxP位点,产物用琼脂糖凝胶电泳检测,在5′端会检测到593 bp的LoxP条带和369 bp的野生型条带(图2A上)。用引物Exdel F/R进行PCR扩增检测基因敲除后残余片段,产物用20 g/L的琼脂糖凝胶进行电泳检测,敲除鼠MEFs获得了339 bp条带,而野生型鼠MEFs则没有条带(图2A下)。RNA反转录为cDNA后,作为模版用P4 F/R引物检测外显子缺失情况,电泳检测会观察到451 bp的剪切后条带和877 bp的野生型条带(图2B)。在此基础上,Western blot检测MEFs细胞中PP2AC的表达,纯合子中PP2AC蛋白表达量显著降低,并没有完全消失,这是由于C亚基的高度同源性导致抗体不能完全区分这两个亚基(图2C和图2D)。

图1 腺病毒感染效率免疫荧光观察结果(10×)
A. 以DNA为模板,用P2 F/R引物检测5′端LoxP位点,用Exdel F/R引物检测敲除后残余片段;B. 以cDNA为模板,用P4 F/R引物通过RT-PCR检测敲除效率;C. 提取感染后MEFs细胞蛋白,用Western blot检测PP2AC的表达;D. Western blot结果的灰度分析统计。其中1表示Cαfl/fl:Ad-Cre,2表示Cαfl/+:Ad-Cre,3表示Cαfl/+:Ad-EGFP,4表示Cαfl/fl:Ad-EGFP。
A. PCR amplification of 5′ LoxP site with primers P2 F/R,and of residue fragment after deletion by Cre recombinase with primers Exdel F/R; B. RT-PCR investigation on knockout efficiency with primers P4 F/R using cDNA as template;C. Western blot analysis on the protein expression of PP2AC in knockout MEFs and the control;D. Density analysis on the Western blot bands.1 indicates Cαfl/fl:Ad-Cre,2 indicates Cαfl/+:Ad-Cre,3 indicates Cαfl/+:Ad-EGFP,4 indicates Cαfl/fl:Ad-EGFP
图2腺病毒感染后MEFs细胞敲除效率检测
Fig.2Examination of knockout efficiency in MEFs after adenovirus infection
2.2流式细胞仪检测细胞周期
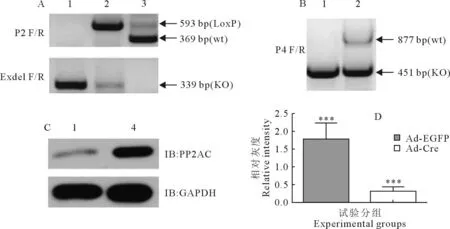
用流式细胞分选技术检测细胞周期,用PI染色后流式分选,发现PP2A Cα缺失的MEFs细胞碎片所占的比例高于野生型细胞,说明其中细胞凋亡较高。对流式分选结果分析发现PP2A Cα敲除MEFs(Cafl/fl:Ad-Cre)中处于G2期的细胞比例为30.8%±2.57%,而野生型MEFs(Cafl/fl:Ad-EGFP)中处于G2期的细胞比例为23.9%±2.46%,统计分析发现二者之间差异并不显著(图3A,B)。
2.3细胞迁移能力的检测
目前也有很多研究表明PP2A通过去磷酸化作用参与了细胞迁移的过程。细胞划痕试验是一种常见的研究细胞迁移的试验方法,简单易行,可重复性较高。因此本研究用细胞划痕试验来检测缺失催化亚基Cα的情况下MEFs迁移能力的变化。通过统计分析发现在划痕后0 h,6 h二者并没有显著性差异。但在12 h时二者差异显著,敲除后MEFs迁移能力显著低于野生型MEFs。在24 h二者的差异更显著(图4)。
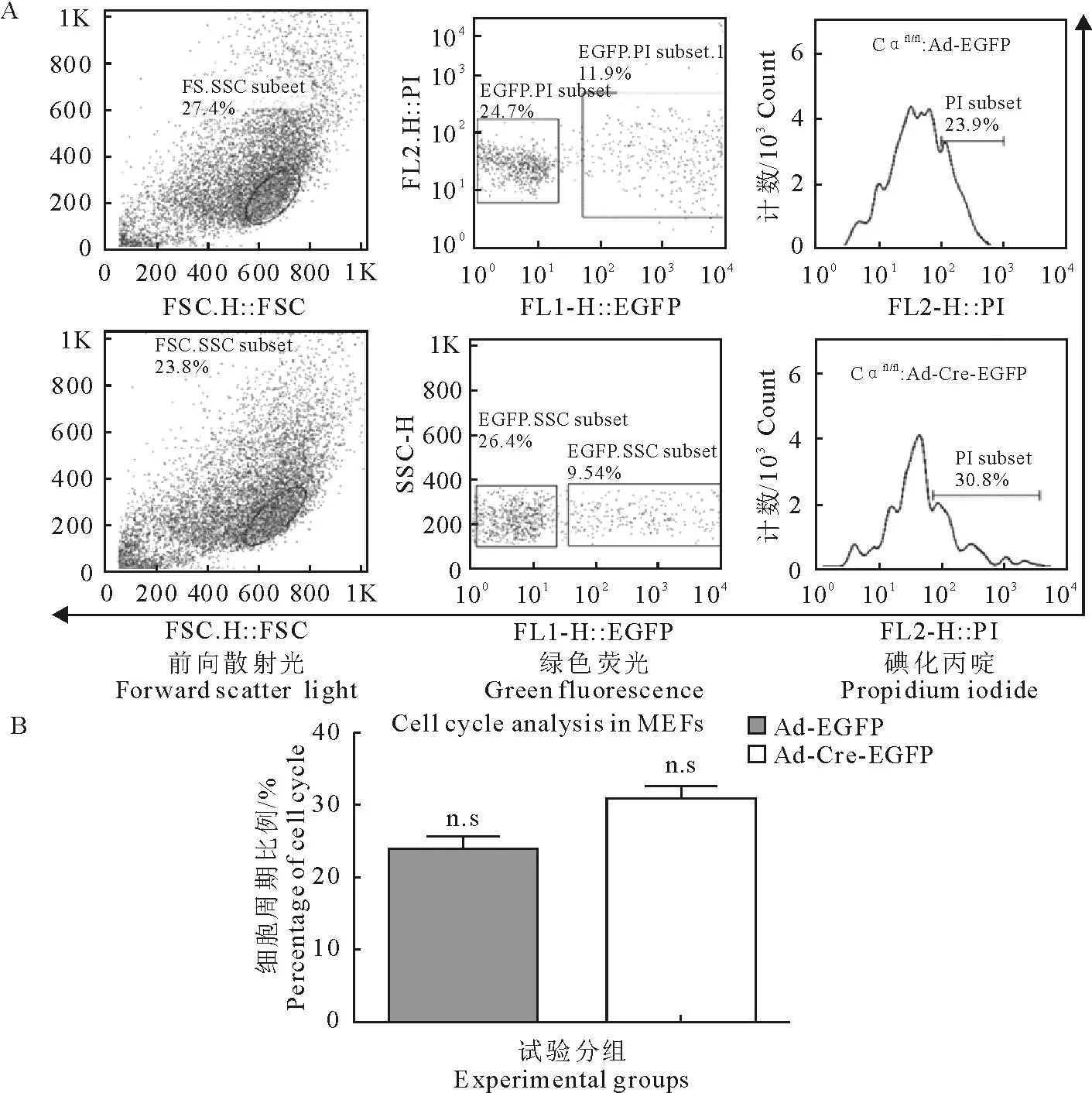
图3 腺病毒感染后细胞凋亡检测

A. 感染后MEFs划痕试验光镜检测(×10);B. 划痕后特定时间点细胞伤痕剩余距离统计结果
A.Scratch test on MEFs infected with Ad-Cre-EGFP and Ad-EGFP (×10);B.Statistics on the distance of MEFs infected with Ad-Cre-EGFP and Ad-EGFP
图4腺病毒感染后MEFs划痕试验结果
Fig.4Scratch test on MEFs after adenovirus infection
3讨论
PP2A是一个广泛性表达的蛋白,主要参与蛋白脱磷酸化过程,从而调控机体的各种生命活动,包括细胞周期和凋亡过程。细胞周期(cell cycle)是指连续分裂细胞从一次有丝分裂结束到下一次有丝分裂所经历的所有过程,包括间期(interphase)和有丝分裂期(M phase)。间期以DNA合成为标志,由G0期、间期、G1期和S期构成,而M期则完成了细胞的分裂,从而形成新的细胞。这过程受到内源性“Cyclins-CDKs-CKIs”调控网络的调节,从而完成器官和组织的发育。其中Cyclins为正向调控CDKs的关键因子,而研究表明PP2A(Cdc55/B55)能够调节Cyclin D1的转录水平[11]。在T淋巴细胞中,蛋白磷酸酶I和蛋白磷酸酶2A能够和cofilin结合并使之去磷酸化从而促进细胞的迁移过程[2]。PP2A通过B′亚基定位到细胞黏着点并与paxillin结合使之络氨酸基团去磷酸化促进细胞迁移[3-4]。在MEFs细胞中,PP2A也参与多条信号通路的调控,进而影响MEFs细胞DNA修复,周期变化以及迁移[9-10]。
本研究发现,利用12.5 d的小鼠胚胎通过胰酶消化的方法成功获得胚胎成纤维细胞,利用腺病毒载体表达系统成功构建和扩增了表Cre重组酶和EGFP荧光蛋白的对照腺病毒。通过体外用腺病毒感染MEFs的方法成功建立了PP2A Cα敲除的MEFs细胞,并直接通过观察荧光的表达来判断感染效率。通过PCR方法鉴定出ppp2ca敲除的MEFs,从而在DNA水平上确认了Cα基因已经被敲除。接着以cDNA为模板,利用RT-PCR技术鉴定出Cα基因在RNA水平上也成功被敲除掉了[12]。最后利用Western blot技术在蛋白水平上验证了Cα基因的敲除状况。可以看出纯合子MEFs中PP2A的表达量显著低于野生型,但并没有完全剔除干净。这是由于Cα和Cβ基因仅在N端有3个氨基酸序列的差异,没有特异性的抗体进行识别,而前者表达量是后者的10倍[13-14],Cβ基因的冗余效应导致蛋白表达量检测不能达到100%的敲除效率,但整体表达量的显著下降也表明敲除是有效的。
本研究PI染色后流式分选结果显示,敲除MEFs中处于G2期的比例为30.8%±2.57%,高于野生型MEFs中的23.9%±2.46%,说明敲除Cα后细胞会倾向于阻滞在G2期,降低其增殖效率,但统计分析并没有显著差异(P>0.05)。我们在试验过程中也观测到敲除的MEFs中细胞碎片的比例也高于野生型MEFs,这也部分验证了敲除Cα可能会增加MEFs凋亡。由于在FACs分选时凋亡细胞被洗掉,从而导致细胞周期并没有差异。
本研究细胞划痕试验表明,缺失Cα基因导致细胞迁移能力在12 h后显著降低(图4B)。在图4A中可以观察到敲除组MEFs虽然划痕也在缓慢愈合,但愈合速度显著低于对照组细胞,表明其迁移能力降低,与目前已发表的研究结论相吻合,PP2A功能的缺失导致了cofilin和paxillin不能正常去磷酸化而活性降低,从而不能正常地继续细胞的迁移活动[2]。
综上所述,PP2A的Cα基因在调节MEFs细胞周期和细胞迁移过程中具有重要的作用。本研究的结果显示,Cα基因的缺失能够轻微影响小鼠胚胎成纤维细胞周期,而显著降低其迁移的能力。对于其具体作用于何种下游底物以及具体的作用机制尚需要进一步研究。
参考文献:
[1]Larsen M,Tremblay M L,Yamada K M.Phosphatases in cell-matrix adhesion and migration[J].Nat Rev Mol Cell Biol,2003,4(9):700-711.
[2]Ambach A,Saunus J,Konstandin M,et al.The serine phosphatases PP1 and PP2A associate with and activate the actin-binding protein cofilin in human T lymphocytes[J].Eur J Immunol,2000,30(12):3422-3431.
[3]Ito A,Kataoka T R,Watanabe M,et al.A truncated isoform of the PP2A B56 subunit promotes cell motility through paxillin phosphorylation[J].EMBO J,2000,19(4):562-571.
[4]Jackson J L,Young M R.Protein phosphatase-2A modulates the serine and tyrosine phosphorylation of paxillin in Lewis lung carcinoma tumor variants[J].Clin Exp Metastasis,2002,19(5):409-415.
[5]Janssens V,Goris J.Protein phosphatase 2A:a highly regulated family of serine/threonine phosphatases implicated in cell growth and signalling[J].Biochem J,2001,353(Pt 3):417-439.
[6]Shi Y G.Serine/Threonine phosphatases:Mechanism through structure[J].Cell,2009,139(3):468-484.
[7]Low I C,Loh T,Huang Y,et al.Ser70 phosphorylation of Bcl-2 by selective tyrosine nitration of PP2A-B56delta stabilizes its antiapoptotic activity[J].Blood,2014,124(14):2223-34.
[8]Janssens V,Longin S,Goris J. PP2A holoenzyme assembly:in cauda venenum (the sting is in the tail)[J].Trends Biochem Sci,2008,33(3):113-121.
[9]Lin H,Ha K,Lu G,et al.Cdc14A and Cdc14B redundantly regulate DNA double-strand break repair[J].Mol Cell Biol,2015,35(21):3657-3668.
[10]Khanal P,Kim G,Yun H J,et al.The prolyl isomerase Pin1 interacts with and downregulates the activity of AMPK leading to induction of tumorigenicity of hepatocarcinoma cells[J].Mol Carcinog,2013,52(10):813-823.
[11]Noguchi E.PP2A(Cdc55/B55),a possible therapeutic target in cyclin D1-dependent cancers[J].Cell Cycle,2013,12(10):1484.
[12]苏春霞,段相国,郑洁,等.共表达FMDV VP1-2A基因与猪IL-2重组腺病毒的构建及其免疫原性研究[J].动物医学进展,2014,35(2):1-5.
[13]于艳红,许杰,李文彬,等.Tau 蛋白磷酸化在阿尔茨海默病中所处的地位[J].动物医学进展,2015,15(8):1573-1576.
[14] 王庆华,王生存,李斌,等. 蛋白磷酸酶2A的Cβ亚基在胚胎成纤维细胞凋亡过程中的作用[J]. 动物医学进展,2016,37(2):64-69.
Effects of Catalytic Subunit α of Protein Phosphatase 2A on Cell Migration of Mouse Embryo Fibroblasts
WANG Qing-hua1,WANG Sheng-cun1,LI Bin2,LIU Chun1,WU Liu-cheng1,WANG Xu1,SHAO Yi-xiang1
(1.LaboratoryAnimalCenterofNantongUniversity,Nantong,Jiangsu,226001,China;2.DepartmentofPediatrics,AffiliatedHospitalofNantongUniversity,Nantong,Jiangsu,226001,China)
Abstract:To investigate the effects of catalytic subunit α of protein phosphatase 2A (PP2A) on cell cycle and cell migration in mouse embryo fibroblasts(MEFs), the mouse embryos were got at E12.5 by mating the heterozygotes of Cα subunit conditional knockout male and female homozygous mice at the ratio of 1∶2.MEFs were prepared by trypsin digestion and genotyped by PCR,RT-PCR and Western blot to identify the genetic basis of each embryo.Adenovirus associated Cre recombinase and GFP immunofluorescence protein were constructed and delivered to the P3 MEFs to knockout the Cα gene,GFP was used as control.After confirming the knockout efficiency by PCR,RT-PCR and Western blot,FACs was carried out to determine the cell cycle.Cell scratch test was carried in MEFs treated with the two kinds of viruses to investigate the effects on migration.Adenovirus associated Cre recombinase could knockout the gene efficientlyinvitro.The knockout MEFs at G2 stage was 30.8%±2.57%,while the control MEFs was 23.9%±2.46%,and had more cell debris.Loss of Cα decreased the cell migration ability significantly from 12h after the scratch.Cre recombinase delivered by adenovirus could efficiently pop out double floxed geneinvitro.Disruption of Cα subunit slightly arrested the MEFs at G2 stage,and decreased the migration ability.
Key words:protein phosphatase 2A; mouse embryonic fibroblast; cell migration; cell cycle
收稿日期:2015-10-29
基金项目:江苏省高校自然科学研究项目(11KJB180010);江苏省高校自然科学研究项目(14KJB180018);江苏省高校自然科学研究项目(15KJB180015)
作者简介:王庆华(1978-),男,江苏泰州人,硕士研究生,主要从事实验动物学及细胞生物学研究。*通讯作者
中图分类号:S852.2
文献标识码:A
文章编号:1007-5038(2016)06-0049-06
