双峰驼隐睾组织结构分析
2016-07-16袁莉刚曲亚玲鲁玉荣闫振龙
袁莉刚,曲亚玲,李 聪,鲁玉荣,闫振龙
双峰驼隐睾组织结构分析
袁莉刚*,曲亚玲,李 聪,鲁玉荣,闫振龙
(甘肃农业大学动物医学院,兰州730070)
摘 要:比较观察同年龄(2岁)双峰驼(Camelus bactrianous)正常睾丸与隐睾的显微及超微结构特点。采用光镜和电镜制片及组织化学染色技术,比较双峰驼隐睾与正常睾丸的组织结构特点,进而用IPP图像分析软件进行定量分析。结果:光镜下双峰驼隐睾生精上皮由1~3层细胞组成,生精小管平均直径显著减小(P<0.05),间质组织面积极显著增加(P<0.01),间质/管腔面积比较正常组极显著增大(P<0.01)。电镜观察,双峰驼正常睾丸生精小管固有膜层发育良好,相邻Sertoli细胞之间形成典型连接复合体;生精细胞之间多处形成细胞间小管和桥粒结构。隐睾生精上皮基膜增生明显,其上半桥粒结构不清晰,发育不成熟的Sertoli细胞相邻细胞膜间存在不完全的桥粒结构,可见相邻精母细胞间的胞质桥及Sertoli细胞与初级精母细胞之间桥粒连接;双峰驼正常睾丸Leydig细胞内滑面型内质网和粗面型内质网相延续;隐睾Leydig细胞形态不规则,胞内肿胀线粒体数量较多,内质网不发达;隐睾间质毛细血管基膜不清晰;血管内皮细胞之间可见缝隙连接。双峰驼隐睾生精小管组织结构主要变化为Sertoli细胞异常分化及精子发育阻滞;隐睾Sertoli细胞多为幼稚型,其与基膜连接的改变以及Sertoli细胞外质特化区形态结构及桥粒结构不完整影响了血-睾屏障构成;Leydig细胞内质网发育不均衡为其分泌功能与机体发育阶段关系研究提供思路。
关键词:双峰驼;隐睾;睾丸;显微结构;超微结构
双峰驼(Camelus bactrianus)是中国西北荒漠地区的主要畜种资源,能在生存条件极差的地域繁衍生息与其独特的繁殖机制有关。近年来农村产业结构调整和农业机械化程度的提高导致双峰驼养殖户不断减少,骆驼科动物自身繁殖率又较低,诸多因素影响导致分布在亚洲双峰驼数量急剧下降;尤其是自然生态环境恶化导致野生双峰驼濒临灭绝,使其携带的优良基因大量丢失[1-2],国际动物保护同盟(IUCN)于2002年将野生双峰驼从濒危物种提升为极濒危物种。资料表明,双峰驼雄性生殖系统组织学结构与多数哺乳动物类似,但也有与其他动物不同的特征,睾丸内除了Sertoli细胞之间的紧密连接之外,桥粒也参与血-睾屏障的形成,该特征可能有利于提高双峰驼对沙漠环境的适应性[3]。
隐睾是引起驼科动物不孕的生殖系统疾病之一,据报道,单峰驼不孕时生精小管基膜增厚,Sertoli细胞数量减少及其结构变化是精子发生障碍的主要病理表现[4];研究表明,猪隐睾内Sertoli细胞和Leydig细胞增殖和分化不足,且分化成熟的Sertoli细胞较少而导致生精上皮内紧密连接带数量较少,同时,生精小管上皮基膜异常增厚,导致精子发生异常[5]。隐睾是研究睾丸内紧密连接动力学的模型之一,对于分析血睾屏障损坏时细胞因子激活或抑制作用具有重要意义,且对于深入研究雄性生殖生理局部微环境调节也不可忽视[6]。目前骆驼睾丸形态学资料中对双峰驼或单峰驼正常睾丸结构研究较多[3-4,7],少量资料报道了雄性单峰驼不孕时睾丸的病理特征,但对于双峰驼隐睾组织结构尚未见研究。作者通过光镜及电镜比较观察同年龄双峰驼隐睾及正常睾丸显微及超微结构,并以IPP图像统计软件对局部组织结构变化指数进行分析,探究隐睾时生精细胞发育微环境变化,为深入探讨双峰驼生殖生理研究提供参考资料。
1 材料与方法
1.1 试验材料
自宁夏回族自治区吴忠市涝河桥养殖户,冬季采集健康未交配2岁双峰驼。经睾丸摘除手术采集组织标本,共5例,其中正常睾丸2例,隐睾3例。组织样分正常睾丸组和隐睾组进行比较研究。
1.2 试验方法
1.2.1 组织样本制备和观察 组织样品切成1cm×1cm×0.6cm大小,Bouin’s液固定,梯度酒精逐级脱水,二甲苯透明,常规石蜡包埋,切片厚5μm,苏木素-伊红常规染色。Masson三色染色(亮绿),胶原纤维呈现蓝绿色,细胞核呈现灰黑或灰蓝色,红细胞呈红色;Gomori银染显示网状纤维为灰色,苏木素-伊红复染后呈棕红色。中性树脂封片,显微镜下观察照相。
1.2.2 电镜样本制备和观察 样品切成0.1cm×0.1cm×0.1cm组织块,2%多聚甲醛-2.5%戊二醛溶液固定24h,1%锇酸后固定,丙酮乙醇梯度脱水,Epon812包埋,LKB8800型超薄切片机切片,醋酸铀、硝酸铅双重染色,日本JEM-100CX透射电子显微镜观察照相。
1.3 测量及数据统计分析
切片在NIKON ECLIPSE 80i显微摄像系统进行照相。每组随机选取5张切片,每张切片随机选取6个不重复视野(×400),用Image Pro Plus 6.0软件统计每个视野下Sertoli细胞、生精小管管径和生精小管面积;用SPSS13.0软件进行配对t检验。结果计为均值±标准差(±s)表示,P<0.05为差异有显著性意义。
2 结 果
2.1 双峰驼正常睾丸及隐睾显微结构特点
光镜下,双峰驼正常睾丸表面有一层厚而致密的结缔组织被膜,深入实质将其分成大小不等的睾丸小叶,其间分布有丰富的结缔组织(图1A)。生精上皮为3~5层生精细胞及柱状Sertoli细胞构成,腔面无明显精子分布,肌样细胞细胞核呈长索形围绕于生精小管固有膜外周(图1B);间质组织中毛细淋巴管及血管散在,Leydig细胞核呈圆形、椭圆形,核膜清晰明显,成簇分布于丰富的胶原纤维及网状纤维之间(图1C,D)。隐睾内生精小管发育不全,管间结缔组织疏松(图1E);生精上皮由1~3层细胞组成,以Sertoli细胞数量居多,与圆形初级精母细胞存在于基膜处,Leydig细胞核呈圆形或椭圆形散在于结缔组织之间(图1F);间质内胶原纤维稀疏,仅小血管周围较清晰(图1G),网状纤维明显分布于生精小管周围(图1H)。
统计结果表明,隐睾Sertoli细胞数量较正常睾丸显著增加,生精小管平均直径较正常组显著减小(P<0.05,表1),间质组织面积极显著增加,间质/管腔面积比较正常组极显著增大(P<0.01,表1)。

图1 双峰驼正常睾丸和隐睾组织显微结构Fig.1 The microstructure of the Bactrian camel scrotal testis and cryptorchidism
2.2 双峰驼正常睾丸及隐睾超微结构特点
电镜观察,正常睾丸生精小管发育良好的固有膜层由基膜、Ⅰ型胶原(collagen,ColⅠ)构成一个非细胞区和管周肌样细胞、淋巴内皮细胞参与的细胞区组成,内层连续基膜上半桥粒结构将Sertoli细胞锚定在生精上皮,连续基膜外围与内层肌样细胞之间包绕着一层较厚的Ⅰ型胶原纤维,在内层肌样细胞内表面形成一层不连续的基膜,固有膜最外层由一层丰富的胶原纤维及外层肌样细胞包绕。Sertoli细胞和精原细胞靠近基膜交错排列,核仁明显,细胞质内线粒体以及滑面内质网分布较少(图2A)。Sertoli细胞多边形核内有一个或多个核仁,异染色质集合于核膜不同部分,细胞核核孔清晰,相邻细胞膜下形成典型外质特化与肌动蛋白丝形成的细胞膜下纤维束,且由膜性囊泡定向平行于Sertoli细胞质膜,相邻Sertoli细胞间由紧密连接、中间连接、桥粒和缝隙连接共同构成典型的连接复合体(图2B)。Sertoli细胞近腔面有发育不同程度的初级精母细胞,内有少量脂褐素颗粒,相邻初级精母细胞之间呈现出相互交叉的指状突起及桥粒连接(图2C),高倍下可见相邻细胞膜下也形成典型外质特化区,且由膜性囊泡定向平行于质膜,细胞之间多处形成细胞间小管和桥粒结构(图2D)。
相比较正常睾丸,双峰驼隐睾生精上皮基膜增生明显,凹凸不平,其上半桥粒结构不明显,外围Ⅰ型胶原纤维较少,而胶原原纤维异常丰富,管周肌样细胞不典型;Sertoli细胞异染色质丰富,靠近基膜排列,核呈多边形,核仁不明显,细胞质内分布滑面内质网以及线粒体,相邻Sertoli细胞细胞膜下线粒体丰富,不规则囊泡散在(图2E);没有观察到Sertoli细胞之间的连接复合体,偶尔能够看到内质网池及细胞膜下细丝束,且存在发育不完全的桥粒结构(图2F);生精细胞内质网为典型不规则、松散的泡状结构,初级精母细胞少见,可见相邻精母细胞间的胞质桥(图2G);Sertoli细胞与初级精母细胞之间细胞膜下散在线粒体及内质网,可见二者细胞膜之间桥粒连接(图2H)。
双峰驼正常睾丸Leydig细胞核为圆形或椭圆形(图2I);细胞内滑面型内质网和粗面型内质网稀疏,二者相延续,高尔基器与线粒体散在,脂滴不明显(图2J);隐睾Leydig细胞形态不规则,绒毛突起不明显(图2K),细胞内线粒体数量较多,肿胀明显,线粒体嵴模糊;内质网较少,没有形成平行排列,偶见脂滴(图2L)。双峰驼正常睾丸间质内毛细血管丰富,其横切可见核扁平状的内皮细胞及清晰的管壁基膜,血管外周可见成纤维细胞和胶原纤维(图2M);高倍下相邻毛细血管内皮细胞之间形成紧密连接,可见内皮细胞内外较多的胞质小泡(图2N)。隐睾间质组织内纤维细胞散在,核形态不规则,细胞质较少;间质毛细血管管径较小,基膜不清晰(图2O);血管内皮细胞之间可见缝隙连接及零散的胞质小泡(图2P)。
表1 双峰驼正常睾丸及隐睾生精小管特征指数比较(±s,n=20)Table 1 The characteristics index of seminiferous tubule in the Bactrian camel scrotal testis and cryptorchism(±s,n=20)

表1 双峰驼正常睾丸及隐睾生精小管特征指数比较(±s,n=20)Table 1 The characteristics index of seminiferous tubule in the Bactrian camel scrotal testis and cryptorchism(±s,n=20)
与正常睾丸相比,*.P<0.05;**.P<0.01Compared with counterparts of the Bactrian camel normal testis,*P<0.05;**P<0.01
间质面积/管腔面积The ratio of interstitial area and bureaucratic area正常睾丸Scrotal testis 13.7±3.7 164.695±2.146 20 291.761±132.416 8 Sertoli细胞个数/个Numbers of Sertoli cells生精小管管径/μm The diameter of the seminiferous tubules生精小管横截面积/μm2Bureaucratic area间质面积/μm2Interstitial area 768.196±897.338 0.452±0.067隐睾Cryptorchidism22.8±4.5*98.512±2.155*7 618.741±82.592**17 682.286±1 535.427**2.432±0.081**
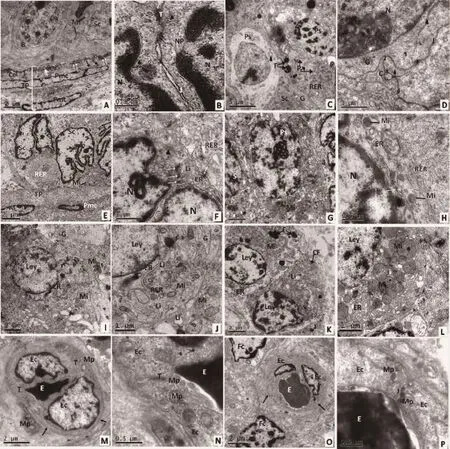
图2 双峰驼正常睾丸和隐睾组织超微结构Fig.2 The ultrastructure of the testis tissue of the Bactrian camel scrotal and cryptorchidism
3 讨 论
睾丸组织形态学发生改变其生精功能也会受到影响。研究表明,隐睾症的病理改变是由于睾丸热效应导致精子活动能力降低及成年干细胞迟发育及减数分裂障碍,生殖细胞数目减少[3-6]。雄性双峰驼一般于4岁进入初情期,本研究中2岁双峰驼正常睾丸生精上皮虽无明显精子存在,但发育良好已形成3~5层生精细胞,而在同一季节同年龄双峰驼隐睾则以Sertoli细胞数量居多及圆形初级精母细胞存在于近基膜处,电镜下观察则多为幼稚型Sertoli细胞且生精细胞明显退化,生精小管的组织学改变主要表现为Sertoli细胞异常分化及精子发育阻滞。哺乳动物睾丸间质结缔组织构成间质内血管、淋巴管以及Leydig细胞等的组织支架。D.N.Ezeasor[8]研究表明,山羊隐睾时生精小管发育不全而显得管间结缔组织更加疏松,与此相一致,本研究中双峰驼隐睾生精小管平均直径较正常组显著减小,间质胶原纤维稀疏,间质/管腔面积比较正常组极显著增大。研究表明,间质面积增加对精子数量及质量都会产生不利影响,导致生精功能下降[9]。牛睾丸间质结缔组织的增加与精子质量降低相关,间质结缔组织的变化可能会影响睾丸间质组织局部代谢[10];本研究中双峰驼隐睾间质组织的变化也可能为生精功能下降的因素之一。
哺乳动物成熟睾丸血-睾屏障位于间质毛细血管腔和生精小管管腔之间,由Sertoli细胞之间膜性囊泡,肌动蛋白丝及紧密连接共同形成,Sertoli细胞质膜下微丝束和内质网池构成细胞外质特化(Ectoplasmic specialization,ES)结构与紧密连接等共同构成连接复合体,是哺乳动物血睾屏障建立和完善的重要标志[11]。研究表明,人进入老年后睾丸Sertoli细胞形态异常影响血-睾屏障构成[12]。本研究表明双峰驼正常睾丸生精上皮下有一层发育良好的固有膜,其上半桥粒结构将Sertoli细胞锚定在基膜上,外围包绕着一层较厚的Ⅰ型胶原,在肌样细胞内表面形成一层不连续基膜;而且Sertoli细胞之间连接复合体结构清楚,间质毛细血管紧密连接完整,这些结构区域是构成良好的血睾屏障的强有力凭证。与之相比,隐睾时电镜下生精小管固有膜增厚,组织分层不明显。研究报道,单峰驼生殖机能障碍以及山羊和猪隐睾时会产生睾丸组织纤维化及生精小管固有膜增厚,分析认为其与Sertoli细胞的发育密切相关,Sertoli细胞发育不成熟会影响固有膜的形态及血睾屏障连接的完整性[4,8,13];本研究中双峰驼隐睾Sertoli细胞多为幼稚型,其与基膜连接的改变可能影响了血-睾屏障。本研究中双峰驼隐睾虽然间质毛细血管壁内皮细胞间形成缝隙连接,相邻Sertoli细胞存在发育不完全的桥粒结构,但生精小管内内质网池及细胞膜下细丝束偶见,尤其缺乏血-睾屏障所特有外质特化区形态结构。研究表明,外质特化是精子与Sertoli细胞粘连部位[14]。血-睾屏障改变会引起管腔环境的异常,而且细胞间连接的变化可影响生精小管内细胞间信息传递,进一步导致生精细胞发育障碍[12]。因此,双峰驼睾丸Sertoli细胞外质特化区形态结构及桥粒结构不完整影响了血-睾屏障的构成,进而阻碍生精功能。
研究认为,Sertoli细胞与生精细胞间相互交叉指状突起类似桥粒连接,或细胞间形成连接复合体有利于细胞间连接稳定及信息传递,且与生精细胞沿Sertoli细胞移动有密切关系[15-16]。本研究中正常双峰驼睾丸相邻初级精母细胞之间呈现桥粒连接,而且初级精母细胞之间形成细胞间小管和桥粒,这与前人在大鼠和牛睾丸研究相一致,认为其有利于Sertoli细胞分泌物释放或生精细胞移动[16-17]。哺乳动物生精过程中从精原细胞到精子形成要经过数次细胞分裂,在多次分裂中除早期几次精原细胞分裂是完全分裂外,生精过程中同源细胞有胞质桥(cytoplasmic bridge)相连有利于生精细胞传递信息,保持同步发育,与生精上皮波的形成密切相关[18]。本研究中双峰驼隐睾生精小管初级精母细胞少见,Sertoli细胞与初级精母细胞之间细胞膜下散在线粒体及内质网,可见二者细胞膜之间的桥粒连接以及相邻精母细胞间的胞质桥,提示双峰驼隐睾时生精过程中亦可能会形成生精上皮波,也为深入研究其生精细胞的同步发育提供参考。
睾丸Sertoli细胞内不同信号通路的激活控制着精原干细胞增殖和分化因子的表达,其结构改变可致使细胞功能受到影响[19]。据报道,成年人睾丸Sertoli细胞的特征是核仁大居中及细胞质中大量脂滴;季节性发情动物在非发情季节,Sertoli细胞中脂滴数量明显增加[20-21]。H.Jiang等[20]研究表明老年人Sertoli细胞内质网和高尔基复合体含量较少,脂滴含量也较少,认为因其合成能力较低。研究报道,2岁之前双峰驼睾丸内生精小管以未空腔化睾丸索形式存在,尚未进入青春期[3],本研究中双峰驼睾丸精原干细胞并不处于大量分化和增殖阶段,Sertoli细胞内没有脂滴积聚,同时线粒体及滑面内质网较少,或者表明其合成能力较低。
Leydig细胞是睾丸间质组织中最重要的内分泌细胞,其超微结构变化在一定程度上反映其功能状态。研究表明,牦牛隐睾时Leydig细胞内线粒体肿胀与细胞氧化应激有关[22],隐睾时睾丸处于高温、缺血、缺氧等非正常状态,进而影响生精功能[6]。M.Ott等[23]研究发现,氧化应激介导线粒体变性,使其功能受损,最终导致细胞凋亡。本研究中隐睾Leydig细胞内线粒体肿胀明显,线粒体嵴模糊。线粒体内膜上附着着各种代谢生化酶,内膜面积与酶数量成正比,当组织缺氧时,线粒体发生损伤,线粒体蛋白合成受阻,嵴消失内膜面积减小,氧化能力下降并产生畸变凋亡[24];因此,隐睾时Leydig细胞内线粒体肿胀致氧化能力下降,而数量增加可能作为总线粒体呼吸功能代偿。
D.N.Ezeasor[8]研究表明山羊隐睾时Leydig细胞内脂滴较正常睾丸增加明显,认为脂滴为雄激素合成前体,可能因Leydig细胞合成活性下降,导致激素前体积累。本研究中双峰驼隐睾与正常睾丸相比Leydig细胞内脂滴无明显增加。研究报道,袋鼠Leydig细胞脂滴含量初生时增加,10d后下降,60d以后又会出现增加,与其睾酮水平变化相一致[25]。研究表明单峰驼在2岁快速发育时期,无论在发情季节还是非发情季节,睾丸组织中睾丸酮浓度较1.5和3岁及以后都要低[26],这与N.Rawlings等[27-28]在牛和猪的研究相一致,认为在动物体成熟迅速发育阶段,睾丸组织中睾丸酮浓度有急剧降低的趋势,且与Leydig细胞体积、数量以及细胞内滑面内质网含量显著相关。本研究中2岁阿拉善双峰驼正处于快速生长发育初期,尚未进入初情期,性活动不明显,正常睾丸Leydig细胞内滑面型内质网和粗面型内质网相延续,表明其处于不断发育完善过程;而隐睾Leydig细胞内质网较少且没有平行排列,这与山羊隐睾时Leydig细胞超微结构相一致,表明细胞合成能力没有完全形成[8],因此,2岁双峰驼雄激素前体尚未储备,滑面内质网发育不均衡,与机体发育阶段细胞分泌功能变化关系密切;隐睾时Leydig细胞超微结构特点与其发育阶段及合成分泌能力的关系有待于进一步研究。
因此,本研究中2岁双峰驼隐睾生精小管的组织学改变主要表现为Sertoli细胞异常分化及精子发育阻滞;隐睾Sertoli细胞多为幼稚型,其与基膜连接的改变以及Sertoli细胞外质特化区形态结构及桥粒结构不完整影响了血-睾屏障的构成;Leydig细胞肿胀内线粒体数量增加,雄激素前体尚未储备,Leydig细胞内质网发育不均衡为其分泌功能与机体发育阶段关系研究提供思路;本研究提示双峰驼隐睾时生精过程中亦可能会形成生精上皮波,也为深入研究其生精细胞的同步发育提供参考。
参考文献(References):
[1] SKIDMORE J A.The main challenges facing camel reproduction research in the 21st century[J].Reprod Suppl,2003,61:37-47.
[2] TIBARY A,ANOUASSI A,SGHIRI A,et al.Current knowledge and future challenges in camelid reproduction[J].Soc Reprod Fertil Suppl,2007,64:297-313.
[3] 徐志浩.雄性双峰驼生殖系统组织学特征研究[D].兰州:兰州大学,2011.XU Z H.Histological studies on reproductive system in male Bactrian camel(Camelus Bactrianus)[D].Lanzhou:Lanzhou University,2011.(in Chinese)
[4] ALI A,DERAR R,AL-SOBAYIL F,et al.Impotentia generandi in male dromedary camels:clinical findings,semen characteristics,and testicular histopathology [J].Theriogenology,2014,82(6):890-896.
[5] PINART E,SANCHO S,BRIZ M D,et al.Ultrastructural study of the boar seminiferous epithelium:changes in cryptorchidism[J].J Morphol,2000,244 (3):190-202.
[6] AMANN R P,VEERAMACHANENI D N.Cryptorchidism in common eutherian mammals[J].Reproduction,2007,133(3):541-561.
[7] 袁莉刚,闫振龙,陶金忠,等.PGP9.5和神经肽Y在双峰驼正常睾丸和隐睾的分布比较[J].畜牧兽医学报,2015,46(2):303-308.YUAN L G,YAN Z L,TAO J Z,et al.The distribution of PGP9.5and NPY in the normal testis and cryptorchidism of Bactrian camel[J].Acta Veterinaria et Zootechnica Sinica,2015,46(2):303-308.(in Chinese).
[8] EZEASOR D N.Light and electron microscopical observations on the Leydig cells of the scrotal and abdominal testes of naturally unilateral cryptorchid West African dwarf goats[J].J Anat,1985,141:27-40.
[9] POP O T,COTOI C G,PLE爦EA I E,et al.Histological and ultrastructural analysis of the seminiferous tubule wall in ageing testis[J].Rom J Morphol Embryol,2011,52(1Suppl):241-248.
[10] HOFLACK G,VAN DEN BROECK W,MAES D,et al.Testicular dysfunction is responsible for low sperm quality in Belgian Blue bulls[J].Theriogenology,2008,69(3):323-332.
[11] LI M W,CHENG C Y,MRUK D D.Sertolin mediates blood-testis barrier restructuring[J].Endocrinology,2014,155(4):1520-1531.
[12] PAUL C,ROBAIRE B.Impaired function of the blood-testis barrier during aging is preceded by a decline in cell adhesion proteins and GTPases[J].PLoSOne,2013,8(12):e84354.
[13] PINART E,BONET S,BRIZ M,et al.Morphological and histochemical characteristics of the lamina propria in scrotal and abdominal testes from postpubertal boars:correlation with the appearance of the seminiferous epithelium[J].J Anat,2001,199(4):435-448.
[14] CHENG C Y,MRUK D D.Actin binding proteins and spermiogenesis:Some unexpected findings[J].Spermatogenesis,2011,1(2):99-104.
[15] KOPERA I A,BILINSKA B,CHENG C Y,et al.Sertoli-germ cell junctions in the testis:a review of recent data[J].Philos Trans R Soc Lon B Biol Sci,2010,365(1546):1593-1605.
[16] KAYA M.HARRISON R G.The ultrastructural relationships between Sertoli cells and spermatogenic cells in the rat[J].J Anat,1976,121(Pt 2):279-290.
[17] WROBEL K H,SINOWATZ F,MADEMANN R.Intertubular topography in the bovine testis[J].Cell Tissue Res,1981,217(2):289-310.
[18] GREENBAUM M P,YAN W,WU M H,et al.TEX14is essential for intercellular bridges and fertility in male mice[J].Proc Natl Acad Sci U S A,2006,103(13):4982-4987.
[19] GARCIA T X,FARMAHA J K,KOW S,et al.RBPJ in mouse Sertoli cells is required for proper regulation of the testis stem cell niche[J].Development,2014,141(23):4468-4478.
[20] JIANG H,ZHU W J,LI J,et al.Quantitative histological analysis and ultrastructure of the aging human testis[J].Int Urol Nephrol,2014,46(5):879-885.
[21] HAYRABEDYAN S,TODOROVA K,PASHOVA S,et al.Sertoli cell quiescence-new insights[J].Am J Reprod Immunol,2012,68(6):451-455.
[22] 陈国娟.牦牛睾丸局部调节因子增龄性与季节性变化的表达研究[D].兰州:甘肃农业大学,2015.CHEN G J.The Expression study of the local regulation factor in Yak testis associated with age and season[D].Lanzhou:Gansu Agricultural University,2015.(in Chinese)
[23] OTT M,GOGVADZE V,ORRENIUS S,et al.Mitochondria,oxidative stress and cell death[J].Apoptosis,2007,12(5):913-922.
[24] 左清清,姚 娜,董坤哲,等.低氧适应的线粒体调控机制研究进展[J].畜牧兽医学报,2013,44(7):993-999.ZUO Q Q,YAO N,DONG K Z,et al.How mitochondria play a role in hypoxic adaptation[J].Acta Veterinaria et Zootechnica Sinica,2013,44(7):993-999.(in Chinese).
[25] BUTLER C M,SHAW G,CLARK J,et al.The functional development of Leydig cells in a marsupial[J].J Anat,2008,212(1):55-66.
[26] EL-HARAIRY M A,ATTIA K A.Effect of age,pubertal stage and season on testosterone concentration in male dromedary camel[J].Saudi J Biol Sci,2010,17(3):227-230.
[27] RAWLINGS N,EVANS A C,CHANDOLIA R K,et al.Sexual maturation in the bull[J].Reprod Domest Anim,2008,43(Suppl 2):295-301.
[28] LUNSTRA D D,FORD J J,CHRISTENSON R K,et al.Changes in leydig cell ultrastructure and function during pubertal development in the boar[J].Biol Reprod,1986,34(1):145-158.
(编辑 白永平)
The Histologic and Ultrastructural Characteristics of the Bactrian Camel Testis in Cryptorchidism
YUAN Li-gang*,QU Ya-ling,LI Cong,LU Yu-rong,YAN Zhen-long
(College of Veterinary Medicine,Gansu Agricultural University,Lanzhou730070,China)
Abstract:The histological and ultrastructural features of testis tissue between the healthy Bactrian camels and the bilateral cryptorchid Bactrian camels were compared at the same ages.The Bactrian camel scrotal testis and cryptorchidism testis of 2years old were prepared for light and electron microscopy by histochemistry and transmission electron methods and IPP(Image-Pro Plus)statistics methods were used to identify the characteristics index of seminiferous tubule in the both testis.The observations made with the light microscope showed that the bilateral cryptorchid Bactrian camels with 1-3layers seminiferous epithelium in seminiferous tubules of much smaller diameter(P<0.05),thus accounting for the interstitial area and the ratio of interstitial area and bureaucratic area were significantly increased(P<0.01).Electron micrographs of seminiferous tubule showed that the junctional complex between adjacent Sertoli cells,and also the intercellular canaliculi and associated desmosomes between adjacent primary spermatocyte were obviously observed in the Bactrian camel scrotal testis,but in the testis of the bilateral cryptorchid Bactrian camels,the lamina propria of seminiferous epithelium were hyperplasia which specifically associat-ed with hemidesmosomes.However,there were rudimentary desmosome between adjacent immature Sertoli cells and the primary spermatocytes were rarely found in the tubular lumen with cytoplasmic bridge and desmosome between adjacent Sertoli cells and primary spermatocyte.The Leydig cells of the scrotal testis note the typical features of granular reticulum in the cisternae in direct continuity with this type of agranular reticulum,but in the cryptorchidism Leydig cell,the background cytoplasm were crowded with swelling mitochondria and reticulum were not obvious.The capillary vessel of cryptorchid Bactrian camels testis was smaller and the epithelial basal of the lamina was not clear,and the junction were observed between adjacent microvessel endothelial cells.Taken together,the abnormal proliferation of the Sertoli cells and the arrest of spermatogenesis were the main characters in cryptorchidism seminiferous tubule,and the blood-testis barrier,which affected by the immature Sertoli cells connection with the basement membrane,the defects of the ectoplasmic specialization in Sertoli cells and the rudimentary desmosome adjacent between the Sertoli cells and primary spermatocyte,in addition,the paucity of mixed endoplasmic reticulum and the differences in the development of smooth endoplasmic reticulum apparent in the Leydig cells of the cryptorchid testis could serve as a meaningful index for the further research of the reticulum involved in steroid biosynthesis may be related to the stage of different ages.
Key words:Bactrian camel;cryptorchidism;testis;histologic structure;ultrastructural character
中图分类号:S852.162
文献标志码:A
文章编号:0366-6964(2016)05-0993-08
doi:10.11843/j.issn.0366-6964.2016.05.017
收稿日期:2015-09-28
基金项目:国家自然科学基金项目(31160488);甘肃省自然科学研究基金(145RJZA223);甘肃省财政厅基本科研业务项目(2012)
作者简介:袁莉刚(1974-),女,甘肃陇南人,教授,博士,主要从事动物发育生物学研究,Tel:0931-7631229
*通信作者:袁莉刚,教授,E-mail:yuan2918@126.com
