抑制组蛋白去乙酰酶1后对人胃癌干细胞的影响*
2016-07-15侯曦露严和中余森源历海清王教学
侯曦露,唐 郡,朱 斌,严和中,余森源,贺 艳,历海清,王教学,刘 卫△
(1.安徽医科大学附属解放军临床学院消化内科/解放军第一〇五医院消化内科,合肥 230601;2.蚌埠医学院附属解放军临床学院消化内科,合肥 230031)
抑制组蛋白去乙酰酶1后对人胃癌干细胞的影响*
侯曦露1,唐郡1,朱斌1,严和中1,余森源1,贺艳2,历海清1,王教学1,刘卫1△
(1.安徽医科大学附属解放军临床学院消化内科/解放军第一〇五医院消化内科,合肥 230601;2.蚌埠医学院附属解放军临床学院消化内科,合肥 230031)
[摘要]目的研究抑制组蛋白去乙酰化酶1(HDAC1)后对人胃癌干细胞(GCSGs)增殖、干性及侵袭作用的影响。方法以CD44为胃癌干性标志物,流式分选出GCSCs。实时荧光定量核酸扩增检测(RT-qPCR)和蛋白免疫印迹法(Western blot)分别检测GCSGs与胃癌非干细胞中HDAC1的表达量。组蛋白去乙酰化酶抑制剂处理GCSCs后,CCK-8法、克隆形成和Transwell实验观察细胞增殖和侵袭的变化;RT-qPCR和Western blot检测其对凋亡、侵袭相关蛋白及干性标志物表达的影响。结果HDAC1在GCSCs中的表达比胃癌非干细胞高。实验组细胞的增殖和侵袭能力相较于对照组均减弱,且下调干性标志物及介导上皮间质转化。结论抑制HDAC1的去乙酰化作用后GCSCs的增殖、干性及侵袭能力降低。
[关键词]组蛋白去乙酰化酶1;胃癌干细胞;增殖;干性;侵袭
胃癌是我国常见的恶性肿瘤之一,其病死率居恶性肿瘤的首位[1]。即使正规治疗后,大多数患者仍死于转移和复发[2]。肿瘤干细胞是一种具有自我更新和产生异质性肿瘤细胞系的肿瘤细胞亚群[3]。近年研究表明,肿瘤干细胞对多种肿瘤增殖和侵袭作用相关[3]。然而肿瘤干细胞增殖与侵袭的相关分子标志物与胃癌的关系尚需确定。表观遗传修饰是分子调控中的重要作用模式之一,在细胞的增殖、分化中起着重要的作用。组蛋白乙酰化/去乙酰化调控是表观遗传学中研究的主要内容,组蛋白去乙酰化酶1(HDAC1)催化组蛋白去乙酰化作用,可使基因转录活性下降[1]。近年来研究表明,异常的组蛋白去乙酰化可能与肿瘤的发生、发展相关,并且HDAC1在结肠癌、肝癌、胰腺癌和前列腺癌中均高表达[4-8]。笔者前期研究结果提示,HDAC1在胃癌干细胞(GCSCs)中表达异常,同时也提示HDAC1可能在GCSCs自我更新及分化过程中起一定的作用。因此,本研究通过CCK-8法、克隆形成、Transwell实验及检测干性(SOX2、BMI1、c-Myc)、侵袭(E-cadherin、Vimentin)标志物的表达,探究去乙酰化酶抑制剂(TSA)抑制HDAC1去乙酰化作用后对GCSCs中增殖、干性及侵袭的影响,以进一步明确HDAC1在GCSCs生长中的作用。
1材料与方法
1.1材料人胃癌MGC803细胞(购自中国科学院上海细胞库)培养于含10%胎牛血清、双抗(青霉素100 U/mL+链霉素100 μg/mL)的RPMI-1640培养液,置于37 ℃、5% CO2和100%湿度培养箱中培养。将实验分成两组,每组培养48 h,每24小时更换1次培养液。实验组:培养液中TSA浓度400 nmol/L;对照组:培养液中与实验组TSA等量的DMSO。
1.2主要试剂RPMI-1640培养基(美国Gibco公司);胎牛血清(杭州四季青生物制品公司);CCK8(上海碧云天生物制品公司);TSA(美国Cayman公司);鼠抗人HDAC1、SOX2、BMI1、c-Myc 、GAPDH单克隆抗体(美国Santa Cruz公司);鼠抗人E-cadherin、Vimentin单克隆抗体(美国Cell Signaling Technology公司);羊抗鼠二抗(上海碧云天生物制品公司)。
1.3方法
1.3.1流式分选收集1×106个贴壁培养的胃癌MGC803细胞, 磷酸盐缓冲液(PBS)冲洗2次,重悬在100 μL FACS缓冲液中。设立实验组和对照组,实验组加入CD133-PE和CD133-FITC各10 μL,对照组为CD133-PE和CD133-FITC单阳性对照组,阴性对照加入10 μL同型对照抗体,于4 ℃避光孵育,每隔10 min混悬1次细胞,30 min后流式细胞仪检测。流式分选的目标细胞群体为CD133+和CD133-细胞亚群。
1.3.2平板克隆形成用0.25%胰酶彻底分离MGC803-control 和MGC803-TSA细胞,使其为单细胞悬液,以200个/孔的浓度接种到6孔板中。用含有10%胎牛血清的RPMI-1640培养基培养 2周,Giemsa染色后计数菌落个数。
1.3.3实时荧光定量核酸扩增检测(RT-qPCR)按照TRIzol(TAKARA,Kyoto,Japan)说明书提取总RNA,经紫外分光光度计测量其纯度及浓度后,分别取总RNA 1 000 ng,按照运转录试剂盒说明书操作,逆转录反应合成20 μL体系cDNA。以反应所得cDNA及SYBR Premix Ex TaqⅡ (TAKARA,Kyoto,Japan)进行定量PCR扩增,以GAPDH为内参照。所有引物序列见表1。

表1 RT-qPCR检测引物序列
1.3.4蛋白免疫印迹法(Western blot)检测用含有1 mmol/L蛋白酶抑制剂的RIPA裂解液在冰上裂解细胞30 min。将总细胞裂解物在4 ℃下离心15 min后吸取上清液并用DAB试剂(Thermo,USA)测量总蛋白水平。以10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离,半干电转移法转至聚偏二氟乙烯(PVDF)膜,室温下摇床封闭2 h。4 ℃过夜敷一抗,PBST洗膜后放入羊抗鼠二抗(1∶5 000)中,室温孵育1~2 h,PBST洗膜后电化学发光法显色,以GAPDH为内参照。
1.3.5CCK-8检测用0.25%胰酶分离MGC803-control和MGC803-TSA细胞,使其成为单细胞悬液,以5 000个/孔的浓度接种到96孔板中。每组设4个平行孔,并设3个不含细胞的空白对照,37 ℃环境中用含有10%胎牛血清的RPMI-1640培养基培养24 h使细胞贴壁后,每孔加入10 μL CCK-8试剂,继续培养2 h后检测光密度(OD)值(450 nm)。
1.3.6体外侵袭实验在Transwells上室中加入20 μL Matrigel/RPMI-1640 (1∶2)混合液后放入37 ℃孵育箱中30 min使其凝固。用0.25%胰酶分离MGC803-control和MGC803-TSA细胞,使其成为单细胞悬液,以3×104个/孔的浓度接种到Transwells上室中。上室再加入200 μL无血清RPMI-1640培养基,下室加入500 μL含有10%胎牛血清的RPMI-1640培养基。在37 ℃中培养24 h后,用4%多聚甲醛将上室细胞固定15 min,结晶紫染色5 min,最后用棉签小心擦拭染色细胞。随机取10个200倍下视野拍照并计数细胞个数。
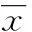
2结果
2.1HDAC1在GCSCs与胃癌非干细胞中的表达将流式分选的CD133+GCSCs和CD133-胃癌非干细胞分别通过RT-qPCR和Western blot的方法在mRNA和蛋白水平上检测HDAC1表达水平。结果表明在mRNA和蛋白水平上HDAC1在CD133+GCSCs的表达高于CD133-胃癌非干细胞,差异有统计学意义(P<0.01),见图1、2。
2.2GCSCs增殖能力的变化抑制HDAC1去乙酰化导致GCSCs增殖能力降低。为了检测HDAC1去乙酰化对GCSCs增殖能力的影响,采用200 nmol/L TSA处理GCSCs 24 h。细胞增殖通过CCK-8实验和克隆实验检测。如图3所示:前3 d 实验组与对照组中细胞的增殖能力差异无统计学意义(P>0.05)。后3 d 实验组GCSCs的增殖能力较对照组逐渐减弱,而且随着时间的推移,两组差距增大(P<0.05)。TSA抑制GCSCs的增殖能力且具有时间依赖性。克隆形成实验结果也表明,实验组GCSCs的克隆形成能力比对照组明显减弱(P<0.01),HDAC1去乙酰化被抑制后GCSCs的增殖能力明显降低,见图4。

图1 流式分选出CD133+和CD133-的胃癌细胞
2.3处理GCSCs后侵袭能力的变化抑制HDAC1去乙酰化导致GCSCs侵袭能力降低基于侵袭是GCSCs重要特征之一,通过Transwell实验检测GCSCs的侵袭能力。为了评估HDAC1在GCSCs侵袭中的作用,用TSA抑制HDAC1去乙酰化,从而使HDAC1失去功能。实验组GCSCs的侵袭能力显著减弱(50%,P<0.01),见图5。
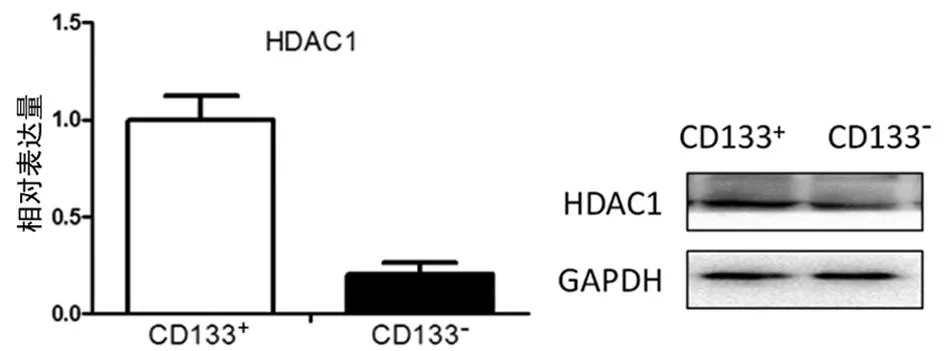
图2 RT-qPCR和Western blot鉴定HDAC1在CD133+
2.4抑制HDAC1去乙酰化导致GCSCs干性蛋白的下调和介导上皮间质转化(EMT)因为胃癌肿瘤干性标志物都不够特异,所以检测了几种可能维持肿瘤干细胞干性的转录因子表达情况。RT-qPCR和Western blot表明实验组细胞的Sox2、Bmi1和c-Myc 的mRNA和蛋白表达量均比对照组细胞的表达量低(P<0.05)。为探究实验组侵袭能力减弱的可能机制,笔者进一步检测了TSA抑制HDAC1乙酰化作用后细胞中侵袭相关分子的表达,发现抑制HDAC1乙酰化后Vimentin的mRNA和蛋白表达均降低(P<0.05)。而E-cadherin的mRNA和蛋白表达均增高(P<0.05),见图6。
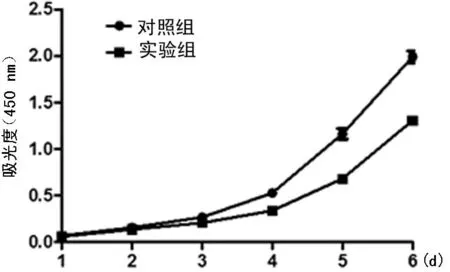
图3 CCK-8实验检测TSA处理GCSCs
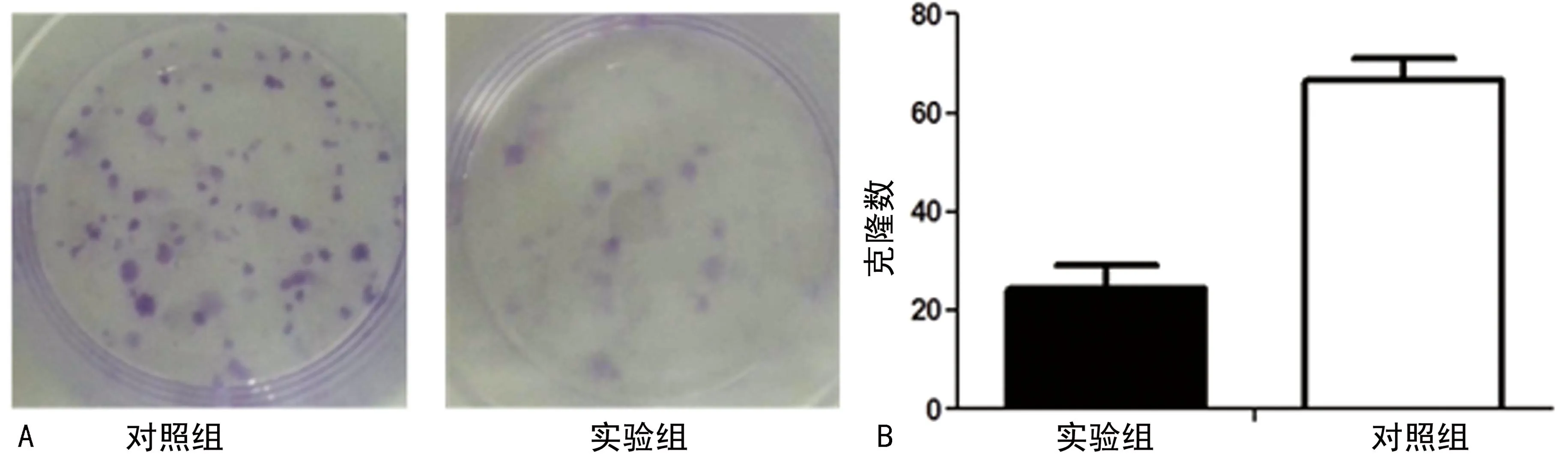
A:两组克隆实验;B:两组克隆个数定量分析。
图4克隆实验检测TSA处理GCSCs后增殖能力的变化
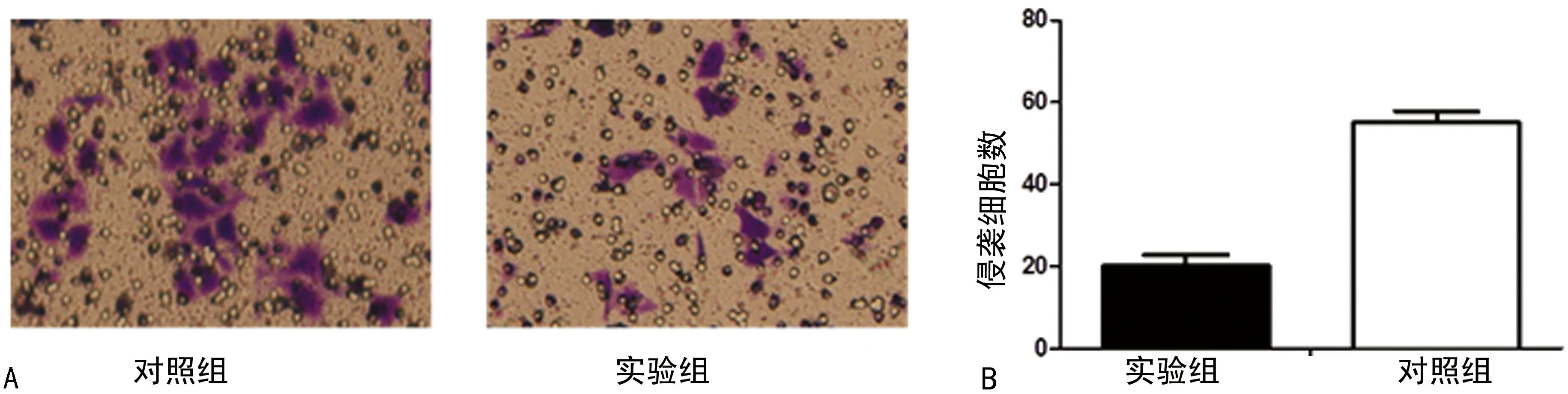
A:两组Transweel实验(×200);B:两组侵袭细胞数定量分析。
图5处理GCSCs后侵袭能力的变化

图6 RT-qPCR和Western blot检测TSA处理GCSCs后
3讨论
HDACs属于去乙酰化酶家族,有Ⅰ、Ⅱ、Ⅲ、Ⅳ 4型。HDACs可通过调节组蛋白或者转录因子等其他蛋白的转录从而调节基因转录[9]。近年发现,HDACs参与肿瘤的发生、发展,且在人类多种肿瘤细胞中均高表达,如HDACs可增加肿瘤细胞的增殖能力,可影响细胞外基质从而增强肿瘤细胞侵袭和转移的能力。同时HDACs抑制剂可通过抑制去乙酰化作用从而抑制体外肿瘤细胞的增殖[10]。组蛋白的去乙酰化修饰在胚胎干细胞干性的维持和分化过程中起着非常重要的作用。大量研究表明,胚胎干细胞特征性的基因都受去乙酰化水平的调控,例如BMI1、OCT4和SOX2等,对胚胎干细胞的自我更新和分化的状态产生重要影响[11]。其中,HDAC1是一种与肿瘤关系最密切的组蛋白去乙酰化酶[4]。
HDAC1是由美国哈佛大学的Taunton等发现的第1个哺乳动物的组蛋白去乙酰化酶,其蛋白质含有482个氨基酸,相对分子质量约5.5×104。HDAC1不仅抑制基因的转录,而且可以通过线粒体转位促进癌基因合成,抑制细胞凋亡与分化障碍。因此,深入探讨HDAC1的调节机制有助于研发高效安全的靶向药物。前期笔者验证了HDAC1在GCSCs中高表达。为了探究HDAC1去乙酰化作用对GCSCs的影响,通过TSA抑制HDAC1的去乙酰化作用,发现抑制乙酰化后GCSCs的增殖、侵袭及其干性能力均减弱。另外,庄涵虚等[1]用HDAC1 siRNA干扰片段干扰HDAC1的表达后发现HDAC1 siRNA可使胃癌细胞MGC-803癌基因c-Myc基因表达降低,下调凋亡相关蛋白caspase-9、caspase-3及抗凋亡蛋白BCL-2。同时Zhang等[12]发现HDAC抑制剂能活化胃癌细胞系中的抑癌基因p21 VAF1,组蛋白去乙酰化可使胃癌细胞中p21VAF1基因失活,而p21VAF1基因可影响c-Myc、Bcl-2的表达,从而抑制DNA的复制,阻断细胞周期。
研究胃癌细胞的干性对于了解胃癌细胞转移的机制至关重要。然而,GCSCs的分离和培养仍具有挑战性。尽管大多数的胃癌细胞表达CD133,但其可作为GCSCs的一个标志分子。本研究发现抑制HDAC1去乙酰化后,干性因子SOX2、BMI1、c-Myc的表达也随之降低。张永杰等[13]发现在肠型胃癌组织标本中HDAC1和Oct4两者表达呈正相关,且HDAC1可通过调节Oct4的表达从而维持干细胞的干性特征和多能性。说明HDAC1的去乙酰化作用对维持GCSCs的干性有影响,因此HDAC1有望成为鉴定和分离GCSCs的一个新的标志物。
EMT是胚胎发育过程中的一个关键步骤,并且是休眠肿瘤细胞获得侵袭能力的一种最常见的现象[14]。越来越多的证据表明EMT与GCSCs侵入邻近胃癌组织相关[2]。EMT的主要分子机制为上调间质标志物和下调上皮标志物[15]。研究发现,抑制HDAC1去乙酰化水平后,GCSCs间质标志物Vimentin表达降低和上皮标志物细胞黏附分子E-cadherin表达升高,该结果代表EMT过程的抑制。本研究结果表明HDAC1去乙酰化作用通过介导EMT促进GCSCs的侵袭作用。
综上所述,TSA抑制GCSCs HDAC1去乙酰化作用后,体外GCSCs的增殖、干性和侵袭能力显著降低。其机制可能与下调干性标志物、凋亡相关蛋白及EMT相关蛋白相关。本研究丰富了HDAC1在GCSCs中的作用研究,探究其成为胃癌预测指标的可能性。但其在肿瘤致瘤、进展、增殖、侵袭等方面相关具体分子机制复杂,所以HADC1影响GCSCs干性、增殖和侵袭的其他机制有待进一步研究。
参考文献
[1]庄涵虚,马旭东,赖亚栋,等.RNA干扰沉默HDAC1基因对胃癌细胞增殖、凋亡、组蛋白乙酰化和甲基化的影响[J].南方医科大学学报,2014,34(2):246-250.
[2]Yang L,Ping YF,Yu X,et al.Gastric cancer stem-like cells possess higher capability of invasion and metastasis in association with a mesenchymal transition phenotype[J].Cancer Lett,2011,310(1):46-52.
[3]Yang L,Ren Y,Yu X,et al.ALDH1A1 defines invasive cancer stem-like cells and predicts poor prognosis in patients with esophageal squamous cell carcinoma[J].Mod Pathol,2014,27(5):775-783.
[4]董洁,尹晓燕,崔铮,等.组蛋白去乙酰化酶1对人胃癌发生发展的影响[J].中国医药指南,2011,9(17):60-62.
[5]李曾,廖洪,谭政,等.组蛋白去乙酰化酶1在人肾癌、膀胱癌和前列腺癌组织中的表达及临床意义[J].广东医学,2012,33(1):92-95.
[6]吕必华,张玲,朱长才,等.姜黄素抑制HepG2细胞HDAC1活性及促进P21WAF1/CIP1表达的研究[J].中国中药杂志,2007,32(19):2051-2055.
[7]Higashijima J,Kurita N,Miyatani T,et al.Expression of histone deacetylase 1 and metastasis-associated protein 1 as prognostic factors in colon cancer[J].Oncol Rep,2011,26(2):343-348.
[8]高道键,徐岷,张玉琦,等.RNA干扰组蛋白去乙酰化酶1对人胰腺癌细胞增殖、凋亡的调控机制研究[J].解放军医学杂志,2010,35(4):380-383.
[9]Pflum MK,Tong JK,Lane WS,et al.Histone deacetylase 1 phosphorylation promotes enzymatic activity and complex formation[J].J Biol Chem,2001,276(50):47733-47741.
[10]谷华伟,刘艳,桑军侠,等.组蛋白去乙酰化酶抑制剂的研究进展[J].中国当代医药,2015,7(16):15-21.
[11]Hattori N,Imao Y,Nishino K,et al.Epigenetic regulation of Nanog gene in embryonic stem and trophoblast stem cells[J].Genes Cells,2007,12(3):387-396.
[12]Zhang Q,Song Y,Chen W,et al.By recruiting HDAC1,MORC2 suppresses p21 Waf1/Cip1 in gastric cancer[J].Oncotarget,2015,6(18):16461-16470.
[13]张永杰,秦叔逵,王杰军,等.肠型胃癌中HDAC1与Oct4表达的相关性研究[J/CD].中华临床医师杂志(电子版),2013,7(14):6387-6390.
[14]Lee HJ,Park MK,Lee EJ,et al.Resolvin D1 inhibits TGF-β1-induced epithelial mesenchymal transition of A549 lung cancer cells via lipoxin A4 receptor/formyl peptide receptor 2 and GPR32[J].Int J Biochem Cell Biol,2013,45(12):2801-2807.
[15]Xu YF,Ge FJ,Han B,et al.High-mobility group box 1 expression and lymph node metastasis in intrahepatic cholangiocarcinoma[J].World J Gastroenterol,2015,21(11):3256-3265.
Effection of HDAC1 deacetylase inhibition on gastric cancer stem cells*
Hou Xilu1,Tang Jun1,Zhu Bin1,Yan Hezhong1,Yu Senyuan1,He Yan2,Li Haiqing1,Wang Jiaoxue1,Liu Wei1△
(1.DepatmentofGastroenterology,theAffiliatedPeople′sLiberationArmyClinicalCollegeofAnhuiMedicalUniversity/the105thHospitalofPeople′sLiberationArmy,Hefei,Anhui230060,China;2.DepatmentofGastroenterology,theAffiliatedPeople′sLiberationArmyClinicalCollegeofBengbuMedicalCollege,Hefei,Anhui230031,China)
[Abstract]ObjectiveTo explore the effect of HDAC1 deacetylase inhibition on the proliferation differentiation and invasion in human gastric cancer stem cells(GCSCs).MethodsThe GCSCs were selected as CD44 marker by using flow cytometry.RT-qPCR and Western Blot were used to detect the expression of HDAC1 in GCSCs and non GCSCs.The effect of proliferation and invasion in GCSCs were observed by CCK-8 assay,colony formation and transwell assay after the cells were treated with TSA.The expression of proteins related apoptosis,differentiation and invasion were detected by using RT-qPCR and Western blot.ResultsThe expression of HDAC1 in GCSCs was higher than that in non GCSCs.The capacities of proliferation and invasion in experimental group were attenuated compared to the control group.The proteins related differentiation was down regulated,and epithelial mesenchymal transition was mediated.ConclusionAfter the deacetylation of HDAC1 was inhibited,the proliferation,differentiation and invasion of GCSCs were reduced.
[Key words]HDAC1;gastric cancer stem cells;proliferation;differentiation;invasion
doi:·论著·10.3969/j.issn.1671-8348.2016.17.005
*基金项目:南京军区面上A类项目(11MA041)。
作者简介:侯曦露(1989-),住院医师,硕士,主要从事胃癌的分子生物学研究。△通讯作者,Tel:18909696246;E-mail:liuwei196432@sina.com。
[中图分类号]R735.2
[文献标识码]A
[文章编号]1671-8348(2016)17-2319-04
(收稿日期:2015-11-28修回日期:2016-01-14)
