奥美拉唑促小鼠胃癌发生的机制研究
2016-07-15齐东江徐阿曼
何 伟,齐东江,徐阿曼,2,袁 笑,陆 震
(1.安徽医科大学第四附属医院普外科,安徽 合肥 230032;2.安徽医科大学第一附属医院胃肠外科一病区,安徽 合肥 230022)
奥美拉唑促小鼠胃癌发生的机制研究
何伟1,齐东江1,徐阿曼1,2,袁笑1,陆震1
(1.安徽医科大学第四附属医院普外科,安徽 合肥230032;2.安徽医科大学第一附属医院胃肠外科一病区,安徽 合肥230022)
摘要:目的研究奥美拉唑(omeprazole,ome)是否会增加小鼠胃癌的发病率并探讨其可能存在的机制。方法实验分为单纯对照组、ome低剂量组(6 mg·kg-1)、ome高剂量组(30 mg·kg-1)、甲基硝基亚硝基胍(N-methyl-N'-nitro-N-nitrosoguanidine,MNNG)组、MNNG+ome低剂量组、MNNG+ome高剂量组。 MNNG加入饮用水中(100 mg·L-1)小鼠自由饮用。每组7只小鼠,常规饲养24周后处死小鼠收集标本并计算小鼠脾质量指数,HE染色观察小鼠胃病理形态学改变,ELISA法检测小鼠血清及脾脏中酸性磷酸酶(acid phosphatase,ACP)、N-乙酰-β-D-氨基葡萄糖苷酶(N-acetyl-β-D-glucosaminidase,NAG)含量; Western Blotting检测小鼠胃p21、p53、mTOR表达。结果ome组与对照组相比及MNNG组与ome+组相比,小鼠脾质量指数、血清及脾脏中溶酶体酶活性明显下降;与MNNG组相比ome+组小鼠胃癌发生率明显增加,尤其是MNNG+ome高剂量组,两者差异有统计学意义(P<0.05); 和对照组相比,实验组p53表达增加,p21表达减少,mTOR表达减少,差异均有统计学意义(P<0.05)。结论ome可以促进胃癌发生,其机制可能是和抑制小鼠体内溶酶体及其水解酶的活性,从而降低小鼠免疫功能有关。
关键词:胃肿瘤;奥美拉唑;溶酶体;酸性磷酸酶;印迹法, 蛋白质;小鼠, 基因敲除
胃癌是人类最常见的消化道恶性肿瘤之一,每年胃癌死亡率约占癌症相关死亡的10%,仅次于肺癌[1]。我国一直是胃癌高发地区,其发病率在我国肿瘤中居第二位,死亡率仅次于肺癌和肝癌[2]。20世纪90年代(1994年)世界卫生组织/国际癌症研究机构(WHO/IARC)将幽门螺杆菌(Helicobacter pylori,Hp)定为Ⅰ类致癌原,随后根除Hp的药物大量使用于临床,尤其是以ome为代表性药物的质子泵抑制剂(proton pump inhibitors,PPIs)。
PPIs是一种非常有效的药物,其作用机制是阻断胃壁细胞分泌管上H+/K+-ATP酶的活性从而阻断任何刺激引起的胃酸分泌,但会引起胃壁细胞增生、腺囊肿、高胃泌素血症及胃底腺息肉等不良反应。对于长期使用PPIs是否会增加胃癌发病率仍缺乏充分的实验室证据及临床病例支持。本研究通过不同剂量ome长期给小鼠灌胃及ome与甲基硝基亚硝基胍(MNNG)合用时对小鼠胃黏膜的影响,并观察ome是否会增加小鼠胃癌发病率并对其机制进行探索,从而为临床合理用药提供理论依据。
1实验动物与试剂
清洁级KM小鼠,雄性,体质量24~26 g,共42只,由安徽医科大学实验动物中心提供。奥美拉唑肠溶片购自山东新时代药业有限公司,批号:009131003。MNNG购自日本TCI公司,于4 ℃冰箱保存。N-乙酰-β-D-氨基葡萄糖苷酶(NAG)ELISA检测试剂盒、酸性磷酸酶(ACP)ELISA检测试剂盒购自百奥莱博;日立7020全自动生化分析仪;SpectraMax 190酶标仪;JEDR801D 形态学图像分析系统Version6.0;NOVA型切片机;美国Bio-Rad电泳仪。
2方法
2.1胃癌动物模型建立与分组小鼠饲养于安徽医科大学药理教研室动物中心,聚丙烯笼内标准条件下饲养,温度维持在24 ℃,自动进食饮水。所有动物随机分为对照组、ome低剂量组、ome高剂量组、MNNG组、MNNG+ome低剂量组(ome低+)、MNNG+ome高剂量组(ome高+)六组,每组7只。后三组饮用水中加入MNNG 100 mg·L-1,小鼠自由饮用。ome、ome低+组及ome高+组小鼠每天给予ome灌胃,低剂量为(6 mg·kg-1,按体质量60 kg成人每日服用40 mg ome为标准,按照小鼠与人体药物剂量换算公式计算)、高剂量为30 mg·kg-1。动物常规饲养,每周称量体质量一次,24周后处死小鼠,收取标本,处死前小鼠禁食24 h。
2.2小鼠脾质量指数测定小鼠处死前称量小鼠体质量。脱颈椎处死后剖腹迅速取出小鼠脾脏,分析天平称重。计算脾质量指数,即脾质量指数=脾脏质量(mg)/体质量(g)。
2.3小鼠胃组织病理形态学观察用2.5%戊巴比妥钠(2 mL·kg-1)腹腔注射麻醉动物后取血。脱颈椎处死小鼠后迅速打开小鼠腹腔,取出胃组织,沿胃大弯侧切开,0.9%NaCl清洗三次并把标本固定,肉眼观察胃黏膜大体形态变化。每只小鼠于胃底、胃体及胃窦各取两块组织固定于10%中性甲醛溶液,固定24 h后,组织脱水、浸蜡、包埋、切片,行行苏木精-伊红(HE)染色,光电下观察胃组织病理形态学改变。胃黏膜病理变化由病理科医师双盲读片。
2.4小鼠血清及组织中ACP及NAG含量测定采用ELISA法测定血清及组织中ACP和NAG含量。实验步骤严格按照操作说明书操作。并在450 nm处测定吸光度值。
2.5蛋白质印迹法(Western Blotting)随机选取每组小鼠5只,将蛋白从小鼠前胃组织中提取,BCA法定量蛋白(BCA蛋白检测试剂盒购自中国碧云天),SDS-PAGE凝胶电泳分离蛋白,电泳后将蛋白转移至聚偏氟乙烯(PVDF)膜上,使用含5%脱脂奶的0.3%吐温20Tris缓冲盐溶液(TBST)封闭1 h,分别用兔抗小鼠p21抗体(购自英国Abcam公司)、兔抗小鼠p53抗体、兔抗小鼠mTOR抗体(购自美国Affinity Biosciences公司)孵育过夜,TBST洗三次后使用羊抗兔IgG抗体(购自美国Affinity Biosciences公司)孵育2 h,增强化学发光(Enhanced Chemiluminescence,ECL)法观察蛋白表达水平,使用ImageJ软件分析结果,计算相对灰度值。
3结果
3.1小鼠一般情况MNNG组与ome低+和ome高+比较小鼠明显不活泼,毛发光泽度较差,食量减少,但小鼠平均体质量较后两组高,这可能和ome可以改善MNNG对小鼠的消化道症状相关。ome组和对照组比较差异无统计学意义。
3.2ome对小鼠脾质量指数的影响各组小鼠脾质量指数见表1。长期使用ome均可导致小鼠脾质量指数下降。与对照组相比,ome低剂量组小鼠脾质量指数下降,但差异无统计学意义,ome高剂量组小鼠脾质量指数下降,差异有统计学意义(P<0.05)。与MNNG组相比,ome+组小鼠脾质量指数下降,差异均有统计学意义(P<0.01),见表1。
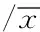
表1 各组小鼠脾质量指数±s
注:与对照组相比,aP<0.05;与MNNG组相比,bP<0.01。
3.3小鼠胃组织病理学观察
3.3.1大体观察对照组小鼠胃黏膜光滑、腺胃黏膜皱襞明显,肉眼观无溃疡及隆起型病灶。ome组肉眼观察小鼠前胃无明显改变,腺胃黏膜皱襞变浅。MNNG组与ome+组前胃黏膜表面可见大小不等白色突起物,呈乳头状突向胃腔,部分可见溃疡型病灶;小鼠腺胃黏膜皱襞变浅,有的甚至消失,见图1。
3.3.2镜下观察对照组小鼠前胃黏膜呈现正常组织学形态,黏膜及黏膜下层无炎性细胞浸润,各层组织结构明显。MNNG组小鼠前胃呈乳头状增生伴角化过度、角化不全,部分镜下可见癌细胞,小鼠腺胃基本正常。与MNNG组相比ome+组小鼠前胃癌变率增高,差异有统计学意义(见表2),并且癌组织向深肌层浸润。小鼠腺胃镜下可见黏膜及黏膜下层可见炎细胞浸润,可见肠化及腺体异常增生,少数呈现腺癌(见图2)。
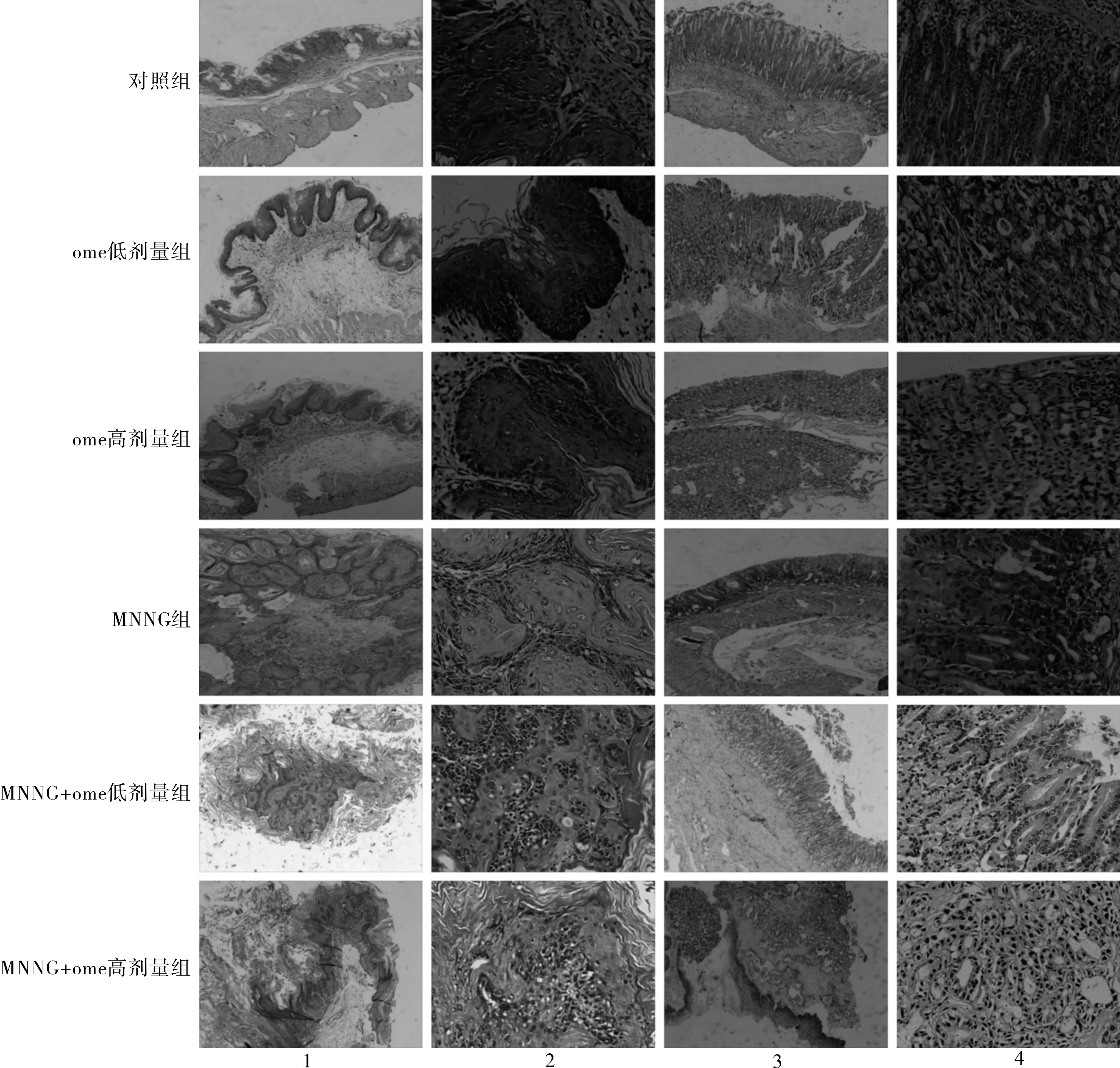
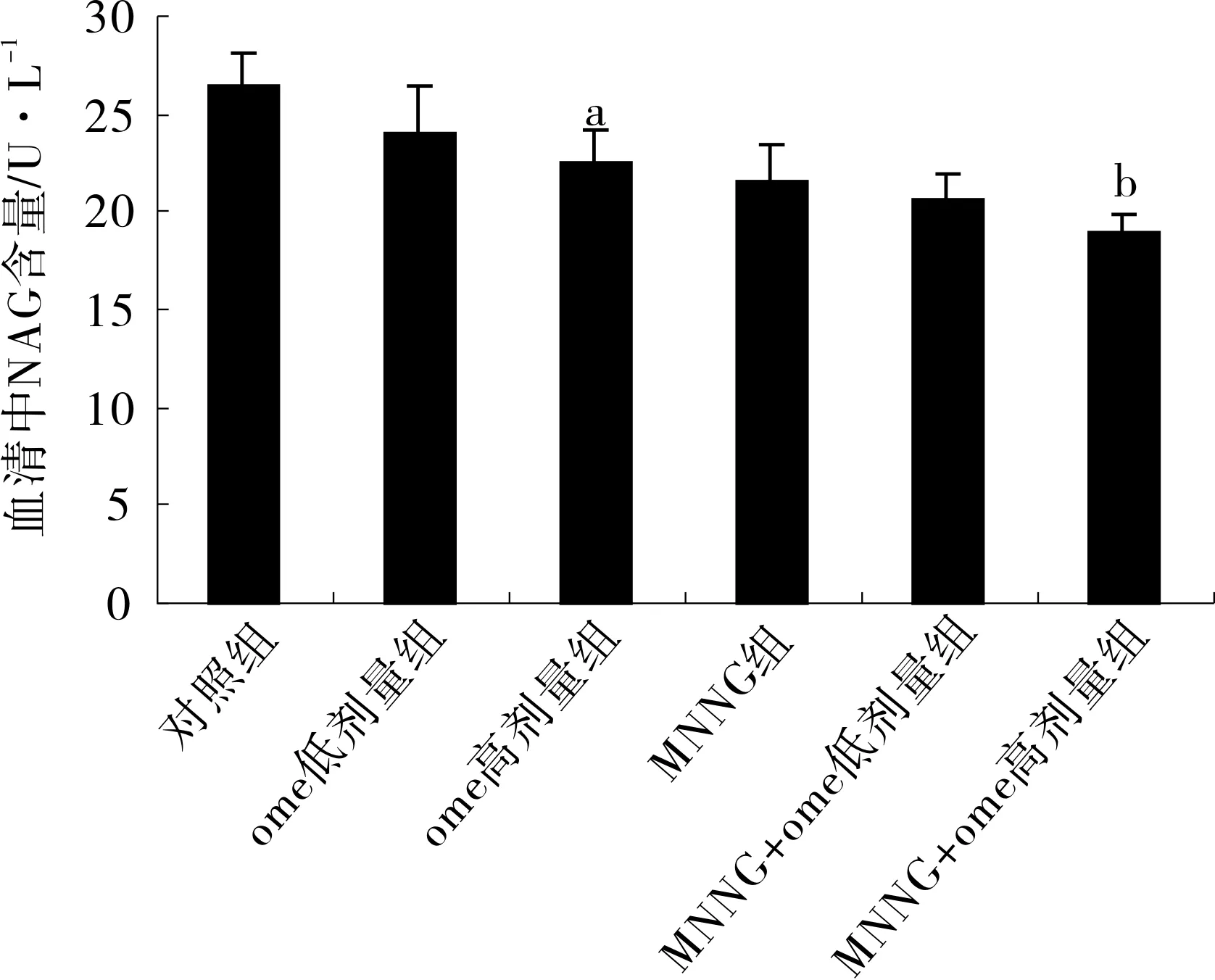
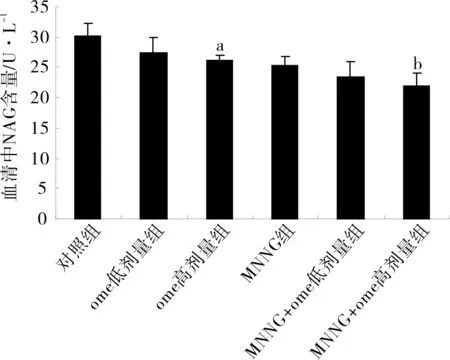
3.4ome对小鼠血清中ACP及NAG含量影响ome组给药24周后小鼠血清中ACP及NAG含量均减少。与对照组相比,ome低剂量组ACP及NAG含量均下降,但差异无统计学意义,ome高剂量组与对照组相比差异有统计学意义(P<0.05);与MNNG组相比,ome+组均可以明显减少小鼠血清中ACP及NAG含量,差异均有统计学意义,见图3、4。
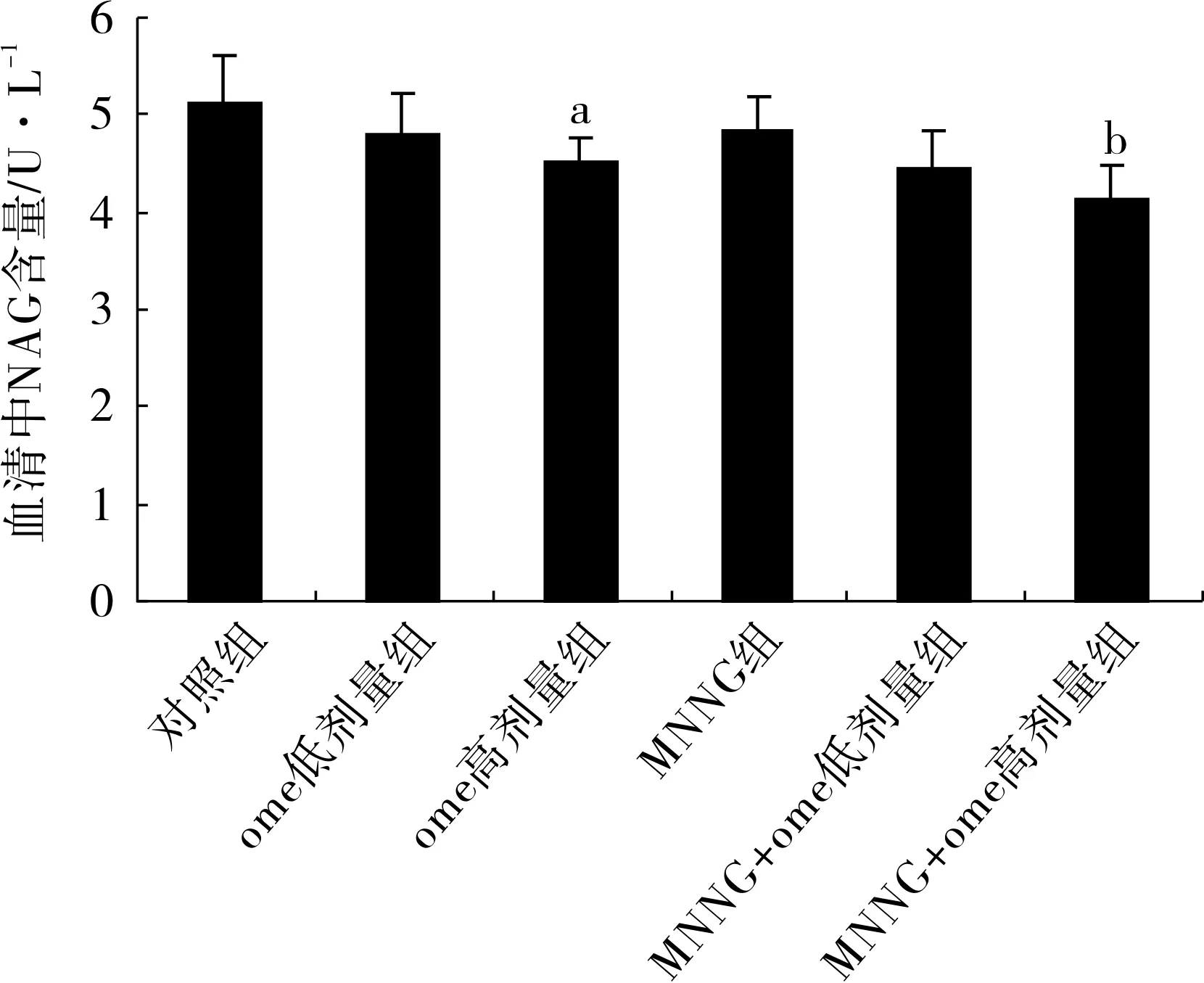
3.5ome对小鼠脾脏中ACP及NAG含量影响ome组给药24周后小鼠脾脏中ACP及NAG含量均减少。与对照组相比,ome低剂量组ACP及NAG含量均减少,但差异无统计学意义;ome高剂量组与对照组相比差异有统计学意义(P<0.01)。与MNNG组相比,ome+组同样均可降低小鼠脾脏中ACP及NAG含量,MNNG+ome低剂量组差异无统计学意义,MNNG+ome高剂量组差异有统计学意义(P<0.01),见图5、6。
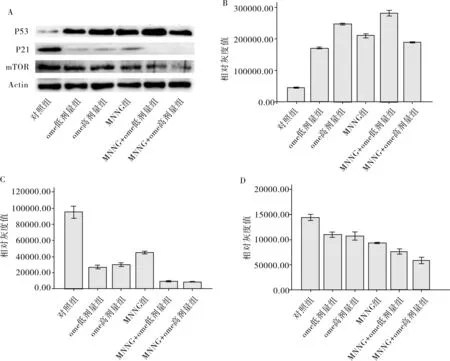
3.6各组小鼠前胃组织p53、p21和mTOR表达量和对照组相比,实验组p53表达增加,p21表达减少,mTOR表达减少,差异均有统计学意义(P<0.01),见图7。
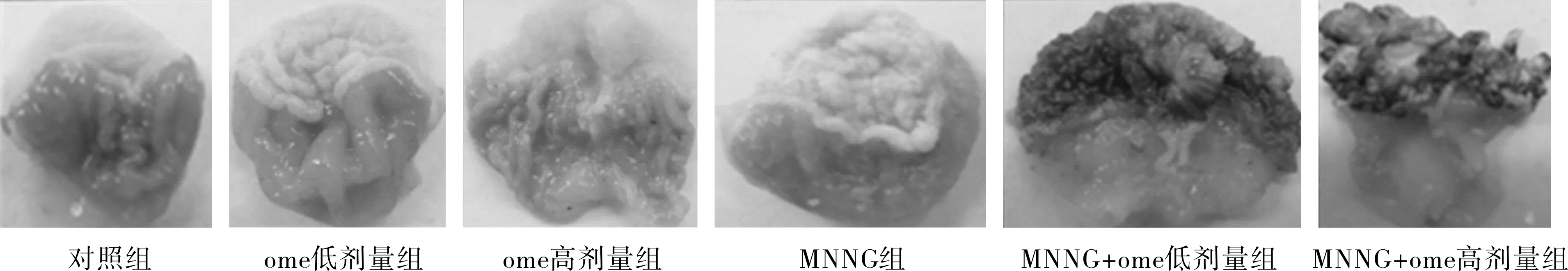
图1 小鼠胃大体标本(标尺:2 mm)

组别鼠数前胃乳头状增生鳞癌腺胃慢性胃炎萎缩性胃炎肠上皮化生不典型增生腺癌对照组70000000ome低剂量组75001010ome高剂量组77002020MNNG组77200010MNNG+ome低剂量组7746004b0MNNG+ome高剂量组776a7014b1
注:a和MNNG组存在差异,b和MNNG组存在差异(SNK-Q检验)。
注:第1列为各组小鼠前胃HE染色图(×40);第2列为各组小鼠前胃HE染色图(×200);第3列为各组小鼠腺胃HE染色图(×40);第4列为各组小鼠腺胃HE染色图(×200)。
图2各组小鼠前胃及腺胃HE染色图
注:与对照组相比,aP<0.05;与MNNG组相比,bP<0.01。
图3各组小鼠血清中ACP含量(n=7)
注:与对照组对比,aP<0.01;与MNNG组对比bP<0.01。
图4各组小鼠血清中NAG含量(n=7)
注:与对照组相比,#P<0.01,.与MNNG组相比#P<0.01。
图5各组小鼠脾脏中ACP含量(n=7)
注:与对照组相比,#P<0.01,与MNNG组相比,*P<0.05。
图6各组小鼠脾脏中NAG含量(n=7)
注:和对照组相比,实验组p53高表达,p21低表达,mTOR低表达;A.各组p53、p21、mTOR的Western blotting结果;B.各组p53的相对灰度值,与对照组相比,P<0.01;C.各组p21的相对灰度值,与对照组相比,P<0.01;D.各组mTOR的相对灰度值,与对照组相比,P<0.01。
图7各组p21,p53,mTOR表达水平(n=5)
4讨论
溶酶体是一种分解代谢的酸性细胞器(pH 4.5~5.5),在哺乳动物中除了成熟的红细胞,普遍存在于其他的细胞[3]。它通过自噬、内吞和吞噬功能负责处理、回收利用受损的细胞、生物大分子和细胞器,同时消化那些转运到溶酶体中的细胞外来物质,并通过溶酶体内的水解酶消化这些物质,并将消化后的产物通过弥散或者其他的特殊的转运通道再循环回胞浆,或者通过细胞外分泌到细胞外间隙。水解酶特异性的广泛存在于溶酶体内,这些水解酶在溶酶体内被高酸环境所激活(pH 4.5~5.0)。因此在溶酶体内保持高度酸性的pH值对溶酶体的正常功能是所必须的。溶酶体利用一种质子泵V-ATP酶来形成和维持pH梯度的稳定,它通过消耗ATP将H+逆电子梯度转入溶酶体内[4]。Ⅴ-ATP酶的活性不仅确保溶酶体的消化功能而且还对溶酶体的钙的平衡及溶酶体的转运、融合功能都是必要的[5]。因此,抑制Ⅴ-ATP酶的活性同时也会损坏细胞的内吞作用和自噬,甚至是溶酶体酶功能的丧失。Liu等[6]证实PPIs在pH为5时容易激活并与含有半胱氨酸的肽结。那么PPIs有可能对细胞内溶酶体的Ⅴ-ATP酶具有强大的抑制作用导致溶酶体内pH值增加从而抑制溶酶体的功能及其水解酶的活性。溶酶体及其水解酶在人体防御及免疫反应中扮演重要的角色。在细胞免疫中T细胞抗原呈递和T淋巴细胞清除肿瘤细胞、病菌感染的细胞、细胞核功能失调的细胞都需要溶酶体酶的参与。
ACP及NAG均是溶酶体内水解酶,同时ACP又是溶酶体的特征性酶,分析两者的含量可以直接反应溶酶体酶的含量。本研究显示ome对脾脏及血清中ACP和NAG具有明显的抑制作用,同时这也提示溶酶体的功能处于一种抑制状态。同时长期使用ome会造成小鼠脾脏的重量指数的下降。小鼠处死后本课题组还发现MNNG+ome高剂量组半数以上的小鼠胸腺萎缩明显。众所周知,脾脏和胸腺是人类最重要的免疫器官。因此,长期使用ome可能会引起系统性的免疫功能损伤,此结果和以往的文章是一致的[7],这可能是其导致胃癌发生率增加一个主要因素。
本实验结果提示ome+组小鼠胃癌发病率增加,其中MNNG+ome低剂量组差异无统计学意义,MNNG+ome高剂量组小鼠前胃癌明显增高,差异有统计学意义。ome+组小鼠腺胃腺体不典型增生发生率均明显增加。腺体的不典型增生是胃癌的癌前病变,本研究ome+组小鼠腺癌发病率低可能是由于本实验诱导时间较短相关。高胃泌素血症假说认为PPIs增加肿瘤发生的机制是由于其抑制胃酸的产生导致高胃泌素血症。因为高胃泌素血症对胃黏膜和其他的上皮组织具有有营养的作用并导致其增生,这可能导致肿瘤的发生。但是这并不能完全解释Zollinger-Ellison综合征患者、迷走神经切断术后及其他高胃泌素血症患者并没有增加胃癌发生的风险。与高胃泌素血症假说相比,本实验能更好的解释为什么单独使用质子泵抑制剂并不会引发肿瘤,但进食质子泵抑制剂和高亚硝酸盐的实验动物胃癌发生率明显增高。
本实验结果提示ome可以促进小鼠前胃p53表达,抑制p21,mTOR表达。P53基因是位于17号染色体短臂的一种抑癌基因,它编码的p53蛋白作为一种转录因子在调控细胞周期中起抑制DNA合成、修复DNA损伤和调控细胞凋亡等作用。它通过消除损伤细胞、抑制肿瘤的发生等维持生物的遗传稳定性。据报道,27%左右的胃癌患者中存在p53突变[8],突变型p53蛋白的半衰期较正常p53蛋白长,p53的过度表达可能是p53基因突变的一个指标。突变型p53蛋白的异常功能可能增强增殖活性,促进肿瘤进展。有数据表明,突变型p53蛋白可以干扰p53家族中的p63进而促进肿瘤细胞的迁移和转移[9]。p53蛋白的表达和胃癌的浸润深度、淋巴结转移、TNM分期、血管侵犯呈正相关[10]。ome促进小鼠前胃p53的表达,但本实验并未发现单独使用ome导致胃癌的现象,这可能是实验时间较短造成的。P21位于P53基因下游,其表达的p21蛋白是一种细胞周期负调节因子,它通过抑制细胞周期蛋白依赖性激酶的活性导致细胞在细胞周期中的某个特定阶段停止生长。p21与胃癌间的关系尚不明确,Huang等[11]表明较低的细胞核p21表达和较高的细胞质p21表达和胃癌患者较差的预后相关, Liu等[12]表示p21的表达和胃癌患者的不良预后明显相关,但是Gunia等[13]表示并没有发现p21的表达和生存率之间有关,本实验表明ome抑制小鼠胃p21的表达,特别是MNNG+ome低组和MNNG+ome高组。据Seo等[14]报道高p53、低p21表达的胃癌患者预后最差,虽然我们的实验结果表明ome并不直接导致胃癌,但是ome可以促进p53表达,抑制p21表达,我们有理由相信长期使用ome的患者如果发生胃癌那么其预后较差。哺乳动物雷帕霉素靶蛋白(mTOR) 与肿瘤细胞的增殖、诱导凋亡和逆转肿瘤细胞的耐药性有关。Tapia等[15]报道胃癌患者mTOR的表达上升,本实验结果提示小鼠胃癌mTOR表达水平下降,可能和ome的作用有关。Marino等[16]报道埃索美拉唑(esomeprazole,ESOM)可以抑制mTOR信号通路,可能会促进黑色素瘤细胞内ESOM诱导的自噬反应。在本实验中,ome抑制mTOR的表达,其抑制机制可能和ESOM一致,但ome作用下的mTOR的低表达和胃癌的发展之间的关系需要进一步的实验来证明。
长期使用PPIs会增加沙门氏菌、弯曲杆菌、梭状芽孢杆菌[17]的风险。PPIs增加细菌感染的风险普遍认为是其抑制胃酸的分泌导致胃中的pH值增加。但是这并不能解释增加梭状芽孢杆菌感染风险的问题。这种细菌是使用耐酸孢子作为传播的主要工具。本实验也能更好的阐释长期PPIs增加梭状芽孢杆菌感染的现象。
目前临床医师对PPIs的用药指征把握不准和大量不规范用药导致质子泵抑制剂使用泛滥。在澳大利亚、英国和爱尔兰使用PPIs的患者中,分别有63%、67%和33%的患者没有按照标准使用该药[18]。武航海等[19]统计所属医院2011—2012年ome使用情况发现10 000张含ome的处方中1 752张为不合理处方。国内大部分地区尤其是农村及偏远地区,人们喜食腌制及烟熏食品,该类食品含有大量亚硝酸盐,本研究提示对于这一类患者长期使用ome(尤其是大剂量使用ome)可增加胃癌发病率、胃腺细胞不典型增生率。对于需要长期使用ome的患者,建议定期胃镜并取活检避免胃癌发生。同时本研究存在一定的不足,实验样本量较小,实验时间较短,有待大样本实验近一步探索研究。本研究对于合理、规范化使用PPIs具有一定的临床指导意义,特别是对于那些行部分胃切除术后出现消化道症状的患者。
参考文献
[1]Jemal A,Bray F,Center MM,et al.Global cancer statistics[J].CA Cancer J Clin,2011,61(2):69-90.
[2]代敏,任建松,李霓,等.中国2008年肿瘤发病和死亡情况估计及预测[J].中华流行病学杂志,2012,33(1):57-61.
[3]Xu H,Ren D.Lysosomal physiology[J].Annu Rev Physiol,2015,77:57-80.
[4]Mindell JA.Lysosomal acidification mechanisms[J].Annu Rev Physiol,2012,74:69-86.
[5]Morgan AJ,Platt FM,Lloyd-Evans E,et al.Molecular mechanisms of endolysosomal Ca2+signalling in health and disease[J].Biochem J,2011,439(3):349-374.
[6]Liu W,Baker SS,Trinidad J,et al.Inhibition of lysosomal enzyme activities by proton pump inhibitors[J].J Gastroenterol,2013,48(12):1343-1352.
[7]齐东江,徐阿曼.奥美拉唑对小鼠胸腺、脾脏免疫功能的影响[J].安徽医药,2015,19(9):1665-1667.
[8]Waraya M,Yamashita K,Ema A,et al.Exclusive Association of p53 Mutation with Super-High Methylation of Tumor Suppressor Genes in the p53 Pathway in a Unique Gastric Cancer Phenotype[J].Plos One,2015,10(10):e0139902.
[9]Muller PA,Vousden KH,Norman JC.P53 and its mutants in tumor cell migration and invasion[J].J Cell Biol,2011,192:209-218.
[10] Wei K,Jiang L,Wei Y,et al.The prognostic significance of p53 expression in gastric cancer: a meta-analysis[J].J Cancer Res Clin Oncol,2015,141:735-748.
[11] Huang Y,Wang W,Chen Y,et al.The opposite prognostic significance of nuclear and cytoplasmic p21 expression in resectable gastric cancer patients[J].Journal of Gastroenterology,2014,49(11):1-12.
[12] Liu X,Yu H,Hong CM,et al.Expression of CD24,p21,p53,and c-myc in alpha-fetoprotein-producing gastric cancer: Correlation with clinicopathologic characteristics and survival[J].Journal of Surgical Oncology,2014,109(8):859-864.
[13] Gunia S,Kakies C,Erbersdobler A,et al .Expression of p53,p21 and cyclin D1 in penile cancer: p53 predicts poor prognosis[J].Journal Clinical Pathology,2012,65(3):232-236.
[14] Seo YH,Joo YE,Chol SK,et al.Prognostic Significance of p21 and p53 Expression in Gastric Cancer[J].The Korean Journal of Internal Medicine,2003,18(2):518-525.
[15] Tapia O,Riquelme I,Leal P,et al.The PI3K/AKT/mTOR pathway is activated in gastric cancer with potential prognostic and predictive significance[J].Virchows Archiv,2014,465(1):25-33.
[16] Marino ML,Fais S,Djavaheri-Mergny M,et al.Proton pump inhibition induces autophagy as a survival mechanism following oxidative stress in human melanoma cells[J].Cell Death and Disease,2010,1(10):e87.
[17] Bourne C,Charpiat B,Charhon N,et al.Effets indésirables émergents des inhibiteurs de la pompe à protons[J].La Presse Médicale,2013,42(2):e53-e62.
[18] Hoffmann F,Glaeske G,Schmiemann G.Increased proscribing of proton pump inhibitors in ambulatory care over the years 2005—2013[J].Z Gastroenterol,2015,53(2):95-100.
[19] 武航海,罗维楠,张艺雯.我院2011—2012年奥美拉唑使用情况及处方分析[J].中国药房,2013,24(36):3439-3441.
Study on the mechanism of omeprazole in promoting the development of gastric cancer in mice
HE Wei1,QI Dong-jiang1,XU A-man1,2,et al
(1.DepartmentofGeneralSurgery,TheFourthAffiliatedHospitalofAnhuiMedicalUniversity,Hefei,Anhui230032,China;2.DepartmentofGastrointestinalSurgery,TheFirstAffiliatedHospitalofAnhuiMedicalUniversity,Hefei,Anhui230022,China)
Abstract:ObjectiveTo investigate if oral omeprazole(ome) will increase the incidence of gastric cancer in mice and the possible mechanism.MethodsMice were divided into 6 groups,with seven mice in each group,including control group,low-dose ome group,high-dose ome group,N-methyl-N'-nitro-N-nitrosoguanidine (MNNG) group,MNNG+low-dose ome group (6 mg·kg-1),and MNNG+high-dose ome group (30 mg·kg-1).The mice were administrated with drinking water containing MNNG.The mice were raised in a routine way for 24 weeks.After that the mice were sacrificed to collect samples and calculate the mice spleen index.HE staining of the mice stomach was applied to exam the histological changes.Serum and spleen concentrations of acid phosphatase (ACP) and N-acetyl-β-D-glucosaminidase (NAG) were detected by ELISA.And the expression levels of p21,p53 and mTor in the mouse stomach were detected by Western Blotting.ResultsIn the comparison of the ome group with the control group and the MNNG group with the ome + group,mice spleen weight indexes in the ome group and the ome+ group decreased significantly.Meanwhile,mice serum and spleen lysosomal enzyme levels also decreased significantly.Compared with MNNG group,the incidence of gastric cancer in the ome+ group was increased significantly.especially in the MNNG+ome high-dose group,.and the difference was statistically significant (P<0.05).Compared with the control group,the expressions of p53 in the experimental group was increased,the expressions of p21 decreased,and the expressions of mTOR also decreased (P<0.05).ConclusionsOme can promote gastric carcinogenesis in mice,and its mechanism may be through the inhibition of lysosomal hydrolase enzyme and its fuction in mice,thereby reducing the immune fuction in these mice.
Key words:Stomach neoplasms;Omeprazole;Lysosomes;Acid phosphatase;Blotting,western;Mice,knockout
通信作者:徐阿曼,男,主任医师,硕士生导师,研究方向:胃肠肿瘤,E-mail:xuaman166@sina.com
doi:10.3969/j.issn.1009-6469.2016.06.008
(收稿日期:2016-01-16,修回日期:2016-04-10)
