疫霉葡聚糖激发子Gep1诱导烟草对烟草花叶病毒的抗性研究
2016-07-15薛守聪任加庆许汝冰李锡宏赵秀云华中农业大学生命科学技术学院武汉430070湖北省烟草科学研究院武汉430030
霍 瑞,薛守聪,任加庆,许汝冰,李锡宏,赵秀云*(.华中农业大学生命科学技术学院,武汉 430070;.湖北省烟草科学研究院,武汉 430030)
疫霉葡聚糖激发子Gep1诱导烟草对烟草花叶病毒的抗性研究
霍 瑞1,薛守聪1,任加庆1,许汝冰2,李锡宏2,赵秀云1*
(1.华中农业大学生命科学技术学院,武汉 430070;2.湖北省烟草科学研究院,武汉 430030)
摘 要:烟草花叶病毒病是危害烟草的重要病害,可通过激发子诱导烟草产生抗病性。利用乙醇沉淀、DEAE-52、SephadexG-100柱层析的方法,从疫霉菌中分离纯化出一种葡聚糖类激发子Gep1。Gep1诱导后,烟草叶片产生和积累H2O2、酚类物质;烟草叶片苯丙氨酸解氨酶、多酚氧化酶和过氧化物酶活性均有不同程度的提高。Gep1可以诱导烟草抗TMV。盆栽实验表明,4mg/mL Gep1的防效为67.4%,降低了发病率,推迟了发病时间。半定量RT-PCR结果显示,Gep1激发子诱导烟草抗病相关基因的上调表达,表明Gep1可激发烟草防卫反应,诱导烟草产生系统抗性,提高烟草对病毒的抗性。
关键词:烟草花叶病毒;疫霉;葡聚糖激发子;防卫反应
烟草花叶病毒(Tobacco mosaic virus, TMV)引起的病毒病是烟草主要病害之一,严重制约了烟草的生产[1]。目前,抗病毒剂的作用以抑制病毒活性和诱导烟株抗性为主[2]。已有许多关于糖类作为激发子防治烟草花叶病的报道。商文静等[3]报道壳寡糖对烟草花叶病防效可达84.73%。苍耳多糖可诱导烟草产生抗性,抑制 TMV的侵染[4]。氨基寡糖对烟草花叶病的防效可达77.9%[5]。
糖类激发子是指具有激活植物自身免疫、提高植物抗病能力的糖类物质[6]。糖类激发子包括以下几类:寡聚半乳糖醛酸、葡聚糖及其寡糖、几丁聚糖及其寡糖、壳聚糖及其寡糖、海藻酸钠寡糖、果寡糖、木寡糖等[7-8]。目前已鉴定的真菌激发子多数是低聚糖或糖蛋白,少数为蛋白质或多肽。β-1,3-β-1,6-葡寡糖是从大豆致病菌大雄疫霉菌(Phytophthora megasperma)的细胞壁水解产物中得到的激发子,可诱导大豆叶片产生植保素。壳多糖能够诱导多种植物产生抗病性,如可诱导番茄对根腐菌(Fusarium oxyporum)和早疫霉(Alternaria spp.)的抗性[10-11]。β-D-葡聚糖(β-D-glucan)广泛存在于真菌、褐藻、地衣中,具有诱导植物产生抗细菌、抗病毒等活性[12-13]。
寡聚糖不仅能够调控植物生长,还能够诱导植物产生抗性相关活性物质,抑制病害的发生。本研究拟从疫霉中挖掘新的糖链类激发子,分析多糖激发子诱导烟草后,烟草早期信号事件、防卫物质的产生、防御相关酶活性的变化以及抗性相关基因的表达规律,以明确其作用机制,为烟草病毒病的绿色防控开发新的生物药剂。
1 材料与方法
1.1 材料
疫霉菌(Phytophthora sp.)由本实验室保存。烟草悬浮细胞BY2由华中农业大学柳俊教授馈赠。烟草花叶病毒由中国农业科学院烟草研究所馈赠。
DAB显色试剂盒购自博士德生物工程有限公司,反转录试剂盒购自宝生物工程(TaKaRa)有限公司,超敏蛋白为美国伊甸生物技术公司产品。
1.2 实验方法
1.2.1 疫霉多糖激发子的分离纯化 将疫霉接种于土豆培养液中,26 ℃、200r/min培养 24 d后,发酵液离心,收集上清液,加入1/5体积的氯仿振荡、离心,取上清液,加入 4×体积的无水乙醇于-20 ℃沉淀过夜,8000r/min离心5min,真空冷冻干燥获得多糖。
多糖溶于蒸馏水(10mg/mL),上样至DEAE-52纤维素柱层析,依次用蒸馏水0.1、0.5、1mol/L NaCl溶液洗脱。多糖生物活性检测:取上述多糖组分各20 µL(1mg/mL)分别注入叶片,以蒸馏水作对照。2 d后观察过敏反应。选择能诱导烟草产生过敏反应的多糖组分,分别加到 Sephadex G-100柱,以0.01mol/L NaCl为洗脱液,分别收集各主峰,得到均一多糖,再次检测其生物活性,确认获得的多糖激发子命名为Gep1。
1.2.2 多糖激发子 Gep1的单糖组成分析 采用三氟乙酸水解多糖激发子,并用薄层色谱法(TLC)分析其单糖组成[14]。展开剂为乙酸乙酯-吡啶-无水乙醇-水(8:1:1:2,V/V),显色剂为苯胺-二苯胺-磷酸。以葡萄糖、果糖、核糖(10mg/mL)为参照。
1.2.3 Gep1诱导烟草过氧化氢和酚类的产生用0.4mg/mL的Gep1注射烟草叶片,24 h后,采用3,3’-二氨基联苯胺(DAB)组织染色法检测 H2O2的产生[15],蒸馏水注射作对照。
取300 µL烟草细胞,加入0.4mg/mL Gep1,于25 ℃,150r/min处理108 h后,在荧光显微镜(395 nm激发波长)下观察酚类物质的积累。
1.2.4 过氧化物酶(POD)、多酚氧化酶(PPO)、苯丙氨酸解氨酶(PAL)活性测定 用4mg/mL多糖激发子喷雾烟株叶片,以蒸馏水为对照。处理前采样1次,喷雾后第4天开始每天采样1次,共8次。分别测定POD、PPO、PAL酶活性[16]。
1.2.5 Gep1诱导烟草抗性基因的表达 用 4mg/mL激发子Gep1喷雾烟草的下位叶片,在处理后不同时间,采取上位叶片,利用Trizol试剂提取RNA,测定RNA浓度。采用半定量 RT-PCR分析抗性基因的表达,以Actin基因作内参。首先合成cDNA,以cDNA为模板,PCR扩增抗性基因。PCR反应体系为:ddH2O 6.4 μL,2×Taq Mix 10 μL,正、反向引物 各0.8 μL,cDNA 2 μL。扩增条件:94 ℃预变性4min;94 ℃ 30 s,50~55 ℃ 30 s,72 ℃ 40 s,35个循环。PCR产物在1.2%琼脂糖凝胶中检测。
1.2.6 盆栽试验检测Gep1对TMV的防治效果 8叶期云烟87烟苗,分别用2、3、4mg/mL的多糖激发子Gep1喷雾叶片,每浓度处理3次,以蒸馏水和超敏蛋白(1mg/mL)为对照。10 d后摩擦接种TMV。烟苗开始发病时进行第1次病情调查,每隔7天调查,共4次。按下列公式计算病情指数和防治效果:
病情指数= [Σ(各级病株×该病级值)/(调查总株数×最高级值)]×100
防治效果/% = [(对照病情指数-处理病情指数)/对照病情指数]×100%
1.2.7 统计分析方法 不同处理组间的差异显著性分析采用 SPSS Statistics 20软件的单因素ANOVA进行分析。
2 结 果
2.1 多糖激发子Gep1的分离纯化
多糖经DEAE-纤维素层析纯化后,收集到5个组分HD1~5,其中HD2组分能引起烟草叶片的过敏性反应。HD2经Sephadex G-100柱层析纯化,分离得到主要组分Gep1(图1),Gep1能够诱导烟草产生过敏性反应,形成明显的坏死斑。
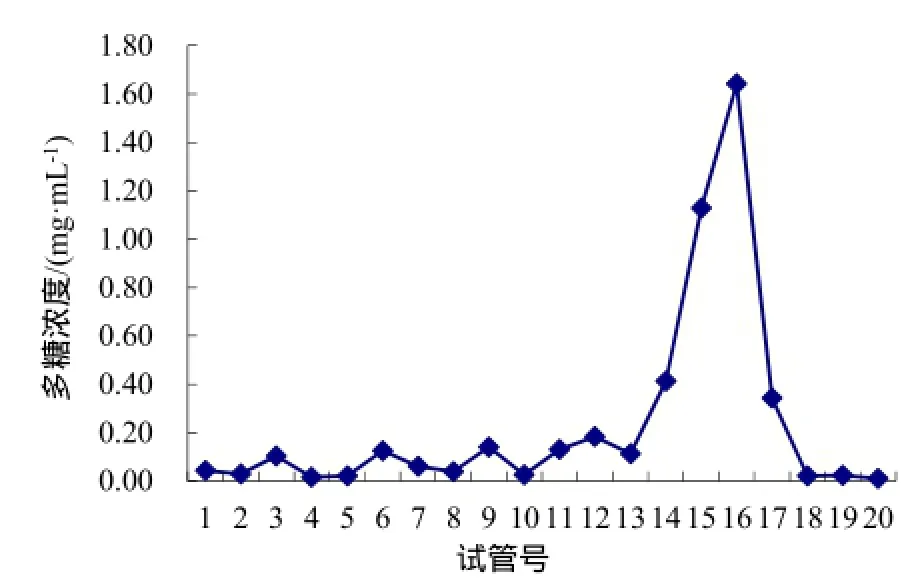
图1 多糖激发子的分离纯化Fig.1 Isolation and purification of polysaccharide elicitors
2.2 Gep1的单糖组分
Gep1的酸水解产物,经薄层层析分离后发现只有一个深蓝色的斑点(图 2),通过与标准单糖的Rf值比对,发现其组成成分中只含有葡萄糖。确定Gep1为由葡萄糖组成的多糖或寡糖。
2.3 Gep1激活过氧化氢在烟草叶片内的沉积
DAB可以与烟草叶片中产生的 H2O2反应,形成红褐色斑点。Gep1激发子处理后,诱导烟草叶片产生H2O2,主要在叶脉和处理部位累积(图3)。
2.4 Gep1诱导酚类的产生
酚类化合物具有抗氧化活性,它的积累有利于提高植物的抗病抗逆性。Gep1处理烟草细胞后,可明显的观察到酚类物质的产生和积累(图4)。
2.5 Gep1诱导烟草防御相关酶的活性
从图5看出,Gep1可诱导烟草防御相关酶的活性提高。Gep1诱导4 d后,POD活性明显高于对照组(P<0.01),7 d后活性最高,为对照组的3倍(P <0.01)。Gep1处理烟草后,PPO活性开始升高,7 d时达到最大值,显著高于对照组(P<0.01)。Gep1处理6 d后,PAL活性开始增加,9 d时活性最高,为对照组的1.6倍(P<0.05)。
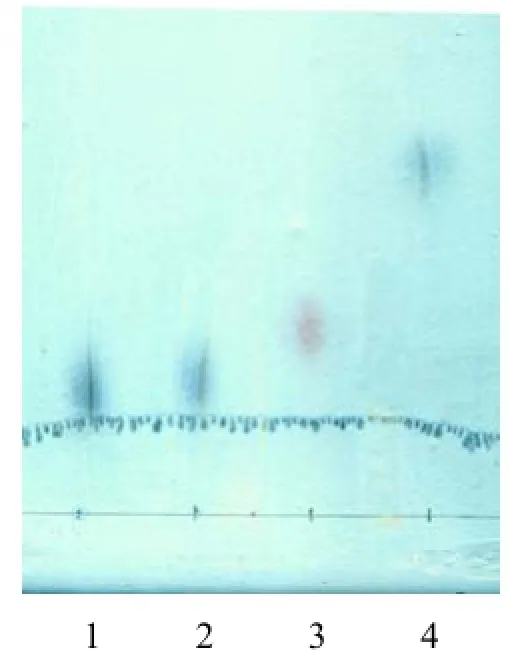
图2 Gep1酸水解产物的薄层层析Fig.2 Analysis of hydrolysates from Gep1 by TLC
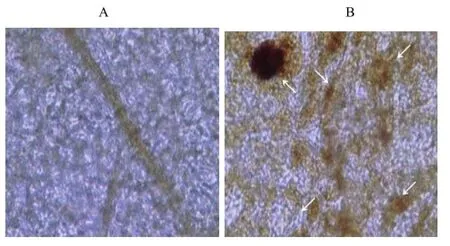
图3 检测烟草体内H2O2的积累.Fig.3 Deposition of H2O2in tobacco leaves
2.6 Gep1诱导烟草抗性相关基因的表达
在Gep1处理后,水杨酸(SA)信号途径的关键调控蛋白基因NPR1和EDS1,及抗性基因PR1-b的转录量开始增加,7 d时转录量均达到最大值。PR1-a的转录在7 d时也达到最大值(图6)。表明,Gep1可诱导烟草产生系统性抗性,并且依赖于SA信号途径。
2.7 Gep1对TMV的防治效果
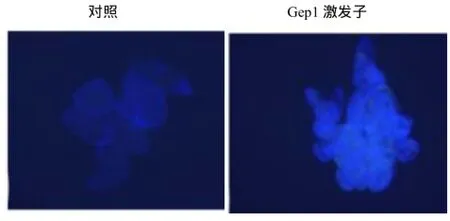
图4 Gep1诱导烟草叶片酚类物质的积累Fig.4 Gep1 induced phenolic substances deposition in tobacco leaves
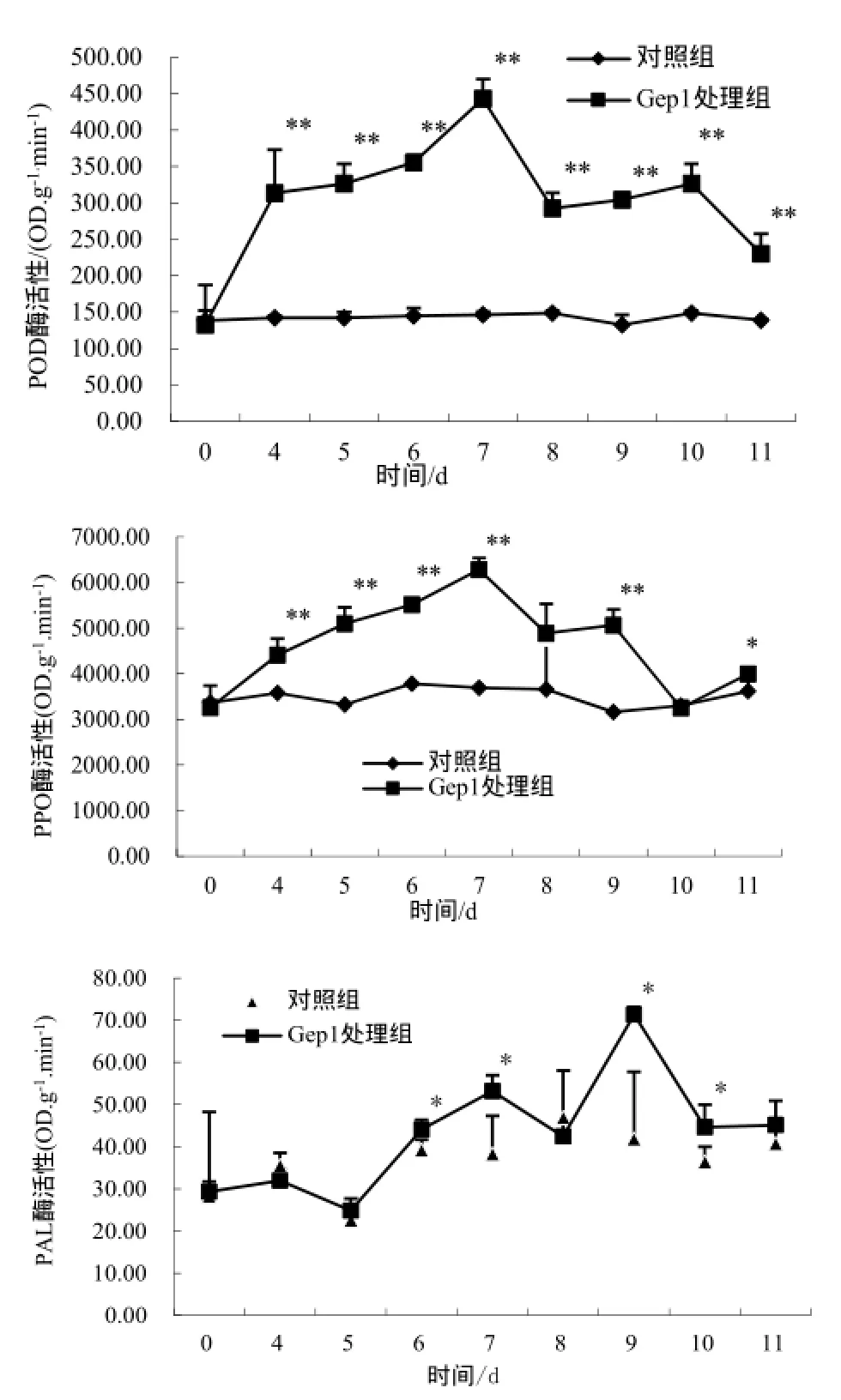
图5 Gep1诱导烟草叶片防御相关酶的活性Fig.5 Gep1 induces increased activities of defense-related enzymes
Gep1处理后的烟草,病毒病显症明显推迟,症状减轻。2mg/mL和3mg/mL Gep1对TMV的防治效果低于4mg/mL Gep1。4mg/mL Gep1处理组的防效在4次统计中依次为100%,96.67%,87.93% 和67.4%,均比超敏蛋白、2和3mg/mL Gep1处理组的防效高(图7)。
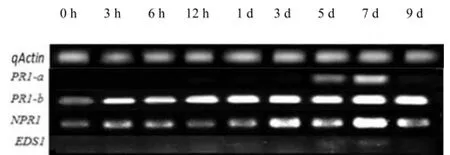
图6 Gep1 诱导水杨酸信号途径相关基因的表达Fig.6 Expression of SA signal pathway genes induced by Gep1
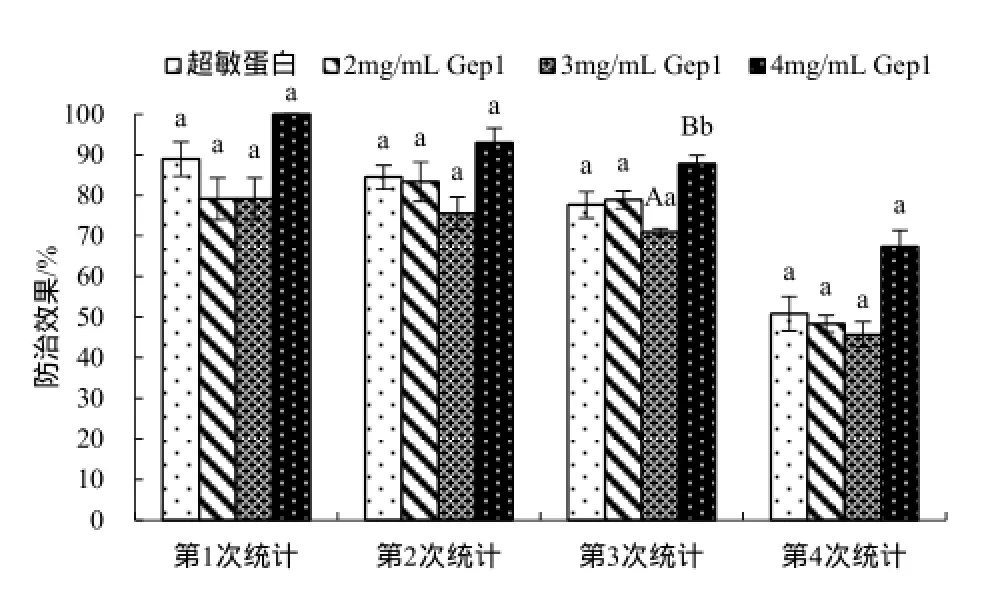
图7 激发子Gep1对TMV的防治效果Fig.7 Control effect of Gep1 elicitor on TMV
3 讨 论
研究发现,寡糖、壳寡糖等功能糖具有激活植物自身免疫、提高植物抗病性的功能。例如,壳寡糖及其衍生物可降低侵染病毒烟草中的叶绿素下降幅度,还可以提高叶片中超氧化物歧化酶、过氧化物酶、过氧化氢酶和苯丙氨酸解氨酶的活性[17]。我们从疫霉菌中分离纯化出一种多糖激发子Gep1。Gep1的酸水解产物,经薄层层析分离后,确定其中只含有葡萄糖,无其他单糖成分。
有报道β-葡寡糖激发子能诱导大豆、甜椒、紫花苜蓿、水稻、拟南芥、烟草、小麦等多种植物产生抗性[18-19]。我们发现葡聚糖激发子 Gep1也能激发烟草防卫反应。Gep1可诱导烟草叶片积累H2O2和酚类,并诱导烟草叶片PAL、PPO和POD等防御酶活性明显提高,有助于寄主植物抵抗病原菌的侵染。
系统获得性抗性(systemic acquired resistance,SAR)指植物的某个局部受到生物或非生物的因子胁迫时产生的信号物质传递到未被侵染的部位或整个植株,进而诱导产生对胁迫因子的抗性。水杨酸(salicylic acid,SA)是SAR的介导信号分子。NPR1蛋白是 SAR信号转导途径中的关键调控因子,能诱导PR1等基因的表达[20]。PR1基因被视为SAR的标记基因。我们研究发现激发子Gep1可诱导烟草产生依赖于SA的系统获得性抗性,从而提高对TMV的抗性。Gep1诱导了烟草叶片NPR1、EDS1、PR1-a和PR1-b等的上调表达,并表现一定的时序性。
目前已报道的多糖抗病毒制剂中,对TMV引起的烟草花叶病防效最好的是氨基壳寡糖,最高可达84.73%[3]。室内盆栽实验表明,多糖激发子Gep1诱导处理后的烟草可显著降低发病程度。4mg/mL 的Gep1对烟草花叶病的防治效果最好,其能有效地抑制TMV在烟草体内的繁殖,显症明显推迟,症状减轻。在4次统计调查中,其防治效果依次为100.00%、93.00%、87.78%、67.39%,优于超敏蛋白和氨基壳寡糖。
综上所述,本研究从疫霉发酵液中分离出葡聚糖激发子Gepb1,对Gep1的理化性质及其诱导烟草抗 TMV的抗病机制进行了研究。但尚需要对Gep1的结构以及Gep1多糖的发酵条件、田间应用技术等进行研究。
参考文献
[1] 陈利锋,徐敬友.农业植物病理学[J].北京:中国农业出版社,2003:232.
[2] 杨德廉,王凤龙,钱玉梅,等.我国烟草病毒病的防治研究策略[J].中国烟草科学,2001,22(1):46-48.
[3] 商文静,赵小明,杜昱光,等.壳寡糖诱导植物抗病毒病研究初报[J].西北农林科技大学学报:自然科学版,2005,33(5):73-75.
[4] 许玉娟,范素素,齐文静,等.苍耳多糖对烟草花叶病毒的抑制作用及对烟草几种防御酶活性的影响[J].山东农业大学学报:自然科学版,2010(4):485-488.
[5] 赵小明,杜昱光,白雪芳.氨基寡糖素诱导作物抗病毒药效试验[J].中国农学通报,2004(4):245-247.
[6] Yin H, Zhao H M, Du Y G.Oligochitosan: A plant diseases vaccine-A review[J].Carbohydr Polym, 2010,82 (1): 1-8.
[7] 尹恒,赵小明,王文霞,等.植物糖生物学与糖链植物疫苗[J].生命科学,2011(6):598-604.
[8] 杜昱光,赵小明,尹恒,等.糖链植物疫苗研究与应用[M].北京:科学出版社,2012:10-11.
[9] Sharp J K,Valent B, Albersheim P.Host-pathogen interaction: purification and partial characterization of a β-glucan fragment that elicits phytoalexin accumulation in soybean[J].Journal of Biological Chemistry, 1984,259(18): 1312-1320.
[10]廖春燕,马国瑞,洪文英.壳聚糖对番茄枯萎病菌的拮抗作用[J].浙江大学学报:农业与生命科学版,2001,27(6):619-623.
[11]廖春燕,马国瑞,洪文英.壳聚糖诱导番茄对早疫病的抗性及其生理机制[J].浙江大学学报:农业与生命科学版,2003,29(3):280-286.
[12]Bohn J A, BeMiller J N.(1→3)-β-D-Glucans as biological response modifiers: a review of structure-functional activity relationships[J].Carbohydrate polymers, 1995,28(1): 3-14.
[13]陈红霞.真菌多糖的活性研究进展[J].生物技术通讯,2005,16(4):460-462.
[14]颜军,郭晓强,李晓光,等.TLC快速分析多糖的单糖组成[J].食品科学,2007,27(12):603-607.
[15]Hano C, Addi M, Fliniaux O, et al.Molecular characterization of cell death induced by a compatible interaction between Fusarium oxysporum f.sp.linii and flax (Linum usitatissimum) cells[J].Plant Physiology and Biochemistry, 2008, 46: 590-600.
[16]徐艳.水稻纹枯病菌毒素的致病机理及对寄主防御酶活性的影响[D].扬州:扬州大学,2006.
[17]孙翠红,徐翠莲,赵铭钦,等.壳寡糖及其衍生物抗烟草花叶病毒机理的初步研究[J].中国烟草科学,2015,36(2):87-92.
[18]Klarzynski O, Plesse B, Joubert J M, et al.Linear β-1, 3 glucans are elicitors of defense responses in tobacco[J].Plant Physiology, 2000, 124(3): 1027-1038.
[19]Renard-Merlier D, Randoux B, Nowak E, et al.Iodus 40,salicylic acid, heptanoyl salicylic acid and trehalose exhibit different efficacies and defence targets during a wheat/powdery mildew interaction[J].Phytochemistry,2007, 68(8): 1156-1164.
[20]贺晓庆.NPK1和NPR1基因的克隆及其转化辣椒的研究[D].咸阳:西北农林科技大学,2007.
Study of Glucan Elicitor Gep1 from Phytophthora Which Induces Resistance in Tobacco to Tobacco Mosaic Virus
HUO Rui1, XUE Shoucong1, REN Jiaqing1, XU Rubing2, LI Xihong2, ZHAO Xiuyun1*
(1.College of Life Science and Technology, Huazhong Agricultural University, Wuhan 430070, China; 2.Tobacco Research Institute of Hubei Province, Wuhan 430030, China)
Abstract:Tobacco mosaic virus is an important disease and causes damage on tobacco.Elicitors can induce tobacco systemic resistance against TMV.In this study, a glucan elicitor Gep1 was isolated and purified from the culture filtrate of Phytophthora sp.through the procedures of ethanol precipitation, DEAE-52 and SephadexG-100 column chromatography.Gep1 triggered tobacco defense responses.After induced by Gep1, H2O2and phenolics accumulated more and activities of peroxides, polypheol oxidase and phenylalanine ammonia lyase all increased in tobacco leaves.Gep1 could induce tobacco resistance against TMV.In pot experiment,control efficiency of 4mg/mL Gep1 was 67.4%.Gep1 could effectively reduce the incidence and delay the onset time.Semi-quantitative RT-PCR data revealed that expression of the resistance-related genes in tobacco was up-regulated after Gep1 treatment.The results suggested that Gep1 could trigger defense reactions, induce systemic resistance and improve resistance of tobacco against TMV.
Keywords:tobacco mosaic virus; Phytophthora sp.; glucan elicitor; defense response
中图分类号:S435.72
文章编号:1007-5119(2016)02-0001-05
DOI:10.13496/j.issn.1007-5119.2016.02.001
基金项目:湖北省烟草公司科技项目“烟草主要病毒病快速检测及防控新技术研究集成与示范”(027Y2013-006)
作者简介:霍 瑞,女,硕士,研究方向为生物防治。E-mail:176545420@qq.com。*通信作者,E-mail:xiuyunzh@mail.hzau.edu.cn
收稿日期:2015-09-27 修回日期:2016-03-15
