9311与日本晴间一个杂种不育基因的鉴定与定位
2016-07-14张宏根张丽佳孙一标刘巧泉汤述翥顾铭洪扬州大学江苏省作物遗传生理国家重点实验室培育点粮食作物现代产业技术协同创新中心教育部植物功能基因组学重点实验室江苏扬州225009
张宏根张丽佳孙一标 司 华 刘巧泉 汤述翥顾铭洪扬州大学江苏省作物遗传生理国家重点实验室培育点 / 粮食作物现代产业技术协同创新中心 / 教育部植物功能基因组学重点实验室,江苏扬州225009
9311与日本晴间一个杂种不育基因的鉴定与定位
张宏根**张丽佳**孙一标 司 华 刘巧泉 汤述翥*顾铭洪
扬州大学江苏省作物遗传生理国家重点实验室培育点 / 粮食作物现代产业技术协同创新中心 / 教育部植物功能基因组学重点实验室,江苏扬州225009
摘 要:以克服亚种间杂种不育来充分发掘亚种间杂种优势是提高水稻单产的一条有效途径。本研究从一套以日本晴为背景、9311为供体的染色体片段代换系中鉴定出一个系T9424,其与日本晴配置的F1植株小穗与花粉育性较双亲显著降低,双亲间存在不亲和。重测序结果表明T9424在第1、第4和第5染色体上导入9311片段。日本晴/T9424 F2群体内单株基因型及育性鉴定结果表明,T9424与日本晴间杂种不育基因位于第5染色体上。利用F2群体内790株单株将该杂种不育基因定位于第5染色体分子标记PSM8与A14之间110 kb的物理区段内。对日本晴/T9424 F1植株花粉与胚囊育性鉴定结果表明该杂种不育基因同时控制雌、雄配子败育,将该基因暂命名为S39(t)。相关结果有助于加深对水稻亚种间杂种不育现象的认识,为该基因克隆及其育种利用奠定基础。
关键词:水稻;杂种不育基因;基因定位
本研究由国家重点基础研究发展计划项目(2011CB100101)和江苏高校优势学科建设工程项目资助。
This study was supported by the Key Project of Chinese National Programs for Fundamental Research and Development (2011CB100101)and the Project Funded by the Priority Academic Program Development of Jiangsu Higher Education Institutions.
第一作者联系方式∶ 张宏根,E-mail∶ zhg@yzu.edu.cn ;张丽佳,E-mail∶ 1255012022@qq.com
URL∶ http∶//www.cnki.net/kcms/detail/11.1809.S.20160322.1600.002.html
水稻籼粳亚种间杂交较品种间杂交具有更强的杂种优势,利用籼粳亚种间杂种优势打破限制水稻产量大幅提升的瓶颈,成为育种研究者的共识。但是籼粳亚种间遗传距离远,遗传背景差异大,亚种间存在生殖隔离。根据发生时间可将其分为合子形成前的生殖隔离和合子形成后的生殖隔离,前者包括物理隔离(来自地理、生态、形态等因素)、物种间的生殖隔离、不同物种间的配子不兼容、精子没有适合的酶穿透卵膜等导致不能形成合子的生殖隔离;后者又称为杂交障碍,包括配子型、合子型、胚或胚囊、杂种无活、杂种不育和杂种衰败[1-2]。造成水稻杂种不育的原因很多,包括雄配子败育,雌配子败育,雌、雄配子同时败育以及其他细胞学原因,例如花药开裂障碍、雌雄异熟、环境条件等因素对F1小穗育性的影响[3-7]。
目前,对籼粳杂种不育遗传机理有细胞质效应[8]、染色体结构差异[9]和基因控制理论[10]3种解释,其中基因控制理论受到国内外学者普遍支持,并定位与克隆了许多杂种不育基因,包括 S5[11]、S7[12]、S8[13]、S15[14]、S16[15]、S17[16]、S29[17]、S30[18]、S31[19]、S32[20]及S35[21]等雌配子败育基因,Sb、Sc、Sd、Se、Sf[22-24]、S20[25]、S24[26]、S36[27]等已鉴定或定位的和Sa[28]、S27[29]、S28[29]、DPL1[30]、DPL2[30]等5个已成功克隆的雄配子败育基因,以及S1[31-32]、S10[33]和S6[34]等控制雌、雄配子同时败育的基因。
日本晴作为一个典型的日本粳稻品种,被广泛用于水稻分子科学研究。9311 (扬稻6号)是由江苏省里下河地区农业科学研究所培育的中籼品种,具强大的生物学优势、理想的株型、优异的抗逆性、与不育系配组的高配合力,常被用于水稻育种和分子科学研究。为挖掘9311中控制产量、品质等性状的优良等位基因,本实验室构建了一套以日本晴为背景,9311为供体的染色体片段代换系,目前利用该套染色体片段代换系已就控制产量、品质等性状的基因开展了广泛研究[35]。在该套染色体片段代换系中,有一系(编号为T9424)与日本晴及部分代换系配置的 F1小穗育性在多年鉴定中均表现为部分可育,这说明 T9424与日本晴间存在不亲和,初步推测是由9311与日本晴间杂种不育基因控制。
本研究以代换系T9424重测序来明确其背景中导入的9311片段,在此基础上利用T9424与日本晴配置 F2群体对杂种不育基因精细定位,同时通过对T9424与日本晴F1花粉和胚囊的细胞学观察确定该杂种不育基因的作用方式,相关结果为该基因克隆及育种利用研究打下基础。
1 材料与方法
1.1 供试材料
2012年冬季在海南种植T9424与日本晴,配置日本晴/T9424 F1组合;2013年正季在扬州种植T9424、日本晴及配置的F1(分成两份,一份种植,一份保留到次年种植),成熟时收获日本晴/T9424组合的F2种子;2014年正季在扬州种植日本晴/T9424 F1及F2群体、BT型日本晴A及C418,以BT型日本晴A为母本,配置BT型日本晴A//日本晴/T9424三交群体,同时分别以BT型日本晴A、日本晴/T9424 F1为母本,人工剪颖后以C418为父本饱和授粉;2014年冬季在扬州温室种植日本晴A//日本晴/T9424三交群体。
1.2 育性鉴定
每日早晨 7∶00—9∶00,从田间每个始花植株上选取一个已抽出约 1/3的主穗或较大分蘖穗。选取每个穗子中上部枝梗3朵当天要开放的颖花,用1% I2-KI液染色、压片,在低倍显微镜下观察花粉育性。根据花粉粒的形状和对I2-KI液的染色反应,将花粉划分为典败、圆败、染败和正常 4种类型。选择分布均匀、花粉数目超过 100粒的视野,分别记录 4类花粉的数目,并计算4类花粉的百分率。
抽穗期间,每日上午 7∶00—9∶00,选取尚未开花的小穗套袋,每袋2穗,20 d后,剔除折断或自交袋破损的穗子,同时选择单株中较大的两穗考查自然小穗育性,调查单株的套袋小穗育性与自然小穗育性。对亲本及F1群体各考查5株。采用子房整体透明法观察水稻胚囊[36]以鉴定F1雌配子育性。
1.3 DNA提取与分子标记分析
采用 CTAB法[37]提取水稻基因组 DNA。普通PCR体系含模板DNA 1.0 μL、10×PCR的缓冲液2.0 μL、25 mmol L-1的MgCl22.0 μL、2 mmol L-1的dNTP 2.0 μL、0.3 μmol L-1的引物2.0 μL、Taq酶0.5 U,加ddH2O补足20 μL。PCR扩增条件为95℃预变性5 min,94℃变性40 s,55℃退火40 s (温度因引物不同而异),72℃延伸40 s (不同长度的预期产物按1 kb min-1调整延伸时间),扩增32个循环;72℃延伸10 min,18℃保温。PCR产物经3%琼脂糖凝胶电泳,溴化乙锭染色后在UVP Bioimaging-Systems凝胶成像仪上成像。根据分子标记检测的结果,具有日本晴带型的个体赋值1,具有9311带型的个体赋值3,具有双亲带型(杂合带)的个体赋值2。
SSR引物的信息来自Gramene网站(http∶//www. gramene.org/)。DNA聚合酶、普通PCR试剂购自上海生工生物工程技术服务有限公司,引物由上海生工生物工程技术服务有限公司和上海捷瑞生物工程有限公司合成。
1.4 染色体片段代换系重测序
由深圳华大基因科技服务有限公司完成。
1.5 统计方法与数据分析
利用 SPSS 19.0完成数据多重比较。利用Mapmaker 3.0作图软件进行基因位点与标记间连锁分析,并用 Kosambi函数将重组率转化为遗传距离(cM)。在Microsoft Excel 2013中处理其他数据。
2 结果与分析
2.1 亲本及日本晴/T9424 F1的农艺性状及育性鉴定
2014年正季,分别调查代换系 T9424、日本晴及日本晴/T9424 F1植株抽穗期、株高、花粉育性和自然小穗育性。

表1 双亲及F1抽穗期、株高、花粉育性与小穗育性Table 1 Heading stage,plant height,pollen and spikelet fertility of the parents and F1
由表1可知,日本晴、T9424和日本晴/T9424 F1抽穗期相同,但双亲与 F1株高、花粉育性和自然小穗育性均有显著差异,日本晴/T9424 F1的花粉育性和自然小穗育性较双亲显著降低,败育花粉以圆败为主(图1)。
2.2 代换系T9424的重测序
T9424为日本晴背景代换系,为明确该代换系中导入的 9311片段,2013年冬季,温室发苗提取DNA后交由深圳华大基因科技服务有限公司重测序,结果如图2所示。
重测序结果表明,代换系 T9424在日本晴核背景中共导入 3个 9311片段,分别位于第 1染色体35 532 181 ~ 40 686 256 bp、第4染色体557 914 ~ 3 601 565 bp和第5染色体1 ~ 5 791 607 bp之间。根据Gramene (http∶//www.gramene.org/)网站提供的SSR序列信息及本实验室已有的分子标记信息,在第1、第4和第5染色体相应区段内分别合成35、3 和15对标记,获得15、2和3对9311与日本晴间具有多态的标记。选用第 1染色体上的标记RM1361、第4染色体上的标记STS4-7.1和第5染色体上的标记RM1200对9311、日本晴和T9424进行检测,结果显示这3个标记在T9424的扩增条带与9311一致,标记检测结果与重测序结果相吻合。由于代换系T9424在第1染色体上导入片段中包含sd1基因,代换系 T9424株高显著降低,日本晴/ T9424 F1株高则表现为双亲中间型(图1-A)。

图1 双亲及F1的植株和花粉Fig. 1 Plant and pollen grains phenotype of the parents and F1
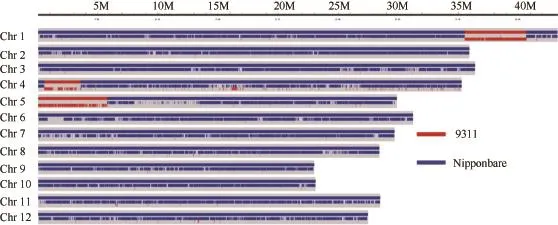
图2 T9424的全基因组重测序Fig. 2 Whole genome re-sequencing of T9424
2.3 9311与日本晴间杂种不育基因的初步定位
2014年正季,在扬州种植日本晴/T9424 F2群体790株。利用RM1361、STS4-7.1和RM1200三对标记对该群体内单株进行检测,结果如表2所示。

表2 目标标记在日本晴/T9424 F2群体中分离情况Table 2 Segregation of the target markers in Nipponbare/T9424 F2Population
由表 2可知,群体内单株在标记 RM1361及RM1200处基因型均偏离 1∶2∶1的分离比(χ2= 31.92,111.11 > χ20.05,2= 5.99),在STS4-7.1处的基因型符合1∶2∶1的分离比(χ2= 4.02 < χ20.05,2= 5.99)。根据检测结果,初步推测该杂种不育基因可能位于第1和第5染色体上。
从理论上讲,日本晴/T9424 F2群体内单株在标记RM1361、STS4-7.1及RM1200处应包含27种基因型。本研究中,在日本晴/T9424 F2群体内790株植株中共检测出 26种,相同基因型单株最少 6株,最多98株。计算相同基因型单株的平均自然小穗育性,以RM1361、STS4-7.1及RM1200标记处基因型分别统计,26种基因型植株自然小穗育性与RM1361、STS4-7.1及RM1200位点上基因型的关系如图3所示。
由图3可见,在标记 RM1361和 STS4-7.1处,植株基因型与小穗育性间没有规律(图3-A,B);在标记RM1200处,当植株为纯合基因型时,自然小穗育性表现正常,与亲本日本晴、T9424相当,当植株为杂合基因型时,其自然小穗育性与日本晴/T9424 F1植株育性相仿(60%左右),较基因型纯合单株育性明显偏低(图3-C),据此初步将该杂种不育基因定位于第5染色体,与标记RM1200连锁。已有研究表明,在此定位区段内,报道过多个杂种不育基因,包括李文涛等[38]定位的S-b,Takahiko等[39]定位的S24,Wang等[40]定位的f5-Du,Zhao等[19]定位的雌配子败育基因S31。与这些基因不同的是,本研究杂种不育基因能够同时影响花粉育性与小穗育性,因此将该杂种不育基因暂命名为S39(t)。
2.4 S39(t)的精细定位
在标记 RM1200所在的染色体区段上,结合Gramene网站上(http∶//www.gramene.org/)提供的SSR序列信息合成17对SSR标记、5对S-b基因的定位标记[38]及根据9311、日本晴之间序列差异设计的9对STS标记,在T9424与日本晴间进行多态性分析,其中 3对 S-b基因定位标记 PSM8、A14、PSM202和2对STS标记STS5-3、X7等5对标记有多态。STS5-3引物序列为F∶ 5′-TTGGACAGAGGG AGTAGA-3′,R∶ 5′-TCAGAAATGCAGAACAATA-3′;X7引物序列为F∶ 5′-CAAGTCTCGTATCAAACAG C-3′,R∶ 5′-ATTACTTGGTTGGTTGAAAA-3′。
选取标记X7对日本晴/T9424 F2群体790株单株进行检测,结果表明在标记X7与RM1200之间发生交换的单株有91株,根据交换株的自然小穗育性与基因型,将S39(t)初步定位在X7与RM1200之间,其中标记RM1200、X7处的交换株数分别为29株和62株。进一步利用PSM8、STS5-3、A14、PSM202等多态性标记对上述91株交换株进行检测,PSM8、STS5-3、A14、PSM202检测到交换株株数分别为3、0、2、11,由此将 S39(t)定位在标记 PSM8与 A14之间,STS5-3与该基因共分离,标记PSM8与A14间物理距离为110 kb (图4)。
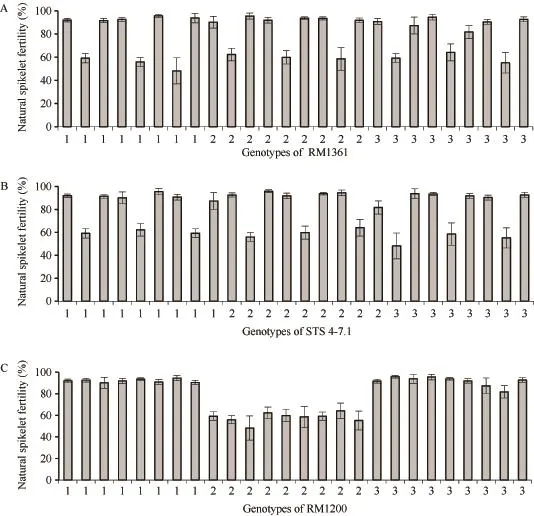
图3 不同基因型与小穗育性分布图Fig. 3 Distribution of different genotypes and spikelet fertility

图4 S39(t)基因的精细定位Fig. 4 Fine-mapping of the gene S39(t)
2.5 S39(t)作用方式分析
2012—2014年间,观察日本晴/T9424 F1发现,其花粉育性超过 50%,小穗育性只有 60%左右,推测其胚囊败育。为了验证该推测,一是2014年正季,以粳稻恢复系C418为父本、日本晴/T9424 F1和BT型日本晴A分别为母本配制组合,人工剪颖后(每个组合10个穗子),采用饱和授粉,9月底收取稻穗统计其结实率,其中日本晴/T9424 F1植株结实率为40.17%±19.79%,BT型日本晴 A 植株结实率为85.34%±6.98%;二是2014年正季,以子房整体透明法观察20个亲本胚囊及72个日本晴/T9424 F1的胚囊,其中亲本20个胚囊均正常(图5-A),日本晴/T9424 F1植株有28个败育胚囊(图5-B),胚囊育性61.11%,与其自然小穗育性相当。以上结果表明日本晴/T9424 F1植株雌配子部分败育。

图5 T9424及日本晴/T9424 F1胚囊Fig. 5 Embryo-sac of T9424 and F1
为明确日本晴/T9424 F1植株败育雄配子的基因型,2014年正季,以日本晴/T9424 F1为父本、BT型日本晴A为母本配置群体。10月底收杂交种,实验室发苗得到植株 96株,用共分离标记STS5-3检测植株基因型,结果显示其中24株单株为日本晴基因型,72株单株为杂合基因型,2种基因型植株数不符合1∶1的分离比(χ2= 48 > χ20.05,1= 3.84),带有日本晴基因型的植株明显偏少,表明日本晴/T9424 F1植株中带有日本晴基因型的花粉部分败育。
3 讨论
杂交水稻的兴起与发展极大提高了水稻单产,水稻亚种间杂交较品种间杂交表现出更为强大的杂种优势,但亚种间杂种不育限制了水稻亚种间杂种优势的利用,克服亚种间杂种不育来充分发掘亚种间杂种优势成为提高水稻单产的一条有效途径。已有的研究表明,水稻杂种不育主要是由核内杂种不育基因造成的。20世纪80年代发现广亲和基因S5n[41],为亚种间杂种优势的利用提供了可能,但是大量的育种实践表明 S5n不能克服所有杂种不育。因此,加强水稻杂种不育基因的挖掘及机制研究,可以为水稻的育种改良提供理论基础,同时也有利于加深对生殖隔离现象的认识。本研究中,在一套以日本晴为背景,9311为供体的染色体片段代换系中鉴定出一个系 T9424,其与受体亲本日本晴间存在不亲和,是研究日本晴与9311亚种间杂种不育的理想材料。
水稻育性是一个复杂的性状,易受环境影响,因此在水稻育性研究中,表型鉴定成为科研工作者首先面对的难题。采用 F2、三交群体、回交群体等初级群体时,群体内植株育性表现呈连续分布,不育株与可育株鉴定存在一定困难。染色体片段代换系是通过多代回交将供体亲本的少部分染色体片段导入受体中构建而成,其与受体亲本杂交衍生的后代遗传背景基本一致,有利于性状准确鉴定,是QTL精细定位与克隆的理想材料[42]。本研究中,代换系T9424在日本晴核背景中仅第1、第4、第5染色体上有少部分染色体片段被9311替换,在日本晴/T9424 F2群体中,植株抽穗期等表型一致,育性分离明显,表型鉴定准确,有利于杂种不育基因的遗传分析与基因定位。
杂种不育基因的败育机制主要分为重复隐性基因配子体致死模式和单基因座孢子体—配子体互作模式两种。前者又叫做双基因座模式,认为非等位基因的互作导致水稻雌、雄配子在减数分裂后期携带致死基因的配子体败育。后者最早由Kitamura[43]提出,他认为在籼粳亚种间杂交 F1出现的配子体不育是由一对等位基因互作导致的。根据日本晴/T9424 F2群体单株育性与基因型鉴定结果,明确了日本晴与 T9424间不亲和由单个基因控制,该基因位于第 5染色体上,符合单基因座孢子体—配子体互作模式。利用该 F2群体将基因定位到分子标记PSM8与A14之间110 kb的物理区段内。在该定位区段内,已报道了S-b[38]、S24[39]、f5-Du[40]3个杂种花粉不育基因及雌配子败育基因 S31[19],但相关基因未被克隆。根据基因定位结果,推测这3个杂种花粉不育基因可能为同一基因。本研究中发现的杂种不育基因能够同时影响雌、雄配子的育性,与上述该定位区段内杂种不育基因的表现均不相同,因此将该杂种不育基因暂命名为S39(t)。S39(t)可能是一个新的杂种不育基因,不同水稻材料在 S39(t)位点上具有不同复等位基因,不同复等位基因互作效应不同,如引起雌配子败育的S31,引起雄配子败育的Sb;也可能是9311在S39(t)定位区段内同时存在紧密连锁的雌配子杂种不育基因 S31和雄配子杂种不育基因 Sb,从而使得杂种雌、雄配子同时败育,相关问题有待进一步研究探明。
4 结论
从一套以日本晴为背景,9311为供体的染色体片段代换系中鉴定出一个系 T9424,其与日本晴配置的 F1植株小穗与花粉育性较双亲显著降低,双亲间存在不亲和,受1对杂种不育基因S39(t)控制。利用日本晴/T9424 F2群体内790株单株将S39(t)定位于第5染色体分子标记PSM8与A14之间110 kb的物理区段内,该杂种不育基因同时控制雌、雄配子败育,带有日本晴基因型的雄配子部分败育。
References
[1] Sano Y. Sterility barriers between Oryza sativa and O. glaberrima. In∶ International Rice Research Institute,eds. Rice Genetics. Manila∶ International Rice Research Institute,1986. pp 109-118
[2] Orr H A,Presgraves D C. Speciation by postzygotic isolation∶forces,genes and molecules. Bioessays,2000,22∶ 1085-1094
[3] 何光华,郑家奎,阴国大,杨正林. 水稻亚种间杂种配子育性的研究. 中国水稻科学,1994,8∶ 177-180 He G H,Zheng J K,Yin G D,Yang Z L. Game fertility of F1between indica and japonica. Chin J Rice Sci,1994,8∶ 177-180 (in Chinese with English abstract)
[4] 王才林,张兆兰,汤述翥,施建达. 三系法籼粳亚种间杂种优势利用研究∶ I. 籼粳交不育与细胞质雄性不育的区别及其检测. 江苏农业学报,1992,8(3)∶ 1-7 Wang C L,Zhang Z L,Tang S Z,Shi J D. Exploitation of heterosis between indica and japonica by three-line method I differentiation between indica-japonica sterility and cytoplasmic male sterility. Jiangsu J Agric Sci,1992,8(3)∶ 1-7 (in Chinese with English abstract)
[5] Sano Y,Sano R. Variation of the intergenic spacer region of ribosomal DNA in cultivated and wild rice species. Genome,1990,33∶209-218
[6] Maekawa M,Inuaki T,Shinbashi N. Spikelet sterility in F1hybrids between rice varieties Silewah and Hayakogane. Ikushugaku Zasshi,1991,41∶ 359-363
[7] 马生健,刘耀光,刘金祥. 水稻的杂种不育研究进展. 植物遗传资源学报,2014,15∶ 1080-1088 Ma S J,Liu Y G,Liu J X. Research progress of hybrid sterility of rice. J Plant Genet Resour,2014,15∶ 1080-1088 (in Chinese with English abstract)
[8] 陆驹飞,严长杰,汤述翥,朱立煌,顾铭洪. 云南水稻品种花糯广亲和性的遗传分析. 扬州大学学报(自然科学版),1998,1(4)∶ 31-35 Lu J F,Yan C J,Tang S Z,Zhu L H,Gu M H. Genetic analysis of the wide compatiblity of rice variety Huanuo from Yunnan province. J Yangzhou Univ (Nat Sci),1998,1(4)∶ 31-35 (in Chinese with English abstract)
[9] Yao S Y,Henderson M T,Jodon N E. Cryptic structural hybridity as a probable cause of sterility in inter-varietal hybrids of cultivated rice,Oryza sativa L. Cytologia,1958,23∶ 46-55
[10] Oka H. Analysis of genes controlling F1sterility in rice by the use of isogenic lines. Genetics,1974,77∶ 521-534
[11] Chen J J,Ding J H,Ou-Yang Y D,Du H Y,Yang J Y,Cheng K. A triallelic system of S5 is a major regulator of the reproductive barrier and compatibility of indica-japonica hybrids in rice. Proc Natl Acad Sci USA,2008,105∶ 11436-11441
[12] 田华. 水稻籼粳亚种间杂种胚囊不育基因S7的精细定位及细胞学研究. 南京农业大学硕士学位论文,江苏南京,2009 Tian H. Cytological Studies and Gene Mapping of Intersubspecies Hybrid Embryo Sac Sterility Gene S7 of Rice (Oryza sativa L.). MS Thesis of Nanjing Agricultural University,Nanjing,China,2009 (in Chinese with English abstract)
[13] Singh S P,Sundaram R M,Biradar S K,Ahmed M L,Viraktamath B C,Siddiq E A. Identification of simple sequence repeat markers for utilizing wide-compatibility genes in inter-subspecific hybrids in rice (Oryza sativa L.). Theor Appl Genet,2006,113∶509-517
[14] Wan J,Yamaguchi Y,Kato H,Ikehashi H. Two new loci for hybrid sterility in cultivated rice (Oryza sativa L.). Theor Appl Genet,1996,92∶ 183-190
[15] Wan J,Ikehashi H. Identification of anew locus S16 causing hybrid sterility in native rice varieties (Oryza sativa L.) from Taihu Lake region and Yunnan province,China. Breed Sci,1995,45∶461-470
[16] Wan J M,Ikehashi H,Sakai M,Horisue H,Imbe T. Mapping of hybrid sterility gene S17 of rice (Oryza sativa L.) by isozyme and RFLP markers. Rice Genet Newsl,1998,15∶ 151-154
[17] Zhu S,Wang C,Zheng T,Zhao Z,Ikehashi H,Wan J. A new gene located on chromosome 2 causing hybrid sterility in a remote cross of rice. Plant Breed,2005,124∶ 440-445
[18] Zhu S S,Jiang L,Wang C M,Zhai H Q,Li D T,Wan J M. The origin of weedy rice Ludao in China deduced by genome wide analysis of its hybrid sterility genes. Breed Sci,2005,55∶409-414
[19] Zhao Z G,Jiang L,Zhang W W,Yu C Y,Zhu S S,Xie K,Tian H,Liu L L,Ikehashi H,Wan J M. Fine mapping of S31,a gene responsible for hybrid embryo-sac abortion in rice (Oryza sativa L.). Planta,2007,226∶ 1087-1096
[20] Li D T,Chen L M,Ling J,Zhu S S,Zhao Z G,Liu S J,Su N,Zhai H Q,Ikehashi H,Wan J M. Fine mapping of S32(t),a new gene causing hybrid embryo sac sterility in a Chinese landrace rice (Oryza sativa L.). Theor Appl Genet,2007,114∶ 515-524
[21] Chen M,Zhao Z,Jiang L,Wan J. A new gene controlling hybrid sterility in rice (Oryza sativa L.). Euphytica,2012,184∶ 15-22
[22] 张桂权,卢永根. 栽培稻(Oryza sativa)杂种不育性的遗传研究∶I. 等基因 F1不育系杂种不育性的双列分析. 中国水稻科学,1989,3∶ 97-101 Zhang G Q,Lu Y G. Genetic studies on the hybrid sterility in cultivated rice (Oryza sativa)∶ I. Diallel analysis of the hybrid sterility among isogenic F1sterile lines. Chin J Rice Sci,1989,3∶97-101 (in Chinese with English abstract)
[23] 张桂权,卢永根. 栽培稻杂种不育性的遗传研究∶ II. F1花粉不育性的基因模式. 遗传学报,1993,20∶ 541-551 Zhang G Q,Lu Y G. Genetic studies on the hybrid sterility in cultivated rice (Oryza sativa)∶ II. A genic model for F1pollen sterility. Acta Genet Sin,1993,20∶ 222-228 (in Chinese with English abstract)
[24] 张桂权,卢永根,张华,杨进昌,刘桂富. 栽培稻(Oryza sativa)杂种不育性的遗传研究∶ IV. F1花粉不育性的基因型遗传. 遗传学报,1994,21∶ 34-41 Zhang G Q,Lu Y G,Zhang H,Yang J C,Liu G F. Genetic studies on the hybrid sterility in cultivated rice (Oryza sativa)∶ IV. Genotypes for F1pollen sterility. Acta Genet Sin,1994,21∶ 34-41 (in Chinese with English abstract)
[25] 夏继星. 水稻矮化突变体的分子遗传学分析和杂种不育基因S20的图位克隆. 华南农业大学博士学位论文,广东广州,2008 Xia J X. Genetic Analysis of a Rice Dwarf Mutant Z110-6 and Molecular Cloning of S20 for Hybrid Male Sterility in Rice. PhD Dissertation of South China Agricultural University,Guangzhou,China,2008 (in Chinese with English abstract)
[26] Takahiko K,Atsushi Y,Nori K. Hybrid male sterility in rice is due to epistatic interactions with a pollen killer locus. Genetics,2011,189∶ 1083-1092
[27] Win K T,Kubo T,Miyazaki Y,Doi K,Yamagata Y,Yoshimura A. Identification of two loci causing F1pollen sterility in interand intraspecific crosses of rice. Breed Sci,2009,59∶ 411-418
[28] Long Y M,Zhao L F,Niu B X,Su J,Wu H,Chen Y L,Zhang Q Y,Guo J X,Zhuang C X,Mei M T,Xia J X,Wang L,Wu H B,Liu Y G. Hybrid male sterility in rice controlled by interaction between divergent alleles of two adjacent genes. Proc Natl Acad Sci USA,2008,105∶ 18871-18876
[29] Yamagata Y,Yamamoto E,Aya K,Win K T,Doi K,Sobrizal,Ito T,Kanamori H,Wu J Z,Matsumoto T,Matsuoka M,Ashikari M,Yoshimura A. Mitochondrial gene in the nuclear genome induces reproductive barrier in rice. Proc Natl Acad Sci USA,2010,107∶1494-1499
[30] Mizuta Y,Harushima Y,Kurata N. Rice pollen hybrid incompatibility caused by reciprocal gene loss of duplicated genes. Proc Natl Acad Sci USA,2010,107∶ 20417-20422
[31] Sano Y,Sano R. Variation of the intergenic spacer region of ribosomal DNA in cultivated and wild rice species. Genome,1990,33∶209-218
[32] Koide Y,Onishi K,Nishimoto D,Baruah A R,Kanazawa A,Sano Y. Sex-independent transmission ratio distortion system responsible for reproductive barriers between Asian and African rice species. New Phytol,2008,179∶ 888-900
[33] Sano Y,Sano R,Eiguchi M,Hirano H Y. Gamete eliminator adjacent to the wx locus as recealed by pollen analysis in rice. J Hered,1994,85∶ 310-312
[34] Sano Y. Genetic comparisons of chromosome 6 between wild and cultivated rice. Jpn J Breed,1992,42∶ 561-572
[35] Zhang C Q,Hu B,Zhu K Z,Zhang H,Leng Y L,Tang S Z,Gu M H,Liu Q Q. QTL mapping for rice RVA properties using high-throughput re-sequenced chromosome segment substitution lines. Rice Sci,2013,20∶ 407-414
[36] 赵世绪,杜中,凌祖铭. 用子房整体透明法和微分干涉差显微镜研究水稻的胚胎发育. 遗传,1993,15∶ 33-33 Zhao S X,Du Z,Ling Z M. The use of a whole clearing technique and differential interference contrast microscope for study on embryology of rice. Hereditas (Beijing),1993,15∶ 33-33 (in Chinese)
[37] Murray M G,Thompson W F. Rapid isolation of high molecular weight plant DNA. Nucl Acid Res,1980,8∶ 4321-4325
[38] 李文涛,曾瑞珍,张泽民,丁效华,张桂权. 水稻 F1花粉不育基因座S-b的精细定位. 科学通报,2006,51∶ 404-408 Li W T,Zeng R Z,Zhang Z M,Ding X H,Zhang G Q. Fine mapping of F1pollen sterility loci S-b in rice. Chin Sci Bull,2006,51∶404-408 (in Chinese)
[39] Kubo T,Yoshimura A,Kurata N. Hybrid male sterility in rice is due to epistatic interactions with a pollen killer locus. Genetics,2011,18∶ 1083-1092
[40] Wang G W,He Y Q,Xu C G,Zhang Q. Fine mapping of f5-Du,a gene conferring wide-compatibility for pollen fertility in intersubspecific hybrids of rice (Oryza sativa L.). Theor Appl Genet,2006,112∶ 382-387
[41] Ikehashi H,Araki H. Varietal screening of compatibility types revealed in F1fertility of distant crosses in rice. Ikushugaku Zasshi,1984,34∶ 304-313
[42] Zhang H,Zhao Q,Sun Z Z,Zhang C Q,Feng Q,Tang S Z,Liang G H,Gu M H,Han B,Liu Q Q. Development and highthroughput genotyping of substitution lines carrying the chromosome segments of indica 9311 in the background of japonica Nipponbare. J Genet Genomics,2011,38∶ 603-611
[43] Kitamura E. Studies on cytoplasmic sterility of hybrids in distantly related∶ varieties of rice (Oryza sativa L.). Jpn J Breed,1962,12∶ 81-84
Identification and Mapping of a Hybrid Sterility Gene between 9311 and Nipponbare
ZHANG Hong-Gen**,ZHANG Li-Jia**,SUN Yi-Biao,SI Hua,LIU Qiao-Quan,TANG Shu-Zhu*,and GU Ming-Hong
Jiangsu Key Laboratory of Crop Genetics and Physiology / Co-Innovation Center for Modern Production Technology of Grain Crops / Key Laboratory of Plant Functional Genomics of the Ministry of Education,Yangzhou University,Yangzhou 225009,China
Abstract:Exploitation of subspecific heterosis is an effective method to improve rice yield by overcoming hybrid sterility between subspecies. In this study,F1plants of the cross between Nipponbare and T9424,a line from a set of chromosome segment substitution lines with Nipponbare background as recipient and 9311 as donor,showed the decreasing spikelet and pollen fertility compared with the two parents,indicating that there was the incompatibility between the parents. Three substituted chromosome segments on chromosome 1,4,and 5,respectively,were identified by whole genome re-sequencing of T9424. Analysis of the genotypes and spikelet fertility of plants in Nipponbare/T9424 F2population indicated that hybrid sterility gene between T9424 and Nipponbare was located on chromosome 5. A total of 790 plants were then used for mapping the hybrid sterility gene,and the target gene was mapped to a candidate region with the physical distance of 110 kb between PSM8 and A14 on chromosome 5. The hybrid sterility gene,named S39(t) temporarily,controlled partial abortion of both pollen grains and embryo-sac of Nipponbare/T9424 F1plants. These results are useful for deepening understanding of the phenomenon of hybrid sterility,and lay the groundwork for the gene cloning and its use in breeding.
Keywords:Rice;Hybrid sterility gene;Gene mapping
DOI:10.3724/SP.J.1006.2016.00787
*通讯作者(
Corresponding author)∶ 汤述翥,E-mail∶ sztang@yzu.edu.cn**同等贡献(Contributed equally to this work)
收稿日期Received()∶ 2015-12-08;Accepted(接受日期)∶ 2016-03-14;Published online(网络出版日期)∶ 2016-03-22.
