水稻PFP基因的克隆及其遗传转化
2016-07-14雷东阳
雷东阳
(湖南农业大学农学院,湖南 长沙 410128)
水稻PFP基因的克隆及其遗传转化
雷东阳
(湖南农业大学农学院,湖南 长沙 410128)
摘 要:采用 RT–PCR 方法,成功克隆到 1 个与水稻苗期耐热相关的基因 PFP,构建了该基因的超表达载体,通过基因枪法转化水稻品种中花17,获得 9 个转基因阳性植株,与对照相比,T1代转基因植株的苗期耐热性明显增强。33 个代表性地方水稻品种的耐热表型与PFP 基因型的相关性分析结果表明,PFP 基因的基因型与品种的耐热表型存在显著的相关性。本研究中还分析了该基因在盐、4 ℃低温、PEG和ABA胁迫处理下的基因表达情况。
关 键 词:水稻;耐热基因PFP;过氧化物酶;基因克隆;遗传转化
投稿网址:http://xb.ijournal.cn
高温和干旱等逆境胁迫使植物的产量降低和种植区域受限制。随着全球气候的变化和人口的增长,迫切需要培育能够耐受不同逆境的作物。为了从分子水平解释植物适应逆境的机制,获得抗逆基因用于抗逆育种,对植物适应逆境机制的研究已经从生理水平进入到了分子水平。水稻基因组学研究已取得了重大进展,其高密度连锁图谱及2个亚种的基因组工作框架图已经被构建,粳稻(日本晴)和籼稻(9311)的全基因组测序已经完成,一批控制质量性状的基因和控制复杂农艺性状及耐逆性状的基因/QTL也已被克隆出来[1–2]。随着全球气候变暖,水稻耐热基因的挖掘和耐热水稻品种的选育已成为水稻遗传育种研究的重要课题。笔者采用基因芯片对经高温处理的热敏感野生稻渗入系 YIL106和耐热轮回亲本特青的基因表达谱进行分析,结合QTL初步定位结果和生物信息学方法,针对野生稻渗入系群体对 QTL 定位区域内的差异表达基因进行分析和验证[3],筛选出与水稻苗期耐热性相关的基因 LOC_Os01g19020。该基因属于过氧化物酶家族类(peroxidase family protein)基因。本研究中克隆了PFP 基因,并将其编码区构建超表达载体,通过基因枪法获得了转基因植株。现将结果报道如下。
1 材料与方法
1.1材料
试验材料为耐热品种特青、热敏感渗入系YIL106、粳稻品种中花17和日本晴等77个具代表性水稻品种。
所用的各种限制性内切酶、T4DNA连接酶、Taq Plus酶等购自TAKARA公司;PCR Buffer、dNTP、TRIzol RNA提取试剂盒、大肠杆菌(E.coli)TOP10 购自天根生物工程公司;反转录酶购自六合通公司。所使用的各引物由北京奥科生物技术公司合成。各序列由北京六合华大基因科技公司进行测序分析。
1.2方法
1.2.1苗期耐热性的鉴定
选取饱满的水稻种子,用3%的次氯酸钠消毒20 min,清洗后室温浸种2 d,30 ℃催芽2 d,将出芽整齐的种子播种于剪去管底的96孔PCR塑料板,放至装有Yoshida培养液的塑料盒子中,置于光照培养箱中培养。每2 d换1次营养液。培养条件为12 h光照(28 ℃)/12 h黑暗(26 ℃),相对湿度为70%。幼苗长至2叶1心时进行42 ℃高温处理9 d,调查叶赤枯度,根据文献[4]中的7级分类法进行抗性鉴定。
1.2.2叶片总RNA的提取和实时荧光定量PCR
(RT–PCR)
叶片总RNA的提取参考文献[5]中的方法。
利用PRIMER3软件设计该基因的特异引物(正向引物5′–AGTCCTGCTGGACAAGTCGT–3′)、反向引物5′–RTAGATGAGGATGTCGGAGCA– 3′),选用水稻的18S基因作为内标基因,引物序列为18S–F (5′–GCTTTGGTGACTCTAGATAAC–3′)和18S–R (5′–GTCGGGAGTGGGTAATTTGC–3′),进行 PCR扩增。手工设定荧光阈值,确定特定荧光阈值下各样品的 Ct 值,采用 2–ΔΔCt对不同样品的相对表达量进行分析。
1.2.3过量表达载体的构建
利用RT–PCR方法扩增目标基因,并在PCR引物中引入合适的限制性内切酶酶切位点(KpnⅠ和SpeⅠ),从 cDNA 模板中扩增出带有酶切位点的目标基因的编码序列。质粒提取、酶切、连接、转化等参照试剂盒说明书。提取过表达载体pCAMBIA1301–PFP 质粒,用基因枪法进行遗传转化,将目的基因超表达载体转化到粳稻品种中花17中。
1.2.4转基因植株的检测
采用 PCR 扩增潮霉素抗性基因(HYG)片段,检测阳性转基因植株。抗性基因(HYG)检测引物为HYG–F(5′–TACTTCTACACAGCCATC–3′)和HYG–R (5′–CGTCTGTCGAGAAGTTTC–3′)。
1.2.5PFP 基因序列的扩增和测序
首先依据已公布的日本晴和9311 DNA序列设计引物,以YIL106和特青2个材料的cDNA为模板进行PCR扩增。PCR反应体系如下:2 μL 模板,0.2 μL Taq Plus(2.5 U/ μL),2 μL Taq Plus Buffer(2x),1 μL dNTPs(2.5 mmol/L),2 μL Primer,12.8 μL ddH2O。扩增程序如下:94 ℃预扩增5 min;94 ℃扩增30 s,58 ℃退火30 s,72 ℃延伸1 min,35个循环;72 ℃延伸10 min。通过1%的琼脂糖凝胶电泳检测,PCR产物送北京六合华大基因科技公司进行测序,用DNAssist 2.0软件进行基因序列比对分析。
1.2.6代表性水稻品种PFP 基因的测序与耐热表型鉴定
选取77个具代表性的地方水稻品种进行苗期耐热性鉴定,筛选表型确定的且耐热级别大于4的17个品种定义为热敏感品种(S),筛选表型确定且耐热等级小于2.5的16个品种定义为耐热品种(R)。对这33个品种分别提取基因组DNA,对目的基因PFP进行PCR扩增和测序。
1.2.7盐和低温等胁迫处理后PFP 基因的表达
为了研究PFP基因是否受ABA、盐胁迫、PEG干旱和低温胁迫的诱导,分别用100 μmol/L ABA、200 mmol/L NaCl、30%PEG 和4 ℃低温处理YIL106和特青2叶1心期的幼苗,处理0、1、8、24 h分别取样,提取RNA,反转录后进行RT–PCR分析。引物序列为HYG–F(5′–AGTCCTGCTGGACAAGTCGT–3′)和HYG–R(5′–TAGATGAGGATGTCGGAGCA–3′)。
2 结果与分析
2.1PFP基因序列的扩增和测序分析
为了获得PFP基因序列的全长编码序列,并验证PFP基因在野生稻热敏感渗入系YIL106和耐热轮回亲本特青的基因组水平上是否存在差异,对YIL106和特青中PFP基因的编码序列进行扩增和克隆测序,结果表明,PFP基因在热敏感渗入系YIL106和耐热轮回亲本特青中的扩增产物长均为1 041 bp,但二者的cDNA序列存在1个碱基的差异,其中特青中第70个碱基为T,而在YIL106中为A。这导致了二者存在1个编码蛋白差异(图 1)。

图1 PFP 基因在YIL106与特青中的编码蛋白Fig.1 Com parison the encoding p roteins of gene PFP in YIL106 and Teqing
2.2PFP基因型与水稻耐热性的相关性分析
PFP基因型与水稻耐热性的相关性分析结果表明,在16个表型被鉴定为耐热的品种中有13个品种的PFP基因序列与耐热品种特青的一致,而17个表型被鉴定为热敏感的品种中有14个品种的PFP基因序列与热敏感品种YIL106的一致。对这33个水稻品种的耐热表型和基因型进行相关性分析的结果表明,PFP基因型与水稻苗期耐热性存在显著的相关性,相关系数为0.610。
2.3PFP基因过表达载体的构建
利用qRT–PCR扩增目标基因,并在PCR引物中引入合适的限制性内切酶KpnⅠ和 SpeⅠ酶切位点,从特青的cDNA模板中扩增出带有酶切位点的目标基因CDS序列,酶切PCR产物,回收后连接到PMD18–T克隆载体上,利用通用引物M 13测序,挑选序列完全正确的克隆,酶切回收后连接到过表达载体pCAMBIA 1301上,对阳性克隆进行酶切、PCR扩增和测序验证,得到了完全正确的克隆。利用水稻品种中花17,采用组成型启动子过表达PFP基因(转特青基因),得到9株阳性转基因植株(图3),并获得转基因T1代植株。
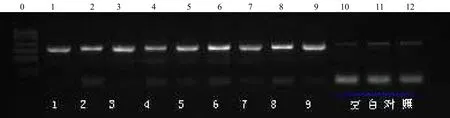
图3 PFP基因过表达转化植株的PCR检测结果Fig. 3 Identification the transformants overexpressed by gene PFP using PCR
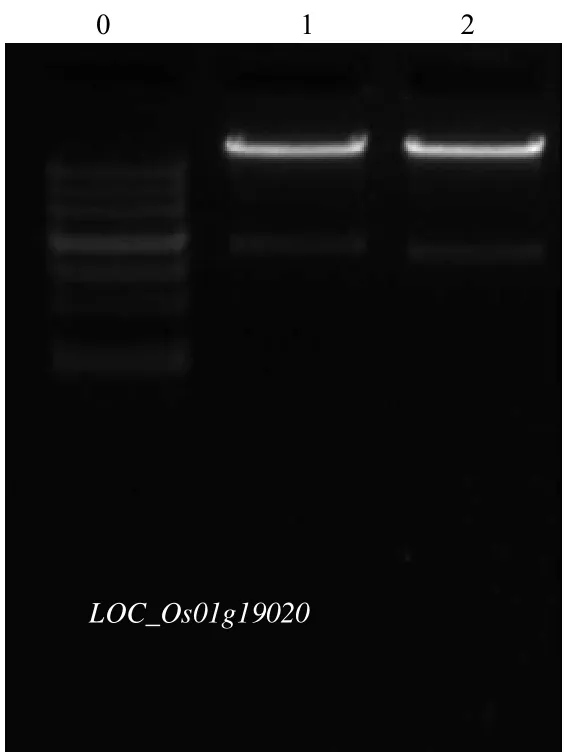
图2 RT–PCR扩增的目的条带Fig.2 RT–PCR resu lt of gene PFP
2.4转PFP基因植株的表型分析
待转PFP基因植株和对照中花17植株长至2叶1心时进行42 ℃高温处理,鉴定耐热表型。由图4可以看出,高温处理后中花17的第2和第3片叶有一半以上枯黄,而转基因植株的第2和第3片叶只有叶尖枯黄,大部分叶片仍为绿色。可以看出,与对照中花17比较,PFP 基因超表达植株的耐热性明显增强,但转基因植株不同株系的耐热表型存在一定程度的分离。

图4 转基因植株和对照中花17高温处理后的表型Fig.4 Phenotypic comparison of transgenic plants and control from Zhonghua17 after heat treatment
2.5NaCl、低温、PEG和ABA胁迫处理下PFP基因的表达情况
由图5可见,与未处理时相比,经NaCl处理后,PFP基因在特青中的表达量在处理1 h时明显上升,随后下降,在YIL106中的表达量相对较低。
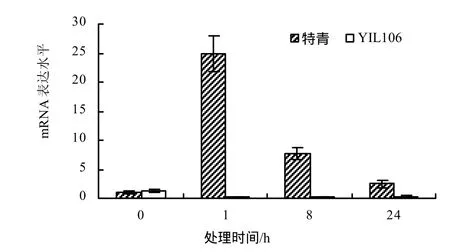
图5 NaCl处理下特青和YIL106中PFP基因在不同处理时间的mRNA表达水平Fig.5 Comparison the expression of PFP gene at different times on NaCl treatments in YIL106 and Teqing
由图6可见,经4 ℃低温处理后,与未处理时相比,PFP基因在YIL106中的表达量变化不大,在特青中的表达量在处理8 h时略有上升。
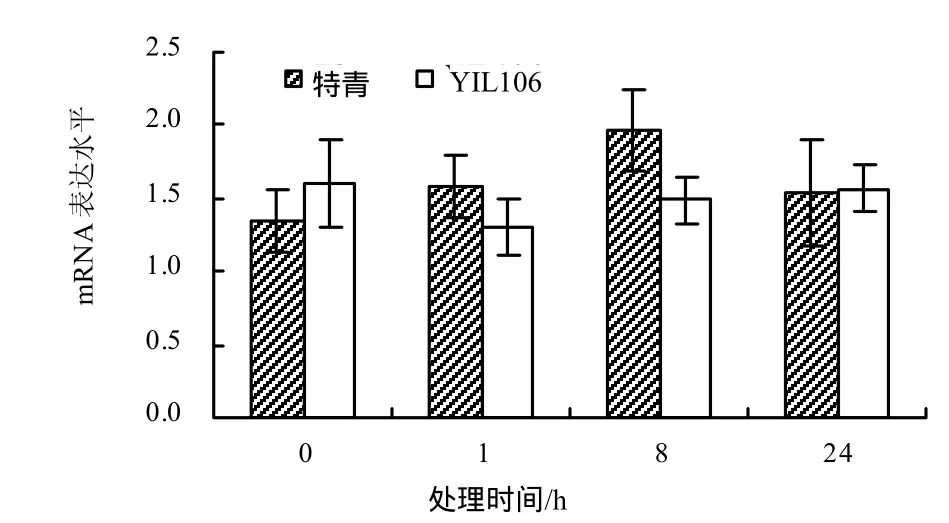
图6 4 ℃低温处理下特青和YIL106中PFP基因在不同处理时间的mRNA表达水平Fig.6 Comparison the expression of PFP gene at different times on 4 ℃ low temperature in YIL106 and Teqing
由图7可见,经PEG处理后,与未处理时相比,PFP基因在特青中的表达量在处理8 h时略有上升,而在YIL106中的表达量各处理均明显下降。
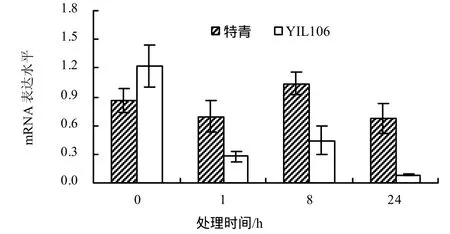
图7 PEG处理下特青和YIL106中PFP基因在不同处理时间的mRNA表达水平Fig.7 Comparison the expression of PFP gene at different times on PEG in YIL106 and Teqing
由图8可见,经ABA处理后,与未处理时相比,PFP基因在YIL106中的表达量在处理24 h时明显上升,在特青中的表达量在处理1 h和处理24 h有比较明显的上升。
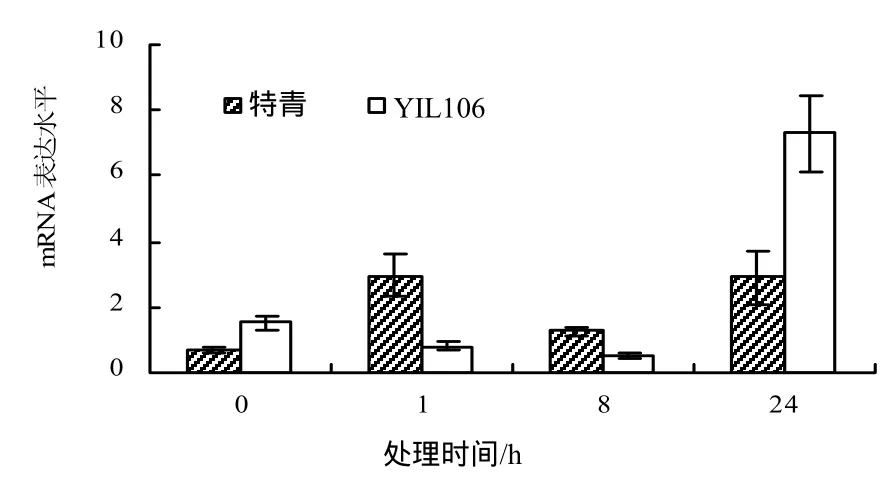
图8 ABA处理下特青和YIL106中PFP基因在不同处理时间的mRNA表达水平Fig.8 Comparison the expression of PFP gene at different times on ABA in YIL106 and Teqing
3 结论与讨论
日本和国际水稻研究所较早地开展了耐热水稻品种的选育研究[4–5]。日本学者Satake等[6]曾进行过水稻耐热品种筛选和耐热性状数量遗传分析,发现水稻对高温的耐性具有品种特异性;中国学者徐云碧等[7]报道,不同水稻品种耐热性的差异较大。这些研究结果表明,遗传因素是影响水稻品种间耐热性差异的主要因素。近年来,随着分子标记技术的发展和广泛应用,已有了利用分子标记对水稻耐热性进行数量性状基因(quantitative trait loci,QTL)定位研究的报道[8–10]。
植物通过一系列生理生化代谢来适应高温逆境,一般认为,植物体内的热激蛋白(heat shock protein, HSP)和热激因子(heat shock factors, HSF)可能是参与调控这些生理过程的重要因子。在水稻中已鉴定出21个在抗逆反应中发挥重要作用的Hsfs[11],如Spl7(HsfA4b) DNA结合域1个碱基的变异引起氨基酸序列发生变化,使色氨酸变为半胱氨酸,导致水稻叶片在高温条件下出现受伤害的表型[12];过量表达OsHsp17.7使水稻耐热UV–B增加和耐干旱等抗逆能力增强[13]。
本研究中克隆了水稻苗期耐热性状的相关基因PFP,构建了该基因的过表达载体,获得了转基因植株后代,其转基因植株的苗期耐热性得到提高,耐热基因PFP在盐和低温胁迫下的基因表达上调。
参考文献:
[1] Fridman E,Carrari F,Liu Y S,et al.Zoom ing in on a quantitative trait for tomato yield using interspecific introgressions[J].Science,2004,305:1786–1789.
[2] Fridman E,Pleban T,Zam ir D.A recombination hotspot delimits a w ide-species quantitative trait locus for tomato sugar content to 484 bp w ithin an invertase gene[J].Proc Natl Acad Sci,2000,97:4718–4723.
[3] Lei D Y,Tan L B,Liu F X,et al.Identification of heat-sensitive QTL derived from common w ild rice (Oryza rufipogon Griff.)[J].Plant Science,2013,201:121–127.
[4] Naga mine T,Nakagahra M.Genetic variation of chilling injury at seedling stage in rice,Orazy sativa L.[J].Japan J Breed,1990,40:449–455.
[5] Sambrook J,Fritsch E F,Maniatis T.分子克隆试验指南[M].金冬雁,译.北京:科学出版社,2002.
[6] Satake T,Yoshida S.High temperature-induced sterility in indica rice at flowering[J].Japanese Journal of Crop Science,1978,47:6–17.
[7] 徐云碧,石春海,申宗坦.热害对早稻结实率的影响[J].浙江农业科学,1989(2):51–54.
[8] 张涛,杨莉,蒋开锋,等.水稻抽穗扬花期耐热性的QTL分析[J].分子植物育种,2008,6(5):867–873.
[9] 赵志刚,江玲,肖应辉,等.水稻孕穗期耐热性QTLs分析[J].作物学报,2006,32(5):640–644.
[10] 曹立勇,赵建根,占小登,等.水稻耐热性的QTL定位及耐热性与光合速率的相关性[J].中国水稻科学,2003,17(3):223–227.
[11] Koskull–Döring P,Scharf K D,Nover L.The diversity of plant heat stress transcription factors[J].Trends Plant Science,2007,12:452–457.
[12] Yamanouchi U,Yano M,Lin H,et al.A rice spotted leaf gene,Spl7,encodes a heat stress transcription factor protein[J].Proceedings of the National Academy of Sciences,2002,99:7530–7535.
[13] Murakami T,Matsuba S,Funatsuki H,et al. Overexpression of a small heat shock protein,sHSP17.7,confers both heat tolerance and UV–B resistance to rice plants[J].Molecular Breeding,2004,13:165–175.
责任编辑:王赛群英文编辑:王 库
Cloning and genetic transformation of gene PFP in rice
Lei Dongyang
(College of Agronomy, Hunan Agricultural University, Changsha 410128, China)
Abstract:PFP, a peroxidase family protein gene, was successfully separated and cloned from rice by means of RT–PCR strategy, overexpression construction was prepared and nine positive transgenic plants were obtained by gene gun bombardment method. Compared to Zhonghua17, the overexpression plants of the candidate gene PFP showed heat tolerance. Functional association analysis of the gene PFP using 33 rice cultivars showed that it had significant correlation (P≤0.01) with heat tolerance. The expression of gene PFP in salt, cold, PEG and ABA stress was also analysised in this study.
Keywords:rice; heat tolerance PFP; peroxidase; gene cloning; genetic transformation
中图分类号:S511.032
文献标志码:A
文章编号:1007−1032(2016)02−0113−05
收稿日期:2015–08–31 修回日期:2016–03–07
基金项目:湖南省自然科学杰出青年科学基金(2016JJ1011);湖南省教育厅优秀青年基金(15B117);湖南农业大学作物学开放基金(ZWKF201506)
作者简介:雷东阳(1980—),男,湖南邵阳人,博士,副教授,主要从事水稻遗传育种研究,leidongyang1980@126.com
