基因A型鸭甲肝病毒弱毒株免疫雏鸭的8种细胞因子mRNA变化分析
2016-07-14张焕容
张焕容,张 冰,王 栋,岳 华
(西南民族大学生命科学与技术学院,成都 610041)
基因A型鸭甲肝病毒弱毒株免疫雏鸭的8种细胞因子mRNA变化分析
张焕容*,张冰,王栋,岳华
(西南民族大学生命科学与技术学院,成都 610041)
为研究基因A型鸭甲肝病毒(DHAV-A)MY弱毒株对雏鸭细胞因子表达的影响,阐明细胞因子在DHAV-A弱毒疫苗免疫中的作用,利用荧光定量RT-PCR(RRT-PCR)方法,检测DHAV-A MY弱毒株接种1日龄SPF雏鸭后0.25、0.5、1、2、3和5 d共6个时间点肝、脾和脑组织中IFN-α、IFN-β、IFN-γ,以及IL-1β、IL-2、IL-6、IL-8和TNF-α共8种细胞因子的mRNA转录水平,并结合各时间点DHAV-A的荷载量进行分析。结果表明:肝和脑组织中2 d时间点以及脾组织中3 d时间点病毒荷载量达到最高;三种组织中,8种细胞因子的转录水平均随着病毒荷载量的增加而升高,且在各组织病毒荷载量最高时间点,8种细胞因子的转录水平均极显著升高(P<0.01),结果证明DHAV-A MY弱毒株可刺激雏鸭抗病毒细胞因子IFN-α、IFN-β、IFN-γ和TNF-α以及炎性细胞因子IL-1β、IL-2、IL-6和IL-8 mRNA的转录,本研究丰富了DHAV-A MY弱毒株的免疫机制。
基因A型鸭甲肝病毒;弱毒株;细胞因子;荧光定量RT-PCR
基因A型鸭甲肝病毒(duck hepatitis A virus genotype A,DHAV-A),是一种能够引起雏鸭急性高度致死性的传染性病原,雏鸭表现为急性发病、肝病变和高死亡率,主要危害4周龄以内的雏鸭。DHAV-A属于小RNA 病毒,入侵机体后主要感染鸭肝、脾和脑组织细胞,该病毒能够与细胞膜上特定受体结合并进入宿主细胞,大量复制,破坏细胞平衡,诱导细胞凋亡,进一步加剧病程发展[1]。为了预防DHAV-A的感染,研究者们把分离的DHAV-A野毒经过鸡胚传代弱化,培育出能够激发雏鸭免疫又不致病的弱毒疫苗株。本研究中的DHAV-A MY株即为本实验室经过鸡胚传代弱化培育的弱毒株。
实时荧光定量RT-PCR(RRT-PCR)广泛应用于病毒定量和细胞因子转录等方面的研究。细胞因子在机体的体液免疫和细胞免疫、抗感染免疫、抗肿瘤免疫、抗排斥反应、自身免疫疾病治疗以及机体造血等方面都具有重要作用,其研究是当代免疫学研究中最为活跃的领域之一[2]。本研究选取与细胞免疫和体液免疫密切相关的8种细胞因子IL-1β、IL-2、IL-6、IL-8、IFN-α、IFN-β、IFN-γ和TNF-α[3-5],采用RRT-PCR检测DHAV-A MY弱毒株接种雏鸭后病毒增殖以及8种细胞因子的转录水平,以期通过检测IFN和TNF以及IL 等细胞因子的动态表达,深入了解DHAV-A弱毒株刺激雏鸭后机体细胞因子的活化水平,为阐明DHAV-A MY弱毒株免疫机制提供理论依据。
1 材料与方法
1.1材料
1.1.1基因A 型鸭甲肝病毒弱毒株和SPF鸭胚基因A 型鸭甲肝病毒(DHAV-A)MY株弱毒株(TCID50=10-5.60·100 μL-1),由西南民族大学动物医学实验室保存;SPF鸭胚购自中国农业科学院哈尔滨兽医研究所,自行孵化,隔离饲养。
1.1.2主要试剂Trizol®试剂购自Invitrogen 公司;PrimescriptTMRT、SYBR Premix Ex TaqTM试剂盒购自TaKaRa 公司。
1.2方法
1.2.1雏鸭分组接种DHAV-A MY弱毒株与样品采集48 只1 日龄SPF 雏鸭随机分成试验组和对照组,每组24只,试验组每只雏鸭腿部肌肉注射0.5 mL 10 000 ×TCID50DHAV-A MY 弱毒株,对照组每只雏鸭相同途径注射0.5 mL无菌生理盐水,于注射后0.25、0.5、1、2、3和5 d共6个时间点各组随机取4只雏鸭,经戊巴比妥钠麻醉后,采取雏鸭肝、脾和脑组织置于液氮中,用于提取组织的总RNA。
1.2.2总RNA的提取和反转录合成cDNA 按照Trizol®试剂盒说明书提取肝、脾和脑组织中的总RNA,并按反转录试剂盒说明书反转录合成cDNA。
1.2.3引物根据文献报道,合成鸭内参基因β-actin及DHAV-A、IFN-α、IFN-β、IFN-γ、IL-1β、IL-2、IL-6、IL-8和TNF-α 引物(表1)。
1.2.4荧光定量PCR反应体系及反应条件内参基因、细胞因子及DHAV-A的荧光定量PCR反应体系均为25 μL:SYBR Green Ⅰ master mix 12.5 μL,上下游引物各1 μL (10 μmol·L-1),cDNA模板2 μL,补充去离子水至25 μL。反应条件:95 ℃预变性5 min;95 ℃变性15 s;优化的DHAV-A和IL-8退火温度为60 ℃,IFN-α退火温度为64 ℃,IFN-β退火温度为56 ℃,IFN-γ退火温度为62 ℃,IL-1β退火温度为54 ℃,IL-2退火温度为59 ℃,IL-6和TNF-α退火温度为58 ℃,β-actin退火温度为61 ℃;退火31 s,共进行40个循环(表2)。1.2.5数据处理以β-actin作为内参基因,利用公式2-△△Ct相对定量方法对各细胞因子mRNA转录水平和病毒拷贝数进行相对定量分析。计算每个时间点4只雏鸭(n=4)的平均值和标准差,使用SPSS 17.0软件的t检验方法分析样本之间的差异性,其中P<0.01为差异极显著,P<0.05为差异显著。
2 结 果
2.1DHAV-A MY弱毒在雏鸭肝、脾及脑组织中的增殖情况
结果显示,肝和脑组织中病毒荷载量在接毒后2 d达到最高值,分别是对照组的280.14倍(P<0.01)和4.40倍(P<0.05),脾中病毒荷载量在接毒后3 d达到最高值,为对照组的86.6倍(P<0.05),雏鸭接种DHAV-A MY弱毒后0.25~1 d时间段各时间点,肝、脾和脑组织中病毒荷载量较低,在2 d时迅速上升(P<0.01),肝中病毒荷载量最高,随后肝中病毒荷载量大幅度下降(P<0.01),2~5 d时间段各时间点,三种组织中病毒荷载量极显著高于对照组(P<0.01)(图1)。


**.P<0.01图1 DHAV-A MY弱毒接种雏鸭肝、脾和脑组织中DHAV-A的增殖情况Fig.1 Proliferation of attenuated DHAV-A in the liver,spleen and brain tissues of attenuated DHAV-A MY strain injected ducklings
2.2雏鸭接种DHAV-A MY弱毒株后肝、脾和脑细胞`因子mRNA转录水平的变化
雏鸭接种DHAV-A MY弱毒株后0.25、0.5、1、2、3和5 d各时间点,IL-1β、IL-2、IL-6、IL-8、TNF-α 以及IFN-α、IFN-β和IFN-γ的mRNA在肝、脾和脑中的转录水平分别如图2~4所示。在 2 d 时间点,肝组织中除IL-2、IL-6、IL-8外,其余5种细胞因子mRNA转录水平极显著升高 (P<0.01);3 d时间点,脾组织中除TNF-α外,7种细胞因子转录水平极显著升高(P<0.01);5 d 时间点,脑组织中8种细胞因子转录水平极显著升高 (P<0.01)。

**.P<0.01,*.0.01 **.P<0.01,*.0.01 **.P<0.01,*.0.01 利用RRT-PCR 方法检测雏鸭接种DHAV-A MY弱毒株后肝、脾和脑组织中病毒复制情况,发现接种后6 h即可在以上组织中检测到病毒,肝中病毒荷载量2 d 时达到峰值,这与C.Q.Gu等[1]研究结果类似。但DHAV-A MY弱毒株在组织中的增殖呈一过性,免疫后3 d肝中病毒含量迅速下降,而C.Q.Gu等[1]和杨苗[11]研究显示雏鸭感染DHAV-A强毒JX株和XC株后3 d时病毒荷载量仍非常高,并持续1月。汪铭书等[12]利用Dot-ELISA方法检测雏鸭接种DHAV-A弱毒株QL79株后各组织器官DHAV-A 弱毒分布,结果表明雏鸭接种DHAV-A 弱毒QL79株后很难在雏鸭脑组织中检测到DHAV-A,这与本试验中脑组织病毒荷载量极低的结果相符。DHAV-A MY弱毒株在雏鸭体内有限制增殖和难以通过血脑屏障是其作为安全的弱毒疫苗候选株的重要生物学特征。 程安春等[13]认为DHAV-A弱毒苗免疫雏鸭后到达免疫器官脾刺激了雏鸭的免疫应答反应,随后抑制了肝和脾组织中疫苗毒的复制,本研究得到了与之相同的结果。雏鸭接种DHAV-A MY弱毒后,随着弱毒在肝、脾和脑组织中病毒荷载量的升高,诱导各组织细胞高水平表达多种细胞因子,2 d时肝组织和脑组织中病毒荷载量达到峰值,此时,各种细胞因子在肝和脑组织中的表达水平极显著升高(P<0.01);脾中病毒荷载量在3 d时间点达到峰值时,各种细胞因子在脾组织中的表达水平也极显著升高(P<0.01);说明病毒的增殖可以活化雏鸭的细胞因子mRNA转录,从而调节免疫应答反应。C.Q.Gu等[1]研究显示雏鸭感染DHAV-A强毒JX株2~5 d时IFN-α mRNA转录水平下降,而本试验中雏鸭接种DHAV-A MY弱毒株2~5 d 时IFN-α mRNA 水平升高,这种反差说明DHAV-A弱毒株可以促进干扰素的表达从而抑制病毒的增殖,而DHAV-A强毒株可以抑制干扰素生成从而导致强毒株的感染。3种干扰素中IFN-α 转录水平最高,说明了IFN-α在随后的抗DHAV-A弱毒株增殖中起主要作用。DHAV-A MY弱毒株接种后3~5 d,肝和脑中荷载量快速下降,各种细胞因子的转录量也快速下降,说明由于弱毒株的下降,导致其对细胞因子的诱导作用减弱。脾组织中细胞因子转录水平在DHAV-A MY弱毒株接种后3~5 d仍极显著高于肝和脑组织中细胞因子转录水平,这与脾中病毒荷载量晚于肝和脑达到高峰相一致,且脾是机体最重要的免疫器官,能在病毒的诱导下产生高水平细胞因子。雏鸭接种DHAV-A MY弱毒后,鸭IFN-α、IFN-β 和IFN-γ的大量表达能够在肝、脾和脑组织中起到很好的抗病毒作用,可有效减少DHAV-A MY弱毒对雏鸭肝、脾和脑组织等的损伤。 IL-1β、IL-2、IL-6和IL-8都是和炎症反应相关的细胞因子。雏鸭接种DHAV-A MY弱毒后0.25~1 d 时,DHAV-A MY弱毒增殖刺激了单核-巨噬细胞和T细胞的增殖,从而导致鸭IL-1β、IL-2、IL-6和IL-8的快速转录,这与郭智莉的研究结果一致[14],雏鸭免疫DHAV-A MY弱毒2 d时,肝组织中DHAV-A 弱毒荷载量达到最大值,鸭IL-1β和IL-2 mRNA 的转录量反而比1 d时下降,说明病毒的大量增殖对鸭IL-1β和IL-2 mRNA 的转录起到了一定的抑制作用[15]。 文献报道[8,15]TNF-α可以参与机体防御反应起到免疫调节作用,且不依赖宿主的其他免疫因素就能起到独立的抗病毒作用,是一种重要的抗病毒细胞因子。本研究中,肝、脾和脑组织中鸭TNF-α mRNA转录量升降与相应组织中DHAV-A弱毒荷载量的升降趋势一致,说明在雏鸭接种DHAV-A弱毒后诱导了鸭TNF-α的表达从而通过免疫调节起到了抑制病毒增殖的作用。 通过对SPF 雏鸭接种DHAV-A MY 弱毒株后组织中8种细胞因子mRNA的定量检测,证明DHAV-A MY弱毒可刺激雏鸭抗病毒细胞因子IFN-α、IFN-β、IFN-γ和TNF-α以及炎性细胞因子IL-1β、IL-2、IL-6和IL-8 mRNA的转录,对采用新的方法评估DHAV-A弱毒疫苗的安全性和免疫机制提供了科学依据。 [1]GU C Q,XIE C Q,HU X Y,et al.Cytokine gene expression in the livers of ducklings infected with duck hepatitis virus-1 JX strain [J].PoultSci,2012,91(3):583-591. [2]窦永喜,景志忠,才学鹏.细胞因子及其应用的研究进展[J].中国兽医科技,2005,35(3):233-238. DOU Y X,JING Z Z,CAI X P.Research progress of cytokines and their application [J].ChineseJournalofVeterinaryScienceandTechnology,2005,35(3):233-238.(in Chinese) [3]THAKUR A,PEDERSEN L E,JUNGERSEN G.Immune markers and correlates of protection for vaccine induced immune responses [J].Vaccine,2012,30(33):4907-4920. [4]KUMAR V,SHARMA A.Neutrophils:Cinderella of innate immune system [J].IntImmunopharmacol,2010,10(11):1325-1334. [5]SCHULTZ U,CHISARI F V.Recombinant duck interferon gamma inhibits duck hepatitis B virus replication in primary hepatocytes [J].JVirol,1999,73(4):3162-3168. [6]黄秋雪,汤承,聂培婷,等.鸭甲肝病毒基因 A 型和 C 型双重 RT-PCR 检测方法的建立 [J].中国预防兽医学报,2012,34(2):120-123. HUANG Q X,TANG C,NIE P T,et al.Establishment of a duplex RT-PCR assay for detection of duck hepatitis A virus genotype A and genotype C [J].ChineseJournalofPreventiveVeterinaryMedicine,2012,34(2):120-123.(in Chinese) [7]杨发龙,谢秀兰,汤承,等.鸭瘟病毒疫苗株与强毒株诱导雏鸭 IFN-α mRNA 在肝脏中表达的动态定量研究 [J].中国预防兽医学报,2008,30(8):647-650. YANG F L,XIE X L,TANG C,et al.Dynamics of IFN-α mRNA expression in liver of ducks infected with duck plague virus of different virulence [J].ChineseJournalofPreventiveVeterinaryMedicine,2008,30(8):647-650.(in Chinese) [8]ADAMS S C,XING Z,LI J,et al.Immune-related gene expression in response to H11N9 low pathogenic avian influenza virus infection in chicken and Pekin duck peripheral blood mononuclear cells [J].MolImmunol,2009,46(8-9):1744-1749. [9]谢秀兰,汤承,杨发龙,等.鸭 IFN-γ mRNA 实时荧光定量 RT-PCR 方法的建立 [J].动物医学进展,2008,29(5):17-20. XIE X L,TANG C,YANG F L,et al.Establishment of real-time RT-PCR for IFN-γ mRNA in duck[J].ProgressinVeterinaryMedicine,2008,29(5):17-20.(in Chinese) [10]谢秀兰,杨发龙,岳华,等.鸭 β-actin 基因实时荧光定量 PCR 方法的建立 [J].西南民族大学学报(自然科学版),2008 (S1):57-60. XIE X L,YANG F L,YUE H,et al.Establishment of real-time PCR for β-actin gene of duck[J].JournalofSouthwestUniversityforNationalities(NaturalScienceEdition),2008(S1):57-60.(in Chinese) [11]杨苗.实时荧光定量 RT-PCR 检测1型鸭病毒性肝炎方法的建立和应用[D].成都:四川农业大学,2009. YANG M.Development and application of a one-step real-time TaqMan RT-PCR assay to detect duck hepatitis virus type 1 [D].Chengdu:Sichuan Agricultural University,2009.(in Chinese) [12]汪铭书,程安春,陈孝跃.鸭病毒性肝炎的研究:弱毒在雏鸭和成年鸭体内分布和排泄 [J].中国畜禽传染病,1997(4):11-15. WANG M S,CHENG A C,CHEN X Y.Research of duck viral hepatitis:distribution and excrement of attenuated duck hepatitis virus in ducks [J].JournalofChineseLivestockandPoultryInfectiousDiseases,1997(4):11-15.(in Chinese) [13]程安春,汪铭书,崔恒敏,等.鸭瘟鸭病毒性肝炎二联弱毒疫苗的研究 1.最佳配比的筛选、安全性及免疫效力 [J].畜牧兽医学报,1996,27(5):466-474. CHENG A C,WANG M S,CUI H M,et al.Study on bivalent attenuated vaccines against duck plague and duck viral hepatitis 1.The most appropriate proportion,safety and immune efficacy test [J].ActaVeterinariaetZootechnicaSinica,1996,27(5):466-474.(in Chinese) [14]郭智莉.DHV-Ⅰ对鸭巨噬细胞 TLRs 信号通路的影响[D].重庆:西南大学,2012. GUO Z L.The effect of DHV-I on TLRs signaling pathway in duck macrophages[D].Chongqing:Southwest University,2012.(in Chinese) [15]SONG C,YU S,DUAN Y,et al.Effect of age on the pathogenesis of DHV-1 in Pekin ducks and on the innate immune responses of ducks to infection[J].ArchVirol,2014,159(5):905-914. (编辑白永平) mRNA Change Analysis of Eight Cytokines in Ducklings Stimulated by Attenuated Duck Hepatitis A Virus Genotype A MY Strain ZHANG Huan-rong*,ZHANG Bing,WANG Dong,YUE Hua (CollegeofLifeScienceandTechnology,SouthwestUniversityforNationalities,Chengdu610041,China) In order to explore the roles of cytokines responding to attenuated duck hepatitis A virus genotype A (DHAV-A) vaccine immunization,the effects of attenuated DHAV-A MY strain on cytokine transcription in ducklings were analyzed.The mRNA transcription levels of 8 cytokines,such as IFN-α,IFN-β,IFN-γ and IL-1β,IL-2,IL-6,IL-8,and TNF-α,were determined by RRT-PCR in liver,spleen and brain of ducklings at different time points of 0.25 0.5,1,2,3 and 5 days post attenuated DHAV-A MY strain injecting 1-day-old SPF ducklings,and the virus loads of DHAV-A MY strain in liver,spleen and brain were also detected by RRT-PCR.The results indicated that the virus load reached the highest level in liver and brain at 2 d time point,and at 3 d time point in spleen post attenuated DHAV-A MY strain injection.The mRNA transcription levels of 8 cytokines in liver,spleen and brain up-regulated very significantly at the corresponding time points when the virus load reached the highest level post DHAV-A MY strain injection (P<0.01).The results indicated that attenuated DHAV-A MY strain could stimulate the transcription of anti-viral cytokines IFN-α,IFN-β,IFN-γ and TNF-α,as well as proinflammatory cytokines IL-1β,IL-2,IL-6 and IL-8,our results enrich the immunization mechanism of DHAV-A MY strain. duck hepatitis A virus genotype A;attenuated strain;cytokine;RRT-PCR 10.11843/j.issn.0366-6964.2016.06.017 2015-11-25 中央高校基本科研业务费专项资金项目(2014NZYQN58); 国家民委科技项目(14XNZ025) 张焕容(1968-),女,重庆江津人,博士,教授,主要从事动物传染病研究,Tel:028-85522727 张焕容, E-mail:zhrong05@163.com S855.3 A 0366-6964(2016)06-1215-07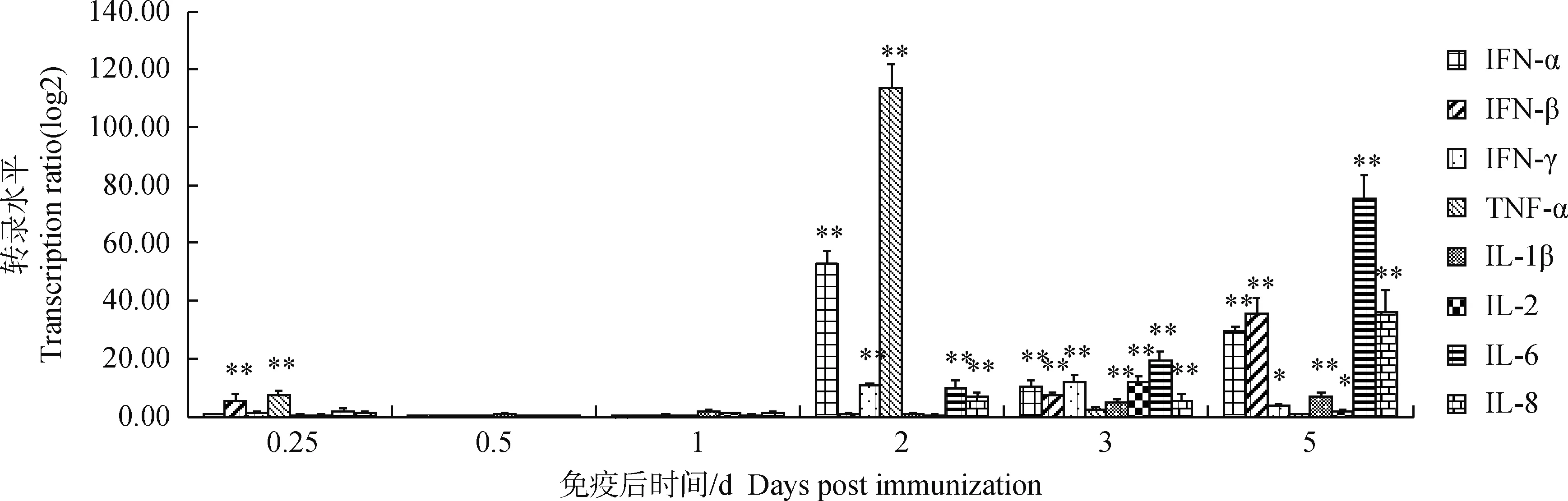

3 讨 论
4 结 论
