掺杂H2和CO2对二甲醚燃烧的耦合化学作用研究*
2016-07-14南京理工大学能源与动力工程学院南京210094
潘 伟,刘 冬(南京理工大学,能源与动力工程学院,南京 210094)
掺杂H2和CO2对二甲醚燃烧的耦合化学作用研究*
潘 伟,刘 冬†
(南京理工大学,能源与动力工程学院,南京 210094)
摘 要:对掺杂H2和CO2的二甲醚预混火焰进行研究,分析H2和CO2的化学效应对二甲醚燃烧火焰温度、主要产物、中间产物和自由基的耦合影响。结果表明,在10%H2条件下,CO2浓度越高,其化学效应对温度下降,二甲醚消耗,乙炔、甲醛、乙醛及H生成的抑制作用越强,对O、OH生成的促进作用也越强;H2的化学效应对温度升高和二甲醚燃烧的促进作用随CO2浓度升高而增强,对H生成的促进作用随CO2浓度升高而减弱,对O、OH、乙炔、甲醛及乙醛生成的促进作用与CO2浓度无关。
关键词:二甲醚火焰;氢气;二氧化碳;化学动力学分析
0 引 言
随着全球范围内化石燃料储量的急剧减少以及环境保护带来的压力,科学界开始寻找替代能源。二甲醚(CH3OCH3, DME)凭借低污染物排放、高十六烷值等特性而受到广泛的关注[1-3]。COOL等[4]测量了低压条件下二甲醚/氧气/氩气预混火焰中21种物质的摩尔分数分布。XU等[5]对低压下二甲醚/氧气/氩气和乙醇/氧气/氩气预混火焰进行了新的主要中间产物的探测并测量其摩尔分数。氢气燃烧在理论上不产生任何污染物,并且具有火焰传播速度快、点火能量低等特性,也成为可再生燃料的研究热点[6-7]。LIU[8]探究了氢气的化学效应以及稀释和热效应对二甲醚火焰的影响。二氧化碳是废气再循环(Exhaust Gas Recirculation,EGR)的主要成分之一,其对火焰燃烧的影响也是研究的焦点[9-10]。LIU等[11]通过数值模拟和实验验证的方法研究了二氧化碳对二甲醚火焰的影响。但是,目前的研究只关注了单独氢气或二氧化碳对二甲醚火焰的影响。因此,本文将探讨两者同时存在的情况下,对二甲醚火焰结构产生的耦合作用影响。
1 动力学模型及分析方法
本研究中采用的动力学机理是在 ZHAO机理[12]的基础上修正过的新机理[11],其准确性已被多种实验装置的实验结果所证实[11-12]。该机理包含了56种物质和 296个基元反应。该修正机理也包含了BURKE等[13]发展的氢气详细反应机理。通过修改的Chemkin II/Premix模块[14]对一维层流二甲醚/氢气/二氧化碳/氩气预混火焰的化学动力学进行模拟。本次模拟的计算区域从上游的 -2 cm到下游的10 cm,确保火焰在下游边界处达到绝热平衡。上游的初始温度和初始压力分别设定为300 K和1 bar。国际上在燃烧化学的研究中通常使用富燃料工况[7-8,11,15],因此本研究亦将各个工况当量比保持在 1.5的富燃料状态。火焰工况见表1。
DU 等[16]指出燃料中添加物的影响可以分为三类:热效应、稀释效应和化学效应。为了将化学效应与稀释和热效应区分开,我们采用加入虚拟氢气(FH2)和虚拟二氧化碳(FCO2)的分析方法。虚拟物质拥有与真实物质完全相同的热物性参数、输运参数和第三体碰撞效率,但是不参加任何化学反应。而当加入虚拟氢气时,为了保证当量比不变,则需要将虚拟氢气所对应的氧气量设为虚拟氧气(FO2)[8]。
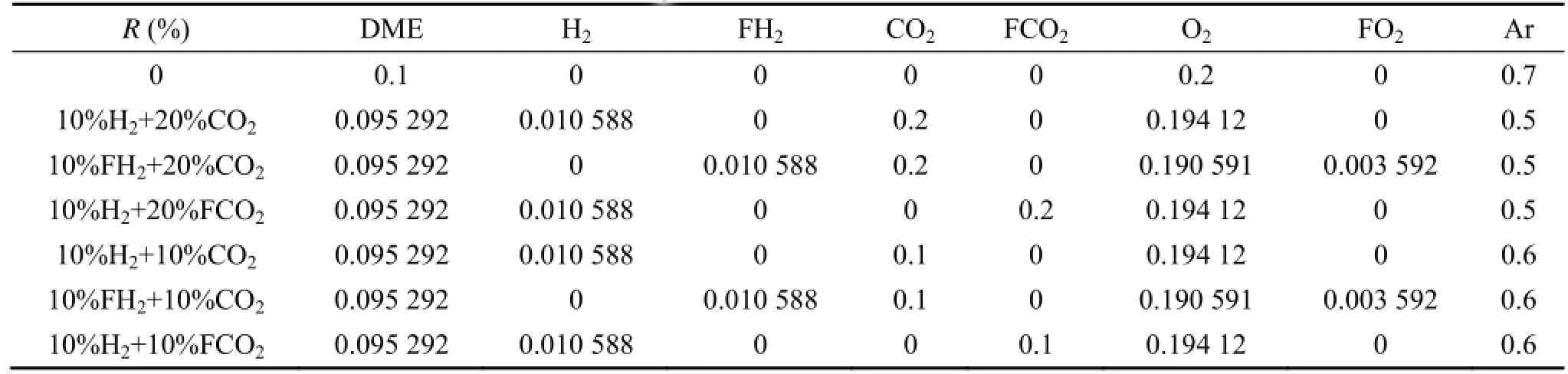
表1 混合燃料中各个组成物质的摩尔分数(当量比为1.5,1 bar)Table 1 Mole fraction of blended fuels at 1 atm with equivalence ratio of 1.5
2 结果与讨论
2.1 对温度分布的影响
不添加物质、10%H2+ 20%CO2、10%FH2+ 20%CO2、10%H2+ 20%FCO2、10%H2+ 10%CO2、10%FH2+ 10%CO2、10%H2+ 10%FCO2七种工况下二甲醚燃烧火焰温度的变化曲线如图1所示。比较曲线10%H2+ 20%CO2和10%H2+ 20%FCO2可以看出,在10%H2存在情况下,20%CO2的化学效应使温度略微下降。比较曲线10%H2+ 10%CO2和10%H2+ 10%FCO2之间的差异得出,在10%H2情况下,10%CO2的化学效应也使温度略微下降,且下降幅度比20%CO2化学效应所引起的下降幅度要小。通过比较曲线 10%H2+ 20%FCO2和 10%H2+ 10%FCO2可以看出,在10%H2存在条件下,20%CO2的稀释效应和热效应要强于 10%CO2,使温度发生较大幅度的下降。而曲线10%H2+ 20%CO2和10%H2+ 10%CO2之间的差异表明,在10%H2存在条件下,20%CO2的综合效应所引起温度的下降要强于10%CO2引起的下降。类似地,比较曲线 10%H2+ 20%CO2和10%FH2+ 20%CO2可以看出在20%CO2存在情况下,10%H2的化学效应使温度略微升高。而比较曲线10%H2+ 10%CO2和10%FH2+ 10%CO2表明在10%CO2存在情况下,10%H2的化学效应也使温度略微升高,且在20%CO2情况下10%H2的化学效应要强于10%CO2情况下的10%H2。可以得出在温度影响方面,CO2的存在对于H2的化学效应有一定的增强效用。
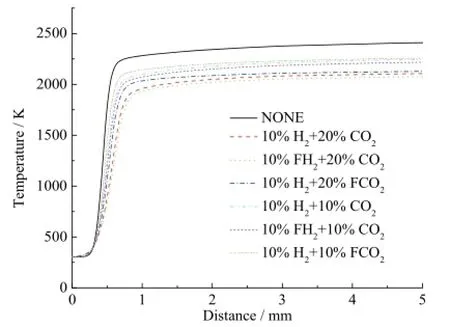
图1 不同二氧化碳和氢气含量下二甲醚预混火焰的温度曲线Fig. 1 DME flames temperature with H2and CO2additions
2.2 对二甲醚摩尔分数分布的影响
图2为七种不同工况下二甲醚的摩尔分数分布。可知,添加氢气和二氧化碳均不同程度地抑制了二甲醚的燃烧。比较曲线 10%H2+ 20%CO2和10%H2+ 20%FCO2以及10%H2+ 10%CO2和10%H2+ 10%FCO2可以看出,在 10%H2存在条件下,20%CO2的化学效应对二甲醚燃烧的抑制程度要强于10%CO2。又可比较10%H2+ 20%FCO2和10%H2+ 10%FCO2,可以明显看出在10%H2存在条件下,20%CO2的稀释和热效应对二甲醚反应的抑制强度要强于10%CO2。而通过比较10%H2+ 20%CO2和10%H2+ 10%CO2可以得出,在10%H2存在条件下,20%CO2的综合效应对二甲醚燃烧的抑制要强于10%CO2。类似地,由图2可得,20%CO2存在条件下的10%H2化学效应对二甲醚燃烧的促进作用要强于在10%CO2条件下的10%H2。对于二甲醚燃烧,CO2的存在对H2的化学效应有一定的增强效用。
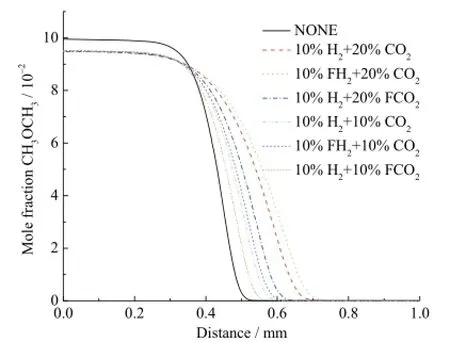
图2 不同工况下二甲醚的摩尔分数分布曲线Fig. 2 Mole fraction of DME profiles with different additions
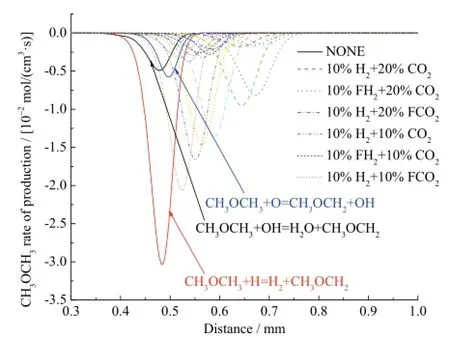
图3 不同工况下二甲醚的反应速率Fig. 3 Rate of production for DME with different additions
图3是不同工况下二甲醚的反应速率曲线,二甲醚燃烧反应的主要反应式为CH3OCH3+ H = H2+ CH3OCH2,CH3OCH3+ O = CH3OCH2+ OH和CH3OCH3+ OH = H2O + CH3OCH2。如图所示,在10%H2存在条件下,20%CO2的综合效应对二甲醚燃烧反应的抑制作用要强于 10%CO2;在 20%CO2存在条件下的10%H2化学效应对二甲醚燃烧反应的促进作用要强于10%CO2存在条件下的10%H2。
2.3 对自由基生成的影响
从上述二甲醚的主要反应式中看出,自由基H、O、OH在其中发挥了重要的作用,因此,下面将讨论氢气和二氧化碳对自由基生成的影响。
不同的工况下自由基H的摩尔分数分布如图4所示。通过比较曲线10%H2+ 20%CO2和10%H2+ 20%FCO2以及 10%H2+ 10%CO2和 10%H2+ 10%FCO2之间的差别,可知,在10%H2存在条件下,20%CO2的化学效应对H生成的抑制作用强度要大于 10%CO2。通过比较曲线 10%H2+ 20%FCO2和10%H2+ 10%FCO2可知,在 10%H2存在条件下,20%CO2的稀释和热效应对H生成的抑制作用要强于10%CO2。通过曲线10%H2+ 20%CO2和10%H2+ 10%CO2可以得出,在 10%H2的条件下,20%CO2的综合效应对H生成的抑制作用要强于10%CO2。同样地,由图可知,在10%CO2条件下 10%H2的化学效应对H生成的促进作用强度要强于20%CO2条件下的10%H2。对于H生成,CO2对H2的化学效应具有抑制作用。
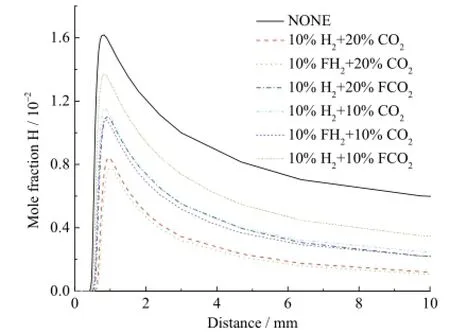
图4 不同工况下自由基H的摩尔分数分布曲线Fig. 4 Mole fraction of H radical with different additions
图5为不同工况下自由基H的反应速率曲线,生成H的主要反应为HCO(+M) = H + CO(+M) 和H2+ OH = H2O + H,消耗H的主要反应为H + O2=O + OH,CH2O + H = HCO + H2和CH3OCH3+ H = H2+ CH3OCH2。如图5所示,在10%H2存在条件下,20%CO2的综合效应对H反应的抑制作用要强于10%CO2;20%CO2条件下10%H2的化学效应对H反应的促进作用要弱于10%CO2条件下的10%H2。
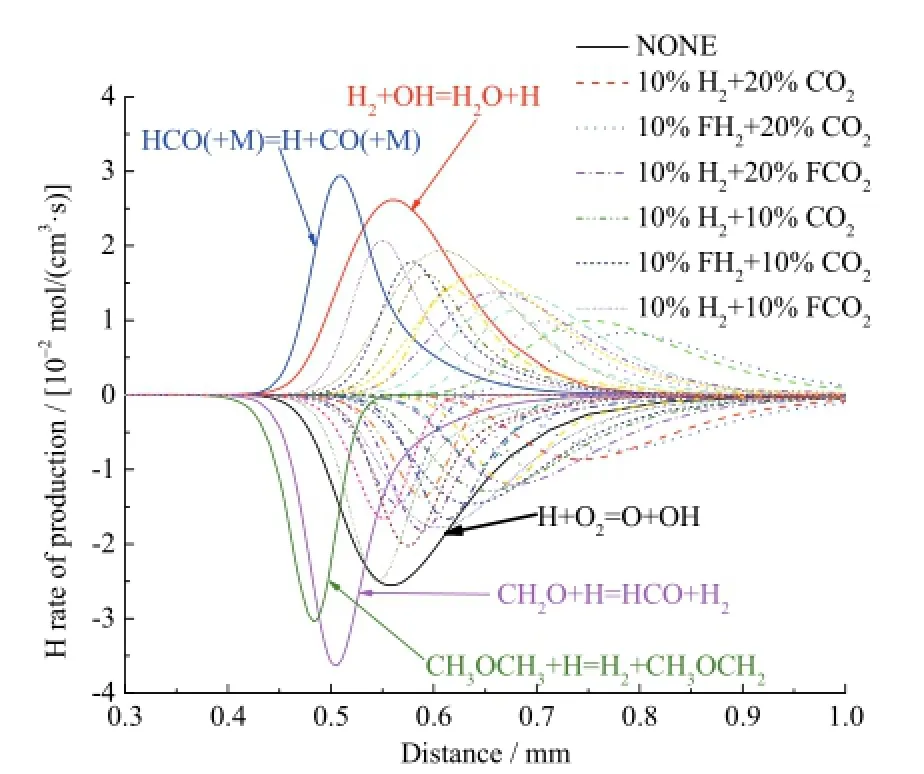
图5 不同工况下自由基H的反应速率Fig. 5 Rate of production for H radical with different additions
在图6中,通过比较10%H2+ 20%CO2和10%H2+ 20%FCO2以及 10%H2+ 10%CO2和 10%H2+ 10%FCO2可得出,在10%H2存在条件下,20%CO2的化学效应对 O生成的促进作用强度要强于10%CO2。比较 10%H2+ 20%FCO2和 10%H2+ 10%FCO2两者的差异,知道在10%H2存在条件下,20%CO2的稀释和热效应对O反应的抑制作用强于10%CO2。再通过比较曲线 10%H2+ 20%CO2和10%H2+ 10%CO2,容易知道在 10%H2条件下,20%CO2的综合效应对 O生成的抑制作用要强于10%CO2,可知,相对于化学效应,在 10%H2存在条件下,CO2的稀释和热效应占主导地位。同样地,通过比较10%H2+ 20%CO2和10%FH2+ 20%CO2之间的差异及10%H2+ 10%CO2和10%FH2+ 10%CO2之间的不同,可知在CO2存在条件下,H2的化学效应对O生成具有促进作用,并且在10%CO2条件下的10%H2的化学效用强度基本等同于20%CO2条件下的10%H2,即对于O生成,CO2对H2的化学效应基本无影响。
不同工况下自由基O的反应速率如图7所示,生成O的主要反应为H+O2=O+OH,消耗O的反应主要为O+H2=H+OH。在10%H2存在条件下,20%CO2的综合效应对O反应的抑制作用要强于10%CO2的综合效应;在10%CO2存在条件下10%H2的化学效应对O反应的促进作用与20%CO2条件下10%H2的基本一致。
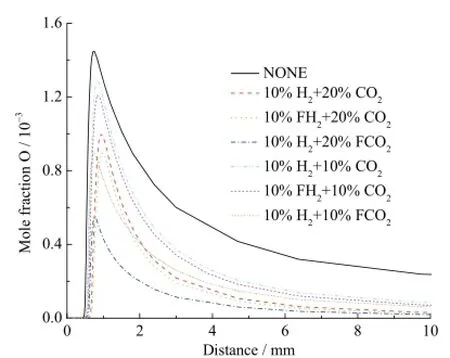
图6 不同工况下自由基O的摩尔分数分布曲线Fig. 6 Mole fraction of H radical with different additions
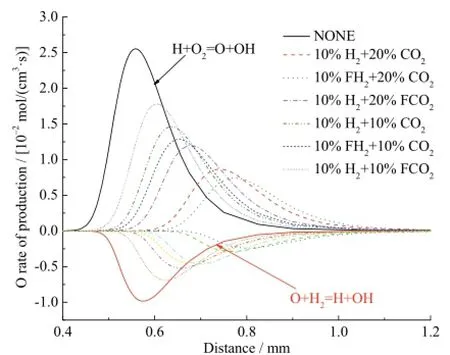
图7 不同工况下自由基O的反应速率Fig. 7 Rate of production for O radical with different additions
图8是不同工况下自由基OH的摩尔分数分布曲线。如图8所示,在10%H2存在条件下,20%CO2的化学效应对OH生成的促进作用要强于10%CO2的化学效应;在10%H2存在条件下,20%CO2的稀释和热效应对O生成的抑制作用要强于10%CO2。通过比较曲线10%H2+20%CO2和10%H2+10%CO2,可知在10%H2条件下,20%CO2综合效应对OH生成的抑制作用要比10%CO2更强。根据上述分析,相对于化学效应,在10%H2存在条件下,CO2的稀释和热效应起主导作用。类似地,不难看出,10%CO2条件下10%H2的化学效应对OH生成的促进作用强度与20%CO2条件下10%H2的强度基本相同。可得出对于OH生成,CO2对H2的化学效应基本无影响。
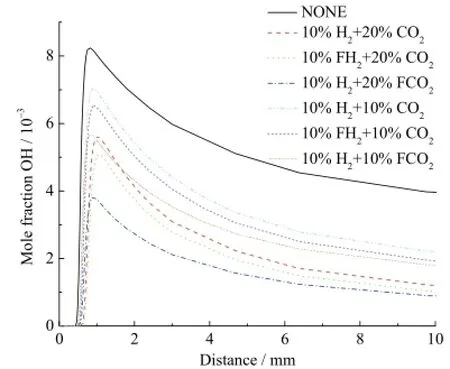
图8 不同工况下自由基OH的摩尔分数分布曲线Fig. 8 Mole fraction of OH radical with different additions
图9为不同工况下自由基OH的反应速率曲线,生成OH的主要反应是H+O2=O+OH,消耗OH的主要反应是H2+OH=H2O+H。如图9所示,在10%H2存在条件下,20%CO2综合效应对OH反应的抑制作用要强于10%CO2;20%CO2条件下10%H2的化学效应对OH反应的促进作用与10%CO2条件下10%H2的化学效应强度大体一致。
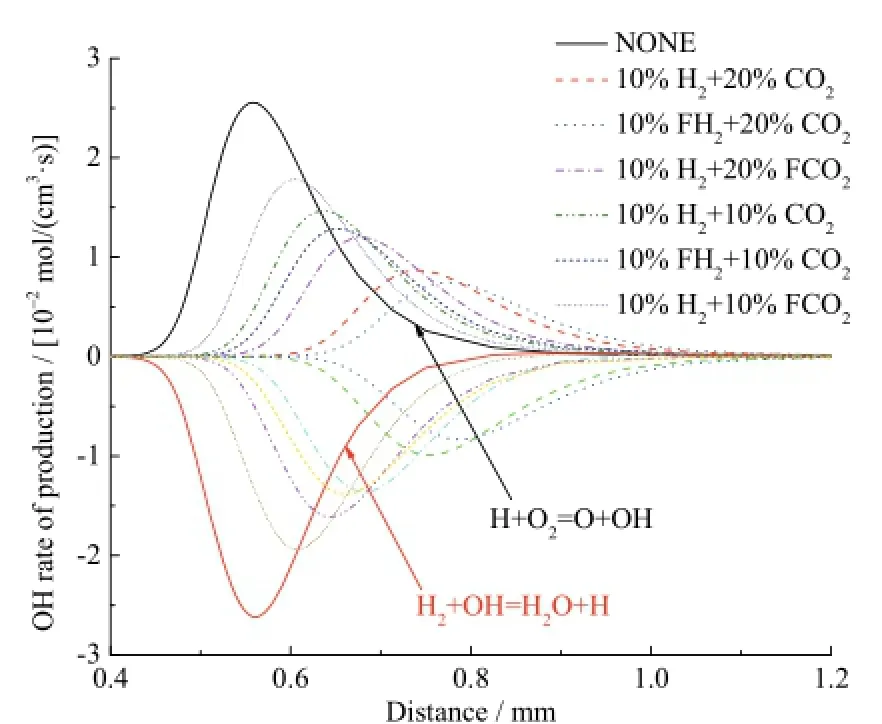
图9 不同工况下自由基OH的反应速率Fig. 9 Rate of production for OH radical with different additions
2.4 对主要中间产物的影响
由于乙炔(C2H2)是重要的烟黑前驱物,它直接影响到烟黑的生成,而甲醛(CH2O)和乙醛(CH3CHO)亦是重要污染物,因此在这一部分将主要讨论氢气和二氧化碳对乙炔、甲醛和乙醛的影响。
不同工况下乙炔的摩尔分数分布曲线如图 10所示。通过图中曲线比较可得出,在 10%H2存在条件下,10%CO2和20%CO2的化学效应均抑制乙炔的生成,并且20%CO2化学效应对C2H2反应的抑制作用要强于10%CO2。而在10%H2存在条件下,20%CO2的稀释和热效应对C2H2生成的抑制作用与10%CO2基本相同。比较曲线 10%H2+20%CO2和10%H2+10%CO2,知道在 10%H2存在情况下,20%CO2综合效应对 C2H2生成的抑制作用要强于10%CO2。类似地,在 CO2存在情况下,10%H2的化学效应均对乙炔生成有促进作用,并且 20%CO2条件下10%H2化学效应的强度与10%CO2条件下的10%H2下相比基本无变化。对于乙炔的生成,CO2对H2的化学效应基本无影响。
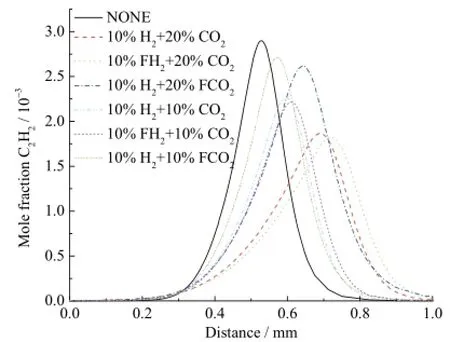
图10 不同工况下乙炔的摩尔分数分布曲线Fig. 10 Mole fraction of C2H2with different additions
图11是不同工况下乙炔的反应速率曲线,生成乙炔的主要反应是 H+C2H2(+M)=C2H3(+M)和C2H3+H=C2H2+H2,消耗乙炔的主要反应是C2H2+O=HCCO+H。如图11所示,在10%H2存在的条件下,20%CO2综合效应对乙炔反应的抑制作用强度比10%CO2大;20%CO2条件下的10%H2化学效应对乙炔反应的促进作用强度与10%CO2条件下的10%H2基本相等。
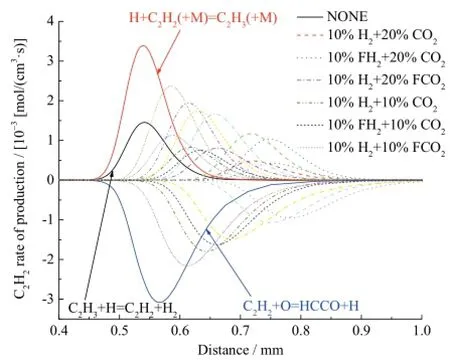
图11 不同工况下乙炔的反应速率Fig. 11 Rate of production for C2H2with different additions
图12是不同工况下CH2O的摩尔分数分布曲线。由图可知在10%H2存在的条件下,20%CO2的化学效应对甲醛生成的抑制作用强度要强于10%CO2。比较10%H2+20%FCO2和 10%H2+ 10%FCO2的差异可得到,在 10%H2存在条件下,20%CO2的稀释和热效应对甲醛生成的抑制作用强度要强于 10%CO2。而比较 10%H2+20%CO2和10%H2+10%CO2得,在10%H2存在条件下,20%CO2综合效应对甲醛生成的抑制作用要强于10%CO2。同样地,20%CO2条件下10%H2的化学效应对甲醛生成的促进作用与10%CO2条件下的10%H2基本一致。对于甲醛的生成,CO2对H2的化学效应基本无影响。
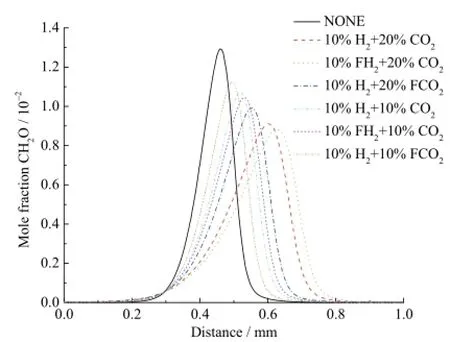
图12 不同工况下甲醛的摩尔分数分布曲线Fig. 12 Mole fraction of CH2O with different additions
不同工况下甲醛的反应速率曲线如图13,生成甲醛的主要反应是 CH3OCH2=CH2O+CH3,消耗甲醛的主要反应是CH2O+H=HCO+H2。由图中曲线可得,在10%H2条件下,20%CO2综合效应对甲醛反应的抑制作用要强于 10%CO2;20%CO2条件下10%H2化学效应对甲醛反应的促进作用大体等同于10%CO2条件下的10%H2。
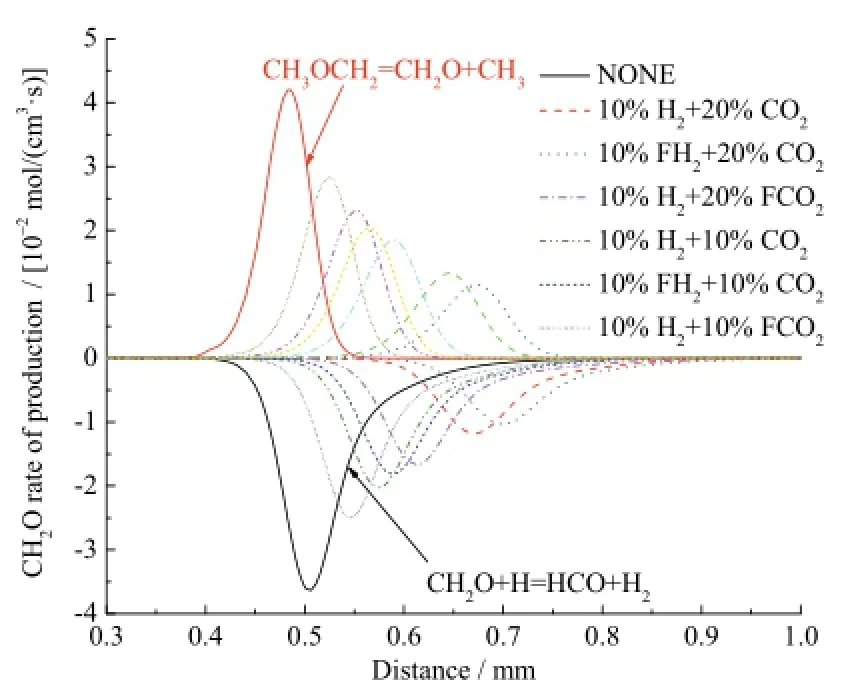
图13 不同工况下甲醛的反应速率Fig. 13 Rate of production for CH2O with different additions
图14是不同工况下乙醛的摩尔分数分布曲线。在10%H2存在的条件下,20%CO2化学效应对乙醛生成的抑制作用要强于 10%CO2。比较 10%H2+ 20%FCO2和 10%H2+ 10%FCO2的不同,表明在10%H2存在条件下,20%CO2的稀释和热效应对乙醛生产的抑制作用强度比10%CO2更大。而10%H2+ 20%CO2和10%H2+ 10%CO2之间的不同,表明在10%H2存在条件下,20%CO2综合效应对乙醛生成的抑制作用要强于 10%CO2。类似地,可知在20%CO2条件下10%H2化学效应对乙醛生成的促进作用和10%CO2条件下10%H2相比基本相同。对于乙醛的生成,CO2对于H2化学效应基本没有影响。
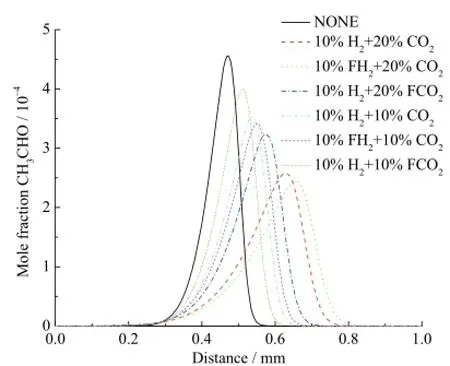
图14 不同工况下乙醛的摩尔分数分布曲线Fig. 14 Mole fraction of CH3CHO with different additions
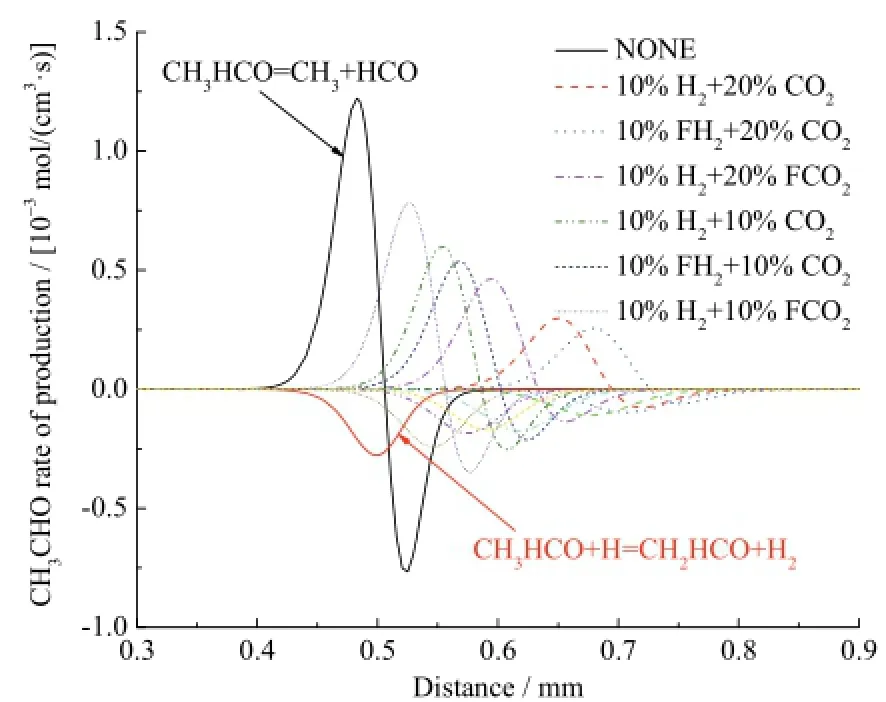
图15 不同工况下乙醛的反应速率Fig. 15 Rate of production for CH3CHO with different additions
不同工况下乙醛的反应速率曲线如图15,生成乙醛的主要反应是CH3HCO = CH3+ HCO,消耗乙醛的主要反应是CH3CHO + H = CH2HCO + H2。如图15所示,在10%H2存在条件下,20%CO2综合效应对乙醛反应的抑制作用要强于10%CO2;20%CO2条件下10%H2的化学效应对乙醛反应的促进作用与10%CO2条件下10%H2大体相等。
3 结 论
本次课题通过模拟计算的方法,研究了二甲醚/氢气/二氧化碳/氩气预混燃料的火焰结构,探讨了在氢气和二氧化碳同时存在的情况下,对二甲醚燃料燃烧的影响。本次研究的主要结论有:
(1)在10%H2存在条件下,二氧化碳化学效应降低火焰温度,抑制二甲醚的燃烧,抑制乙炔、甲醛、乙醛和H自由基的生成,并且随着CO2浓度的升高,其抑制作用的强度更强;
(2)在10%H2存在条件下,CO2的化学效应对O和OH自由基生成有促进作用,且强度随CO2浓度升高而增强;
(3)在CO2存在条件下,H2化学效应使温度升高,促进二甲醚的燃烧,且其强度随着CO2浓度升高而增强;
(4)H2化学效应对H自由基生成有促进作用,且其强度随着CO2浓度升高而减弱;
(5)H2化学效应对O、OH、乙炔、甲醛和乙醛生成有促进作用,且其强度与CO2浓度无关。
参考文献:
[1] SEMELSBERGER T A, BORUP R L, GREENE H L. Dimethyl ether (DME) as an alternative fuel[J]. Journal of power sources, 2006, 156(2): 497-511. DOI: 10.1016/ j.jpowsour.2005.05.082.
[2] XUE Y, JU Y G. Studies on the liftoff properties of dimethyl ether jet diffusion flames[J]. Combustion science and technology, 2006, 178(12): 2219-2247. DOI: 10.1080/00102200600626140.
[3] HANSEN J B, VOSS B, JOENSEN F, et al. Large scale manufacture of dimethyl ether-a new alternative diesel fuel from natural gas[R]. SAE Technical Paper 950063,1995. DOI: 10.4271/950063.
[4] COOL T A, WANG J, HANSEN N, et al. Photoionization mass spectrometry and modeling studies of the chemistry of fuel-rich dimethyl ether flames[J]. Proceedings of the Combustion Institute, 2007, 31(1): 285-293. DOI: 10.1016/j.proci.2006.08.044.
[5] XU H J, YAO C D, YUAN T, et al. Measurements and modeling study of intermediates in ethanol and dimethy ether low-pressure premixed flames using synchrotron photoionization[J]. Combustion and flame, 2011, 158(9): 1673-1681. DOI: 10.1016/j.combustflame.2011.01.004.
[6] WANG J H, HUANG Z H, TANG C L, et al. Numerical study of the effect of hydrogen addition on methane-air mixtures combustion[J]. International journal of hydrogen energy, 2009, 34(2): 1084-1096. DOI: 10.1016/j.ijhydene. 2008.11.010.
[7] LIU J, WANG H W, OUYANG M G. Kinetic modeling study of hydrogen addition to premixed dimethyl ether-oxygen-argon flames[J]. International journal of hydrogen energy, 2011, 36(24): 15860-15867. DOI: 10.1016/j.ijhydene.2011.09.024.
[8] LIU D. Kinetic analysis of the chemical effects of hydrogen addition on dimethyl ether flames[J]. International journal of hydrogen energy, 2014, 39(24): 13014-13019. DOI: 10.1016/j.ijhydene.2014.06.072.
[9] LIU F S, GUO H S, SMALLWOOD G J, et al. The chemical effects of carbon dioxide as an additive in an ethylene diffusion flame: implications for soot and NOx formation[J]. Combustion and flame, 2001, 125(1/2): 778-787. DOI: 10.1016/S0010-2180(00)00241-8.
[10] SCHUG K P, MANHEIMER-TIMNAT Y, YACCARINO P, et al. Sooting behavior of gaseous hydrocarbon diffusion flames and the influence of additives[J]. Combustion science and technology, 1980, 22(5/6): 235-250. DOI: 10.1080/00102208008952387.
[11] LIU D, SANTNER J, TOGBÉ C, et al. Flame structure and kinetic studies of carbon dioxide-diluted dimethyl ether flames at reduced and elevated pressures[J]. Combustion and flame, 2013, 160(12): 2654-2668. DOI: 10.1016/j.combustflame.2013.06.032.
[12] ZHAO Z W, CHAOS M, KAZAKOV A, et al. Thermal decomposition reaction and a comprehensive kinetic model of dimethyl ether[J]. International journal of chemical kinetics, 2008, 40(1): 1-18. DOI: 10.1002/kin.20285.
[13] BURKE M P, CHAOS M, JU Y G, et al. Comprehensive H2/O2kinetic model for high-pressure combustion[J]. International journal of chemical kinetics, 2012, 44(7): 444-474. DOI: 10.1002/kin.20603.
[14] KEE R J, GRCAR J F, SMOOKE M D, et al. PREMIX: a fortran program for modeling steady laminar one-dimensional premixed flames[R]. Albuquerque,USA: Sandia National Laboratories 1985, Modification of PREMIX Version 2.5, 1991.
[15] CHEN Z Y, WEI L X, GU X L, et al. Study of low-pressure premixed dimethyl ether/hydrogen/oxygen/ argon laminar flames with photoionization mass spectrometry[J]. Energy fuels, 2010, 24(3): 1628-1635. DOI: 10.1021/ef901314r.
[16] DU D X, AXELBAUM R L, LAW C K. The influence of carbon dioxide and oxygen as additives on soot formation in diffusion flames[J]. Symposium (international) on combustion, 1990, 23(1): 1501-1507. DOI: 10.1016/ S0082-0784(06)80419-4.
Coupled Chemical Effects of Carbon Dioxide and Hydrogen Additions on Dimethyl Ether Flames
PAN Wei, LIU Dong
(School of Energy and Power Engineering, Nanjing University of Science and Technology, Nanjing 210094, China)
Abstract:Kinetic analysis about coupled chemical effects of CO2and H2additions on laminar premixed dimethyl ether flames is performed. The coupled chemical effects of CO2and H2addition are analyzed on aspects of temperature, major species, intermediate stable species and radicals. The result shows that when H2is added, the CO2chemical effects, which can decrease the temperature, the DME oxidation, the production of C2H2, CH2O, CH3CHO and H radical but promote the production of O and OH radicals, would varies directly with the CO2concentration. However, CO2addition can strengthen the H2chemical effects on increasing the temperature and DME consumption, but mitigate the H2chemical effects on reducing the H mole fraction. And the CO2concentration did not have obvious influence on the H2chemical effects on increasing the production of O, OH, C2H2, CH2O and CH3CHO.
Key words:dimethyl ether flames; hydrogen; carbon dioxide; chemical kinetic analysis
中图分类号:TK6;TK91
文献标志码:A
doi:10.3969/j.issn.2095-560X.2016.02.001
文章编号:2095-560X(2016)02-0081-07
* 收稿日期:2016-02-26
修订日期:2016-03-17
基金项目:国家自然科学基金(51306091,51576100);江苏省杰出青年基金(BK20140034);江苏省自然科学基金(BK20130758);江苏省“ 六大人才高峰”(2014-XNY-002)
通信作者:†刘 冬,E-mail:dongliu@njust.edu.cn
作者简介:
潘 伟(1990-),男,硕士研究生,主要从事含氧燃料燃烧研究。
刘 冬(1982-),男,博士,教授,博士生导师,德国洪堡学者,主要从事先进燃烧与污染控制等方面的研究。
