玉米1-吡咯啉-5-羧酸合成酶在非生物胁迫下的表达分析
2016-07-13决登伟胡会刚赵秋芳贾利强
董 晨,决登伟,胡会刚,赵秋芳,贾利强
(中国热带农业科学院南亚热带作物研究所/农业部热带果树生物学重点实验室,广东 湛江 524091)
玉米1-吡咯啉-5-羧酸合成酶在非生物胁迫下的表达分析
董 晨,决登伟,胡会刚,赵秋芳,贾利强
(中国热带农业科学院南亚热带作物研究所/农业部热带果树生物学重点实验室,广东 湛江 524091)
摘 要:脯氨酸在植物渗透调节中起举足轻重的作用,1-吡咯啉-5-羧酸合成酶(P5CS)是脯氨酸的谷氨酸合成途径中的关键酶,为了研究玉米P5CS基因家族与玉米抗逆性的关系,对玉米幼苗进行了非生物胁迫(干旱、低温、盐胁迫)处理,利用半定量RT-PCR技术分析了ZMP5CS基因家族在不同胁迫条件下的表达特性。结果表明,ZMP5CS基因家族中除ZM02G27230以外的基因不论地上部叶还是地下部根均被干旱胁迫诱导上调表达,但各成员之间其表达量最高点出现的时间不同;相同处理同一基因相同的处理时间点地上部与地下部基因表达量存在差异,在干旱胁迫下ZM08G14210的表达量最高,在盐胁迫下ZM08G31890的表达量最高,在低温胁迫下ZM06G25580的表达量最高,说明ZMP5CS基因家族表达受非生物胁迫的诱导。
关键词:玉米;1-吡咯啉-5-羧酸合成酶(P5CS);非生物胁迫;表达分析;半定量RT-PCR
冷害、干旱、高盐等非生物胁迫严重影响农作物的生长发育,尤其是影响粮食作物的产量[1-2]。我国玉米种植面积居世界第2位,其中约2/3是旱地种植,从播种到收获的全生育期都可遇到干旱。干旱脱水产生渗透胁迫可致玉米减产25%~30%,严重时可导致绝收[3]。盐胁迫等其他非生物逆境也可能产生渗透胁迫[4]。提高玉米渗透胁迫抗性是改善玉米对干旱为主的多种非生物胁迫抗性的重要手段,揭示玉米对渗透胁迫的抗性机制是抗逆育种和栽培技术改良的理论基础。
在渗透胁迫下可积累大量的脯氨酸,脯氨酸是重要渗透调节物质,高等植物体内有谷氨酸途径和鸟氨酸途径来合成脯氨酸[5]。谷氨酸向脯氨酸转化有2个关键酶,即吡咯啉-5-羧酸还原酶(P5CR)和吡咯啉-5-羧酸合成酶(P5CS)。P5CS是一个双功能酶,催化谷氨酸磷酸化及谷氨酸γ半醛还原,其活性受脯氨酸反馈抑制[6-7]。P5CS基因受ABA、干旱、盐胁迫诱导,但它不受热或低温所诱导[8]。拟南芥脱水处理2 h后,P5CS基因mRNA表达量在10 h之内随胁迫的时间延续而不断增加,其后一直保持这一水平。胁迫处理10 h后,复水5 h后转录水平显著下降,回复到脱水处理前的程度[9]。Verbruggen等[10]报道,盐胁迫下拟南芥的叶和根里P5CS基因转录的mRNA水平提高到10倍以上。拟南芥的AtP5CS1 和AtP5CS2具有不同的时间和空间表达特点,AtP5CS1基因在所有的组织中都具有较高的表达活性,并且在ABA处理,脱水和高盐下主要是上调表达;而AtP5CS2基因则在分生组织受到ABA或高盐胁迫的刺激时优先表达[8,11]。Fujita等[12]研究表明,番茄在NaCl胁迫下,tomPRO2的mRNA表达量提高到3倍以上,而tomPRO1的信息没有表达。因此,同一类植物P5CS基因可以对不同的逆境胁迫作出反应,而不同的P5CS基因也可以受同一种胁迫诱导表达。从高粱中分离到的两个P5CS基因序列,在高盐和干旱处理下表达上调,但两个基因的时空表达存在差异,SbP5CS2基因呈组成型表达,而SbP5CS1主要在成熟营养和生殖器官中表达[13]。Chen等[14]将普通菜豆的两个PvP5CS1和PvP5CS2基因序列转化拟南芥,两个基因的表达量在转基因植株与对照植株在盐胁迫下的表达量要高,耐盐性增强。Guerzoni等[15]将豇豆P5CS转化甘蔗,盐胁迫下转基因植株的表达量比对照高,耐盐性增强。
目前关于玉米吡咯啉- 5 -羧酸合成酶(ZMP5CS)的鉴定及其功能研究,国内外尚少有报道。本研究利用半定量RT-PCR技术全面分析了玉米基因组中整个P5CS基因家族在干旱、高盐和低温胁迫条件下玉米叶和根中ZMP5CS的表达特性,为进一步利用ZMP5CS改良玉米的抗逆性及其基因生物学功能及其应用提供基础。
1 材料与方法
1.1 试验材料
供试材料为郑单958,来源于中国热带农业科学院玉米研究中心。
1.2 试验方法
1.2.1 P5CS基因数据来源及进化分析 ZMP5CS基因、蛋白和CDS数据来源于MaizeGDB(Maize Genetics and Genomics Database)数据库(http://www.maizegdb.org/)的玉米B73全基因组数据。玉米P5CS蛋白同源的拟南芥蛋白序列来源于Tair (http://www.arabidopsis.org/index.jsp)网站。玉米P5CS蛋白同源的水稻蛋白序列来源于Rice Annotation Project Database(http://rice.plantbiology. msu.edu/)。GreenPhylDB(http://www.greenphyl. org/cgi-bin/index.cgi)分析P5CS基因家族在不同物种的分布情况。同时采用MEGA5.1对玉米P5CS蛋白和拟南芥、水稻蛋白构建系统进化树。参数设置:使用Neighbor-joining法则的P-距离(P-distance)模型构建,选择成对删除(paiwise deletion)空位(gap)的选项,Bootstrap method取值1 000。
1.2.3 ZMP5CS在不同外源胁迫下的表达特性分析 (1)玉米幼苗的干旱胁迫处理:选取长势一致、生长健壮的玉米幼苗进行水培养7 d,在培养液(1/2 Hoagland培养液)中加入20% PEG6000 进行模拟干旱胁迫处理。分别于干旱胁迫 0、1、6 、24 h进行观察和取样,对株苗分地上部叶和地下部根分别取样,立即用液氮速冻备用。
(2)玉米幼苗的盐胁迫处理:选取长势一致、生长健壮的玉米幼苗进行水培养7 d,在培养液(1/2 Hoagland培养液)中加入200 mmol/L NaCl进行盐胁迫处理。分别于盐胁迫 0、1、6、24 h进行观察和取样,对株苗分地上部叶和地下部根分别取样,立即用液氮速冻备用。
(3)玉米幼苗的低温胁迫处理:选取长势一致、生长健壮的玉米土培苗进行水培养7 d,培养液为(1/2 Hoagland培养液)放置4℃培养箱进行低温胁迫处理。分别于低温胁迫 0、1、6 、24 h进行观察和取样,对株苗分地上部叶和地下部根分别取样,立即用液氮速冻备用。
ZMP5CS半定量表达分析:采用植物RNA提取试剂盒(华越洋生物科技有限公司产品)提取玉米总 RNA。每个样品取1μL检测 RNA 质量和浓度后,利用 M-MLV 逆转录酶(TaKaRa 公司)合成 cDNA 链。选用 NCBI上已登录的玉米ZMActin 片段为内参,引物序列根据已登录序列进行设计,查找已测序玉米基因组中所有的ZMP5CS编码序列,设计相应的半定量引物(表1)。PCR反 应 体系为 20μL,PCR 产物的长度为 200 bp左右。半定量PCR 的反应程序如下 :94℃预变性4 min;94℃变性40 s、55℃退火30 s、72℃延伸 30 s,循环 35次。每个反应重复 3 次。PCR 产物在1.5%的琼脂糖凝胶电泳中检测条带的亮度确定基因的相对表达量。

表1 ZMP5CS引物序列
2 结果与分析
2.1 P5CS基因在不同物种的分布及进化分析
利用GreenPhyl在线数据库分析P5CS基因家族在37个物种中共有163个序列(图 1),玉米中有5个P5CS基因,模式植物拟南芥、水稻P5CS基因均为2个。
利用模式植物拟南芥、水稻的P5CS蛋白序列为参考,对玉米基因组中的P5CS蛋白采用邻接法绘制系统进化树,结果见图2,5个ZMP5CS分为两个亚家族,且与水稻的亲缘关系较近,聚类聚在一起。
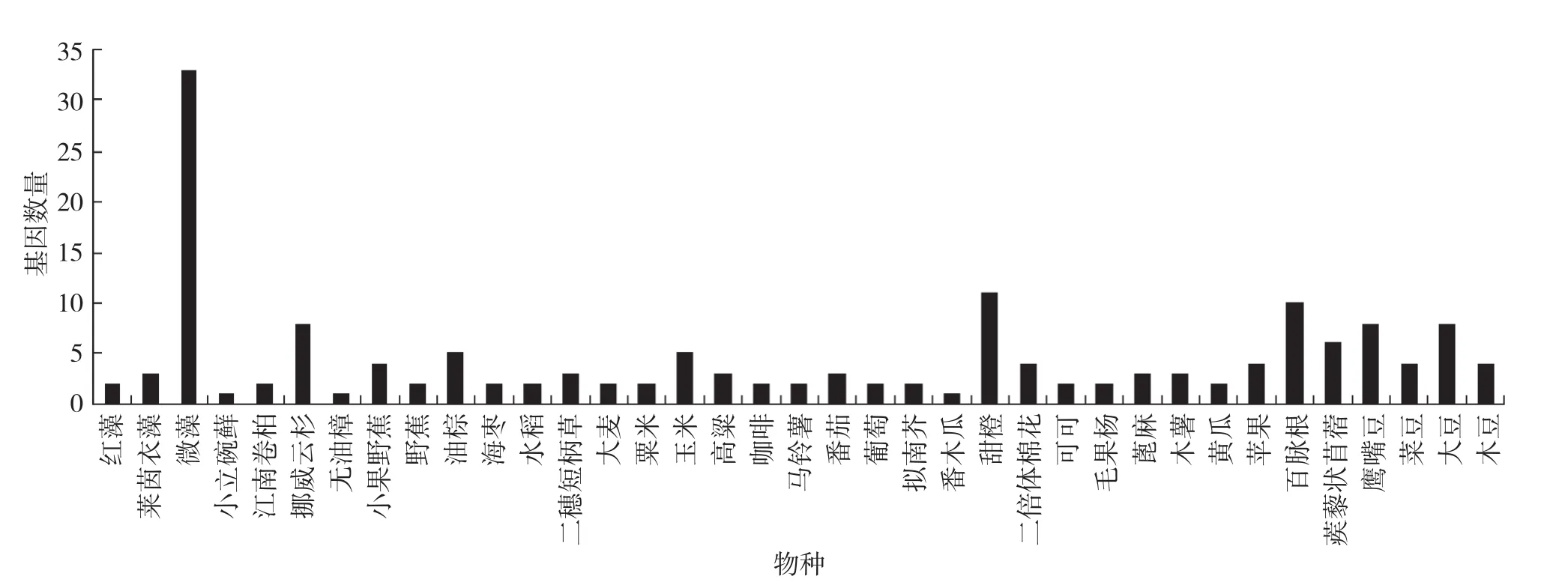
图1 不同物种P5CS基因的分布情况
2.2 干旱胁迫P5CS基因家族表达变化
通过半定量PCR 分析(图3)发现,ZMP5CS家族5个基因中,有5个ZMP5CS除ZM02G27230外均对干旱胁迫响应。干旱处理可以诱导ZM06G25580的表达,其地上部叶中表达量随着干旱处理时间增加呈现降-升-降的趋势;地下部根中表达随着干旱处理时间增加呈现逐步上升趋势,但表达量低于地上部。ZM06G25590地上部叶中表达量随着干旱处理时间的增加呈现升-降的趋势,表达量在干旱胁迫6 h达到最高,干旱胁迫24 h回落到较干旱胁迫0 h稍高的水平;地下部根中表达随着干旱处理时间增加呈现逐步上升趋势,干旱胁迫24 h表达量最高。ZM08G14210的表达最强,其地上部叶中表达量随着干旱胁迫处理时间的增加呈现上升趋势,在干旱胁迫6 h达到最高;地下部根中表达随着干旱处理时间的增加呈现逐步上升趋势,在干旱胁迫24 h达到最高。ZM08G31890地上部叶及地下部根中表达量均随着干旱处理时间的增加呈现逐步上升的趋势,其中地上部叶中在干旱胁迫24 h表达量达到最高,地下部根中干旱胁迫6 h达到最高。
总之,ZMP5CS 受干旱胁迫诱导表达上调,但不同基因间的表达量存在差异,同一基因在不同的组织间表达也存在差异。

图2 拟南芥、水稻和玉米P5CS的邻接法系统进化树

图3 干旱胁迫处理下ZMP5CS的表达

图4 盐胁迫处理下ZMP5CS的表达
2.3 盐胁迫P5CS基因家族表达变化
通过半定量PCR 分析(图4)发现,ZMP5CS家族5个基因中,有5个ZMP5CS基因除了ZM02G27230外均对盐胁迫响应。高盐胁迫处理可以诱导ZM06G25580的表达,其表达趋势与干旱胁迫一致,但地下部该基因的表达量比干旱胁迫高。ZM06G25590基因的表达不论地上部还是地下部其表达量均在盐胁迫6 h达到最高,在盐胁迫6 h地上部表达量要高于地下部;而地上部及地下部盐胁迫1 、24 h表达量低于盐胁迫0 h对照。ZM08G14210的表达趋势呈现为升-降-升,盐胁迫24 h表达量达到最高;地下部根中诱导表达变化不明显,盐胁迫6 h表达量略高于盐胁迫0 h对照,盐胁迫1 h表达量低于盐胁迫0 h对照,盐胁迫24 h表达量与盐胁迫0 h对照相当。ZM08G31890基因的表达在地上部呈现为逐步升高的趋势,在盐胁迫24 h达到最高;地下部根中表达量在盐胁迫1 h到达平台期。
2.4 低温胁迫P5CS基因家族表达变化
通过半定量PCR 分析(图5)发现,ZMP5CS基因家族均响应低温胁迫。受低温胁迫诱导表达上调。ZM02G27230基因在地上部叶中低温胁迫1、6 h检测到表达,但表达量比较低,地下部根中没有检测到表达。ZM06G25580基因地上部表达趋势为在低温胁迫1、24 h比较高,低温胁迫6 h表达量略低于1、24 h处理,但比低温胁迫0 h对照要高;地下部的表达趋势为升-降-升,在低温胁迫1、24 h表达量比较高,低温胁迫6 h表达量与对照相当。ZM06G25590基因地上部表达趋势为逐步升高。地下部的表达趋势为升-降-升,低温胁迫24 h表达量最高,低温胁迫6 h表达量与低温胁迫0 h对照相当。ZM08G14210基因地上部表达在低温胁迫6 h达到最高,地下部的表达在低温胁迫1 h达到最高。ZM08G31890基因地上部表达趋势为逐步升高,在低温胁迫24 h达到最高;地下部的表达趋势为升-降-升,低温胁迫24 h表达量最高。
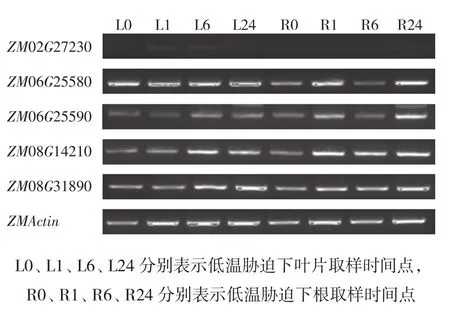
图5 低温胁迫处理下ZMP5CS的表达
3 结论与讨论
植物在低温、干旱、高盐等胁迫下,体内产生大量脯氨酸,它可作为一种渗透调节物质参与环境胁迫下的应激代谢反应。植物体内脯氨酸的合成主要有谷氨酸和鸟氨酸两条途径,其中谷氨酸合成途径在渗透胁迫条件下占主要地位。在谷氨酸途径中,谷氨酸在1-吡咯啉-5-羧酸合成酶(P5CS)的催化下转化成谷氨酸半醛,然后谷氨酸半醛自动转化成吡咯啉-5-羧酸(P5C ),接着P5C被吡咯啉-5-羧酸还原酶 (P5CR ) 催化生成脯氨酸[16-17]。P5CS是植物细胞内脯氨酸合成途径的关键酶,目前已从多种植物中分离得到 P5CS基因,并从分子生物学及遗传学的角度证明该基因属于植物抗逆境胁迫基因[18]。
本研究结果表明,除对照0 h外,不论地上部还是地下部,干旱、高盐、低温胁迫处理玉米幼苗ZMP5CS基因的表达量在不同胁迫时段均呈现为差异型上调表达,说明这3种逆境胁迫处理可以诱导ZMP5CS的表达,这与前人研究结果[16,19]一致。徐博等[19]从朝鲜碱茅分离到1个 P5CS 的同源基因PuP5CS,PuP5CS 基因在朝鲜碱茅的根部和叶片均有表达,叶片中的表达量较高,而根部的表达量较低,且在根部PuP5CS 基因在盐胁迫、碱胁迫和盐碱复合胁迫下变化大;在叶片中各胁迫的诱导作用也不同。陈吉宝等[16]研究表明,干旱、NaCl和低温均可诱导普通菜豆的PvP5CS1和PvP5CS2基因的表达,不同的胁迫处理使两个基因有不同的表达模式,从而使脯氨酸积累也发生变化。本研究不同胁迫处理条件下P5CS表达变化规律基本一致,均受胁迫诱导表达上调,但诱导的强度及出现最高峰的位置上有差异。葛淑娟等[20]通过对玉米种质POB21采用15% PEG渗透胁迫处理,表明玉米叶片 的P5CS响应渗透胁迫表达上调。
本试验结果还显示,在干旱、高盐处理条件下,玉米幼苗根和叶中大多数ZMP5CS基因表达量明显上升,说明ZMP5CS基因也是一个渗透胁迫诱导上调表达的基因,同时说明脯氨酸在胁迫诱导下快速积累,渗透调节剂的积累是植物提高渗透胁迫逆境适应能力最直接的方式。利用4℃冷处理水稻和拟南芥,水稻经1 h可检测到OsP5CS1表达水平的明显增加[21],而拟南芥24 h后AtP5CS1基因的表达才略有增加[8];我们的研究发现ZMP5CS地下部根中该基因家族表达与OsP5CS1基因相似,都对4℃冷处理反应迅速,是一个冷胁迫诱导早期表达基因,在早期渗透调控中起重要作用。正常情况下,苜蓿MtP5CS1基因在各个器官中的表达水平一样,MtP5CS2没有的表达信号;渗透胁迫下MtP5CS1的表达量没有增加,但促进了苜蓿根的MtP5CS2基因大量表达[22]。我们的检测结果显示,玉米ZMP5CS基因家族中ZM02G27230在对照叶片和根中均检测不到表达,干旱胁迫及高盐胁迫下也没有表达,而在低温情况下检测到表达;其他4个ZMP5CS基因在叶片和根中都表达。这些结果说明,ZMP5CS基因的表达具有胁迫响应和器官的特异性。可以推断,ZMP5CS 基因在胁迫条件下玉米幼苗的早期渗透调控中起重要作用。
总之,ZMP5CS 基因家族是受干旱、高盐、冷害等逆境胁迫诱导表达的基因,该基因家族可能参与多种逆境胁迫过程中玉米体内的渗透调节过程。本研究初步验证了ZMP5CS在植物抗逆过程中可能起着重要作用,但 ZMP5CS在植物抗逆过程中具体的功能和机制尚需深入研究。
参考文献:
[1] Cattivelli L,Rizza F,Badeck F,et al. Drought tolerance improvement in crop plants:an integrated view from breeding to genomics[J]. Field Crops Research,2008,105(1):1-14.
[2] Hussain T M,Chandrasekhar T,Hazara M,et al. Recent advances in salt stress biology-a review[J].Biotechnol Mol Biol Rev,2008,3(1):8-13.
[3] 张仁和,薛吉全,浦军,等. 干旱胁迫对玉米苗期植株生长和光合特性的影响[J]. 作物学报,2011,37 (3):521-528.
[4] Munns R,Tester M. Mechanisms of salinity tolerance [J]. Annu Rev Plant Biol,2008,59:651-681.
[5] Delauney A J,Verma D P S. Proline biosynthesis and osmoregulation in plants[J]. The Plant Journal,1993,4(2):215-223.
[6] Hu C A,Delauney A J,Verma D P. A bifunctional enzyme(delta 1-pyrroline-5-carboxylate synthetase)catalyzes the first two steps in proline biosynthesis in plants[J]. Proceedings of the National Academy of Sciences,1992,89(19):9354-9358.
[7] Hong Z,Lakkineni K,Zhang Z,et al. Removal of feedback inhibition of Δ1-pyrroline-5-carboxylate synthetase results in increased proline accumulation and protection of plants from osmotic stress[J]. Plant Physiology,2000,122(4):1129-1136.
[8] Yoshiba Y,Kiyosue T,Katagiri T,et al. Correlation between the induction of a gene for Δ1-pyrroline-5-carboxylate synthetase and the accumulation of proline in Arabidopsis thaliana under osmotic stress[J]. The Plant Journal,1995,7(5):751-760.
[9] Savouré A,Jaoua S,Hua X,et al. Isolation,characterization,and chromosomal location of a gene encoding the Δ1-pyrroline-5-carboxylate synthetase in Arabidopsis thaliana[J]. FEBS Letters,1995,372 (1):13-19.
[10] Verbruggen N,Villarroel R,Van Montagu M. Osmoregulation of a pyrroline-5-carboxylate reductase gene in Arabidopsis thaliana[J]. Plant Physiology,1993,103(3):771-781.
[11] Székely G,ábrahám E,Cséplő Á,et al. Duplicated P5CS genes of Arabidopsis play distinct roles in stress regulation and developmental control of proline biosynthesis[J]. The Plant Journal,2008,53(1):11-28.
[12] Fujita T,Maggio A,Garcia-Rios M,et al. Comparative analysis of the regulation of expression and structures of two evolutionarily divergent genes for Δ1-pyrroline-5-carboxylate synthetase from tomato[J]. Plant Physiology,1998,118(2):661-674.
[13] Su M,Li X,Ma X,et al. Cloning two P5CS genes from bioenergy sorghum and their expression profiles under abiotic stresses and MeJA treatment[J]. Plant Science,2011,181(6):652-659.
[14] Chen J B,Yang J W,Zhang Z Y,et al. Two P5CS genes from common bean exhibiting different tolerance to salt stress in transgenic Arabidopsis[J]. Journal of Genetics,2013,92(3):461-469.
[15] Guerzoni J T S,Belintani N G,Moreira R M P,et al. Stress-induced Δ1-pyrroline-5-carboxylate synthetase(P5CS)gene confers tolerance to salt stress in transgenic sugarcane[J]. Acta Physiologiae Plantarum,2014,36(9):2309-2319.
[16] 陈吉宝,景蕊莲,毛新国,等. 普通菜豆 PvP5CS2基因对逆境胁迫的应答[J]. 作物学报,2008,34 (7):1121-1127.
[17] 陈吉宝. 普通菜豆P5CS基因的克隆,功能验证及单核苷酸多态性[D]. 北京:中国农业科学院,2008.
[18] Bagdi D L,Shaw B P. Analysis of proline metabolic enzymes in Oryza sativa under NaCl stress[J]. Journal of Environmental Biology,2013,34(4):677.
[19] 徐博,任伟,徐安凯,等. 朝鲜碱茅 Δ1-吡咯啉-5-羧酸合成酶 (P5CS) 基因的克隆及表达分析[J].华北农学报,2011,26(6):20-26.
[20] 葛淑娟,孙爱清,刘鹏,等. 玉米响应渗透胁迫的数字基因表达谱分析[J]. 作物学报,2014,40(7):1164-1173.
[21] Igarashi Y,Yoshiba Y,Sanada Y,et al. Characterization of the gene for Δ1-pyrroline-5-carboxylate synthetase and correlation between the expression of the gene and salt tolerance in Oryza sativa L.[J]. Plant Molecular Biology,1997,33(5):857-865.
[22] Armengaud P,Thiery L,Buhot N,et al. Transcriptional regulation of proline biosynthesis in Medicago truncatula reveals developmental and environmental specific features[J]. Physiologia Plantarum,2004,120(3):442-450.
(责任编辑 崔建勋)
Differential exprssion of maize delta-1-pyrroline-5-carboxylate synthase( P5CS)gene family members under different abiotic stress
DONG Chen, JUE Deng-wei, HU Hui-gang, ZHAO Qiu-fang, JIA Li-qiang
(Institute of South Subtropical Corp Research, Chinese Academy of Tropical Agricultural Sciences/ Key Laboratory of Tropical Fruit Biology, Ministry of Agriculture, Zhanjiang 524091,China)
Abstrct:Proline plays an important role in plant osmotic regulation, Delta-1-pyrroline-5-carboxylate synthase (P5CS) is a key enzyme in proline of glutamic acid synthesis pathway. In order to study the relationship between P5CS gene families and abiotic stress in maize, the maize seedings were treated with abiotic stress (drought, low temperature and salt stress). The expression levels of ZMPSCS in maize (leaf, root) under different stresses were analyzed by semi-quantitative RT-PCR. The results showed that the excepted ZM02G27230 in the ZMP5CS gene family both up-regulated in the leaf and root by drought stress, but its expression among each member peak appeared in different time. The same treatment of the same gene time point of leaf and root,gene expression was different. Under drought stress,ZM08G14210 expression quantity was the highest. Under salt stress,ZM08G31890 expression quantity was the highest. Under low temperature stress,ZM06G25580 expression quantity was the highest. The results indicated that the ZMP5CS expression was induced by abiotic stress.
Key words:maize;delta-1-pyrroline-5-carboxylate synthase(P5CS);abiotic stress; expression analysis;semi-quantitative RT-PCR
中图分类号:S503.4;Q559
文献标识码:A
文章编号:1004-874X(2016)02-0008-06
收稿日期:2015-08-03
基金项目:中央级公益性科研院所基本科研业务专项(1630062014010,1630062015017,1630062015003);海南省自然科学基金(20153134)
作者简介:董晨(1981-),女,硕士,讲师,E-mail:nysdongchen@sina.com
通讯作者:贾利强(1976-),男,博士,副研究员,E-mail:liqiangj@zju.edu.cn
