高压氧治疗对急性脑外伤大鼠神经行为学及CREB表达的影响*
2016-07-13修光辉李秀玲朱义超刘萍凌斌孙洁
修光辉李秀玲朱义超刘萍凌斌孙洁
高压氧治疗对急性脑外伤大鼠神经行为学及CREB表达的影响*
修光辉①李秀玲②朱义超①刘萍①凌斌①孙洁①
【摘要】目的:探讨高压氧治疗对急性脑外伤大鼠神经功能修复及cAMP应答元件结合蛋白(cAMP response element blinding protein,CREB)信号分子表达的影响。方法:选取成年SD大鼠24只,按随机数字表法分为三组,即假手术组、脑外伤组及高压氧治疗组,每组8只。假手术组行开颅手术不致脑外伤,脑外伤组采用自由落体打击法制作中度脑外伤模型(以50 g重的铁质圆柱体自30 cm高处沿铁杆自由落体撞击暴露的大脑右侧运动皮质区),高压氧治疗组在脑外伤模型上行高压氧治疗(1次/d,连续治疗10 d)。各组伤后第10天对大鼠进行神经功能缺损(Neurological Severity Scores,NSS)评分,然后处死大鼠,获取大脑右侧运动皮质区,采用逆转录聚合酶链式反应(Reverse Transcription-Polymerase Chain Reaction,RT-PCR)方法测定CREB mRNA的表达。结果:大鼠中度脑外伤后出现不同程度的抽搐,瘫痪和平衡功能缺失。NSS评分结果显示:脑外伤组NSS评分(4.50±0.40)分,与假手术组的(0.30±0.10)分比较明显升高,差异有统计学意义(P<0.01),高压氧治疗组NSS评分(3.10±0.35)分与脑外伤组比较明显降低,差异有统计学意义(P<0.05)。同时,RT-PCR结果显示:脑外伤组CREB mRNA表达为(0.81±0.02),与假手术组的(0.62±0.01)比较明显升高,而高压氧治疗组(0.72±0.02)较脑外伤组CREB mRNA明显减少,差异均有统计学意义(P<0.01)。结论:高压氧治疗能明显改善大鼠神经行为学,其作用机制可能与抑制CREB信号分子的表达有关,从而抑制神经细胞的凋亡。
【关键词】高压氧治疗; 脑外伤; cAMP应答元件结合蛋白(CREB); NSS评分; 大鼠
①昆明医科大学第四附属医院 云南 昆明 650021
②云南省第一人民医院
First-author’s address:The No.4 Hospital Affiliated to Kunming Medical University,Kunming 650021,China
颅脑外伤(traumatic brain injury,TBI)是指暴力直接或间接作用于头部造成的颅脑外伤或颅内血肿,临床上死亡率及致残率高,预防和减少继发性脑损伤是促进患者存活,改善患者预后的关键。脑外伤临床治疗手段有限,高压氧治疗(hyperbaric oxygen treatment,HBOT)是临床上一种有效的能促进TBI修复的非创伤性康复疗法。本研究探讨了HBOT对急性颅脑外伤大鼠神经功能修复的影响及其对信号分子cAMP应答元件结合蛋白(cAMP response element blinding protein,CREB)基因表达的调节,为HBO治疗颅脑外伤的临床应用提供分子依据。
1 材料与方法
1.1 实验动物与分组 清洁级雄性SD大鼠24只,体重(220±20)g,购自昆明医科大学动物实验中心。按随机数字表法分为假手术组、脑外伤组及高压氧治疗组,每组8只。假手术组,只切开头皮和凿开颅骨;脑外伤组,切开头皮和凿开颅骨后,用重物自由落体冲击脑组织造成中度脑挫伤;高压氧治疗组,脑中度撞击伤并给予高压氧治疗一疗程。
1.2 方法
1.2.1 动物模型制备 参照Feeney等[1]文献介绍的方法制备大鼠中度颅脑损伤模型:用1%水合氯醛(1 mL/100 g)行腹腔注射麻醉,俯卧位固定大鼠。常规消毒铺巾,在头部距前囟5 mm处冠状切开皮肤成“U”型切口,将头皮向尾侧翻开。分离骨膜,暴露右侧顶骨,于矢状缝旁2.5 mm,冠状缝后1.5 mm钻一骨孔,咬除颅骨至骨窗直径为5.0 mm×5.0 mm,显露硬脑膜,以50 g重的铁质圆柱体自30 cm高处沿铁杆自由落体撞击垫片,造成右侧大脑运动皮质区挫裂伤。然后缝合皮肤,常规喂养,并给予抗生素治疗。
1.2.2 高压氧治疗 高压氧治疗组在脑外伤后1 h即行高压氧治疗,治疗10 d,1次/d。加压舱为上海七〇五所生产的SHC900Ⅱ型单人透明氧气加压舱。大鼠进舱后直接加压供氧。先升压15~20 min,然后稳压25~30 min,最后减压20 min。吸氧浓度91%~99%,治疗期间压力维持在0.18 MPa。
1.2.3 神经功能缺损(neurological severity scores,NSS)评分 于高压氧治疗一疗程后(即伤后第10天)采用双盲法,参照Chen等[2]报道的NSS评分表,对各组大鼠进行神经功能缺损评分。得分越高,则大鼠神经功能缺损越严重。
1.2.4 样本获取 高压氧治疗一疗程后,完成NSS评分,将大鼠处死,获取右侧大脑运动皮质,进行后续的逆转录聚合酶链式反应检测。
1.2.5 逆 转 录 聚 合 酶 链 式 反 应(Reverse Transcription-Polymerase Chain Reaction,RTPCR) 利用Primer Premier 5.0软件设计目的基因CREB和内参β-actin的引物序列,并送生物公司(Invitrogen,USA)合成。以下为目的基因的引物序列、退火温度、产物长度。CREB,上游引物5’-CAGATTGCCACATTAGCCC-3’,下游引物5’-TTCCCTGTTCTTCATTAGACG-3’, 退 火温度49.5 ℃,产物长度792 bp;β-actin,上游引物5’-GTAAAGACCTCTATGCCAACA-3’,下游引物5’-GTGAGCACTGAAGCGAAAGC-3’,退火温度52.5 ℃,产物长度227 bp。使用Trizol试剂盒(Invitrogen,USA)提取三组样品的总RNA,用分光光度计测量样本纯度和浓度;逆转录cDNA的制备,按照PCR Master Mix Kit(Thermo,USA)说明书操作进行PCR扩增,反应体系总体积为25 μL。反应条件为:94 ℃预变性3 min,94 ℃变性45 s,各因子退火温度退火45 s,72 ℃延伸1 min,35个循环后72 ℃延伸5 min。PCR产物于1%琼脂糖凝胶电泳检测分析,分别计算CREB的PCR产物与β-actin的PCR产物间光密度比值。
1.3 统计学处理 所有数据均用SPSS 22.0软件进行统计学分析,采用单因素方差分析进行统计学检验,计量资料以(±s)表示,以P<0.05为差异有统计学意义。
2 结果
2.1 各组大鼠NSS评分结果比较 大鼠急性脑外伤后,大部分动物损伤当天即发生抽搐,随后出现瘫痪不能正常行走,四肢与躯干失去平衡功能,容易在平衡木上跌落。术后第10天NSS评分结果显示:与假手术组得分(0.30±0.10)分比较,脑外伤组NSS评分(4.50±0.40)分明显升高,差异有统计学意义(P<0.01),而高压氧治疗组NSS评分(3.10±0.35)分,较脑外伤组明显降低,差异有统计学意义(P<0.05),见图1。NSS评分结果说明脑外伤后大鼠神经功能明显受损,而高压氧治疗促进了脑神经功能修复,提高了大鼠神经行为学功能。
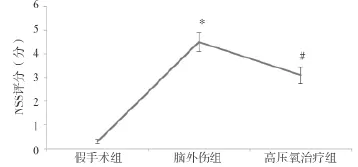
图1 各组大鼠NSS评分结果比较
2.2 各组大鼠CREB mRNA的表达变化 RT-PCR结果显示:三组大鼠大脑皮层样本中均能检测到信号分子CREB mRNA的表达。结合β-actin内参,对三组CREB mRNA扩增产物条带进行光密度值检测,结果显示:脑外伤组CREB mRNA为(0.81±0.02),与假手术组的(0.62±0.01)比较,表达水平明显升高,差异有统计学意义(P<0.01);高压氧治疗组CREB mRNA为(0.72±0.02),与脑外伤组比较,表达水平明显降低,差异有统计学意义(P<0.01)。RT-PCR结果表明急性脑外伤后,损伤的运动皮质区CREB mRNA的表达明显升高,而高压氧治疗抑制了皮质区CREB基因的表达,说明高压氧治疗改善大鼠神经功能可能与抑制损伤皮质区CREB信号分子的表达有关。具体见图2。
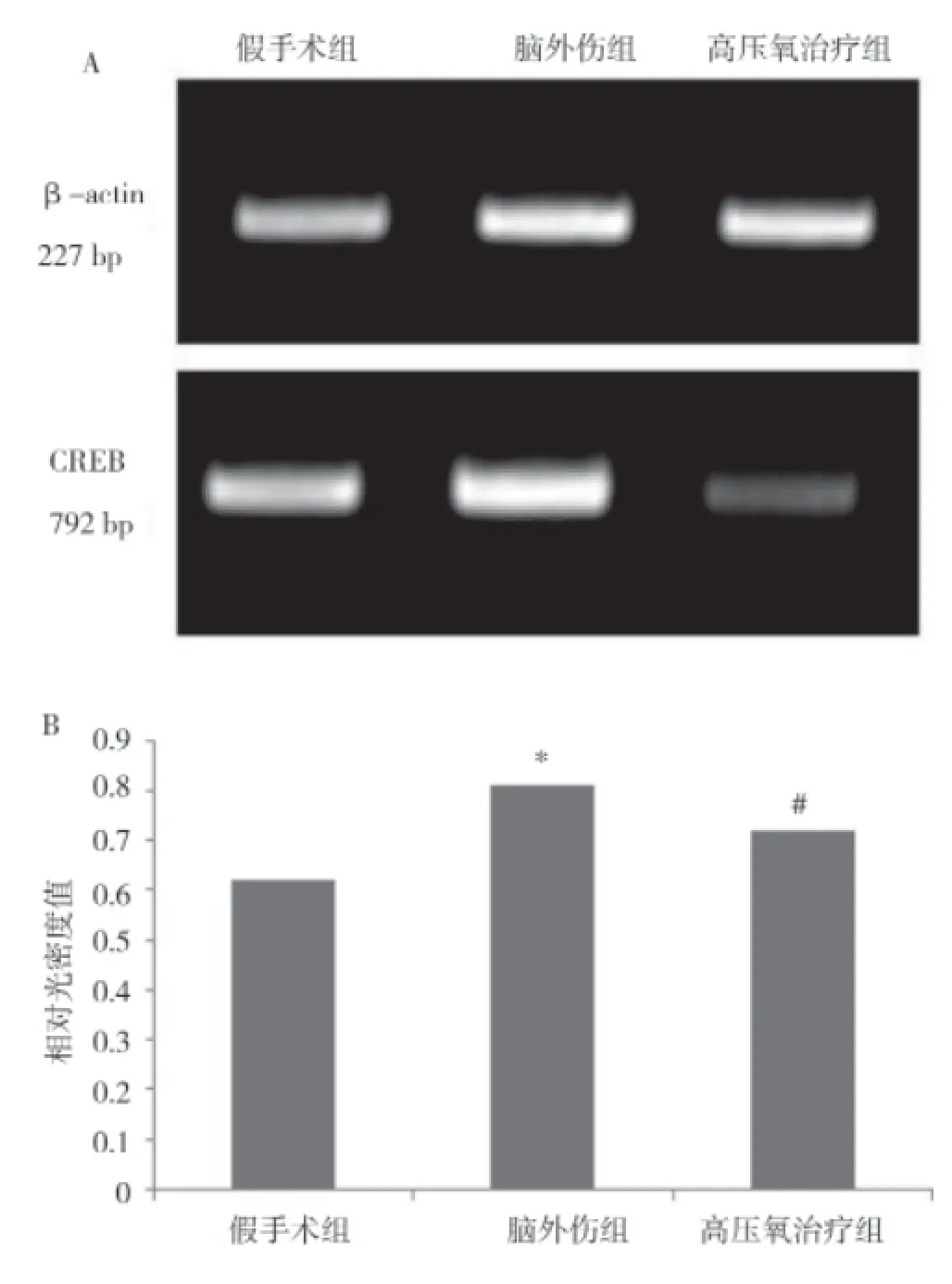
图2 各组大鼠的CREB mRNA表达变化比较
3 讨论
颅脑外伤(TBI)是临床上常见的神经外科急危重症,其致死率及致残率高,临床治疗方法少,疗效差。TBI一旦发生,常常导致神经元变性坏死,神经突起断裂,细胞凋亡等原发及继发性损伤,最终致残,影响生活质量。高压氧治疗能通过减轻颅脑外伤缺氧后宿主脑水肿,减少内源性神经元变性、凋亡与坏死,提高生长因子的生物活性等来发挥治疗作用[3]。本研究发现,大鼠急性脑外伤后,大部分动物损伤当天即发生抽搐,随后出现瘫痪不能正常行走,四肢与躯干失去平衡功能,容易在平衡木上跌落,NSS评分表现是TBI组较假手术组明显升高,而高压氧治疗10 d后NSS评分明显降低,说明高压氧治疗能明显改善脑外伤大鼠神经功能,提高大鼠神经行为学。实验结果进一步验证了高压氧对TBI的具有明显治疗效果[4]。关于其作用机制可能为:(1)改善脑血流及脑细胞供氧。脑损伤后,神经组织缺血缺氧,脑细胞功能得不到足够的能量保障,脑细胞将发生一系列继发性损伤。高压氧治疗通过改善脑血流及增加血液中物理溶解的氧,改善氧供、促进组织氧代谢,减少氧自由基的产生,从而促进脑细胞的修复[5-6]。(2)降低颅内压,减轻脑水肿。脑水肿在脑外伤病理生理改变中具有普遍性。脑水肿的发生是由于血脑屏障的破坏,脑微循环障碍,脑细胞代谢障碍及自由基损伤。颅脑损伤亦可因脑出血形成颅内血肿,组织渗出明显,导致颅内压升高。高压氧治疗可以通过提高血氧分压,收缩血管,减少脑血流量,从而减轻脑水肿,使颅内压下降,促进脑细胞修复[7]。(3)通过轴索发生新的侧枝,建立新的突触联系,使神经功能得到恢复;(4)神经保护作用。高压氧治疗可以通过分泌神经营养因子、抗炎因子(如IL-10等)、抑制小胶质细胞激活及促炎因子的产生(如TNF-ɑ等)等方式,阻碍炎症瀑布的发生及细胞凋亡等,促进受损的神经细胞修复,发挥神经保护作用[3,8-10]。
高压氧在脑外伤治疗中的研究和应用取得了很大的成绩,但高压氧治疗颅脑外伤的分子信号机制尚不清楚。本实验调查了高压氧治疗脑外伤大鼠损伤运动皮质区的cAMP反应元件结合蛋白(CREB)信号分子的表达。实验发现,脑外伤后损伤运动皮质区CREB mRNA的表达明显上调,而高压氧治疗下调了运动皮质区CREB的表达。CREB是转录因子bZIP蛋白家族中CREB/ATF亚家族的一员,能够选择特异性结合cAMP反应元件(CRE),发挥生物学效应。CREB由341个氨基酸残基组成,分子量约为43 KD,其分子结构分两个区域,N-端区域和C-端区域,N-端区域主要与调节转录的功能有关,C-端区域主要是与启动子结合的部位。CREB分子是多种蛋白激酶作用的底物,其转录活性受多种信号转导通路的调控,主要是cAMP通道、钙离子通道的调节、蛋白激酶A、Ras/MAPK以及RSKp90等[11]。研究表明:在脑外伤中,活化(磷酸化)的CREB可直接或间接激活相关基因转录,进而表达某些蛋白分子(如c-Fos、Jun-B、bcl-2等)和神经营养因子来发挥作用[12]。最新研究发现,在中枢神经系统损伤中,缺氧导致的神经细胞凋亡是由于CREB信号的激活所致[13]。此外也有文献报道,持续的CREB的激活在脑外伤中介导了神经元的凋亡,抑制了神经组织的修复[14]。大量研究认为,CREB信号是神经炎症反应中神经胶质细胞激活的重要通路,可诱发炎症因子的大量释放引起的炎症瀑布式反应,最终导致神经细胞凋亡[15],而研究表明高压氧治疗可以抑制脑外伤后的神经炎症风暴及小胶质细胞激活所致的受损细胞的凋亡[9-10]。因此,本实验发现TBI术后CREB表达明显上调,可能由于损伤缺氧导致CREB的激活促进损伤皮质区神经元的凋亡,而高压氧治疗明显下调了CREB信号分子的表达,并且在神经行为学上得到明显的改善,结合文献报道,高压氧治疗可能是通过抑制CREB信号的激活,减少了胶质细胞及炎症因子的产生,阻碍了炎症瀑布式反应导致的细胞损伤,最终减少细胞凋亡,改善了神经功能,提高了TBI术后大鼠的神经行为学。
本研究为高压氧治疗脑外伤提供了重要的行为学和分子学证据。结果提示高压氧不仅是脑外伤治疗的有效方法,而且提示CREB的过表达可能是促进脑损伤神经细胞凋亡的重要机制。高压氧治疗改善脑外伤大鼠神经行为学可能与抑制CREB信号的表达有关。研究结果为临床应用高压氧治疗脑外伤提供了重要的实验依据。
参考文献
[1] Feeney D M, Boyeson M G, Linn R T, et al.Responses to cortical injury:I.methodology and local effect s of contusions in the rat[J]. Brain Res,1981,211(1):67-77.
[2] Chen Y,Constantini S,Trembovler V,et al.An experimental model of closed head injury in mice: pathophysiology,histopathology, and cognitive deficits[J].J Neurotrauma,1996,13(10):557-568.
[3] Wee H Y,Lim S W,Chio C C,et al.Hyperbaric oxygen effects on neuronal apoptosis associations in a traumatic brain injury rat model[J].J Surg Res,2015, 197(2):382-389.
[4] Wang G H,Zhang X G,Jiang Z L, et al.Neuroprotective effects of hyperbaric oxygen treatment on traumatic brain injury in the rat[J].J Neurotrauma,2010,27(9):1733-1743.
[5] Rockswold S B,Rockswold G L,Zaun D A,et al.A prospective,randomized clinical trial to compare the effect of hyperbaric to normobaric hyperoxia on cerebral metabolism, intracranial pressure,and oxygen toxicity in severe traumatic brain injury[J].J Neurosurg,2010,112(5):1080-1094.
[6] Micarelli A,Jacobsson H,Larsson S A,et al.Neurobiological insight into hyperbaric hyperoxia[J].Acta Physiol(Oxf),2013,209(1):69-76.
[7] Liu S,Liu Y,Deng S,et al.Beneficial effects of hyperbaric oxygen on edema in rat hippocampus following traumatic brain injury[J].Exp Brain Res,2015,233(12):3359-3365.
[8] Zhang X G,Jiang Z L,Wang G H,et al.Therapeutic efficacy of hyperbaric oxygen on traumatic brain injury in the rat and the underlying mechanisms[J].Chinese Journal of Applied Physiology,2012,28(1):42-46.
[9] Chen X,Duan X S,Xu L J,et al.Interleukin-10 mediates the neuroprotection of hyperbaric oxygen therapy against traumatic brain injury in mice[J].Neuroscience,2014,39(266):235-243.
[10] Lim S W,Wang C C,Wang Y H,et al.Microglial activation induced by traumatic brain injury is suppressed by postinjury treatment with hyperbaric oxygen therapy[J].J Surg Res,2013,184(2):1076-1084.
[11] Yu S,Cheng Q,Li L,et al.2-(4-Methoxyphenyl)ethyl-2-acetamido-2-deoxy-β-d-pyranoside confers neuroprotection in cell and animal models of ischemic stroke through calpain1/PKA/ CREB-mediated induction of neuronal glucose transporter 3[J]. Toxicol Appl Pharmacol,2014,277(3):259-269.
[12] Huang W,Cao J,Liu X,et al.AMPK Plays a dual role in regulation of CREB/BDNF Pathway in mouse primary hippocampal cells[J].J Mol Neurosci,2015,56(4):782-788.
[13] Chio C C,Wei L,Chen T G,et al.Neuron-derived orphan receptor 1 transduces survival signals in neuronal cells in response to hypoxia-induced apoptotic insults[J].J Neurosurg,2015,11(27):1-11.
[14] Wu X,Jin W,Liu X,et al.Cyclic AMP response element modulator-1 (CREM-1) involves in neuronal apoptosis after traumatic brain injury[J].J Mol Neurosci,2012,47(2):357-367.
[15] Qin L,Bouchard R,Pugazhenthi S,et al.Regulation of cAMP response element binding protein during neuroglial interactions[J]. J Neurochem,2015,136(5):918-930.
Effects of Hyperbaric Oxygen Treatment on Improving Neural Behavior and Regulating the CREB Expression in Acute Traumatic Brain Injury Rats
XIU Guang-hui,LI Xiu-ling,ZHU Yi-chao,et al.// Medical Innovation of China,2016,13(12):005-009
【Abstract】Objective:To investigate the effects of hyperbaric oxygen treatment(HBOT) on neural behavior improvement in acute traumatic brain injury(TBI) rats associated to the expression of cAMP response element blinding protein (CREB) signaling molecule.Method:Twenty-four adult Sprague-Dawley rats were divided into three groups according to the random number table:sham-operated group,TBI group and HBOT group,eight rats in each group.The sham-operated group was subjected to skull open only but not brain injury;TBI rats were subjected to TBI procedure according to the weight-dropping method(the 50 g weight-drop device was employed and falled from 30 cm height to hit the exposed motor cortex on the right side of the brain);the HBOT group was performed for HBO treatment for 10 days (one time per day)after TBI.The Neurological severity score (NSS) records were evaluated to determine the improvement of neural behavior among all groups after 10 days post injury.Then all rats were sacrificed and the motor cortex were obtained for the following reverse transcriptionpolymerase chain reaction(RT-PCR) to determine the expression of CREB.Result: TBI procedure resulted in a several neurological functional deficit symptoms in TBI rats.The NSS records in the TBI group was (4.50±0.40),which was significantly increased at the tenth day comparing to (0.30±0.10) of the sham-operated group,while (3.10±0.35) of the HBOT group showed a significant decrease comparing to the TBI group(P<0.01),the differences were statistically significant (P<0.05).Corresponding to these changes was the expression of CREBmRNA,(0.81±0.02) of the TBI group showed significantly up-regulated compared with (0.62±0.01) of the sham-operated rats,while (0.72±0.02) of the HBOT group was significantly down-regulated compared with TBI rats,the differences were statistically significant(P<0.01).Conclusion:The HBO treatment may ameliorate the neurological behavior of rats after experimental traumatic brain injury by inhibiting the expression of CREB signaling molecule,which results in the apoptosis of nerve cells.
【Key words】Hyperbaric oxygen treatment; Traumatic brain injury; cAMP response element blinding protein(CREB); NSS records; Rats
*基金项目:云南省科技厅-昆明医科大学联合专项基金(2015FB079);云南省科技厅-昆明医科大学联合专项基金(2013FB185)
通信作者:孙洁
doi:10.3969/j.issn.1674-4985.2016.12.002
收稿日期:(2015-12-15) (本文编辑:刘蕾)
