氯化钙-甲酸溶解体系再生丝素长丝的制备及其性能
2016-07-12吴惠英左保齐
吴惠英,左保齐
(1.苏州经贸职业技术学院,江苏 苏州 215009;2.苏州大学 纺织与服装工程学院,江苏 苏州 215006;3.现代丝绸国家工程实验室(苏州),江苏 苏州 215123)
氯化钙-甲酸溶解体系再生丝素长丝的制备及其性能
吴惠英1,2,左保齐2,3
(1.苏州经贸职业技术学院,江苏 苏州 215009;2.苏州大学 纺织与服装工程学院,江苏 苏州 215006;3.现代丝绸国家工程实验室(苏州),江苏 苏州 215123)
为改善再生丝素长丝力学性能差的问题,选用氯化钙-甲酸溶解体系获得丝素溶液并采用湿法纺丝技术制备再生丝素长丝。研究结果表明:与传统的三元溶剂溶解丝素至分子水平有所不同,氯化钙-甲酸可在常温条件下溶解蚕丝,更重要的是在溶解过程中保留了原纤结构,在牵伸作用下再生丝素长丝的断裂应力较传统溶解方法提高了近1倍,纤维表面均匀光滑,在放线菌蛋白酶溶液中表现出相对缓慢的降解速度。该方法工艺简单,环境友好、高效,并可实现再生丝素长丝的连续制备。
氯化钙-甲酸;丝素;湿法纺丝;原纤结构;性能
近年来国内外学者对丝素独特氨基酸成分及结晶结构等理化性质研究不断深入,从多用途开发到高新技术的相互渗透,目前对丝素的应用已从传统纺织领域向生物医药等领域逐渐渗透和拓展。再生丝素材料具有无毒、无刺激性、可降解以及良好的生物相容性[1-4],成为组织工程领域的常用材料。然而再生丝素材料的力学性质一直很难提高,表现出柔韧性差、断裂强力低等问题,究其原因认为,丝素在溶解过程中溶剂对其结构造成破坏,如传统溶解方法(如三元溶剂)将蚕丝溶解到分子水平,对丝素结构的破坏较为严重,使再生丝素材料的力学性能很难提高,与天然蚕丝的力学性能相差甚远[5]。因此探讨对丝素破坏小的溶解方法对制备再生丝素材料至关重要。
本文采用氯化钙-甲酸(CaCl2-FA)溶解体系溶解脱胶蚕丝,探讨该溶解体系获得的再生丝素溶液的形态,再采用对环境友好、流程短、成本低的自透析湿法纺丝技术并以水为凝固浴制备再生丝素长丝,测试长丝的相关性能。通过SEM表征再生丝素溶液及再生丝素长丝的形态,采用红外光谱以及X射线衍射测试表征再生丝素长丝的二级结构,并测试再生丝素长丝在不同拉伸倍数下的力学性能,讨论CaCl2-FA溶解体系获得的再生丝素溶液结构与长丝力学性能的关系,以放线菌蛋白酶溶液测试讨论再生丝素长丝的降解性。
1 实验部分
1.1 实验材料与仪器
桑蚕丝(湖州新天丝生物技术有限公司),碳酸钠(Na2CO3,上海试剂总厂),氯化钙(CaCl2,上海试剂总厂),甲酸(江苏强盛化工有限公司),磷酸缓冲溶液(PBS,上海试剂总厂),放线菌蛋白酶(Actinomycetes Protease,Sigma公司)。
测试仪器: Hitachi S-570型扫描电镜(日本Hitachi Limited);Nicolet 5700智能型傅里叶红外光谱仪(美国Thermo Nicolet Corporation);X′Pert Pro MPD型 X射线衍射仪(荷兰PAN alytical 公司);DF-101S型集热式恒温加热磁力搅拌器(巩义市英峪予华仪器厂)。
1.2 再生丝素长丝的制备
1.2.1 脱胶过程
将天然桑蚕丝用0.05%的Na2CO3溶液按1∶20的浴比沸煮脱胶30 min,反复进行3次,每次脱胶后用60 ℃的去离子水清洗,放在60 ℃下的烘箱里烘干即为脱胶蚕丝。
1.2.2 纺丝溶液的制备
分别将脱胶蚕丝在2种溶解体系下溶解,将脱胶桑蚕丝溶于CaCl2质量分数为5%的CaCl2-FA溶解体系中制备质量分数为15%的再生丝素溶液,溶解时间约为2 h,该丝素溶液可直接进行湿法纺丝。采用CaCl2-C2H5OH-H2O三元溶液溶解丝素,在75~80 ℃的恒温水浴条件下搅拌4~5 h,获得质量分数为2%再生丝素溶液,经去离子水透析后,在室温条件下成膜,将丝素膜与六氟异丙醇(HFIP) 按一定比例混合浓缩后,得到质量分数为15%的溶液进行湿法纺丝。与常用CaCl2-C2H5OH-H2O三元溶液溶解丝素的方法相比,采用CaCl2-FA溶解体系制备纺丝溶液流程短,效率高。
1.2.3 湿法纺丝过程
本文采用自制的湿法纺丝装置进行再生丝素长丝的制备,湿法纺丝装置示意图如图1所示。水作为凝固浴,凝固槽长度为1.5 m,纺丝压力为0.1 MPa,采用MT-Ⅲ型009-300-S-D脉动无级变速器进行长丝卷绕。分别采用CaCl2-FA和CaCl2-C2H5OH-H2O溶解体系进行丝素的溶解制备不同再生丝素溶液,其中CaCl2-FA溶解体系制备得到的再生丝素溶液在常温下具有良好的流动性,在室温条件下即可进行纺丝,纺丝速率为5 mL/h,卷绕速率为10 r/min。而CaCl2-C2H5OH-H2O溶解体系获得的纺丝液纺丝速率较低,纺丝速率只能设置在1~2 mL/h 才能保证正常纺丝。分别将2种溶解体系得到的再生丝素长丝命名为SF-CaCl2-FA和SF-CaCl2-C2H5OH-H2O。
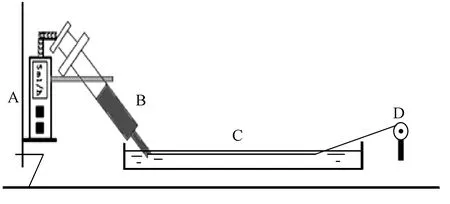
注:A— 计量泵; B— 纺丝液; C— 凝固浴; D— 卷绕辊。图1 自制湿法纺丝装置示间图Fig.1 Schematic of custom-made wet-spinning device
1.3 形貌与性能测试
1.3.1 溶液形形态观察
利用Hitachi S-570型扫描电子显微镜观察溶液形态,将溶解得到的丝素溶液稀释至质量分数低于0.001%,用移液器将1 μL稀释后溶液悬涂在新鲜硅片的表面,然后用氮气迅速吹干,备用。测试前将涂有丝素溶液的干燥硅片、纤维进行喷金处理,喷金厚度在20~30 nm之间。
1.3.2 红外光谱分析
利用美国NicoLet5700型红外光谱仪(扫描次数为32,波数范围为4 000~500 cm-1,光谱分辨率为4 cm-1)测定材料的二级结构,测试前将丝素纤维剪成粉末,KBr压片法制成薄饼状进行测试。
1.3.3 X射线衍射分析
利用荷兰PAN alytical 公司的X′Pert Pro MPD X射线衍射仪(CuKα靶,加速电压为40 kV,电流为40 mA,λ=0.154 nm)测试材料的二级结构,测试前将丝素纤维剪成粉末状。
1.3.4 力学性能测试
利用美国Instron3365型万能材料试验机对再生丝素长丝进行拉伸力学性能测试。测试参数设置为:测试夹距10 mm,拉伸速率10 mm/min,初始张力0.2 cN,强力与伸长的精度分别为0.01 cN和0.01 mm,测试温度25 ℃,相对湿度(50±5)%,每类样品测试根数为20根。
1.3.5 降解性能测试
将放线菌蛋白酶溶解在0.05 mol/L(pH=7.4)的PBS溶液中配制5 U/mL的放线菌蛋白酶溶液。降解过程中每隔2 h取出样品,并补充用酶溶液,体外降解实验持续12 h。取出的样品在蒸馏水中浸泡1 d并反复清洗,在室温条件下干燥,备用。
2 结果与分析
2.1 再生丝素溶液的形态观察
实验过程中采用2种溶剂对丝素进行溶解,采用传统的CaCl2-C2H5OH-H2O三元溶液溶解丝素需要在75~80 ℃的恒温水浴条件下搅拌4~5 h。溶解过程中溶剂将蚕丝溶解到分子水平,氢键被破坏,同时会伴随着分子质量的下降、结晶结构的破坏[6-7],该溶解方式导致再生丝素材料力学性能变差,严重影响到再生丝素材料的应用范围[8-9]。
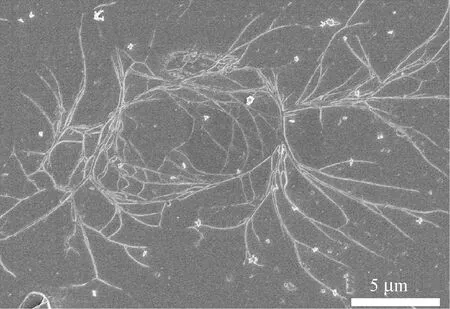
图2 CaCl2-FA溶解体系下丝素溶液形貌态(×5 000)Fig.2 Morphology of SF solutions prepared by CaCl2-FA dissolved system (×5 000)
而采用CaCl2-FA溶解体系所得的再生丝素溶液中可清晰观察到有丝素原纤结构,如图2所示。而且丝素溶液中的原纤结构直径和长度不同,原纤结构在天然蚕丝的优异力学性质中的贡献较大,因此推断CaCl2-FA溶解体系获得的丝素溶液中的原纤结构可对高性能再生丝素长丝的制备提供条件。
2.2 再生丝素长丝的表面形貌观察
湿法纺丝制备长丝的过程实质为双扩散过程,当纺丝液进入凝固浴时,纺丝溶液内部的溶剂和凝固剂双向扩散,在相分离过程中实现长丝内部盐、酸的析出,纤维表面易出现微孔[10]。同时当初生纤维经过沿纤维长度方向的外力拉伸作用时,纤维表面未完全固化的蜂窝状结构沿受力方向逐渐变形,直至形成致密的结构。将初生纤维处理后经过3倍拉伸后的纤维表面形貌如图3所示。

图3 不同溶解体系下再生丝素长丝的表面形貌(×5 000)Fig.3 Morphologies of regenerated SF filaments prepared by different dissolved system(×5 000)
采用CaCl2-FA溶解体系制备得到的再生丝素长丝表面较为光滑,粗细均匀,更重要的是可连续进行纺丝并收集至卷绕筒上;而采用CaCl2-C2H5OH-H2O溶解体系制备得到的再生丝素长丝的纤维纵向出现明显沟槽,且纤维表面有大小不一的颗粒状,在纺丝过程中经常会出现断头,很难进行连续化纺丝。因此分析可知,CaCl2-FA溶解体系丝素溶液中保留的原纤结构在再生丝素长丝中也可清晰观察到,说明在湿法纺丝过程中,丝素溶液中的原纤结构经过纺丝又重新组装,该结构保证了长丝的顺利进行。而CaCl2-C2H5OH-H2O制备的长丝易断可能就是因为该溶解体系将丝素溶解至分子水平所导致。
2.3 再生丝素长丝的二级结构表征
红外光谱测试是研究丝素二级结构普遍采用的一种方法,被用于定性表征丝素分子构象的转变。2种溶解体系制备的再生丝素长丝的红外光谱图如图4所示。由图4(a)可知,SF-CaCl2-FA的主要吸收峰出现在1 625、1 526、1 235 cm-1附近,均归属于β折叠构象,SF-CaCl2-C2H5OH-H2O的吸收峰位置与SF-CaCl2-FA相似,分别是1 623、1 526 cm-1和1 235 cm-1,归属于β折叠构象[11],相对来说SF-CaCl2-FA的红外光谱曲线峰值位置更尖锐。为进一步表征再生丝素长丝的二级结构,本文还进行了X射线衍射测试,2种长丝的主要衍射峰出现在8.7°、20.1°、23.9°和24.6°,均为silkⅡ结构[12],2种测试结果验证了再生丝素长丝的结构为β折叠构象。
2.4 再生丝素长丝的力学性能分析
分别将2种溶解体系制备的再生丝素长丝进行不同倍数的拉伸以提高长丝的力学性能,结果如表1所示。纺丝液内部高分子链的高度缠结,初生纤维脆性较大,拉伸过程可降低丝素内部分子链的缠结程度,增加了分子链的规整性和取向度[13],因此采用后拉伸的方式可有效提高纤维的力学性能。在2种溶解体系获得的再生丝素长丝的力学性能表现出明显差异,可看出CaCl2-C2H5OH-H2O制备的长丝纤维直径细,且该长丝脆,不易拉伸,牵伸3倍后的断裂应力为(88.4 ± 16.2) MPa,断裂伸长率为(14.8 ±3.8)%。而采用CaCl2-FA制备的长丝表现出较好的可牵伸性,牵伸3倍后的断裂应力达到了(158.4 ± 16.2) MPa,断裂伸长率为(23.8 ±4.5)%。这也证明了CaCl2-FA溶解体系获得的丝素溶液中的原纤结构为再生丝素长丝力学性能的提高提供了条件。
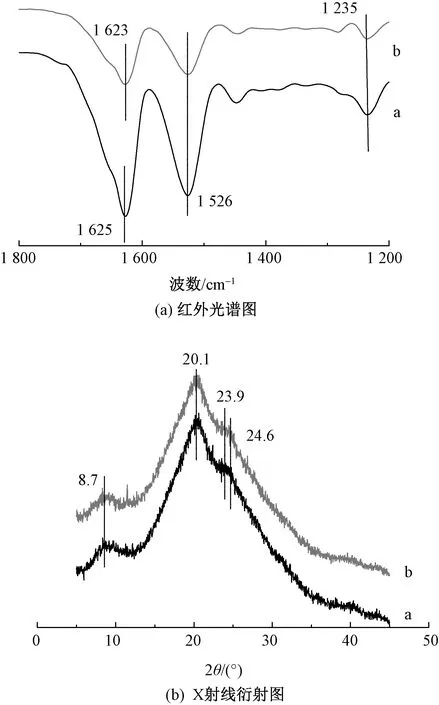
注:a—SF-CaCl2-FA; b—SF-CaCl2-C2H5OH-H2O。图4 再生丝素长丝的红外光谱和X射线衍射图Fig.4 FT-IR (a) and XRD (b) results of regenerated SF filaments
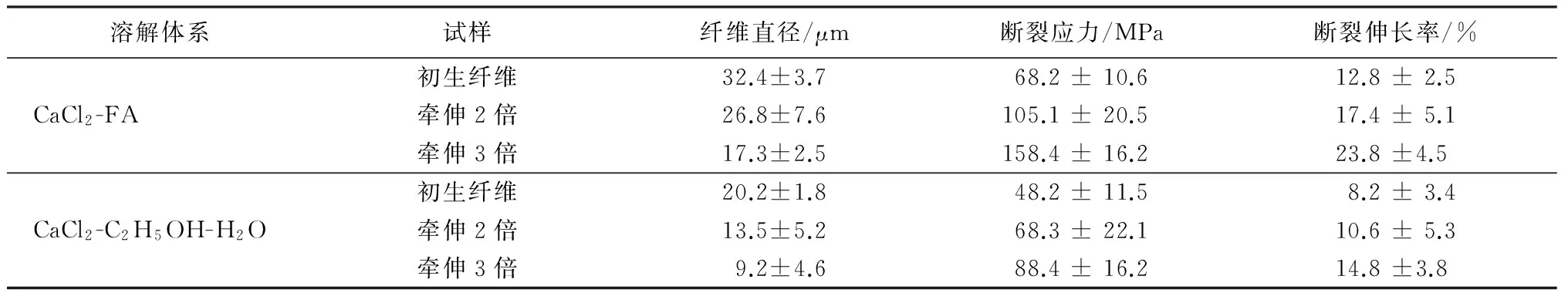
表1 不同倍数牵伸后再生丝素长丝的力学性能Tab.1 Mechanical properties of silk fibroin filaments with varied drawing ratios
2.5 降解后再生丝素长丝的形貌观察
利用扫描电镜对不同降解液中降解后的再生丝素长丝形貌进行观察,结果如图5、6所示。2种长丝在蛋白酶降解液中的降解现象有明显差异。SF-CaCl2-FA长丝在酶溶液降解2 h时,长丝表面基本无明显变化;降解8 h时,长丝的局部出现毛糙,剥离出部分的微纤;当降解至12 h时,表面刻蚀现象明显,粗糙程度加重,微纤结构覆盖明显,但长丝主体仍保持完整清晰。SF-CaCl2-C2H5OH-H2O长丝在蛋白酶降解液中的降解较SF-CaCl2-FA更为明显。在降解初期2 h时就出现了细小的微纤结构;降解8 h时,长丝的表面出现剥离出的微纤;当降解至12 h时,长丝表面被严重刻蚀,纤维主体解体,部分细小的微纤降解于降解液中[14]。上述电镜图片说明蛋白酶降解液对SF-CaCl2-C2H5OH-H2O的作用比SF-CaCl2-FA更剧烈,也就是说SF-CaCl2-FA性质稳定,相对SF-CaCl2-C2H5OH-H2O来说在降解液中的降解速度缓慢。

图5 CaCl2-FA溶解体系再生丝素长丝降解后的SEM照片(×5 000)Fig.5 SEM images of SF filaments prepared by CaCl2-FA dissolved system (×5 000)

图6 CaCl2-C2H5OH-H2O溶解体系再生丝素长丝降解后的SEM照片(×5 000)Fig.6 SEM images of SF filaments prepared by CaCl2-C2H5OH-H2O dissolved system(×5 000)
3 结 论
采用CaCl2-FA溶解体系溶解蚕丝、自透析湿法纺丝方法制备再生丝素长丝,并用CaCl2-C2H5OH-H2O溶解体系作对照。结果表明:CaCl2-FA溶解体系得到的丝素溶液中可观察到原纤结构,而原纤结构的存在为再生丝素长丝力学性能的提高提供前提,3倍牵伸后的断裂应力为(158.4 ± 16.2) MPa,断裂伸长率为(23.8 ±4.5)%,与CaCl2-C2H5OH-H2O制备的长丝力学性能有较大幅度的提高。此外,CaCl2-FA溶解体系溶解丝素流程短,效率高,制备得到的再生丝素长丝表面光滑、均匀,并可连续纺丝。红外光谱和X射线衍射测试结果表明,再生丝素长丝的结构主要以β折叠构象为主,在蛋白酶降解液中的降解速度相对缓慢。
FZXB
[1] TAO Wei,LI Mingzhong,ZHAO Chunxia.Structure and properties of regenerated antheraea pernyi silk fibroin in aqueous solution[J].International Journal of Biological Macromolecules,2007,40: 472-478.
[2] QU J,WANG D,WANG H H,et al.Electrospun silk fibroin nanofibers in different diameters support neurite outgrowth and promote astrocyte migration[J].Journal of Biomedical Materials Research,Part A,2013,101(9): 2667-2678.
[3] HUANG L,LI C,YUAN W J,et al.Strong composite films with layered structures prepared by casting silk fibroin-graphene oxide hydrogels[J].Nanoscale,2013(5): 3780-3786.
[4] KWEON H,LEE K G,CHAE C H,et al.Development of nano-hydroxyalatite graft with silk fibroin scaffold as a new bone substitute[J].Journal of Oral Maxillofac Surgery,2011,69:1578-1586.
[5] HOSSAIN K S,OHYAMA E,OCHI A,et al.Dilute-solution properties of regenerated silk fibroin[J].Journal of Physical Chemistry B,2003,107:8066-8073.
[6] WANG H Y,ZHANG Y Q.Effect of regeneration of liquid silk fibroin on its structure and characteriza-tion[J].Soft Matter,2013(9):138-145.
[7] PAN H,ZHANG Y P,HANG Y C,et al.Significantly reinforced composite fibers electrospun from silk fibroin/carbon nanotube aqueous solutions[J].Biomacromolecules,2012,13(9): 2859-2867.
[8] WANG Q,CHEN Q,YANG Y,et al.Effect of various dissolution systems on the molecular weight of regenerated silk fibroin[J].Biomacromolecules,2013,14: 285-289.
[9] HOLLAND C,TERRY A E,PORTER D,et al.Natural and unnatural silks[J].Polymer,2007,48: 3388-3392.
[10] 曹惠,左保齐,戴礼兴.自透析法再生丝素初生纤维的结构性能分析[J].苏州大学学报(工科版),2005,25(3):1-5.CAO Hui,ZUO Baoqi,DAI Lixing.Analysis of structure and properties of RSF as-spun fibers obtained by self-dialysis process[J].Journal of Soochow University (Engineering Science Edition),2005,25(3):1-5.
[11] CHEN Xin,SHAO Zhengzhong,MARINKOVIC N S,et al.Conformation transition kinetics of regenerated Bombyx mori silk fibroin film monitored by time-resolved FTIR spectroscopy[J].Biophysical Chemistry,2001,89(1): 25-34.
[12] LI M,WU Z,LU S,et al.Study on porous silk fibroin matrials[J].Journal of Donghua University (Nature Science Edition),2001,27(2): 12-18.
[13] KIM H J,UM I C.Effect of degumming ratio on wet spinning and post drawing performance of regenerated silk[J].International Journal of Biological Macromolecules,2014,67: 387-393.
[14] LI M,OGISO M,MINOURA N.Enzymatic degradation behavior of porous silk fibroin sheets[J].Biomaterials,2003,24 (2): 357-365.
Preparation and properties of regenerated silk fibroin filaments using CaCl2-formid acid system
WU Huiying1,2,ZUO Baoqi2,3
(1.SuzhouInstituteofTrade&Commerce,Suzhou,Jiangsu215009,China;2.CollegeofTextile&ClothingEngineering,SoochowUniversity,Suzhou,Jiangsu215006,China;3.NationalEngineeringLaboratoryforModernSilk(Suzhou),Suzhou,Jiangsu215123,China)
To improve the mechanical properties of the regenerated silk fibroin filaments,CaCl2-formid acid (FA) system was adopted to dissolve degummed silk to obtain silk solution,and regenerated silk fibroin filaments were prepared by wet spinning process.The results indicated that different from that the present dissolved system can dissolve silk to the molecular level,silk fibroin can be dissolved in CaCl2-FA at room temperature,more importantly,which is characterized by preserving the fibrils structure.The breaking stress of the regenerated fibroin was improved nearly by 1 time after stretching,compared with conventional dissolution methods.The surface of silk fibroin filaments was smooth and uniform,and the degradation speed in protease XIV solution was relatively slow.It is a simple,efficient and environmentally friendly method to achieve continuous production of silk fibroin filaments.
CaCl2-formid acid; silk fibroin; wet spinning; fibril; property
10.13475/j.fzxb.20150905106
2015-07-22
2015-11-02
获奖说明:本文荣获中国纺织工程学会颁发的第16届陈维稷优秀论文奖
江苏省应用基础研究计划项目(BK20141207);苏州市应用基础研究计划项目(SYG201431);中国纺织工业联合会科技指导性项目(2015009);苏州经贸职业技术学院自然基金项目(KY-ZR1401)
吴惠英(1980—),女,讲师,博士。研究方向为丝蛋白生物材料的应用。左保齐,通信作者,E-mail:bqzuo@suda.edu.cn。
TS 141.8
A
