激光诱导纳秒时间分辨荧光猝灭法原位研究菲及烷基菲与腐植酸相互作用
2016-07-12刘洋之杨承虎朱亚先
刘洋之,杨承虎,朱亚先,张 勇, 3*
1. 近海海洋环境科学国家重点实验室(厦门大学),厦门大学环境与生态学院,福建 厦门 361102
2. 厦门大学化学化工学院化学系,福建 厦门 361005
3. 漳州职业技术学院,福建 漳州 363000
激光诱导纳秒时间分辨荧光猝灭法原位研究菲及烷基菲与腐植酸相互作用
刘洋之1,杨承虎1,朱亚先2,张 勇1, 3*
1. 近海海洋环境科学国家重点实验室(厦门大学),厦门大学环境与生态学院,福建 厦门 361102
2. 厦门大学化学化工学院化学系,福建 厦门 361005
3. 漳州职业技术学院,福建 漳州 363000
利用激光诱导纳秒时间分辨荧光(laser-induced nanosecond time-resolved fluorescence, LITRF)猝灭法原位研究腐植酸(humic acid, HA)分别与母环多环芳烃(polycyclic aromatic hydrocarbons, PAHs)菲(phenanthrene, Phe)及烷基PAHs 9-乙基菲(9-Ethylphenanthrene, 9-EP)和惹稀(retene, Ret)相互作用,考察HA对母环及烷基PAHs结合特性差异与机制,对了解PAHs环境行为及生物有效性有重要意义。结果表明,通过改变延迟时间(50 ns)可有效消除HA荧光干扰,实现游离Phe,9-EP及Ret浓度直接测定。利用Freundlich非线性等温吸附模型描述Phe, 9-EP和Ret与HA结合特性,LITRF猝灭法与传统荧光法获得的模型拟合参数及单点结合系数结果一致。其中,参数n小于1,表明Phe,9-EP及Ret与HA均以非线性形式结合,且9-EP和Ret非线性程度高于Phe;相同给定平衡浓度下,HA与9-EP和Ret单点结合系数KOC大于Phe,而9-EP和Ret结合能力相近,且PAHs与HA结合系数均随给定浓度增加而降低。疏水性、取代基及与HA疏水空腔适应能力决定特定PAHs与HA结合特性。通过荧光寿命分析,HA存在下Phe,9-EP和Ret寿命分别为36.90,35.34和35.13 ns,与未加入HA时的36.36,35.34和35.84 ns无明显差异,表明Phe,9-EP和Ret与HA间的荧光猝灭以静态过程为主。LITRF猝灭法可快速有效原位研究PAHs与HA相互作用,有助于实现PAHs生态风险原位评估。
激光诱导纳秒时间分辨荧光;荧光猝灭法;腐植酸;菲;烷基菲
引 言
溶解性有机质(dissolved organic matter, DOM)是一类非均相的有机混合物,可显著影响水环境中重金属及有机污染物的迁移转化及生物毒性效应[1]。研究表明,腐殖酸(humic acid, HA)作为DOM重要组成部分,可改变有毒污染物归趋和生物有效性[2-3]。多环芳烃(polycyclic aromatic hydrocarbon, PAHs)具有“三致”作用。目前有关PAHs环境行为研究主要针对母环PAHs开展,烷基PAHs作为PAHs中重要组成关注较少[4-6]。烷基PAHs在海上溢油区域及水环境介质如河流和沉积物中均有较高检出量[7],且已有研究结果表明如果忽略烷基PAHs的存在而对PAHs进行环境风险评价将会显著低估其值[8]。因此,为科学有效地认识PAHs环境行为和生态风险,有必要深入研究烷基PAHs与HA的相互作用。
荧光猝灭法灵敏度高、非破坏性、操作简便而被广泛用于HA与PAHs结合特性研究[9-10]。然而,HA荧光干扰混合体系中PAHs的测定[11],传统荧光法采用扣除法来消除HA的光谱干扰,费时、费力,且无法实现PAHs与HA相互作用的实时原位研究。时间分辨荧光技术已实现PAHs快速鉴别、分析,可有效避免拉曼散射、杂散光、短寿命组分荧光的干扰[12]。激光诱导纳秒时间分辨荧光(laser induced nanosecond time-resolved fluorescence, LITRF)技术作为一种便携、快速、灵敏度高的PAHs原位检测手段,其实际应用研究备受关注[13]。已知HA荧光寿命小于10 ns,多数PAHs荧光寿命大于10 ns[11]。据此,利用LITRF结合荧光猝灭法可实现PAHs与HA相互作用原位研究。本文利用LITRF猝灭法原位研究菲(phenanthrene, Phe)、9-乙基菲(9-Ethylphenanthrene, 9-EP)及惹稀(retene, Ret)与HA相互作用,考察HA对母环及烷基PAHs结合特性与机制差异,为烷基PAHs环境行为提供有意义的科学依据。
1 实验部分
1.1 试剂与仪器
Phe(纯度>98%, Aldrich)、9-EP(纯度>99%, Aldrich)、Ret(纯度>99%, Aldrich),部分理化参数见表1。HA(生化试剂,上海试剂二厂)。准确称取0.050 g Phe,9-EP和Ret分别配制成0.50 g·L-1乙醇储备液,存于冰箱中。称取约0.100 g HA,溶解于2.0 mL氢氧化钠溶液(0.50 mol·L-1),次日与100 mL叠氮化钠溶液(200.0 mg·L-1)混合,调节pH至7.0,过0.45 μm滤膜,测定TOC(TOC-L CPH, 岛津),以有机碳含量表示HA浓度(mgOC·L-1)。采用元素分析仪(Elementar EL Cube, 德国)测定元素C,O,H,N和S含量分别为38.7%,56.6%,3.5%,0.8%和0.4%。利用傅里叶变换红外光谱仪(Nicolet 380, 美国)测定HA官能团。该HA具有明显的羟基基团(3 420 cm-1)、亚甲基基团(2 920 cm-1)、羰基基团(1 710 cm-1)、碳氧基团(1 200 cm-1),及芳香基团(796 cm-1)。LITRF系统(德国哥廷根激光实验室),具体仪器参数为:Timing shift: 1 ns, Lambda excitation: 266 nm, Laser energy: 30 μJ, Time Slices: 130, Cooler temperature:-1 ℃,以Timing Start: 75 ns作为样品荧光测定0 ns延迟模式。
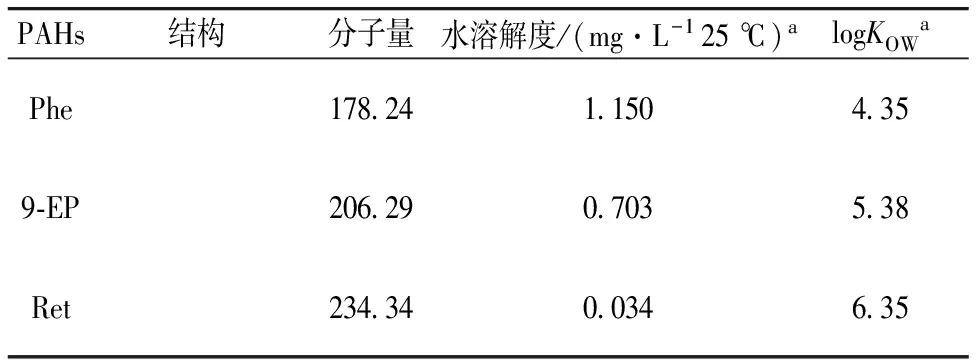
表1 Phe、9-EP及Ret理化属性
aCalculated by ECOSAR v1.11
1.2 方法
采用批次试验法研究HA与Phe,9-EP和Ret结合特性。总反应体系为10.0 mL,背景溶液为200.0 mg·L-1叠氮化钠(pH 7.0)。为避免内滤效应影响,HA浓度为1.0 mg·L-1,Phe浓度范围为0~30.0 μg·L-1,9-EP和Ret浓度范围均为0~12.0 μg·L-1,乙醇浓度低于0.10%[14]。以不含HA的Phe,9-EP和Ret溶液为对照组。样品于(25±1)℃避光静置平衡24 h,LITRF系统扫描荧光光谱。
1.3 数据分析
采用Freundlich非线性等温吸附模型拟合Phe、9-EP和Ret与HA等温曲线,并计算给定平衡浓度(cfree)时单点结合系数KOC[10]。
2 结果与讨论
2.1 Phe,9-EP,Ret及HA荧光光谱分析
由图1可知,HA对三种PAHs荧光光谱存在干扰,传统荧光法无法直接测定三种PAHs荧光强度。由图2可知三种PAHs与HA荧光衰减趋势不同,HA荧光衰减趋势明显快于PAHs,即HA荧光寿命比Phe,9-EP及Ret短。因此,通过改变延迟时间可扣除HA荧光影响。
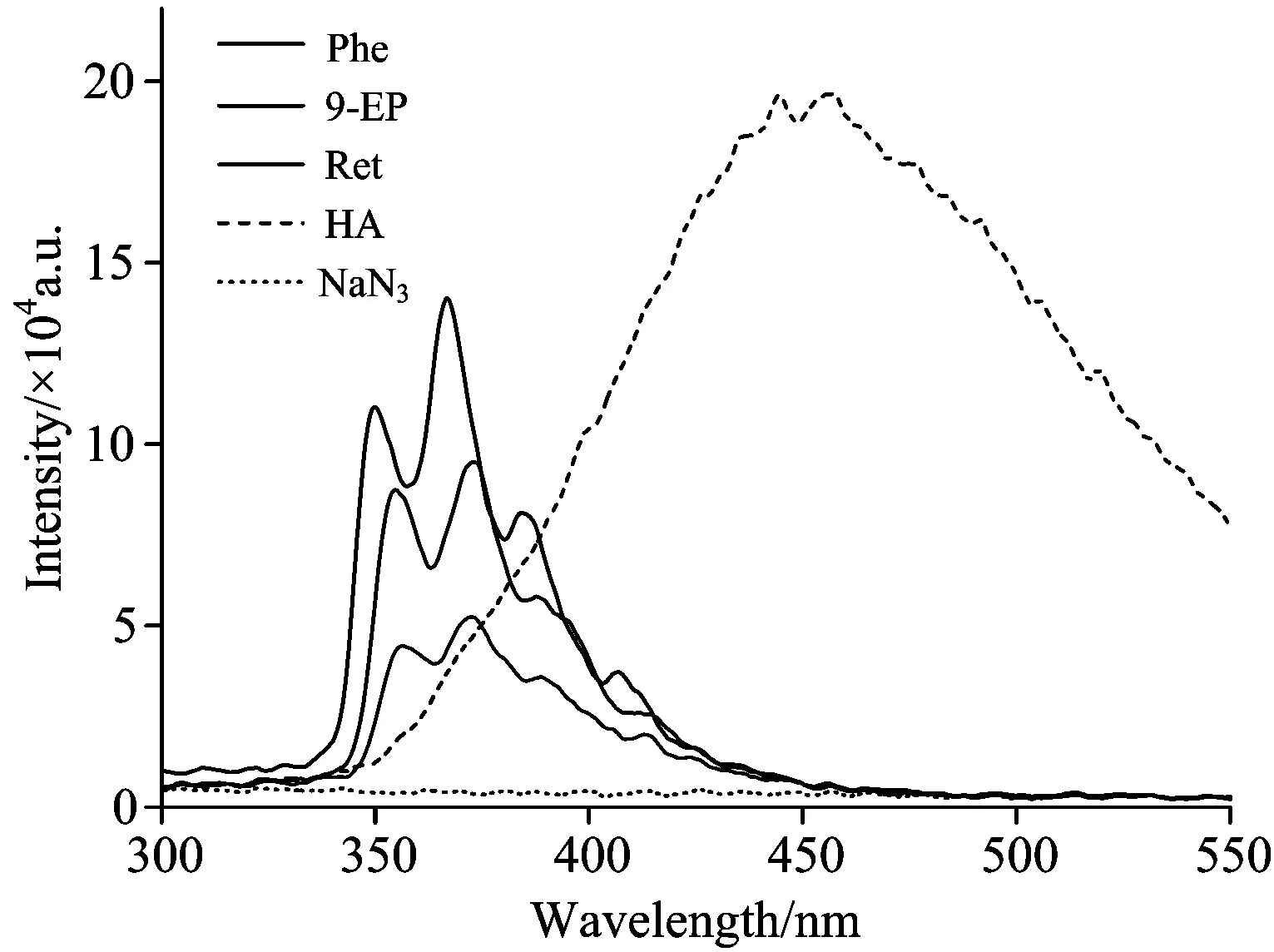
图1 HA(1.0 mg·L-1),Phe(30.0 μg·L-1),9-EP(12.0 μg·L-1)及Ret(12.0 μg·L-1)荧光发射光谱(0 ns 延迟)
Fig.1 Fluorescence emission spectra of HA (1.0 mg·L-1) and Phe (30.0 μg·L-1), 9-EP (12.0 μg·L-1), Ret (12.0 μg·L-1) at 0 ns delay
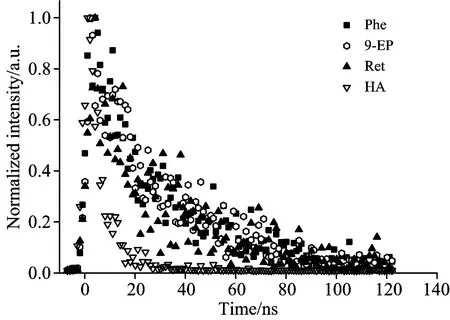
图2 HA,Phe,9-EP及Ret归一化荧光衰减曲线
图3为延迟50 ns时HA及三种PAHs荧光发射光谱图,HA在300~360 nm范围内荧光衰减至背景荧光强度,不影响混合体系中Phe的荧光测定。可见,通过改变延迟时间,可去除HA荧光信号,直接快速检测溶液中游离PAHs含量。其中,Phe,9-EP和Ret选取发射波长分别为350.47, 355.01和355.47 nm。
2.2 Phe,9-EP及Ret与HA等温吸附曲线结果分析
利用对数形式Freundlich模型对试验数据进行拟合以描述Phe,9-EP和Ret与HA结合特性(图4)。拟合结果及给定平衡浓度下Phe,9-EP和Ret单点结合系数KOC见表2。由表2可知,Freundlich非线性等温吸附模型适合描述Phe,9-EP和Ret与HA结合特性。所有Freundlich模型参数n均小于1,表明Phe,9-EP和Ret与HA以非线性形式结合,即除了分子内非极性环境中线性分配外,特异性位点结合在Phe,9-EP和Ret与HA间起重要作用[5, 15-16]。Phe的n大于9-EP和Ret,表明Phe与HA结合作用力中特异性位点结合所占比例更低,因为展示出线性程度较强的吸附形式[17-18]。

图3 HA(1.0 mg·L-1),Phe(30.0 μg·L-1),9-EP(12.0 μg·L-1)及Ret(12.0 μg·L-1)荧光发射光谱(50 ns 延迟)
Fig.3 Fluorescence emission spectra of HA (1.0 mg·L-1) and Phe (30.0 μg·L-1), 9-EP(12.0 μg·L-1), Ret(12.0 μg·L-1) at 50 ns delay
Phe的logKOW较9-EP和Ret小,导致Phe与HA间疏水作用弱[5],且甲基、乙基、异丙基均为供电子基团,可增加PAHs与HA间π—π相互作用,因此,给定平衡浓度下,Phe单点结合系数KOC小于9-EP和Ret。Ret的logKOW比9-EP大,且异丙基较乙基有更强供电子能力使得Ret与HA有更强π—π作用,理论上Ret与HA结合能力应大于9-EP。然而,实验结果显示9-EP和Ret单点结合系数KOC相近。Mark A. Schlautma研究表明特定PAHs与HA结合能力不仅与PAHs疏水性有关,且与其分子量及与HA疏水区域适应能力有关[19]。Ret分子量较9-EP大,且甲基和异丙基分别在1位和7位上,可能导致Ret与HA之间空间位阻效应增加,不利于其与HA特异位点结合。Ret的n值大于9-EP,进一步表明Ret与HA特异位点结合能力比9-EP小。
如表2所示,Phe,9-EP和Ret给定平衡浓度越小,对应KOC越大,与邢宝山等报道母环PAHs与HA结合研究结果一致[16]。邢宝山等提出的“双模式吸附模型”可解释疏水性有机污染物吸附于HA的非线性现象。KOC随PAHs浓度增加而降低表明HA吸附区拥有的高能结合位点数有限,低浓度PAHs较高浓度PAHs吸附于特定位点有更高比例,即PAHs倾向于低浓度时占据这些特异性位点[4, 16]。
表3为传统荧光法所得Phe,9-EP和Ret与HA结合的Freundlich非线性等温吸附模型拟合结果,各参数及单点结合系数KOC与时间分辨荧光猝灭法结果一致。且Phe与HA结合系数介于以往研究不同来源DOM与Phe结合能力之间[4, 20],而有关烷基PAHs研究未见报道,因此未能进行相关比较分析。
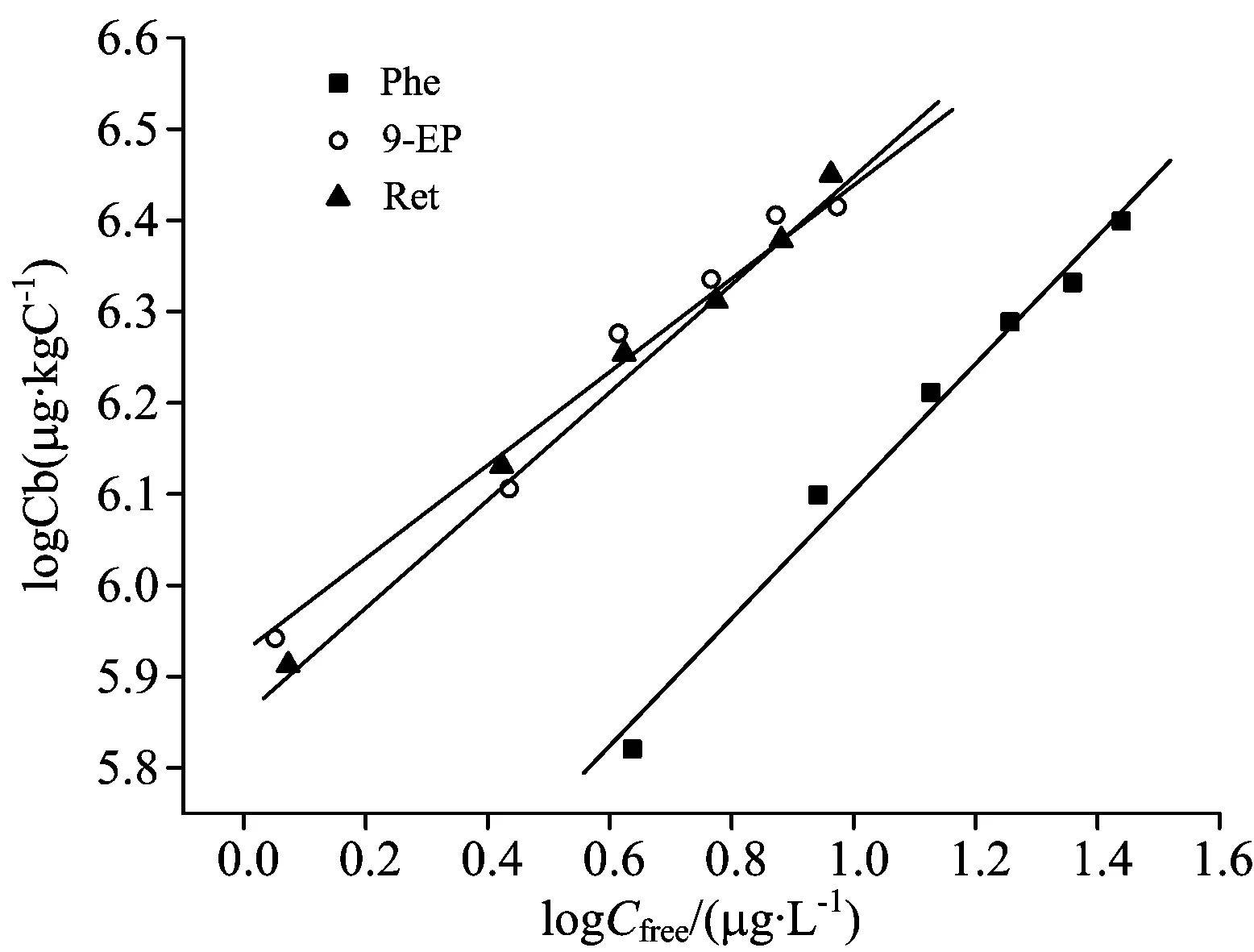
图4 Phe,9-EP及Ret与HA等温吸附曲线
表2 LITRF荧光猝灭法Freundlich等温吸附曲线拟合结果
Table 2 The fitting results of the Freundlich parameters by LITRF quenching method

PAHsnlogKFOCR2logKOC(L·kgC-1)cfree=20μg·L-1cfree=5μg·L-1Phe0 705 410 9831047131584899⁃EP0 555 910 978208930398107Ret0 585 880 995213796389045

表3 传统荧光猝灭法Freundlich等温吸附曲线拟合结果
2.3 荧光寿命分析
已有文献表明荧光寿命分析是判断荧光静态猝灭与动态猝灭最有效方法[15, 21]。然而,PAHs与HA混合时其荧光衰减曲线往往受到HA影响,尤其在前10 ns快衰减阶段。忽视HA对PAHs荧光衰减曲线影响,将干扰PAHs实际荧光寿命测定。HA存在下母环PAHs荧光寿命未改变,表明母环PAHs与HA间的荧光猝灭以静态过程为主[21-22],而有关取代基PAHs与HA间荧光猝灭形式报道较少[7]。
表4为Phe,9-EP和Ret在0 ns延迟(扣除前10 ns)及50 ns延迟条件下HA加入前后对荧光衰减曲线进行单指数拟合寿命结果。由表4可知0 ns延迟时,受HA荧光衰减曲线干扰,直接测定Phe,9-EP和Ret寿命小于未加入HA条件下。延迟50 ns扣除HA荧光衰减曲线影响,结果显示Phe,9-EP和Ret荧光寿命在HA加入前后没有差异,表明三种PAHs与HA间的荧光猝灭以静态过程为主[21]。
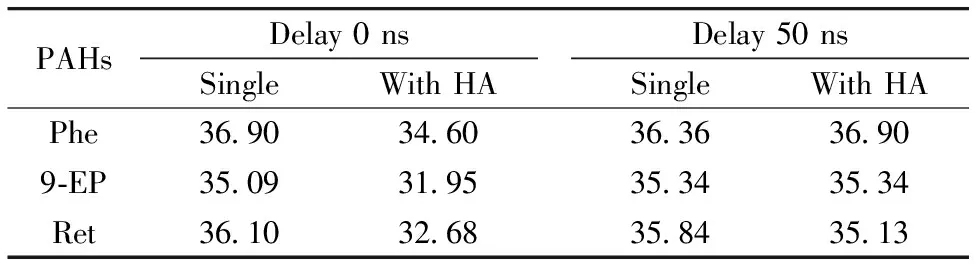
表4 有无HA条件下Phe,9-EP及Ret荧光寿命(ns)分析
3 结 论
与传统荧光法相比,时间分辨荧光猝灭法灵敏度高,为原位在线研究PAHs与HA相互作用提供新的技术支持。该方法无需额外配制HA单组分水溶液,省时、省力。并为烷基PAHs环境行为及生物有效性研究提供了新依据,Phe,9-EP和Ret与HA结合特性(结合能力及等温吸附非线性程度)与它们自身理化属性有关,烷基取代基及分子空间构象对其与HA的相互作用有影响。荧光寿命分析表明Phe,9-EP和Ret与HA间的荧光猝灭以静态过程为主。然而,该方法对荧光寿命较短PAHs(如蒽、芴)无法直接去除HA荧光信号干扰。如引入化学计量学方法(如:平行因子分析)解析HA与PAHs混合体系各自荧光光谱,将来有望实现多组分PAHs共存时与HA相互作用在线原位研究。
[1] Perrichon P, LeB F, Bustamante P, et al. Environ. Sci. Pollut. Res. Int., 2014, 21(24): 13703.
[2] Kim J Y, Kim K T, Lee B G, et al. Ecotoxicol. Environ. Saf., 2013, 92: 57.
[3] Chen S, Ke R H, Zha J M, et al. Environ. Sci. Technol., 2008, 42: 9431.
[4] Mei Y, Wu F, Wang L, et al. J. Environ. Sci., 2009, 21(4): 414.
[5] Plaza C, Xing B, Fernandez J M, et al. Environ. Pollut., 2009, 157(1): 257.
[6] Wang H B, Zhang Y J. J. Environ. Sci. Health., Part A, 2014, 49(1): 78.
[7] Billiard S M, Meyer J N, Wassenberg D M, et al. Toxicol. Sci., 2008, 105(1): 5.
[8] Barron M G, Holder E. Hum. Ecol. Risk Assess., 2003, 9(6):1533.
[9] Lu R, Sheng G P, Liang Y, et al. Environ. Sci. Pollut. Res. Int., 2013, 20(4): 2220.
[10] Liu W X, Xu S S, Xing B S, et al. Environ. Pollut., 2010, 158(2): 566.
[11] Karlitschek P, Lewitzka F, Bunting U, et al. Appl. Phys. B, 1998, 67(4): 497.
[12] Rudnick S M, Chen R F. Talanta, 1998, 47(4): 907.
[13] Clark C D, Morais J J, Jones II G, et al. Mar. Chem., 2002, 78: 121.
[14] Peuravuori J. Anal. Chim. Acta, 2001, 429(1): 65.
[15] Laor Y, Rebhun M. Environ. Sci. Technol., 2002, 36(5): 955.
[16] Pan B, Ghosh S, Xing B S. Environ. Sci. Technol., 2007, 41(18): 6472.
[17] Huang W, Schlautman M A, Weber W J. Environ. Sci. Technol., 1996, 30(10): 2993.
[18] Yang K, Xing B S. Environ. Pollut., 2009, 157(4): 1095.
[19] Schlautman M A, Morgan J J. Environ. Sci. Technol., 1993, 27(5): 961.
[20] Sun K, Gao B, Zhang Z, et al. Environ. Pollut. , 2010, 158(12): 566.
[21] Chen S J, Inskeep W P, Willams S A, et al. Environ. Sci. Technol., 1994, 28(9): 1582.
[22] Gauthler T D, Shane E C, Guerln W F, et al. Environ. Sci. Technol., 1986, 20(11): 1162.
InSituInvestigating of the Interaction of Phenanthrene and Alkyl
(Received Jun. 20, 2015; accepted Oct. 15, 2015)
*Corresponding author
Phenanthrene with Humic Acid with Laser Induced Nanoseconds Time Resolved Fluorescence Quenching Method
LIU Yang-zhi1, YANG Cheng-hu1, ZHU Ya-xian2, ZHANG Yong1,3*
1. State Key Laboratory of Marine Environmental Science (Xiamen University), College of the Environment and Ecology, Xiamen University, Xiamen 361102, China
2. Department of Chemistry, Xiamen University, Xiamen 361005, China
3. Zhangzhou Institute of Technology, Zhangzhou 363000, China
Investigations both on the binding properties and mechanisms of parent polycyclic aromatic hydrocarbons (PAHs) and alkyl PAHs with humic acid (HA) are crucial to understand the environment behavior and bioavailability of PAHs in aquatic ecosystems. Thus, a novel approach for in situ investigation of the interactions between parent PAHs and alkyl PAHs, exemplified by Phenanthrene (Phe), 9-Ethylphenanthrene (9-EP) and Retene (Ret), and HA was established by using fluorescence quenching method with laser-induced nanosecond time-resolved fluorescence (LITRF). By changing the delay time of 50 ns, the fluorescent interference of HA can be eliminated effectively and the concentrations of free Phe, 9-EP and Ret can be determined directly. The binding characteristics of the dissolved HA and Phe, 9-EP and Ret were described by Freundlich nonlinear isothermal model. The results of the model parameters and the single point binding coefficientsKOCof Phe, 9-EP and Ret with HA by LITRF quenching method were consistent with those of the conventional fluorescence quenching method. Nonlinear bindings of Phe, 9-EP and Ret to HA were also observed because of the parameter n values below 1, and the degree of nonlinearity of Phe was lower than 9-EP and Ret duo to the n value of Phe larger than 9-EP and Ret. At a same given equilibrium concentration, theKOCof Phe was lower than 9-EP and Ret, and that of 9-EP was near to Ret. The binding affinity of the three PAHs increased with decreasing the equilibrium concentration. The binding characteristics of PAHs with HA largely depends on their hydrophobicity, substituent groups and its ability to fit into hydrophobic cavities in HA. The fluorescence lifetimes of Phe, 9-EP and Ret in presence of HA were 36.90, 35.34 and 35.13 ns, meanwhile the fluorescence lifetimes of Phe, 9-EP and Ret in absence of HA were 36.36, 35.34 and 35.84 ns. There was no significant difference of three PAHs fluorescence lifetime with or without HA, indicating the quenching mechanism for Phe, 9-EP and Ret with HA were primarily static quenching. The LITRF quenching method could be used to in situ explore the interactions between PAHs and HA, which could be contribute to realize the PAHs risk assessment in real time.
Laser-induced nanosecond time-resolved fluorescence; Fluorescence quenching method; Humic acid; Phenanthrene; Alkyl Phenanthrene
2015-06-20,
2015-10-15
国家自然科学基金项目(21177102,21075102)和国家海洋局海洋溢油鉴别与损害评估技术重点实验室开放基金项目(201405)资助
刘洋之,1991年生,厦门大学近海海洋环境科学国家重点实验室硕士研究生 e-mail:missliu90@126.com *通讯联系人 e-mail:yzhang@xmu.edu.cn
X522
A
10.3964/j.issn.1000-0593(2016)10-3332-05
猜你喜欢
杂志排行
光谱学与光谱分析的其它文章
- Gd靶激光等离子体光源离带辐射及其等离子体演化的研究
- Probing the Binding of Torasemide to Pepsin and Trypsin by Spectroscopic and Molecular Docking Methods
- Mn(Ⅱ)-5-Br-PADAP共沉淀-火焰原子吸收光谱法测定虾、贝样中的镉
- Near Infrared Spectroscopy Study on Nitrogen in Shortcut Nitrification and Denitrification Using Principal Component Analysis Combined with BP Neural Networks
- 内蒙古草原植被最大光能利用率取值优化研究
- 健康和糖尿病大鼠红细胞荧光光谱非线性程度差异
