氯磺丙脲Ⅰ型与Ⅲ型的红外、拉曼及太赫兹光谱研究
2016-07-12方虹霞张慧丽
方虹霞,张 琪,张慧丽,洪 治,杜 勇
中国计量学院太赫兹技术与应用研究所,浙江 杭州 310018
氯磺丙脲Ⅰ型与Ⅲ型的红外、拉曼及太赫兹光谱研究
方虹霞,张 琪,张慧丽,洪 治,杜 勇*
中国计量学院太赫兹技术与应用研究所,浙江 杭州 310018
使用FTIR,FT-Raman和太赫兹时域光谱(terahertz time-domain spectroscopy, THz-TDS)技术在室温下对氯磺丙脲的Ⅰ型与Ⅲ型进行分析与表征。结果显示氯磺丙脲Ⅰ型与Ⅲ型在三种光谱中都表现出明显的差异。红外光谱与拉曼光谱中,Ⅰ型与Ⅲ型的光谱差异主要是吸收峰峰位的移动和峰强的改变; 此外,在拉曼光谱中Ⅲ型在100~1 800 cm-1的特征峰明显多于Ⅰ型; 太赫兹光谱中,Ⅰ型在0.90, 1.09和1.29 THz处有特征峰,而Ⅲ型在0.92, 1.11, 1.23和1.63 THz处有特征峰,尤其是1.63 THz处的一个强峰,明显区别于Ⅰ型。采用密度泛函理论(DFT)对氯磺丙脲两种晶型进行分子模拟,模拟结果与实验光谱较好吻合,同时模拟结果也表明氯磺丙脲Ⅰ型与Ⅲ型在0.9 和1.1 THz处的多分子振动模式相同,可以为氯磺丙脲其他晶型的太赫兹谱归属提供参考。该结果为药物多晶型的IR, Raman以及太赫兹光谱研究提供了依据。
氯磺丙脲; 多晶型; 太赫兹时域光谱; 红外光谱; 拉曼光谱; 密度泛函理论
引 言
药物多晶型现象是指由于同一种元素或化合物在不同的生成条件下质点(原子、离子或分子)排列的空间对称性不同, 质点间的相互作用力和结合能量存在差异, 而导致其在外观形态、理化性质和生物活性上的差异[1]。药物的不同晶型在溶解度、溶出速率、熔点、密度及光学性质都有所不同,因此,检测与控制药物的多晶型是确保药物质量和药物疗效一个重要的环节。
氯磺丙脲(chlorpropamide)作为一种降糖药,常被用于治疗轻、中度成年型糖尿病。同时,氯磺丙脲也是一种典型的多晶型药物[2]。根据Burger[3, 4]的研究结果确认氯磺丙脲共有五种晶型,分别命名为Ⅰ,Ⅱ,Ⅲ,Ⅳ和Ⅴ型,其中Ⅲ型为商业原料。由于药物多晶型会影响药物质量、安全性以及产品的疗效[5, 6],因此针对氯磺丙脲药物多晶型的研究非常有必要。Debrushchak等[7]使用X射线衍射和红外光谱观察氯磺丙脲Ⅰ型在低温下转变为Ⅰ’晶型的过程; Cheslov等[8]用FTIR, FT-Raman结合从头计算理论表征了氯磺丙脲的五种晶型观察了五种晶型NH…O氢键的不同。Tuder等[9]使用FT-Raman定量分析了晶型Ⅱ和Ⅲ的混合物; Wildfong等[10]使用原位Raman技术监测晶型Ⅱ和Ⅲ的压力诱导相变。X射线衍射法[11-14]、差示热量分析法[15-17]、振动光谱[2, 18]和核磁共振[19]都已用于氯磺丙脲晶型的研究。
振动光谱对于药物活性成分(active pharmaceutical ingredient, API)的固态表征是一类非常有效的工具。它的研究重点主要在于分子基本的振动模式。这类方法主要包括红外光谱(中红外)、太赫兹光谱(远红外)以及拉曼散射光谱。Raman光谱源于分子极化率的变化,可以探测分子内化学键的伸缩和弯曲等典型振动; IR光谱检测的则是分子振动时产生的偶极矩变化,对极性基团更为灵敏,两种方法的结合更易于对分子结构的测定和研究。太赫兹光谱属于远红外光谱, 能够探测振动频率更低的分子团的振动和转动振动以及分子间作用力产生的振动。三种振动光谱技术的结合更能够呈现氯磺丙脲不同晶型的光谱差异。
使用FTIR,FT-Raman光谱以及THz-TDS光谱对氯磺丙脲晶型Ⅰ和晶型Ⅲ进行表征。根据剑桥晶体数据库两种晶型的结构数据[7, 20],采用密度泛函理论(DFT)对两种晶型结构进行模拟。结合模拟结果对晶型Ⅰ和晶型Ⅲ在三种光谱中的特征峰进行分析。
1 实验部分
1.1 样品
氯磺丙脲购于西格玛奥德里奇(上海)贸易有限公司,纯度大于99%,使用前未进行进一步的纯化。
晶型Ⅰ:将原料在真空干燥箱(DZF-6020, 杭州艾普仪器设备有限公司)常压、110 ℃下加热1 h,然后冷却至室温; 晶型Ⅲ:商业原料。
1.2 仪器
Raman光谱分析采用的是美国Nicolet公司Nicolet Raman 960型傅里叶变换拉曼光谱仪。拉曼频移范围:3 700~100 cm-1,分辨率为2 cm-1,每个样品累积扫描64次。
FTIR光谱分析采用的是美国Nicolet公司Avatar 370型傅里叶变换红外光谱仪,光谱测量范围4 000~400 cm-1,分辨率为2 cm-1,测试样品采用溴化钾压片法制备,且每组扫描64次。
THz-TDS采用美国Zomega公司Z2测量系统.激发光源为Spectra Physics公司的钛蓝宝石飞秒锁模脉冲激光器, 激光重复频率80 MHz、脉宽100 fs、中心波长800 nm。使用FW-4型压片机(天津天光光学仪器有限公司)将样品在4 MPa的压力下压制成直径为13 mm、厚度为1.5~1.7 mm无裂缝且两端面平行的样片。样品测试在室温下进行, 且使用氮气进行除湿, 使样品腔相对湿度保持在0%。
1.3 理论计算
采用Gaussian03[21]软件分别对氯磺丙脲Ⅰ和Ⅲ型(如图1所示)进行分子模拟,选取密度泛函理论B3LYP方法,结合基组6-31G(d, p)进行理论计算。模拟计算中,首先进行结构优化,再进行频率计算。所有样品的计算结果没有出现虚频,说明所有优化都找到了分子最小能量结构。考虑到模拟中没有完全考虑电子相关作用和其对非简谐性效应的忽略,以及基组选择等因素,采用相应矫正因子0.96[22]。

图1 氯磺丙脲Ⅰ和Ⅲ型的分子结构
2 结果与讨论
2.1 氯磺丙脲晶型Ⅰ和Ⅲ的FTIR,FT-Raman光谱分析
氯磺丙脲晶型Ⅰ和晶型Ⅲ的IR、Raman光谱如图2和图3所示,IR和Raman光谱归属如表1和表2所示。比较晶型Ⅰ与晶型Ⅲ的红外光谱,在400~650 cm-1波段,晶型Ⅲ在438 cm-1处有一个归属于τR弱峰,而晶型Ⅰ在534 cm-1处有一个归属于τR+SO2的强峰; 晶型Ⅰ与晶型Ⅲ在483cm-1处都有一个尖强峰,但晶型Ⅲ在此处的尖峰分裂出一个肩峰,此外晶型Ⅲ在630 cm-1处的尖强峰也分裂出一个肩峰。在950~1 200 cm-1波段,晶型Ⅲ在986,1 015和1 036 cm-1处三个分别归属于Def R,νCCCskeletal和CH3的尖峰的相对强度都强于晶型Ⅰ在此三处的吸收峰; 晶型Ⅲ在1 088 cm-1处的强峰分裂出一个1 118 cm-1的强峰,而晶型Ⅰ在1 169 cm-1处的强峰也同样分裂为两个强峰。在1 250~1 320 cm-1波段,晶型Ⅰ存在一个从1 264~1 289 cm-1的宽峰,而晶型Ⅲ则在该波段出现了很多的小尖峰,且晶型Ⅲ在1 331 cm-1处没有归属于νSO2+τCH2的强峰。在1 500~1 750 cm-1波段,晶型Ⅲ在1 556 cm-1处存在一个归属于νCCring的强宽峰,而晶型Ⅰ则在此处分裂出许多尖峰。晶型Ⅰ在1 660 cm-1处归属于的强峰和1 667 cm-1处归属于的中锋在晶型Ⅲ的光谱图中分别移至1 667和1 701 cm-1。在3 000~3 500 cm-1波段,晶型Ⅲ在3 101 cm-1处归属于νCHring强宽峰的相对强度大于晶型Ⅰ,晶型Ⅰ在3 248 cm-1归属于νCHring和3 398 cm-1归属于νNH的中锋都没有在晶型Ⅲ的光谱图中出现。

图2 氯磺丙脲Ⅰ和Ⅲ型在不同波段的FT-IR光谱图

图3 氯磺丙脲Ⅰ和Ⅲ型在不同波段的FT-Raman光谱图
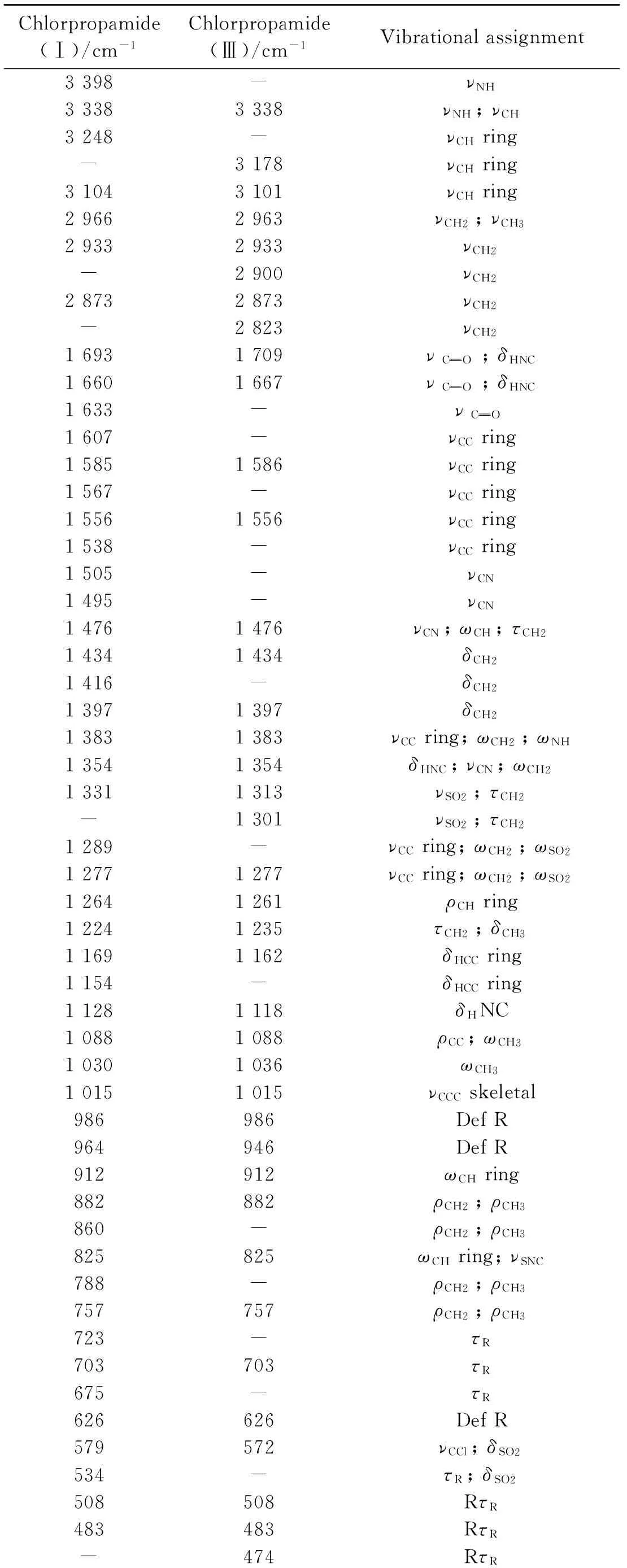
表1 氯磺丙脲Ⅰ和Ⅲ型的红外光谱特征峰的归属
ν: Stretching,δ: Scissor,ρ: in plane bending;ω: out of plane bending;τ: Twisting, Def-torsion; R: Six-member ring

表2 氯磺丙脲Ⅰ和Ⅲ型的拉曼光谱特征峰的归属
ν: Stretching,δ: Scissor,ρ: in plane bending;ω: out of plane bending;τ: Twisting, Def-torsion; R: Six-member ring
根据图3和表2可得,晶型Ⅲ在拉曼光谱中的特征峰多于晶型Ⅰ,且大多集中于800~1 600 cm-1波段。在800~1 600 cm-1波段,氯磺丙脲晶型Ⅲ比晶型Ⅰ多的特征峰位于884, 995, 1 035, 1 237, 1 314和1 354 cm-1等; 晶型Ⅲ归属于ωCH3+ρCC1 088 cm-1处的强尖峰分裂出一个1 122 cm-1处的肩缝; 此外,晶型Ⅰ在1 447 cm-1处有一个归属于δCH3+νCH2的宽峰在晶型Ⅲ的拉曼光谱中分裂为三个连接的小尖峰。除以上两种晶型谱图的不同点外,晶型Ⅰ和晶型Ⅲ的明显区别还在于晶型Ⅰ的谱图在214 cm-1处有一个归属于ρCH3+νCH中强峰。在2 800~3 400 cm-1高波数区,Ⅰ和Ⅲ型的特征峰区别不大,比较明显的是3 338和3 242 cm-1两处归属于γNH+γCH和γCHring的特征峰。
2.2 氯磺丙脲晶型Ⅰ和Ⅲ的THz-TDS光谱及其分析
氯磺丙脲Ⅰ和Ⅲ型的THz-TDS谱图如图4所示,晶型Ⅰ在0.90,1.09,1.29 THz处存在特征吸收峰,晶型Ⅲ则在0.92,1.11,1.23和1.63 THz处存在特征吸收峰。氯磺丙脲晶型Ⅰ太赫兹光谱理论与实验对比如图5所示,氯磺丙脲晶型Ⅲ太赫兹光谱理论与实验对比如图6所示。晶型Ⅰ与晶型Ⅲ的理论特征峰与实验特征峰对比与振动归属如表3、表4所示。由图5、图6及表3、表4可见,氯磺丙脲两种晶型的理论特征峰相对于对应的实验特征峰都出现了蓝移现象,这是因为理论模拟是在0 K的条件下,而实验谱图则是在室温下获得的,因此会产生蓝移现象。至于晶型Ⅰ在0.64 THz的理论特征峰和晶型Ⅲ在0.63 THz处的特征峰未在实验光谱显示的原因可能是这两个特征峰的吸收系数较小,未能体现。
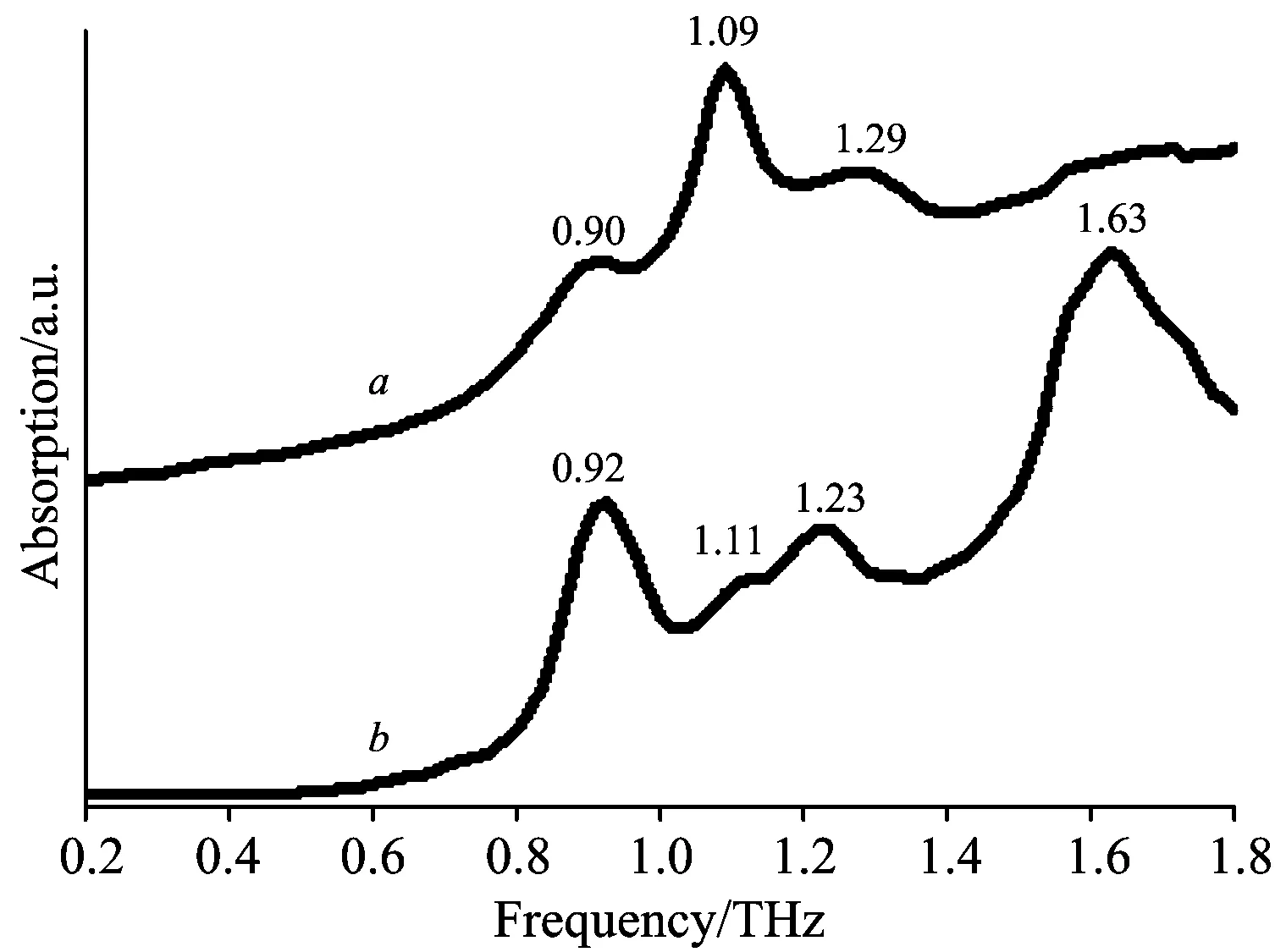
图4 氯磺丙脲Ⅰ和Ⅲ型THz-TDS光谱图
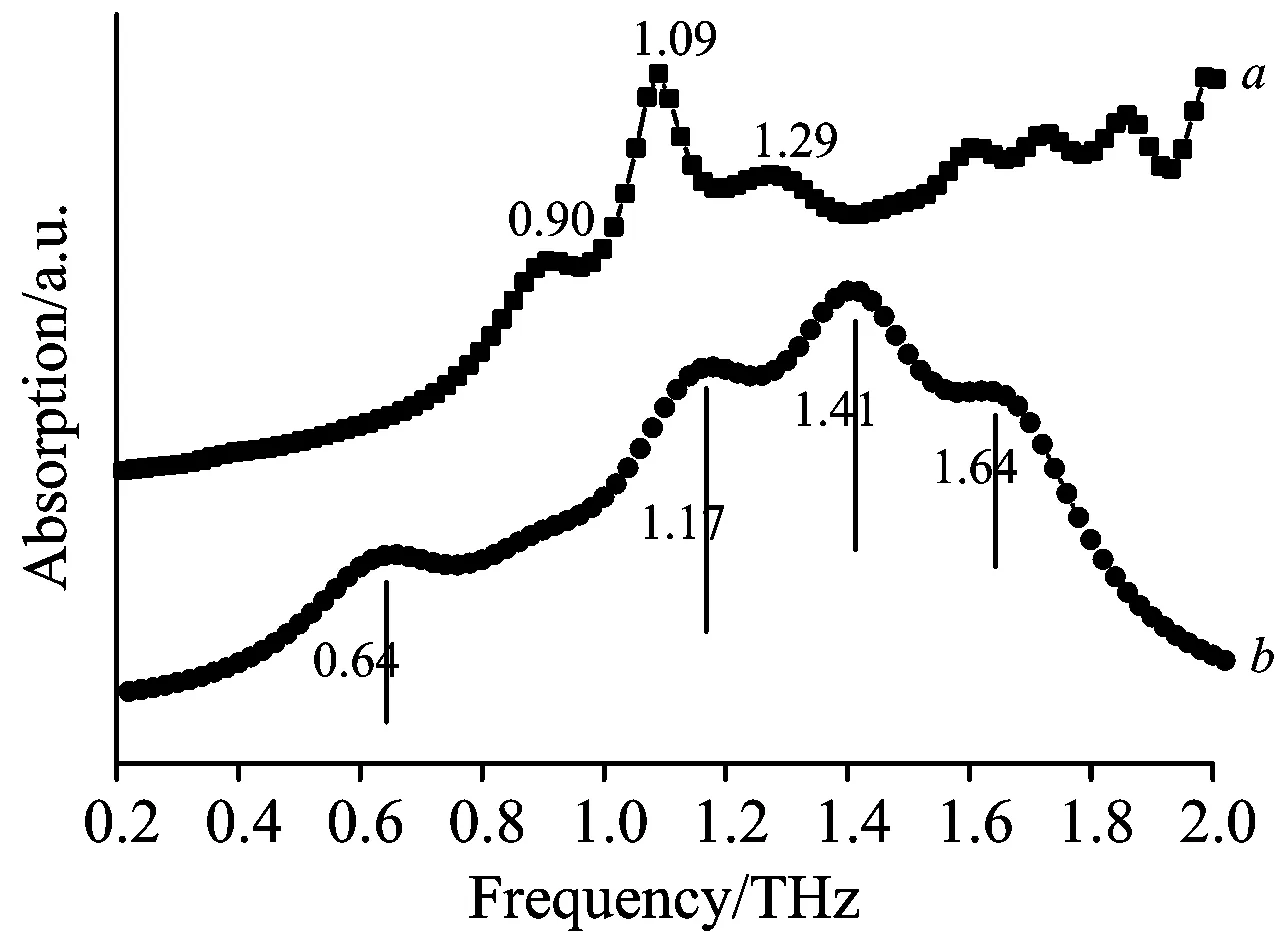
图5 氯磺丙脲晶型Ⅰ太赫兹光谱理论与实验对比

图6 氯磺丙脲晶型Ⅲ太赫兹光谱理论与实验对比

图7 氯磺丙脲Ⅰ和Ⅲ型在0.2~2.0 THz波段的振动模式

表3 氯磺丙脲晶型Ⅰ太赫兹光谱理论与实验对比及振动模式归属
ν:Stretching;δ: Scissor,ρ: in plane bending;ω: out of plane bending;τ: Twisting, Def-torsion; R: Six-membered ring
表4 氯磺丙脲晶型Ⅲ太赫兹光谱理论与实验对比及振动模式归属
Table 4 Comparison and assignment of major bands of terahertz spectra of theoretical spectrum and experimental spectrum of chlorpropamide polymorphs
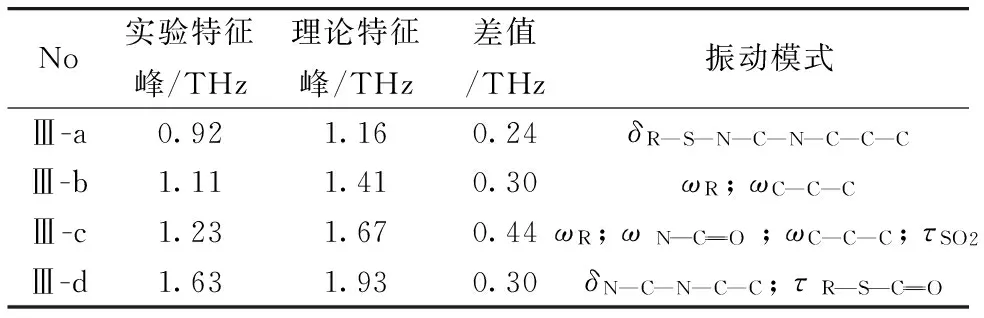
No实验特征峰/THz理论特征峰/THz差值/THz振动模式Ⅲ-a0.921.160.24δR—S—N—C—N—C—C—CⅢ-b1.111.410.30ωR;ωC—C—CⅢ-c1.231.670.44ωR;ωNCO ;ωC—C—C;τSO2Ⅲ-d1.631.930.30δN—C—N—C—C;τRSCO
ν:Stretching;δ: Scissor,ρ: in plane bending;ω: out of plane bending;τ: Twisting, Def-torsion; R: Six-membered ring
由氯磺丙脲晶型Ⅰ和Ⅲ的THz-TDS光谱及特征峰的振动归属可得,晶型Ⅰ和Ⅲ在太赫兹波段展现的特征峰是有多个原子或者是整个分子振动引起的。这一点在IR或Raman光谱中均不能够体现,这也展示了太赫兹光谱在多晶型检测方面的优势。
上述光谱分析可知,IR,Raman及THz光谱都能够分别氯磺丙脲Ⅰ和Ⅲ型。在IR和Raman光谱中,氯磺丙脲Ⅰ和Ⅲ型体现的是分子内化学键的振动。由于氯磺丙脲Ⅰ和Ⅲ型分子的区别在于空间构型不同而分子内化学键大都相同,因此两者在IR和Raman光谱中的特征峰有很多重叠,不利于区分晶型。太赫兹光谱体现的更多是多个原子参与的变形振动、扭动振动和弯曲振动或是分子间振动,能够明显的表征出氯磺丙脲Ⅰ和Ⅲ型构分子象不同,因此,太赫兹光谱更利于区分两种晶型。
3 结 论
使用FTIR,FT-Raman光谱以及THz-TDS光谱对氯磺丙脲晶型Ⅰ和Ⅲ进行表征,结果表明三种光谱技术都能够明显区分的两种晶型。采用密度泛函理论对对两种晶型结构进行模拟,并对晶型Ⅰ和Ⅲ在三种光谱中的特征峰进行归属和分析。比较晶型Ⅰ和Ⅲ的三种光谱,可发现太赫兹光谱技术更利于辨别晶型Ⅰ和Ⅲ,因为晶型Ⅰ和Ⅲ的在太赫兹谱中的振动以基团和链的扭动为主,反映了两种晶型的空间构型不同。这一结果为利用FTIR,FT-Raman以及THz-TDS光谱技术检测药物分子内和分子间相互作用提供了实验及理论参考,同时也证实了THz-TDS技术在药物多晶型检测方面的优越性。
[1] Reutzel E, Susan M.Current Opinion in Drug Discovery & Development, 2006, 9(6): 806.
[2] Ayala A P, Caetano M W C, Honorato S B, et al.Journal of Raman Spectroscopy, 2012, 43: 263.
[3] Burger A.Sci.Pharm, 1975, 43: 152.
[4] Burger A.Pharm.Ind., 1976, 38: 639.
[5] Raw A S, Yu L X.Advanced Drug Delivery Reviews, 2004, 56(3): 235.
[6] Yu L X, Furness M S, Raw A, et al.Pharmaceutical Research, 2003, 20(4): 531.
[7] Drebushchak T N, Chesalov Y A, Boldyreva E V.Acta Crystallographica Section B: Structural Science, 2009, 65(6): 770.
[8] Chesalov V P, Baltakhinov V P, Drebushchak T N, et al.Journal of Molecular Structure, 2008, 891(1-3): 75.
[9] Tudor A M, Church S J, Hendra P J.Pharmceutical Research, 1993, 10(12): 1772.
[10] Wildfong P L D, Morris K R, Anderson C A, et al.Journal of Pharmaceutical Sciences, 2007, 96(5): 1100.
[11] Ueda H, Nambu N, Nagai T.Chemical and Pharmaceutical Bulletin, 1984, 32(1): 244.
[12] Otsuka M, Matsumoto T, Kaneniwa N.Journal of Pharmacy and Pharmacology, 1989, 41(10): 665.
[13] Koivisto M, Heinanen P, Tanninen V P, et al.Pharmaceutical Research, 2006, 23(4): 813.
[14] Alsaieq S S, Riley G S.Pharmceutical Acta Helvetive, 1982, 57(1): 8.
[15] Simmons D L, Ranz R J, Gyanchandani N D.Can.Journal of Pharmaceutical Sciences, 1973, 8(4): 125.
[16] Drebushchak V A, Drebushchak T N, Chukanov N V, et al.Journal of Thermal Analysis and Calorimetry, 2008, 93(2): 343.
[17] Tudor A M, Melia C D, Davies M C.Journal of Pharmacy and Pharmacology, 1991, 43: 34.
[18] Ayala A P.Vibrational Spectroscopy, 2007, 45(2): 112.
[19] Perez S C, Cerioni L, Wolfenson A E, et al.International Journal of Pharmaceutics, 2005, 298(1): 143.
[20] Drebushchak T N, Chukanov N V, Boldyreva E V.Acta Crystallographica Section C: Crystal Structure Communications, 2007, 63(6): o355.
[21] Frisch M J, Trucks G W, Schlegel H B, et al.Gaussian 03, Revision E.01; Gaussian, Inc.; Wallingford, CT, 2004.
[22] ZHAO Rong-jiao, HE Jin-long, LI Jing, et al(赵容娇,何金龙,李 璟).Acta Physical-Chimica Sinica(物理化学学报), 2011, 27(12): 2743.
[23] Yu B, Zeng F, Yang Y, et al.Biophysical Journal, 2004, 86(3): 1649.
(Received Mar.17, 2015; accepted Jul.28, 2015)
*Corresponding author
Experimental Study and DFT Calculation of FTIR, FT-Raman and THz-TDS Spectra of Ⅰ and Ⅲ Polymorphs of Chlorpropamide
FANG Hong-xia, ZHANG Qi, ZHANG Hui-li, HONG Zhi, DU Yong*
Centre for Terahertz Research, China Jiliang University, Hangzhou 310018, China
The absorption spectra of Ⅰ and Ⅲ polymorphs of chlorpropamide were measured with terahertz time-domain spectroscopy (THz-TDS) technique, FT-IR and FT-Raman at room temperature.The results showed that there were distinct differences of Ⅰ and Ⅲ polymorphs of chlorpropamide in those spectra.The IR spectra of two polymorphs of chlorpropamide had showed differences both in the frequencies of the vibrational bands and in the relative band intensities.The obvious differences in Raman spectra of polymorphs of chlorpropamide were that the characteristic peaks of Ⅲ-form were more than Ⅰ-form in 100~1 800 cm-1region.Absorption peaks observing in the terahertz spectra ofⅠ-form were at 0.90, 1.09 and 1.29 THz and Ⅲ-form were at 0.92, 1.11, 1.23 and 1.63 THz.The maximum difference between Ⅰ-form and Ⅲ-form was that the strong peak appeared at 1.63 THz of Ⅲ-form.The characteristic absorption bands of two polymorphs of chlorpropamide were assigned based on the simulation results of DFT calculation.The simulation result is in accordance with the experiment.From simulation results, it is found that the vibration modes of Ⅰ-form and Ⅲ-form were similar in IR and Raman spectra, but there were more differences in terahertz spectra.The study can provide experimental and theoretical references for the application of FT-IR , FT-Raman and THz-TDS spectra techniques to detect pharmaceutical polymorphs.
Chlorpropamide; Polymorphism; FTIR; FT-Raman; Terahertz time-domain spectroscopy; Density functional theory
2015-03-17,
2015-07-28
国家自然科学基金项目(21205110)和浙江省自然科学基金项目(LY15B050004)资助
方虹霞, 女, 1990年生, 中国计量学院太赫兹技术与应用研究所硕士研究生 e-mail:yeyuhaoxifeng@163.com *通讯联系人 e-mail: yongdu@cjlu.edu.cn
O433.5
A
10.3964/j.issn.1000-0593(2016)05-1382-07
