牛蒡子对高糖刺激大鼠系膜细胞增殖作用的机制研究
2016-07-12赵辉
赵辉
(菏泽医学专科学校,山东 菏泽 274000)
牛蒡子对高糖刺激大鼠系膜细胞增殖作用的机制研究
赵辉
(菏泽医学专科学校,山东 菏泽 274000)
目的 探讨牛蒡子对高糖刺激的大鼠系膜细胞(GMC)增殖的影响。方法 大鼠GMC与牛蒡子(100μ mol/L、10μ mol/L)培养48 h后,采用MTT法检测系膜细胞的增殖情况;ELISA法检测转化生长因子-β1(TGF-β1)的分泌水平;实时定量PCR方法检测血管内皮生长因子(VEGF)和血小板衍生性生长因子(PDGF)mRNA的表达。结果 牛蒡子显著抑制高糖诱导的GMC增殖,降低TGF-β1的分泌,降低VEGF和PDGF mRNA的表达。结论 牛蒡子可以显著抑制高糖诱导的GMC增殖,该作用可能与降低TGF-β1、VEGF和PDGF的表达有关。
牛蒡子;转化生长因子β1;血管内皮生长因子;血小板衍生性生长因子
1 材料与方法
1.1 材料
1.1.1 细胞来源 大鼠GMC,购自武汉大学细胞培养物保藏中心。
1.1.2 主要试剂 RPMI 1640、MTT、DMSO:美国Gibco公司;引物:上海博尚生物有限公司;TGF-β1试剂盒:武汉博士德生物有限公司;RNA提取、逆转录及PCR试剂盒:TaKaRa Bio公司。
1.2 方法
1.2.1 细胞培养及分组 GMC在含有10%胎牛血清的RPMI-1640培养液中培养,37℃、5%CO2的培养箱中孵育,2 d传代一次,取对数期细胞用于实验。将细胞分为四组,即阴性对照组(含葡萄糖5.4 mmol/L)、高糖组(含葡萄糖30.0 mmol/L)、牛蒡子高浓度组(含牛蒡子100μ mol/L,葡萄糖30.0 mmol/L)、牛蒡子低浓度组(含牛蒡子10μ mol/L,葡萄糖30.0 mmol/L)。
1.2.2 MMT法检测GMC增殖 取对数期的GMC,置于96孔板中,按照1.2.1中要求分组,每组设6个副孔,培养48 h后,每孔加入20 μ l MTT(5 mg/ml),继续培养4 h,弃去培养基,每孔加入150μ l DMSO,轻轻震荡10 min,使用酶标仪测定490 nm处各孔的吸光度值(OD值),检测GMC增殖情况。
1.2.3 ELISA法检测细胞上清液中TGF-β1的含量取对数期的GMC,置于24孔板中,按照2.1中要求分组,每组设6个副孔,培养48 h后,离心收集上清液,按照ELISA试剂盒操作说明书检测TGF-β1的含量。
1.2.4 PCR法检测细胞中VEGF和PDGF mRNA的表达 取对数期细胞,置于6孔板中,按照1.2.1中要求分组,每组设3个副孔,培养48 h后,后收集细胞加1 ml Trizol提取细胞总RNA,紫外分光光度计测RNA纯度。按cDNA合成试剂盒说明书将RNA逆转录合成cDNA后。以cDNA为模板,以GAPDH为内参,按SYBRGreen荧光染料试剂盒说明进行PCR扩增反应。
VEGF的上游引物序列为5′-CCGCTCTCTTGGGTGCACTGG-3′,下游引物序列为5′-ATCCGGCTTGGCTTGTCGCGA-3′;产物200 bp。
QCS003C教学实验台适用于各高等院校、各中等专业技术学校金属切削机床液压传动课程的教育实验。同样适合于各工人大学培养专门液压技术人员及科研单位作为液压教学和研究使用。
PDGF的上游引物序列为5’-GGGAATACTGCTCACAGAG-3’,下游引物序列为 5’-CGATACAAAATAGCACTTCGG-3’;产物394bp。
GAPDH的上游引物序列为5’–TGCTAGCACCATGAAGACG-3’,下游引物序列为5’–TAACGCAGCTCAGTAACCA-3’,产物212bp。
记录每孔Ct值,并采用△△CT法对结果进行定量分析△△Ct=[Ct(实验组基因)-CtGAPDH(实验组基因)]-[Ct(对照组基因)-CtGAPDH(对照组基因)]。
1.3 统计学处理 应用SPSS20.0软件,所获数据采用方差分析、t检验。
2 结果
2.1 牛蒡子对高糖培养的GMC增殖的影响 培养48h后,高糖组与对照组相比,GMC明显增殖,加入EPA后,GMC的数量显著降低(P<0.05),且呈现剂量依赖性,见表1。
表1 对高糖培养的GMC增殖的影响

表1 对高糖培养的GMC增殖的影响
与对照组比较,*P<0.0005;与HG组比较,#P<0.0005;不同浓度牛蒡子比较,※P<0.005。
组别 n 浓度/(μ mol/L) OD正常组 6 - 0.42±0.01高糖组 6 - 0.70±0.03*高糖+牛蒡子组 6 10 0.63±0.03*#高糖+牛蒡子组 6 100 0.52±0.04*#※
2.2 牛蒡子对高糖培养的GMC TGF-β1分泌的影响培养48 h后,高糖组与对照组相比,细胞上清液中TGF-β 1的分泌量显著升高(P<0.05),加入EPA后,细胞上清液中TGF-β1的分泌量显著降低(P<0.05),且呈现剂量依赖性,见表2。
表2 对高糖培养的GMC TGF-β1分泌的影响

表2 对高糖培养的GMC TGF-β1分泌的影响
与对照组比较,*P<0.0005,△P<0.05;与HG组比较,#P<0.01,☆*P<0.001;不同浓度牛蒡子比较,◇P<0.05。
组别 n 浓度/(μ mol/L) TGF-β1(ng/ml)正常组 6 - 0.44±0.04高糖组 6 - 0.57±0.03*高糖+牛蒡子组 6 10 0.53±0.02*#高糖+牛蒡子组 6 100 0.49±0.04△☆◇
2.3 牛蒡子对高糖培养的GMC VEGF和PDGF表达的影响 培养48 h后,高糖组与对照组相比,GMC VEGF和PDGF mRNA的表达增加(P<0.05),加入EPA后,GMC VEGF和PDGF mRNA的表达明显降低(P<0.05),且呈现剂量依赖性,见表3。
表3 对高糖培养的GMC VEGF和PDGF mRNA表达的影响
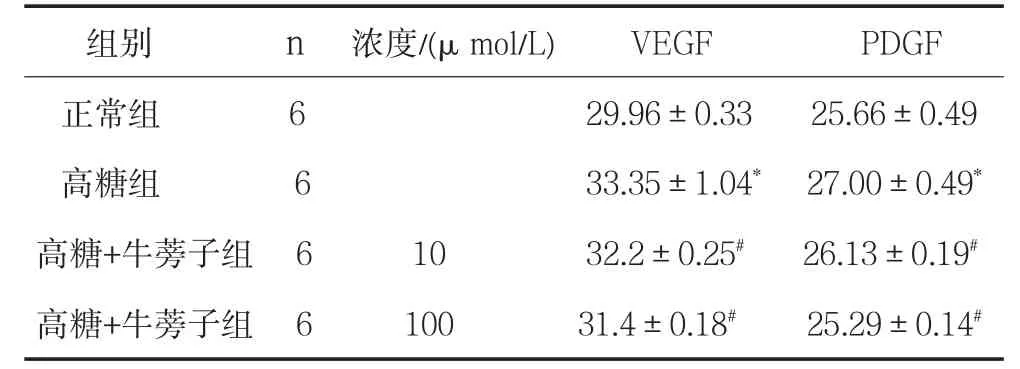
表3 对高糖培养的GMC VEGF和PDGF mRNA表达的影响
与对照组比较,*P<0.05;与HG组比较,#P<0.05。
组别 n 浓度/(μ mol/L) VEGF PDGF正常组 6 29.96±0.33 25.66±0.49高糖组 6 33.35±1.04* 27.00±0.49*高糖+牛蒡子组 6 10 32.2±0.25# 26.13±0.19#高糖+牛蒡子组 6 100 31.4±0.18# 25.29±0.14#
3 讨论
DN即是糖尿病严重而常见的微血管并发症,又是其死亡的主要原因。DN的发生过程中主要的病理变化是肾小球基底膜增厚和系膜外基质增多,导致肾小球硬化和肾功能衰竭。GMC是肾小球中最活跃的细胞,能合成分泌多种细胞因子,在肾小球病的发生中处于重要地位[3]。高糖可以通过激活活性氧、糖基化终末产物、血管紧张素等途径,促进系膜细胞分泌细胞因子,其中包括TGF-β1、VEGF和PDGF[4]。
TGF-β1属于多肽链组成的二聚体,是由多种细胞分泌的的多肽生长因子,广泛存于肾脏中,参与肾小球细胞增殖、分化和凋亡等过程[5]。VEGF可以促进血管内皮细胞增生及诱导血管生成,参与DN早期蛋白尿产生和系膜细胞增殖,目前已成为研究热点[6]。PDGF作为多种因素导致肾脏损伤共同的重要中介,与肾小球系膜细胞增殖、肾小球细胞外基质蛋白积聚密切相关,也与肾小球硬化密切相关[7]。
牛蒡子是从菊科草本植物牛蒡的干燥的成熟果实中提取分离而来的木脂素化合物。研究表明牛蒡子除了抗病毒、抗肿瘤作用外,还能通过抗炎、抗免疫发挥肾脏保护作用[8,9]。
本实验结果发现,高糖环境下培养48 h,RMC增殖明显。而牛蒡子可以抑制高糖环境下GMC的增殖,且浓度越高,抑制作用越强。本实验还发现,牛蒡子还可以抑制高糖环境引起的TGF-β1、VEGF和PDGF的表达增加,且浓度越高,抑制作用越强。这些结果显示,牛蒡子可抑制高糖诱导GMC增殖,保护肾脏,该作用可能与下调TGF-β1、VEGF和PDGF的表达有关。
[1]Dronavalli S,DukaI,BakrisGL.Thepathogenesis of diabetic nephropathy[J].Nat Clin Pract Endocrinol Metab,2008,4(8):444-452.
[2]Ryu JM,Lee MY,Yun SP,et al.High glucose regulates cyclin D1/E of human mesenchymal stem cells through TGF-β1expression via Ca2+/PKC/MAPKs and PI3K/Akt/mTOR signal pathways[J].Journal of Cellular Physiology,2010,224(1):59-70.
[3]李俊燕,谭英姿,冯国鄞,等.糖尿病肾病遗传学研究进展[J].遗传,2012,34(12):1537-1544.
[4]Kim SK,Jung KH,Lee BC.Protective effect of Tanshinone IIA on the early stageof experimental diabetic nephropathy[J].Biol Pharm Bull, 2009,32(2):220-224.
[5] 洪练,李竟,高凌,等.高糖培养人肾小球系膜细胞对TGF-β 1、FN、Smad7表达的影响[J].微循环学杂志,2011,21(2):13-18.
[6]Wu T,Zhang B,Ye F,et al.A potential role for caveolin-1 in VEGF-induced fibronectin upregulation in mesangial cells:involvement of VEGFR2 and Src[J].Am J Physiol Renal physiol,2013,304(6):820-830.
[7]Miyata T.Novel mechanisms and therapeutic options in diabetic nephropathy[J].Pol Arch Med Wewn,2009,119(4):261-264.
[8]Tsai WJ,Chang CT,Wang GJ,et al.Arctigenin from Arctium lappa inhibits interleukin-2 and interferon gene expression in primary human T lymphocytes[J].Chin Med,2011,6(1):12-15.
[9]徐朝晖,李婷,邓毅,等中药活性成分牛蒡子苷元药理作用研究进展[J].湖北畜牧兽医,2013,34(2):65-67.
Effects of Arctium on Proliferation of High Glucose Stimulated Rat Glomerular Mesangial Cell
Zhao Hui
(Heze Medical College,Heze 274000,Shandong)
ObjectiveTo investigate the effects of arctium on Proliferation of highglucose stimulated rat glomer⁃ular mesangial cell.MethodsGMC were incubated with arctium(100μ mol/L、10μ mol/L)for 48 hours,the Prolifera⁃tion of rat glomerular mesangial cell was measured by MTT method,the secretion of TGF-β1was measured by ELISA method,and the expression of VEGF and PDGF mRNA was measured by real-time PCR method.ResultsArctium could decrease the the Proliferation of rat glomerular mesangial cell,TGF-β1secretion,VEGF and PDGF mRNA ex⁃pression by high glucose stimulated rat glomerular mesangial cell.ConclusionThe arctium can decrease the the Prolif⁃eration of rat glomerular mesangial cell by reducing the expression of TGF-β1,VEGF and PDGF.
Burdock;Transforming growth factor-β1;Vascular endothelial growth factor;Platelet-derived growth factor
R285.5
A
1008-4118(2016)03-0012-03
10.3969/j.issn.1008-4118.2016.03.004
2016-07-14
