小剂量美罗华联合重组人血小板生成素治疗难治性ITP疗效以及对细胞免疫功能的影响
2016-07-12骆林胜冯爱梅薛阿利李强吴品张日
骆林胜,冯爱梅,薛阿利,李强,吴品,张日
(1.温州医科大学附属第三医院 血液科,浙江 温州 325200;2.苏州大学附属第一医院 血液科,江苏 苏州 215006)
小剂量美罗华联合重组人血小板生成素治疗难治性ITP疗效以及对细胞免疫功能的影响
骆林胜1Δ,冯爱梅1,薛阿利1,李强1,吴品2,张日2
(1.温州医科大学附属第三医院 血液科,浙江 温州 325200;2.苏州大学附属第一医院 血液科,江苏 苏州 215006)
目的 探讨小剂量美罗华联合重组人血小板生成素(recombinant human thrombopoietin,rhTPO)治疗难治性免疫性血小板减少症(primary immune thrombocytopenia,ITP)疗效以及对细胞免疫功能的影响。方法 选取难治性ITP患者43例,分为观察组(n=23)和对照组(n=20),观察组给予小剂量美罗华联合重组人血小板生成素治疗,对照组给予重组人血小板生成素治疗,2组均治疗1个月,观察并比较2组治疗疗效以及治疗前后血小板计数(PLT),T、B淋巴细胞的变化。结果 治疗1个月后,观察组和对照组总有效率分别为78.26%、70%,差异无统计学意义,治疗3个月后,观察组和对照组总有效率分别为73.91%、40%(P<0.05);2组治疗后PLT水平均时间延长而升高,且观察组PLT水平升高幅度大于对照组(P<0.05);2组治疗后,CD4+、CD4+/ CD8+均显著上升,CD8+均显著下降(均P<0.05),观察组CD19+/ CD20+显著下降(P<0.05),而对照组CD19+/ CD20+差异无统计学意义。结论 小剂量美罗华联合重组人血小板生成素治疗难治性ITP有效,能显著增强患者细胞免疫功能,联合治疗比单用重组人血小板生成素疗效时间更长。
免疫性血小板减少症;难治性;美罗华;重组人血小板生成素;疗效;细胞免疫功能
原发免疫性血小板减少症(primary immune thrombocytopenia,ITP)是由于机体自身免疫功能异常,导致血小板破坏过多或巨核生成障碍,使患者血液中血小板数量减少,临床表现以出血为主的疾病。对于难治性ITP和/或糖皮质激素治疗无效的ITP,国内曾广泛应用环磷酰胺、硫唑嘌呤与长春碱类等免疫抑制剂,但其有效率较低,毒副作用较大,且起效缓慢(平均起效时间1~2个月)[1],故临床应用也逐渐减少。美罗华(即利妥昔单抗)和重组人血小板生成素(recombinant human thrombopoietin,rhTPO)均是治疗ITP的新型药物,美罗华是人鼠嵌合型单克隆抗CD20抗体,能够清除产生自身抗体的B淋巴细胞,且相对安全及较少引起骨髓抑制,现多用于治疗难冶性ITP。重组人血小板生成素(rhTPO)通过刺激巨核细胞分化和成熟来促进血小板的产生,有效增加外周血中血小板计数(platelet count,PLT)。本研究利用美罗华联合rhTPO治疗难治性ITP,取得良好疗效,现报告如下。
1 资料与方法
1.1 一般资料 选择2015年1月-2015年9月温州医科大学附属第三医院血液科收治的难治性ITP患者43例。入组标准:年龄16~75岁,男女不限。符合下列ITP诊断标准[2]:多次实验室检查血小板计数减少,血细胞形态无异常;脾脏一般不肿大;骨髓检查巨核细胞数增多或正常,有成熟障碍;除外各种先天性血小板减少、假性血小板减少和其它继发性血小板减少症;血小板计数≤30×109/L,或血小板计数≥30×109/L但有出血表现;经糖皮质激素正规治疗4周后无效或有效后复发,且不宜或不接受脾切除术治疗,或切脾治疗无效或有效后复发;自愿接受住院治疗并签属知情同意书。本研究经本院伦理委员会批准。排除标准:入组前3个月内接受过其他二线药物治疗的患者,如环孢素、长春新碱、达那唑、环磷酰胺等;入组前3周内接受过化疗,抗凝药物或其他可能影响血小板计数的治疗;严重心、肺、肝、肾功能不全者;严重免疫缺陷,或全身自身免疫性疾病者;研究者认为不宜参加本试验的任何其他情况的患者。
依据患者家庭经济条件以及患者意愿,将所有患者分为观察组和对照组,观察组23例,其中男13例,女10例;年龄21~68岁,平均年龄(44.5±23.5)岁;病程6个月~12年,平均病程(5.71±4.21)年。对照组20例,其中男11例,女9例;年龄24~69岁,平均年龄(46.5±22.5)岁;病程8个月~10年,平均病程(5.23±3.86)年。2组患者一般资料比较差异无统计学意义。
1.2 方法
1.2.1 治疗方法:观察组给予小剂量美罗华联合重组人血小板生成素治疗,具体为:小剂量美罗华100 mg(利妥昔单抗,上海罗氏制药有限公司,批号:SH0066)加入100 mL无菌无致热源的生理盐水中,稀释到利妥昔单抗浓度为1 mg/ mL,单独建立静脉通道,以100 mL/h的速度持续静脉滴注(首次应用需先以50 mL/h的速度滴注,1小时后可调整至100 mL/h,每周1次,分别于第1,8,15,22 d应用,共应用4次。重组人血小板生成素(特比澳,沈阳三生制药股份有限公司,批号:S20050048)300 U/kg qd×14,皮下注射(SC),于第1至14天连续应用,其后根据患者血小板计数情况1~3次/每周,第30天停药。
对照组单予重组人血小板生成素治疗,方法同上。所有患者均予止血对症治疗,有明显出血倾向者予输注血小板悬液。
1.2.2 检测指标
疗效标准[2]:分别于治疗一个月后和三个月后观察2组疗效,疗效标准为:完全反应(complete reaction,CR),治疗后血小板计数≥100×109/L且没有出血;有效(reaction,R),治疗后血小板计数≥30×109/L,并且至少比基础血小板数增加2倍且没有出血;无效(no reaction,NR),治疗后血小板计数<30×109/L或者增加不到基础的2倍或者有出血。
常规检查 2组患者于治疗前,治疗第一个月每周复查血常规,治疗第2到3个月,每2周复查血常规,普朗全自动血液分析仪XFA6000A监测血小板计数(PLT)。
T、B细胞亚群检查 2组患者于治疗前和治疗1个月后新鲜采集外周静脉血标本。所有采集标本用EDTA抗凝管收集,采用密度梯度离心法分离单个核细胞,加入不同的荧光标记抗体,用流式细胞仪(BD公司的FACS Caliber 型)检测 CD19+,CD20+B淋巴细胞和CD4+,CD8+T淋巴细胞亚群的变化。
2 结果
2.1 疗效评价 治疗一个月后,观察组 CR,R例数分别为6,12,总有效率为78.26%(18/23),治疗3个月后总有效率为73.91%(17/23);治疗1个月后,对照组 CR、R例数分别为5、9,总有效率为70%(14/20),治疗3个月后总有效率降为40%(8/20)。2组治疗1个月后总有效率比较差异无统计学意义(χ2=0.383,P>0.05),2组治疗3个月后总有效率比较差异有统计学意义(χ2=5.055,P<0.05)。
2.2 2组治疗前后PLT对比 2组治疗前,PLT差异无统计学意义,2组治疗后,PLT均高于治疗前(P<0.05);治疗7 d、14 d、1个月,观察组和对照组PLT差异无统计学意义;治疗2个月、3个月后,观察组PLT显著高于对照组(P<0.05)。见表1。

表1 2组治疗前后PLT对比
*P<0.05,与同组治疗前比较,compared with the same group pre-treatment;#P<0.05,与对照组治疗后比较,compared with control group post-treatment
2.3 2组治疗前后T、B淋巴细胞对比 2组治疗前, T淋巴细胞亚群差异无统计学意义,2组治疗1个月后 CD4+、CD4+/ CD8+均显著上升,CD8+均显著下降(P<0.05),且观察组和对照组比较差异无统计学意义;2组治疗前,CD19+/CD20+差异无统计学意义,治疗1个月后,观察组CD19+/CD20+显著下降(P<0.05)而对照组CD19+/CD20+差异无统计学意义。见表2。


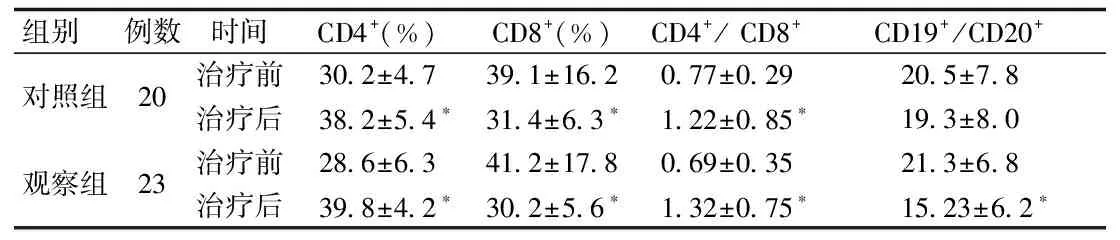
组别 例数时间CD4+(%)CD8+(%)CD4+/CD8+CD19+/CD20+对照组20治疗前30 2±4 739 1±16 20 77±0 2920 5±7 8治疗后38 2±5 4∗31 4±6 3∗1 22±0 85∗19 3±8 0观察组23治疗前28 6±6 341 2±17 80 69±0 3521 3±6 8治疗后39 8±4 2∗30 2±5 6∗1 32±0 75∗15 23±6 2∗
*P<0.05,与同组治疗前比较,compared with the same group pre-treatment;#P<0.05,与对照组治疗后比较,compared with control group post-treatment
3 讨论
最新的国际ITP工作组共识推荐的一线治疗方案有肾上腺皮质激素、静脉注射免疫球蛋白(IVIG)和静脉抗D球蛋白,其中肾上腺皮质激素包括泼尼松/泼尼松龙、地塞米松以及甲基强的松龙。目前糖皮质是治疗初诊成人ITP的一线药物,对大部分ITP有效,而约30%患者糖皮质激素治疗无效或治疗过程中复发,或需要较大剂量的糖皮质激素才能维持疗效从而产生明显的副作用,对这部分难治性ITP患者应考虑二线治疗方案[3-4],美罗华和重组人血小板生成素(rhTPO)均是治疗ITP的新型药物。
ITP的发生主要与免疫功能紊乱相关,包括T、B淋巴细胞功能异常[5]。ITP患者的血小板表面存在着许多自身免疫球蛋白,通过巨噬细胞系统的免疫介导血小板的破坏,B细胞转变而成的浆细胞是所有免疫球蛋白的来源,控制B细胞的过度激活、活化、分化成为浆细胞,甚至清除B细胞已成为ITP治疗的研究方向。美罗华为人鼠嵌合抗CD20单克隆抗体,可通过补体依赖细胞毒作用、抗体依赖的细胞毒作用和诱导凋亡发挥清除血液、淋巴结以及骨髓中B淋巴细胞的作用[6]。本研究结果也表明,观察组患者治疗1个月后患者体内B淋巴细胞均被清除,同时CD4+、CD4+/CD8+均显著上升,CD8+均显著下降(P<0.05)。说明患者细胞免疫功能得到显著提升。国外研究指出美罗华治疗ITP疗效确切,且长期随访结果显示,患者均未发生严重不良反应,不良反应在患者可耐受范围内[7-8]。并且美罗华在慢性ITP患者中可代替脾切除术,是安全有效的治疗药物[9]。但因价格昂贵,且为自费药品,限制了标准剂量在治疗难治性ITP中的应用。近年来,国内外也有报道小剂量美罗华治疗难治性ITP的反应率与标准剂量相近,但起效时间更长[10-11]。
重组人血小板生成素(rhTPO)是在中国仓鼠卵巢细胞中表达的全长糖基化的血小板生成素(TPO)。TPO,亦称作为巨核细胞生长发育因子(MGDF),是一种主要由肝肾合成的糖蛋白,通过刺激巨核细胞分化和成熟来促进血小板的产生。TPO能够刺激骨髓生成血小板,使得外周血中血小板计数增加。由北京协和医院等多中心临床试验研究表明[12],rhTPO升高ITP患者血小板,近期有效率高于50%,临床试验中出现的不良反应多不需处理,如轻微发热,乏力,注射部位疼痛,头晕等,提示其安全性较好。孙君艳等[13]研究表明单一剂量rhTPO能够使血小板计数呈剂量依赖性增加,于给药后第5天开始上升,10~14天达到峰值,但停药后血小板数量逐渐下降至基线。本研究结果表明,单用rhTPO治疗1个月后,PLT均高于治疗前且差异有显著意义(P<0.05),而停药后PLT开始下降,治疗1个月后总有效率为70%,3个月后总有效率降为40%。本实验结果与孙君艳、曹慧琴等[13-14]的研究一致。
美罗华治疗起效时间长,rhTPO起效快但停药后血小板回落,患者不能获得长期缓解。本研究应用小剂量美罗华联合rhTPO治疗难治性ITP,能使难治性ITP患者血小板在短期内(治疗1周后)快速上升,且相比单一rhTPO治疗患者又能获得较长期缓解。因此,本研究具有重要临床价值和现实意义,符合成本效益原则。
总而言之,本研究结果显示小剂量美罗华联合rhTPO治疗难治性ITP有效,能显著增强患者细胞免疫功能,且联合治疗比单用rhTPO疗效时间更长。
[1] 董志高,陈旭艳. 难治性ITP的发病机制和现代免疫治疗[J].中国老年保健医学, 2010,8(5):60-63.
[2] 中华医学会血液分会血栓与止血学组. 成人原发免疫性血小板减少症诊治的中国专家共识(修订版)[J]. 中华血液学杂志, 2011,32(3) : 214-216.
[3] Lozano ML, Vicente V.Current treatment of primary immune thrombocytopenia[J].Med Clin (Barc),2014,142(9):399-405.
[4] Provan D, Stasi R, Newland A C, et al. International consensus report on the investigation and management of primary imrnune throm bocytopenia[J]. Blood, 2010,115(2): 168-186.
[5] 伍星. 免疫性血小板减少症T细胞免疫状态及临床分析[D].天津:天津医科大学.
[6] Cooper N, Stasi R, Cunningham-Rundles S, et al. Platelet-associated antibodies, cellular immunity and FCGR3a genotype influence the response to rituximab in immune thrombocytopenia [J]. Br J Haematol, 2012, 158( 4) : 539-547.
[7] Routy B, Boulassel MR, Spurll GM, et al. Multiple cycles of ritux-imab therapy in chronic refractory immune thrombocytopenia: a case report with a 10-year follow-up[J].Am J Ther, 2013,20(2):219-222.
[8] Zaja F, Volpetti S, Chiozzotto M, et al. Long-term follow-up analysis after rituximab salvage therapy in adult patients with immune thrombocytopenia[J]. Am J Hematol, 2012,87(9): 886-889.
[9] Brah S, Chiche L, Fanciullino R, et al. Efficacy of rituximab in immune thrombocytopenic purpura: A retrospective survey[J]. Ann Hematol, 2012,91(2): 279-285.
[10] 郭素丽,陈娜飞,魏秋平,等. 小剂量与标准剂量利妥昔单抗治疗老年慢性难治性免疫性血小板减少症的临床研究[J]. 实用医学杂志, 2013,29(13):2197-2198.
[11] David Ga, Manuel SG, Lez TA, et al. Low-dose rituximab and alemtuzumab combination therapy for patients with steroid-refractory autoimmune cytopenias[J]. Blood, 2010,116(23): 4783-4785.
[12] 王书杰, 杨仁池, 侯明,等. 重组人血小板生成素治疗特发性血小板减少性紫癜的多中心随机对照临床试验[J].血栓与止血学, 2010,15(4):149-155.
[13] 孙君艳,王伟, 赵洪国,等.重组人血小板生成素治疗原发免疫性血小板减少症的疗效观察[J]. 血栓与止血学, 2014,21(2):76-78.
[14] 曹慧琴, 任羽,苏保雄,等. 重组人血小板生成素在难治性血小板减少性紫癜中的应用[J]. 实用药物与临床, 2012,15(12):781-783.
(编校:谭玲)
Effect of lower-dose rituximab combined with recombinant human thrombopoietin in treatment of patients with refractory primary immune thrombocytopenia and the influence on the cellular immune function
LUO Lin-sheng1Δ, FENG Ai-mei1, XUE A-li1, LI Qiang1, WU Ping2, ZHANG Ri2
(1.Department of Hematology, The Third Affiliated Hospital of Wenzhou Medical University, Wenzhou 325200, China; 2.Department of Hematology, First Affiliated Hospital of Suzhou University, Suzhou 215006, China)
ObjectiveTo investigate the therapeutic effect of lower-dose rituximab combined with recombinant human thrombopoietin (rhTPO) in treatment of patients with refractory primary immune thrombocytopenia (ITP) and the influence on the function of immune cells.Methods43 cases of refractory ITP patients were divided into the observation group(n=23) and the control group(n=20), the observation group was given lower-dose rituximab combined with rhTPO treatment, the control group was given only rhTPO treatment. Both two groups were treated for one month, the therapeutic effect of the two groups and the changes of platelet count (PLT), T and B lymphocytes before and after treatment were observed and compared.ResultsAfter a month of treatment, the total effective rate of the observation group and the control group were 78.26% and 70% respectively, after three months of treatment, the total effective rate of the observation group and the control group were 73.91% and 40% respectively(P<0.05); After treatment, both two group patients’ PLT levels were significantly higher than before treatment (P<0.05); PLT after treatment rised, and the PLT in observation group elevated greater than the control group (P<0.05);After treatment, the level of CD4+, CD4+/CD8+increased significantly in two groups, and CD8+were decreased significantly(P<0.05).CD19+/CD20+levels decreased significantly in the observation group(P<0.05), while the level of CD19+/CD20+in the control group had no significant difference.ConclusionLower-dose rituximab combined with rhTPO treatment could effectively treat refractory ITP, it could significantly enhance the cellular immune function of patients, and the curative effect time of combined treatment is longer than the single use of rhTPO.
immune thrombocytopenic purpura; refractory; rituximab; recombinant human thrombopoietin; clinical efficacy; cellular immune function
温州市科技计划项目(Y20150181)
骆林胜,通信作者,男,硕士,副主任医师,研究方向:血液病的基础和临床研究,E-mail:luolinsheng63@163.com。
R558.2
A
1005-1678(2015)12-0026-03
