ADIG诱导牛成肌细胞转分化及相关基因的表达分析
2016-07-11梅楚刚付常振姜碧杰昝林森
梅楚刚,张 琼,付常振,刘 扬,姜碧杰,成 功,2,昝林森,2*
(1.西北农林科技大学动物科技学院,杨凌 712100; 2.国家肉牛改良中心,杨凌 712100)
ADIG诱导牛成肌细胞转分化及相关基因的表达分析
梅楚刚1,张琼1,付常振1,刘扬1,姜碧杰1,成功1,2,昝林森1,2*
(1.西北农林科技大学动物科技学院,杨凌 712100; 2.国家肉牛改良中心,杨凌 712100)
摘要:旨在通过在牛成肌细胞中过表达ADIG基因,诱导成肌细胞向成脂转分化,探讨该牛脂肪分化转录因子ADIG基因在脂类代谢过程中的功能,为阐明牛脂肪细胞分化转录因子ADIG基因在牛脂肪组织生长发育过程中发挥的作用提供证据。本研究用AD-ADIG腺病毒原液诱导转分化初生荷斯坦牛的成肌细胞,并在诱导分化后第2、4、6、8、10、12、14天进行油红O染色观察诱导成脂情况,同时收集细胞提取总RNA,利用实时荧光定量PCR分别检测ADIG、PPARγ、C/EBPα、SREBPF1、FABP4、FAS、MyoD基因的表达量变化。实时荧光定量PCR检测结果表明,ADIG基因在第2、4、6、8、10、12、14天均有高水平表达,且随着诱导天数增加脂滴明显增多。成脂相关的基因PPARγ、SREBPF1和FAS在后期AD-ADIG组中表达量均高于空白组,成肌相关的基因MyoD相对表达量在初期就显著下降,且AD-ADIG组明显低于对照组。综合脂滴染色和相关基因表达量方面的研究结果,说明ADIG基因在诱导牛成肌细胞分化向成脂转分化过程中发挥着重要作用,而且牛成肌细胞有向脂肪细胞分化的倾向。
关键词:牛成肌细胞;诱导转分化;AD-ADIG
牛肉是一种营养价值较高的肉食品,一直以来作为中国传统的高档肉,受到消费者的普遍欢迎[1]。如何提高肉牛脂肪沉积、改善牛肉嫩度、增加大理石花纹,已成为国内肉牛选育改良的重要课题之一。
小脂肪细胞因子(Small adipocyte factor 1,SMAF1),在牛上命名为ADIG(Adipogenin)。SMAF1基因仅在脂肪细胞中特异性表达,有研究表明,其在培养的大鼠和小鼠原代脂肪前体细胞中表达缺失,SMAF1基因表达和脂肪细胞基因表型呈现密切相关[2]。SMAF1基因在脂肪细胞中的mRNA水平和脂肪细胞成熟分化程度呈正相关,但目前对SMAF1基因在脂肪细胞分化过程中所起的作用尚不清楚,另外,SMAF1基因在牛上的研究报道甚少。腺病毒介导的目的基因超表达和RNA干扰技术是目前研究基因功能的重要方法,目前常用的腺病毒载体系统主要包括ViraPowerTMAdenoviral Expression System和AdEasyTMAdenoviral Vector System[3-4]。
本研究选择将牛脂肪细胞分化转录因子(ADIG)基因作为目标基因,采用ViraPowerTM腺病毒系统构建的重组腺病毒载体,探讨该基因在脂类代谢过程中的功能,为进一步研究牛脂类代谢的分子机制和深入进行肉质性状改良以及针对性地研究调控牛脂肪沉积,培育低体脂、高肌内脂肪的肉牛新品种奠定理论基础。
1材料与方法
1.1主要试剂
DMEM(Dulbecco’s Modified Eagle Medium)basic(1X)培养基和马血清(Horse serum,HS),标准胎牛血清(fetal bovine serum,FBS),PBS,E.Z.N.A.Total RNA提取试剂盒,PrimeScript RT Master Mix反转试剂盒,SYBR Premix Ex TaqⅡ试剂盒(其中包含SYBR Premix Ex TaqⅡ和ROX Reference Dye(50×))。
1.2牛成肌细胞的培养
本研究成肌细胞为本实验室冻存的第2代初生荷斯坦牛的背最长肌来源的成肌细胞,细胞解冻后用培养液(70%DMEM+20%FBS+10%HS)培养,每天进行1次换液,当细胞汇合度达到90%时,按照体积比为1∶3的比例进行传代。
1.3牛成肌细胞诱导转分化
本试验共设计3个处理组,试验周期为14 d,用六孔板培养。第1组为成肌细胞空白对照组(control);第2组为添加AD-NC重组腺病毒原液的成肌细胞,待成肌细胞汇合度达到90%时,添加腺病毒AD-NC重组腺病毒原液;第3组为添加AD-ADIG重组腺病毒原液的成肌细胞,待成肌细胞汇合度达到90%时,添加腺病毒AD-ADIG重组腺病毒原液。第2组添加1 mL AD-NC重组腺病毒原液,第3组添加1 mL AD-ADIG重组腺病毒原液。添加病毒12 h后半量换液,换成肌细胞培养液继续培养,之后每2 d完全换液1次。分别在培养的第2、4、6、8、10、12、14天时收集细胞,提取RNA并进行油红O染色。
1.4油红O染色
培养细胞弃去培养液经PBS洗3次后,4%多聚甲醛固定液固定30 min;PBS洗2次,加入适量油红O染液(0.5 g体积分数为0.5%的油红O染液,加入体积分数为98%的异丙醇100 mL,静置过夜,即为原液。使用时按双蒸水和原液体积比为2∶3的比例进行稀释过滤),染色20~30 min,PBS冲洗,显微镜下观察。
1.5提取细胞中的RNA并反转录成cDNA
使用Total RNA提取试剂盒提取细胞中的总RNA(按照说明书操作)。提取的总RNA用PrimeScript RT Master Mix反转试剂盒进行反转录,反转录得到的cDNA于-20 ℃中保存待用。
1.6实时荧光定量PCR检测成肌细胞向脂肪细胞转分化过程中相关基因表达情况
所用ADIG、PPARγ、C/EBPα、SREBP1、FABP4、MyoD、FAS以及GADPH基因的引物见表1。使用SYBR Premix Ex TaqⅡ试剂盒进行实时定量PCR,反应总体系为20 μL:SYBR Premix Ex TaqⅡ10 μL,上游引物0.8 μL,下游引物0.8 μL,ROX Reference Dye(50×) 0.4 μL,模板2 μL,水6 μL。在7500 Real Time PCR仪上进行反应。每个样3个重复,最后取其均值。PCR循环参数:95℃预变性30 s;95℃变性5 s,60℃退火34 s,循环40次。熔解曲线程序:95℃ 15 s;60℃ 1 min;95℃ 15 s。
表1PCR引物序列
Table 1Primers for PCR of genes
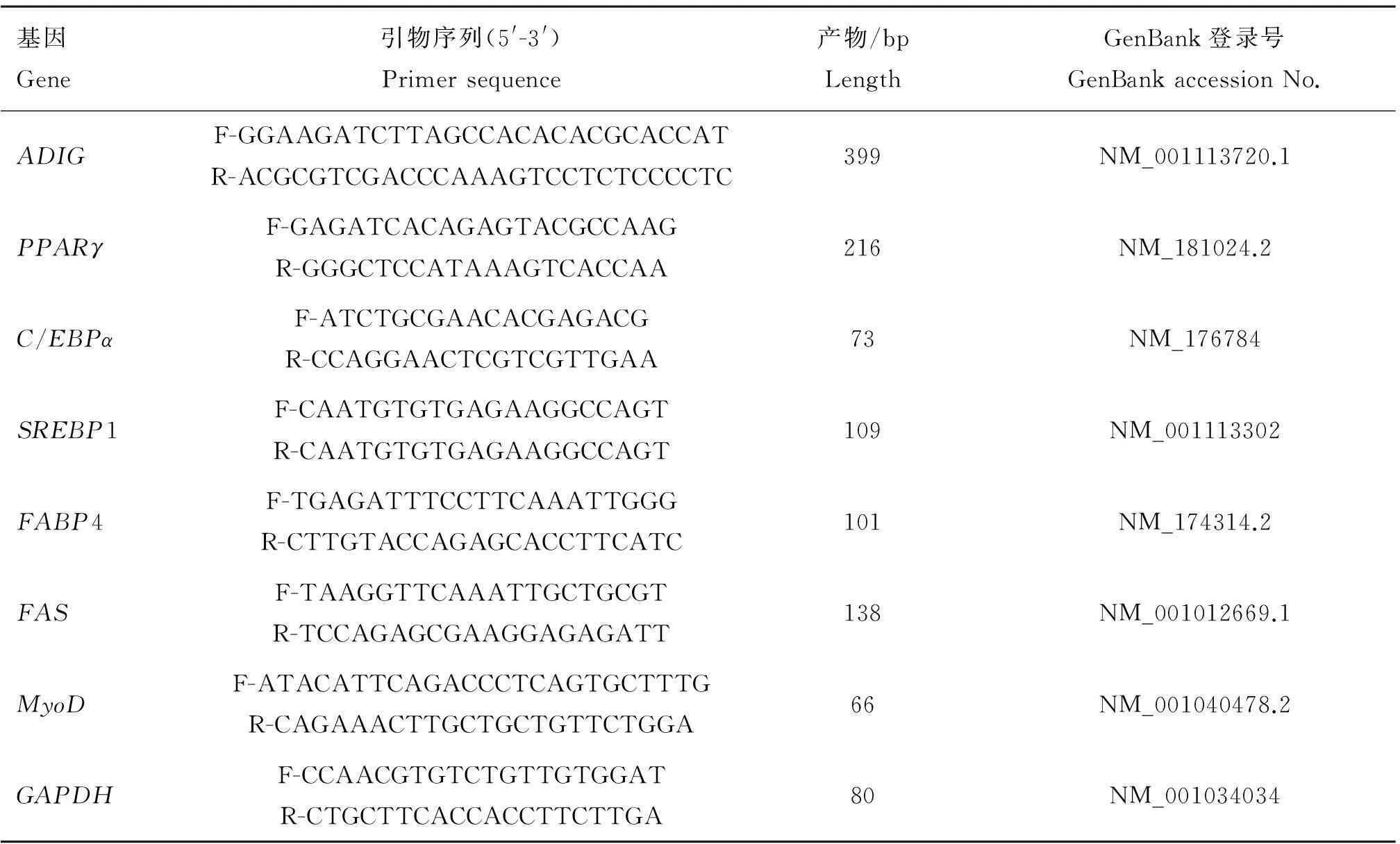
基因Gene引物序列(5'-3')Primersequence产物/bpLengthGenBank登录号GenBankaccessionNo.ADIGF-GGAAGATCTTAGCCACACACGCACCATR-ACGCGTCGACCCAAAGTCCTCTCCCCTC399NM_001113720.1PPARγF-GAGATCACAGAGTACGCCAAGR-GGGCTCCATAAAGTCACCAA216NM_181024.2C/EBPαF-ATCTGCGAACACGAGACGR-CCAGGAACTCGTCGTTGAA73NM_176784SREBP1F-CAATGTGTGAGAAGGCCAGTR-CAATGTGTGAGAAGGCCAGT109NM_001113302FABP4F-TGAGATTTCCTTCAAATTGGGR-CTTGTACCAGAGCACCTTCATC101NM_174314.2FASF-TAAGGTTCAAATTGCTGCGTR-TCCAGAGCGAAGGAGAGATT138NM_001012669.1MyoDF-ATACATTCAGACCCTCAGTGCTTTGR-CAGAAACTTGCTGCTGTTCTGGA66NM_001040478.2GAPDHF-CCAACGTGTCTGTTGTGGATR-CTGCTTCACCACCTTCTTGA80NM_001034034
ADIG基因扩增片段长度为399 bp,扩增效率良好Amplified fragment length ofADIGgene is 399 bp,and the amplification efficiency is fairly good
1.7统计分析
计算所得到的的基因相对表达量用SPSS16.0软件进行方差分析,P<0.05认为差异显著,P<0.01则认为差异极显著。
2结果
2.1牛成肌细胞的培养及诱导分化
解冻后培养的牛成肌细胞形态均一清楚,呈梭状,排列整齐。传代后可以直接用于成肌细胞的诱导转分化(图1)。
2.2AD-ADIG诱导牛成肌细胞转分化结果
分别在试验第2、4、6、8、10、12、14 天,对3个不同的处理组进行油红O染色,染色结果如图2所示。可以清楚观察到,在第2天时,AD-ADIG组的油红O染色量就已经比空白组和AD-NC组多一些。随着天数增加,各组的油红O染色量都在不断增多。空白组和AD-NC组的油红O染色量比较相近,而每天AD-ADIG组的油红O染色量都是最多的。在第12天时AD-ADIG组已经可以形成一个很大的脂滴(图3),在第14天时,脂滴聚集成大脂滴量明显增加(图3)。
2.3牛成肌细胞成脂转分化过程中相关基因表达量变化
2.3.1ADIG基因相对表达量对于ADIG基因,由于第3组是添加AD-ADIG重组腺病毒原液的成肌细胞的处理组,即是过表达ADIG基因的处理组,因此可以看到对于ADIG基因,在第2、4、6、8、10、12、14天,AD-ADIG组ADIG基因的表达量显著高于空白组和AD-NC组(P<0.05),空白组和AD-NC组间ADIG基因表达量差异不显著(P>0.05)(图4)。而且,由图4可以看出自诱导第6天开始,AD-ADIG组ADIG基因表达量一直较高,且在第4天达到最高表达量,之后虽然下降,但也维持着较高水平的表达量(图4)。
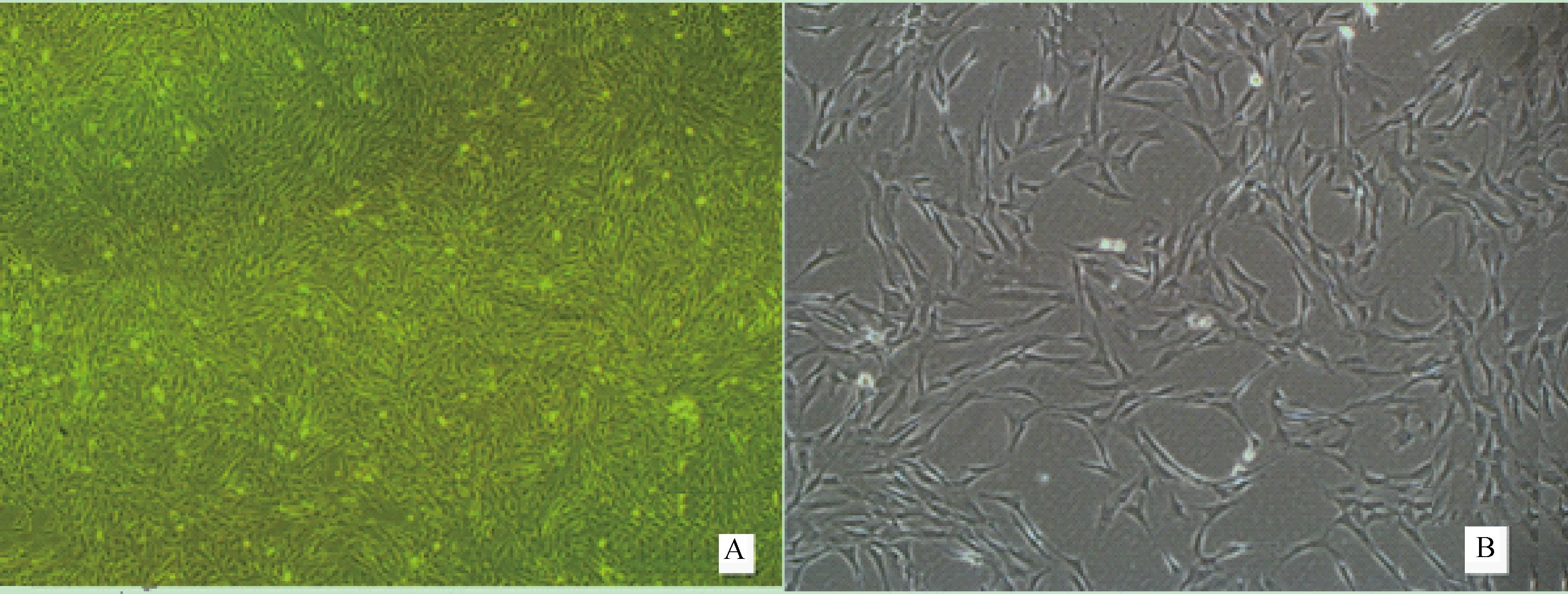
A.40×;B.100×图1 牛传代成肌细胞的显微观察Fig.1 Observation on the bovine sub-culture myoblast using microscope


不同字母表示差异显著(P<0.05)。下同The different letters show significant difference (P<0.05).The same as below图4 ADIG基因相对表达量Fig.4 ADIG gene relative expression
2.3.2PPARγ基因相对表达量对于PPARγ基因,从图5中我们可以看到,在诱导第2天,空白组和AD-NC组的PPARγ基因表达量较AD-ADIG组高,但自诱导第4天开始,第4、6、8、10、12、14天中,AD-ADIG组PPARγ基因的表达量都显著高于空白组和AD-NC组(P<0.05)。PPARγ基因在第10天时表达量最高,随后开始下降。
2.3.3C/EBPα基因相对表达量对于C/EBPα基因,在第2天试验3组的差异比较显著,第4、6、8、10、12天空白组和AD-NC组的相对表达量差异均不显著(P>0.05)。另外,AD-ADIG组的表达量在整个过程中均低于空白组和AD-NC组(第8天除外,图6)。
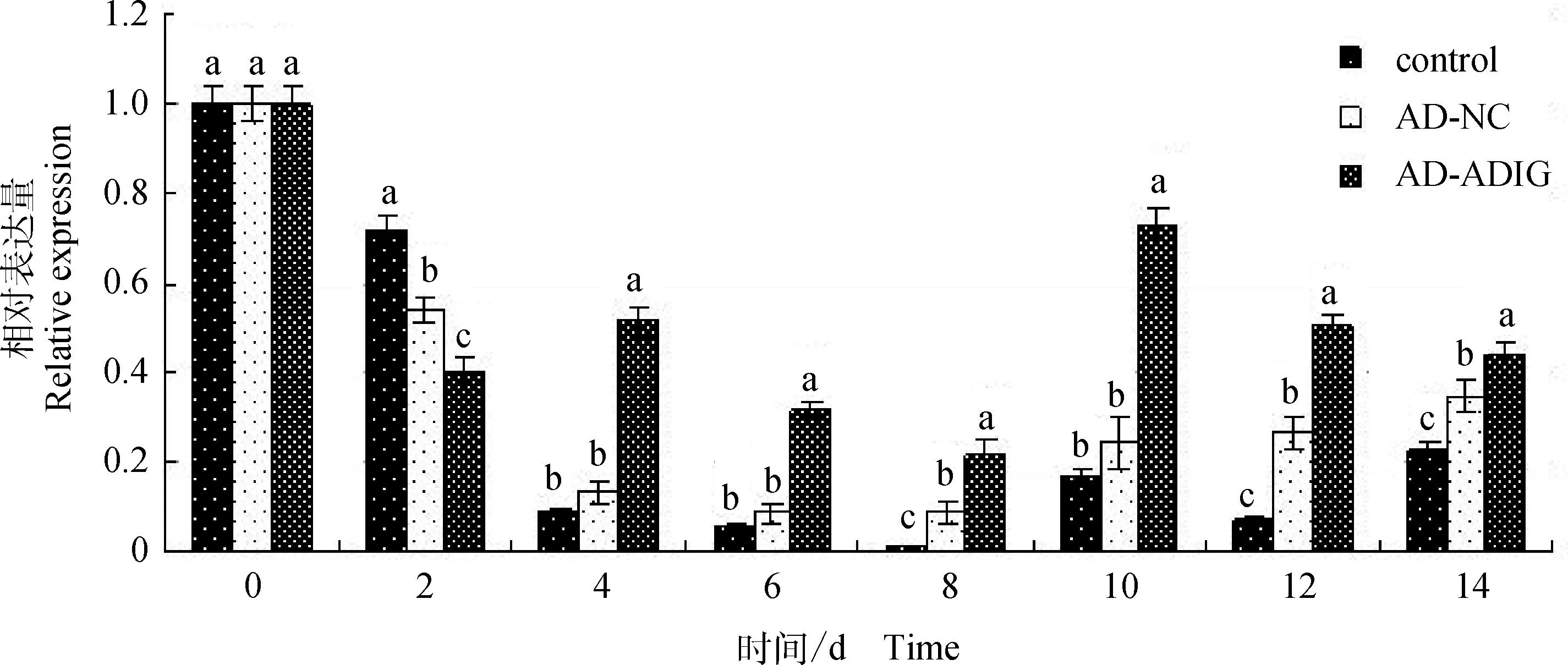
图5 PPARγ基因相对表达量Fig.5 PPARγ gene relative expression
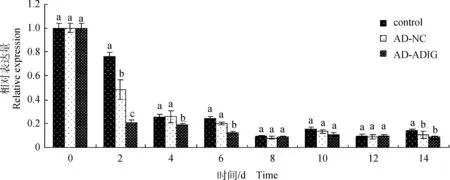
图6 C/EBPα基因相对表达量Fig.6 C/EBPα gene relative expression
2.3.4SREBP1基因相对表达量对于SREBP1基因,第4、6、8、10、12、14天空白组和AD-NC组的表达量差异不显著(P>0.05),在4、6、8、10、12天空白组显著低于AD-ADIG组(P<0.05)。AD-ADIG组的SREBP1基因表达量一直维持在相对较稳定的水平(图7)。
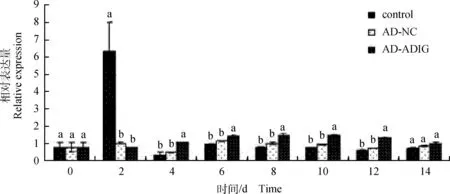
图7 SREBP1基因相对表达量Fig.7 SREBP1 gene relative expression
2.3.5FABP4基因相对表达量对于FABP4基因,3组的相对表达量总体来说表达量变化规律不明显(P>0.05)(图8)。
2.3.6FAS基因相对表达量对于FAS基因,在4、6、8、10、12天,AD-ADIG组的FAS基因相对表达量均要高于空白组和AD-NC组(P<0.05)。另外,第4、6、8、14天,空白组和AD-NC组的相对表达量差异均不显著(P>0.05)(图9)。
2.3.7MyoD基因相对表达量对于MyoD基因,AD-ADIG组自诱导第2天起几乎没有表达量。空白组和AD-NC组MyoD基因的相对表达量不断下降(图10)。
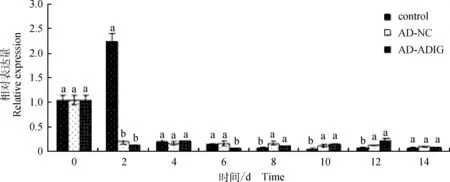
图8 FABP4基因相对表达量Fig.8 FABP4 gene relative expression
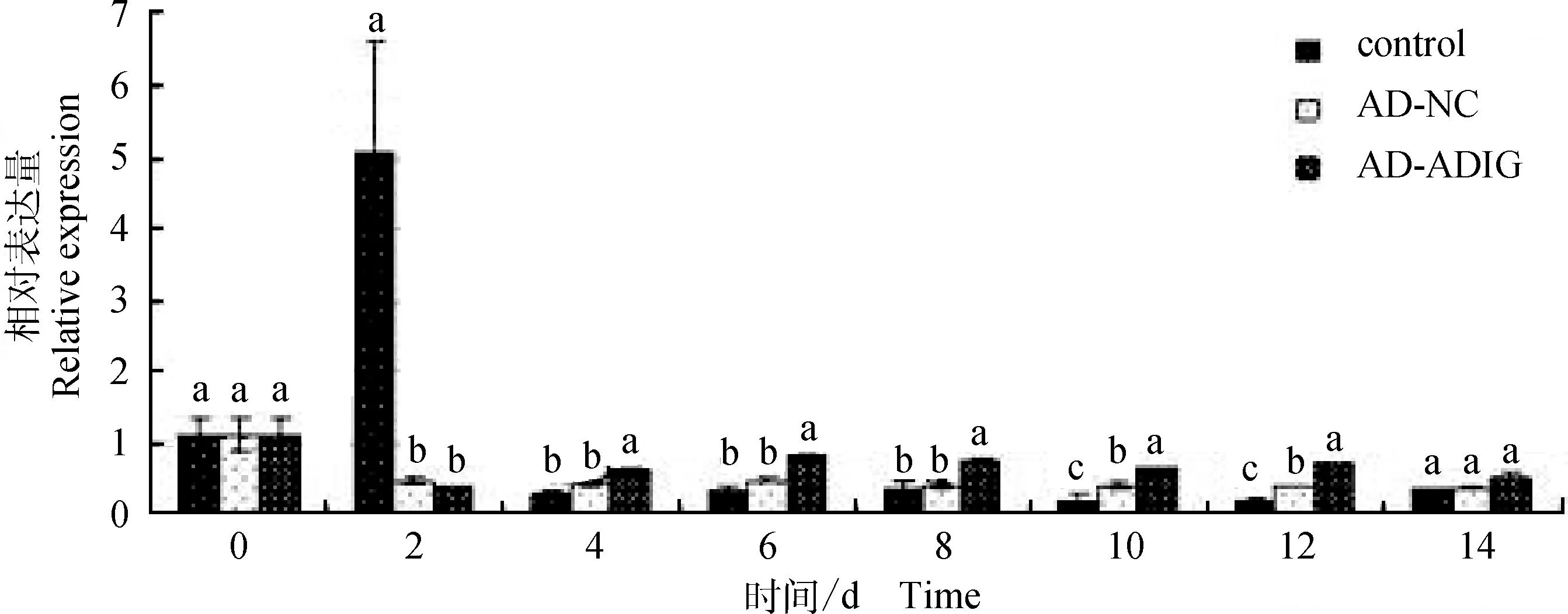
图9 FAS基因相对表达量Fig.9 FAS gene relative expression
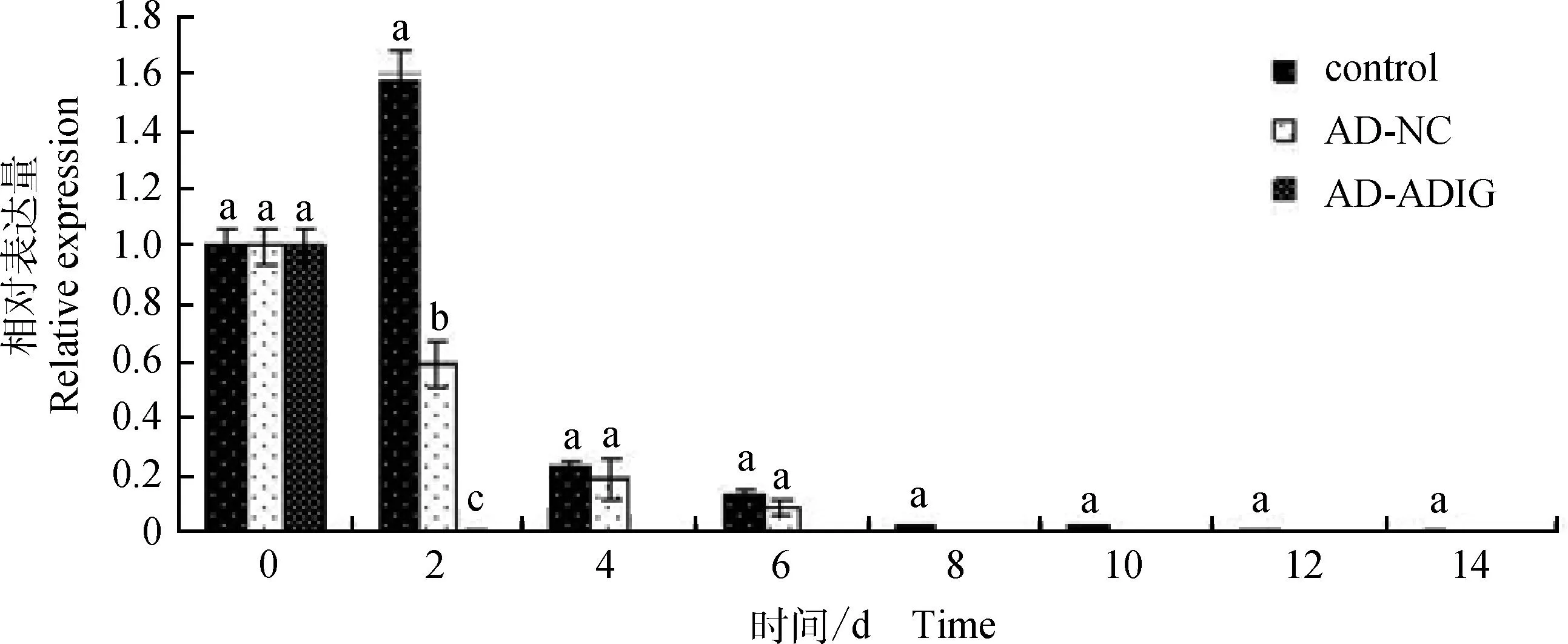
图10 MyoD基因相对表达量Fig.10 MyoD gene relative expression
3讨论
成肌细胞和脂肪细胞来源相同,都来自中胚层。在肌肉中,转录因子基本的螺旋-环-螺旋(bHLH)蛋白MyoD和MYF5发挥了重要作用,在决定分化方向中,MyoD是骨骼肌细胞分化的决定性基因,单一的MyoD即足以使肌干细胞分化为成肌细胞。在脂肪细胞中,细胞分化是被PPARγ和CEBPs两个主要因子或者说一组因子调控的。
研究发现,可以直接诱导成肌细胞向脂肪细胞转化[5]。日本有学者饲喂高脂肪日粮给小鼠,结果,SMAF1的mRNA水平明显提高[6],这与提高PPARγ的表达后取得的效果相同。这也是本试验通过在成肌细胞中过表达ADIG基因来探讨研究ADIG基因在成脂分化过程中调控作用的目的所在。
本研究检测了PPARγ、C/EBPα、SREBP1、FABP4、FAS及MyoD基因在ADIG过表达诱导牛成肌细胞转分化过程中的表达情况,PPARγ、SREBP1和FAS在诱导转分化开始后呈先升高再下降的趋势。结合相关基因的功能,PPARγ基因编码的蛋白是脂肪分化的调节器[7-10];C/EBPα是脂肪细胞分化的关键转录因子,维持脂肪细胞基因的表达并最终促使细胞分化[11-14];SREBP1由SREBPF1基因编码,在维持脂质代谢平衡中发挥着非常重要的作用[15-16];FAS主要作用是催化细胞内脂肪酸的从头合成,是胞内脂肪酸合成的关键酶[17-18]。说明在诱导成脂分化的不同阶段,ADIG基因可能先后激活PPARγ、SREBP1和FAS基因的表达,从而发挥不同的调控作用,证明了ADIG基因在诱导牛成肌细胞向成脂转分化过程中的重要作用。
同时,在本试验中,C/EBPα基因在诱导过程中的表达量呈现降低趋势,该现象与本实验室先前得出的C/EBPα基因在成脂分化方面功能的研究结果(在牛成肌细胞中过表达C/EBPα基因促进成脂的同时,PPARγ基因的表达量也升高)不一致,也与1997年C.S.Hwang等[14]研究的结果(C/EBPα可以促进PPARγ表达,一旦C/EBPα基因的转录被启动,C/EBPα则可通过自身的转录激活而继续高水平表达,从而维持脂肪细胞基因的表达并最终促使细胞分化)不一致。分析原因,有可能是因为ADIG基因的过表达抑制了C/EBPα基因的表达,但需要进一步深入研究。此外,FAS与SREBP1基因相对表达量相一致,再次验证了卓伟华等[16]的发现:SREBP1的表达水平与FAS活性有很强的相关。同时,由以上研究可以推测SREBP1基因可能与激活PPARγ基因的表达有关,这与M.Bionaz 等[19]2008年的研究结果相契合:SREBP1基因在乳脂合成中发挥中央调控的作用。
生肌决定因子(MyoD)基因家族也叫肌肉调节因子(MRFs)基因家族[20],是骨骼肌细胞分化的决定性基因。有研究证明,肌细胞分化和生长调控因子MyoD基因是继生长激素(GH)、胰岛素样生长因子(IGF)之后新发现的功能基因,了解它的功能、结构及遗传变异具有重要的意义[21]。因此,本研究选用MyoD基因作为分化的标记基因,用于标记牛成肌细胞向脂肪细胞分化的进程。结果表明,MyoD基因AD-ADIG组的表达量自第0天就受到抑制,结合观察细胞形态学变化,MyoD基因表达量的变化与细胞分化状态相一致,这充分说明了过表达ADIG基因对成肌细胞向肌细胞分化有明显的抑制作用,也证明了牛成肌细胞有向脂肪细胞分化的倾向。
参考文献(References):
[1]孔保华,陶菲,刁新平.中国肉牛产业的现状和发展趋势[J].肉类研究,2002(1):10-13,21.
KONG B H,TAO F,DIAO X P.Present status and trend of beef cattle breeding in China[J].MeatResearch,2002(1):10-13,21.(in Chinese)
[2]KIM J Y,TILLISON K,SMAS C M.Cloning,expression,and differentiation-dependent regulation of SMAF1 in adipogenesis[J].BiochemBiophysResCommun,2005,326(1):36-44.
[3]HE T C,ZHOU S,DA COSTA L T,et al.A simplified system for generating recombinant adenoviruses[J].ProcNatlAcadSciUSA,1998,95(5):2509-2514.
[4]LODDE B M,DELPORTE C,GOLDSMITH C M,et al.A recombinant adenoviral vector encoding functional vasoactive intestinal peptide[J].BiochemBiophysResCommun,2004,319(1):189-192.
[5]WU Z,XIE Y,BUCHER N L,et al.Conditional ectopic expression of C/EBPβ in NIH-3T3 cells induces PPARγ and stimulates adipogenesis[J].GenesDev,1995,9(19):2350-2363.
[6]HONG Y H,OGIHARA Y,HISHIKAWA D,et al.Molecular cloning and expression analysis of cDNA encoding bovine adipogenin[J].AnimSciJ,2006,77:613-619.
[7]BELFIORE A,GENUA M,MALAGUARNERA R.PPAR-gamma agonists and their effects on IGF-I receptor signaling:implications for cancer[J].PPARRes,2009,2009:830501.
[8]BERGER J,MOLLER D E.The mechanisms of action of PPARs[J].AnnuRevMed,2002,53:409-435.
[9]FEIGE J N,GELMAN L,MICHALIK L,et al.From molecular action to physiological outputs:peroxisome proliferator-activated receptors are nuclear receptors at the crossroads of key cellular functions[J].ProgLipidRes, 2006,45(2):120-159.
[10]LI Y,QI Y,HUANG T H,et al.Pomegranate flower:a unique traditional antidiabetic medicine with dual PPAR-alpha/-gamma activator properties[J].DiabetesObesMetab,2008,10(1):10-17.
[11]LIN F T,LANE M D.CCAAT/enhancer binding protein alpha is sufficient to initiate the 3T3-L1 adipocyte differentiation program[J].ProcNatlAcadSciUSA,1994,91(19):8757-8761.
[12]LINHART H G,ISHIMURA-OKA K,DEMAYO F,et al.C/EBPalpha is required for differentiation of white,but not brown,adipose tissue[J].ProcNatlAcadSciUSA,2001,98(22):12532-12537.
[13]DARLINGTON G J,ROSS S E,MACDOUGALD O A.The role of C/EBP genes in adipocyte differentiation[J].JBiolChem,1998,273(46):30057-30060.
[14]HWANG C S,LOFTUS T M,MANDRUP S,et al.Adipocyte differentiation and leptin expression[J].AnnuRevCellDevBiol,1997,13:231-259.
[15]ASSAF S,HAZARD D,PITEL F,et al.Cloning of cDNA encoding the nuclear form of chicken sterol response element binding protein-2(SREBP-2),chromosomal localization,and tissue expression of chicken SREBP-1 and-2 genes[J].PoultSci,2003,82(1):54-61.
[16]卓伟华,王继文,蒋立.固醇调节元件结合蛋白在动物脂肪代谢中的研究进展[J].中国畜牧杂志,2005,41(2):39-41.
ZHUO W H,WANG J W,JIANG L.Advance in SREBPs in animal lipid metabolism[J].ChineseJournalofAnimalScience,2005,41(2):39-41.(in Chinese)
[17]JENSEN-URSTAD A P,SEMENKOVICH C F.Fatty acid synthase and liver triglyceride metabolism:housekeeper or messenger?[J].BiochimBiophysActa,2012,1821 (5):747-753.
[19]BIONAZ M,LOOR J J.Gene networks driving bovine milk fat synthesis during the lactation cycle[J].BMCGenomics,2008,9:366.
[20]SABOURIN L A,RUDNICKI M A.The molecular regulation of myogenesis[J].ClinGenet,2000,57(1):16-25.
[21]岑石强,杨志明.成肌细胞在基因治疗和组织工程中的应用综述[J].中国修复重建外科杂志,1999,13(3):173-177.
CEN S Q,YANG Z M.A reciew on the application of myoblast on gene therapy and tissue engineering[J].ChineseJournalofReparativeandReconstructiveSurgery,1999,13(3):173-177.(in Chinese)
(编辑郭云雁)
ADIG Inducing the Trans-differentiation of Bovine Myoblasts and Its Related Gene Expression
MEI Chu-gang1,ZHANG Qiong1,FU Chang-zhen1,LIU Yang1,JIANG Bi-jie1,CHENG Gong1,2,ZAN Lin-sen1,2*
(1.CollegeofAnimalScienceandTechnology,NorthwestA&FUniversity,Yangling712100,China;2.NationalBeefCattleImprovementCenterinChina,Yangling712100,China)
Abstract:The aim of this study was to provide evidence about the role ofADIGgene in bovine adipose tissue during growth and development,and to lay a theoretical basis for further study of the molecular mechanisms of bovine fat metabolism and meat quality improvement through inducing bovine myoblasts trans-differentiating into fat with overexpressingADIGgene in bovine myoblasts.We induced bovine myoblasts trans-differentiating with AD-ADIG recombinant adenovirus,observed the lipid droplets after Oil Red O staining,collected cells to extract RNA at the 0th,2nd,4th,6th,8th,10th,12th,14thday,respectively,and detected relative expressions of fat-related genesADIG,PPARγ,C/EBPα,SREBPF1,FABP4,FASas well as the muscle-related geneMyoDby real-time quantitative PCR.The real-time quantitative PCR results showed that during the induced trans-differentiation process,ADIGgene was expressed at high levels at the 2nd,4th,6th,8th,10th,12th,14thday,and lipid droplets increased significantly.The relative expression of the fat-related genesPPARγ,SREBPF1 andFASat late stages were obviously higher in AD-ADIG group than that in other groups,and the relative expression of muscle-related geneMyoDdecreased at early stages,and was obviously lower in AD-ADIG group than that in other groups.The result indicate thatADIGgene play important roles in bovine myoblasts induced into fat and bovine myoblast has the potential of differentiating to adipocyte according to the results of Oil Red O staining and related gene relative expression.
Key words:bovine myoblasts;induced trans-differentiation;AD-ADIG
doi:10.11843/j.issn.0366-6964.2016.04.004
收稿日期:2014-04-15
基金项目:国家863计划(2013AA102505);国家科技支撑计划(2012BAD12B07);国家转基因重大专项(2014ZX08007-002);国家肉牛牦牛产业技术体系(CARS-38)
作者简介:梅楚刚(1986-),男,河南信阳人,博士生,主要从事动物生物技术方面的研究,E-mail: meichugang@163.com *通信作者:昝林森,教授,博士生导师,主要从事肉牛、奶牛遗传改良与健康养殖方面的教学、科研及技术推广工作,E-mail: zanlinsen@163.com
中图分类号:S823;S813.3
文献标志码:A
文章编号:0366-6964(2016)04-0661-10
