高效氯氟氰菊酯和阿维菌素对中华蜜蜂CarE和GSTs的影响
2016-07-09韩文素何杏高景林刘俊峰赵冬香
韩文素 何杏 高景林 刘俊峰 赵冬香
摘 要 羧酸酯酶(Carboxylesterase, CarE)和谷胱甘肽S-转移酶(glutathione S-transferase,GSTs)是蜜蜂体内重要的生化标记酶。本研究探讨了高效氯氟氰菊酯lambda-cyhalothrin和阿维菌素abamectin亚致死剂量对中华蜜蜂Apis cerana cerana中肠CarE和谷GSTs活性的影响。结果表明,用阿维菌素和高效氯氟氰菊酯亚致死浓度LC5饲喂中华蜜蜂,明显诱导CarE活性增强;LC5浓度的阿维菌素诱导GSTs活性增强,而LC10~LC40的浓度抑制GSTs活性;高效氯氟氰菊酯LC5~LC40浓度对GSTs作用不明显;用LC10浓度的阿维菌素和高效氯氟氰菊酯处理中华蜜蜂72 h,CarE活性呈现先提高后降低的趋势,而对GSTs作用不明显。
关键词 羧酸酯酶;谷胱甘肽S-转移酶;中华蜜蜂;高效氯氟氰菊酯;阿维菌素
中图分类号 S482.3 文献标识码 A
近年来,全球蜜蜂数量骤减引起了社会各界的极大关注[1],研究证实,杀虫剂的广泛施用是造成此现象的主要原因之一[2]。蜜蜂具备独特的生物学特性,对杀虫剂非常敏感,常被不同地理区域用作监测杀虫剂污染的生物指示器[3]。中华蜜蜂Apis cerana cerana,是中国特有的蜂种资源,具有嗅觉敏锐、抗寒耐热、抗螨及采集能力强等特点[4]。据报道,中华蜜蜂对药剂更加敏感,一些对意大利蜜蜂低毒的药剂,可能会造成中华蜜蜂的大量中毒死亡[5],因此有必要以中华蜜蜂为生物指示器,监测环境中杀虫剂的污染情况以及杀虫剂对蜂群健康的影响。
生化酶是生物体内最灵敏的生物检测剂,监测其活性变化可知生物体内最早的污染物诱导反应情况[6]。可用作生化标记物的酶有乙酰胆碱酯酶(AchE)、羧酸酯酶(CarE)、过氧化氢酶(CAT)和谷胱甘肽S-转移酶(GSTs)[7]。CarE是昆虫体内重要的解毒酶,参与杀虫剂的Ⅰ项解毒代谢[8],CarE能以水解蛋白和结合蛋白2种物质对杀虫剂进行解毒,其活性与昆虫解毒能力密切相关[9]。GSTs能够催化还原型谷胱甘肽GSH对底物进行亲核共轭代谢,在抗毒机制的第Ⅱ阶段起作用,被称为Ⅱ项代谢酶[4,10],在昆虫体内降解许多外来化合物的过程中发挥解毒和抗氧化的作用[11]。因此,可通过测定CarE和GSTs活性变化,评估环境中杀虫剂的污染状况以及杀虫剂对蜜蜂种群的影响。
高效氯氟氰菊酯和阿维菌素是防治害虫的常用药剂。高效氯氟氰菊酯属于拟除虫菊酯类杀虫剂,杀虫谱广、高效、速效,对中华蜜蜂摄入和触杀毒性均为高毒[12]。阿维菌素杀虫活性强且杀虫谱广,无论单剂还是混配剂对蜜蜂摄入或触杀的急性毒性均为高毒,甚至剧毒[13-16]。施用于田间的杀虫剂随着时间的推移,会逐渐降解为亚致死剂量,亚致死剂量对蜜蜂的学习、行为和生理会产生明显的亚致死效應[17]。迄今为止,亚致死剂量的高效氯氟氰菊酯和阿维菌素对中华蜜蜂解毒酶的影响尚未见报道,因此本研究在实验室条件下测定高效氯氟氰菊酯和阿维菌素对CarE和GSTs的剂量效应和时间效应,以期为诊断杀虫剂对蜂群健康的影响及更好地保护中华蜜蜂提供理论基础。
1 材料与方法
1.1 材料
1.1.1 供试虫源 中华蜜蜂采集蜂,由中国热带农业科学院环境与植物保护研究所试验蜂场提供(N19°32′,E109°32′)。供试蜜蜂要求同一种群、龄期相同、健康状况良好。
1.1.2 仪器与试剂 试验仪器:紫外可见分光光度计(SHIMADZU CORPORATION,UV-2600),数显三用恒温水箱(金坛市金南仪器厂,XMTD-204),漩涡混合器(Labnet,VX100),小型台式冷冻型离心机(Eppendorf,5417R),电子天平(梅特勒-托利多仪器有限公司,TLE204E/02),微量移液枪(SWISS,SOCOREX)及配套吸头,温湿度记录仪(浙江托普仪器有限公司,TPJ-20),超纯水系统(Cascada LS,PAL-CAXXXLSM2)。
供试药剂及试剂:93.5%阿维菌素原药(山东志诚化工有限公司)、97%高效氯氟氰菊酯原药(农业部农药检定所)、考马斯亮蓝G-250(Solarbio公司)、牛血清白蛋白(BSA,Solarbio公司)、十二烷基硫酸钠(SDS,Sigma公司)、α-乙酸萘酯(α-NA,Solarbio公司)、β-乙酸萘酯(β-NA,Solarbio公司)、毒扁豆碱(上海源叶生物科技有限公司)、固蓝B盐(Solarbio公司)、α-萘酚(Macklin 公司)、β-萘酚(Macklin 公司)、谷胱甘肽(GSH,Solarbio公司)、乙二胺四乙酸(EDTA,Biotopped公司)、1,1-二氯-2,4-二硝基苯(CDNB,Sigma公司),95%乙醇(分析纯,西陇化工股份有限公司)、磷酸(分析纯,西陇化工股份有限公司)、磷酸氢二钠(分析纯,广州化学试剂厂)、磷酸二氢钾(分析纯,西陇化工股份有限公司)。
1.2 方法
1.2.1 生物处理 毒力测定:参照国家环境保护部颁布的《化学农药环境安全评价试验准则》,稍加改进。采用摄入法测定经口毒性。用50%蔗糖水将药剂稀释成系列试验浓度,装入15 mL直口离心管中,直至将离心管中事先放入的0.2~0.25 g脱脂棉润湿即可;通过饲喂孔放入贮蜂笼内,让饥饿2 h的中华蜜蜂通过孔眼取食,并且在试验期间保持脱脂棉湿润,用50%蔗糖溶液作为对照组。试验共设6个处理,每处理3次重复,每重复10只蜜蜂,48 h后检查死亡虫数。
剂量效应:根据毒力测定结果,分别选取高效氯氟氰菊酯和阿维菌素对蜜蜂的亚致死浓度LC5、LC10、LC20、LC30、LC40,用摄入法处理中华蜜蜂,同时以无药剂的50%蔗糖溶液作为对照组。试验每药剂共设6个处理,每处理3次重复,每重复10只蜜蜂。取食24 h后将存活蜜蜂放入-20 ℃冰箱使其麻痹,然后取出中肠用于CarE和GSTs的活性测定。
时间效应:根据毒力测定结果,选取亚致死浓度LC10的高效氯氟氰菊酯和阿维菌素,用摄入法处理中华蜜蜂,同时以无药剂的50%蔗糖溶液作为对照组。处理4、8、24、48、72 h后,取存活的蜜蜂立即放入-20 ℃冰箱使其麻痹,然后取出中肠用于CarE和GSTs的活性测定。每处理3次重复,每重复10只蜜蜂,每药剂共用300只蜜蜂。
1.2.2 酶液制备 参照Badiou-Bénéteau等[7]的方法改进。取同一处理的中华蜜蜂5头,用镊子夹住尾端蛰针拽出中肠,放入冰浴的玻璃匀浆器中匀浆,离心后取上清液作为测定CarE和GSTs时的酶源。每处理3次重复,每重复5只蜜蜂。[测定CarE时,加入预冷的pH7.0的0.04 mol/L磷酸缓冲液冰浴并匀浆,然后在4 ℃、10 800 r/min条件下离心15 min;测定GSTs时,加入预冷的pH6.5的0.1 mol/L磷酸缓冲液(含1.0 mmol/L EDTA)冰浴并匀浆,然后在4 ℃、10 000 r/min条件下离心30 min]。
1.2.3 CarE活性测定 参照Van Aspern[18]的方法,并加以改进。以α-乙酸萘酯(α-NA)为底物,测定时在每个试管中依次加入0.45 mL磷酸缓冲液(0.04 mol/L,pH7.0)、1.8 mL 3×10-4 mol/L的α-NA(含3×10-4 mol/L毒扁豆碱)、0.05 mL酶液;于30 ℃反应15 min后,加入0.9 mL显色剂(1%固蓝B盐溶液 ∶ 5% SDS溶液=2 ∶ 5,现配现用)终止反应并显色;静置5~10 min后在600 nm下测定吸光值。对照管中不加酶液,于加入显色剂之后补加0.05 mL酶液。每个处理重复3次,每个重复3次测定。以β-NA为底物的方法同上,在555 nm下测定吸光值。用α-萘酚或β-萘酚标准曲线和酶液蛋白质含量计算出CarE比活力,单位为nmol/(mg·min)。
1.2.4 GSTs活性測定 参照Habig等[19]的方法。反应体系总体积为900 μL,往比色皿中依次加入30 mmol/L GSH 30 μL、0.1 mol/L pH6.5磷酸缓冲液800 μL、40 μL粗酶液、30 mmol/L CDNB 30 μL,迅速混匀后,于340 nm波长下记录2 min内的吸光值变化。各处理设3次重复,每次重复平行测定3次。记录反应速度(OD340 nm/min),以每分钟催化生成1 nmol产物为一个酶活单位。按照下述公式计算比活力:GSTs活力单位nmol/(mg·min)=(△OD340·υ)/X·L·t(min)/a·V。式中,△OD340为每分钟光吸收的变化值(△OD340·/min),υ为酶促反应体积(900 μL),X为产物的消光系数[0.009 6 L/(μmol·cm)],L为比色杯的光程(1 cm),t为反应时间(min),a为酶液蛋白含量(单位:),V为酶液体积(mL)。
1.2.5 蛋白质含量的测定 参照Bradford[20]考马斯亮蓝G-250法。
1.3 数据分析
所有数据均采用SPSS17.0软件进行分析。毒力测定包括计算LC50、回归方程、95%的置信限及高效氯氟氰菊酯和阿维菌素的试验浓度值;时间效应中,各试验组比活力数值均进行独立样本T检验;剂量效应中,各试验组比活力数值均进行单因素方差分析(多重比较用Duncan法)。
2 结果与分析
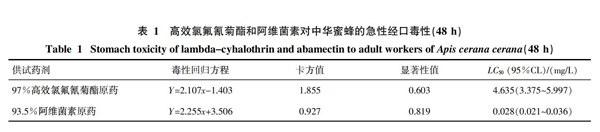
2.1 高效氯氟氰菊酯和阿维菌素对中华蜜蜂的急性经口毒性
由表1结果可知,摄入法测定97%高效氯氰菊酯原药和93.5%阿维菌素原药对中华蜜蜂的LC50值分别为4.635和0.028 mg/L(48 h)。按照农药对蜜蜂急性经口毒性标准,高效氯氟氰菊酯对中华蜜蜂的摄入毒性为高毒,阿维菌素对中华蜜蜂的摄入毒性为剧毒。
根据毒力曲线计算出高效氯氟氰菊酯对中华蜜蜂的亚致死浓度为LC5(0.768 mg/L)、LC10(1.142 mg/L)、LC20(1.847 mg/L)、LC30(2.613 mg/L)、LC40(3.514 mg/L),阿维菌素对中华蜜蜂的亚致死浓度LC5(0.005 mg/L)、LC10(0.008 mg/L)、LC20(0.012 mg/L)、LC30(0.016 mg/L)、LC40(0.022 mg/L),并分别用上述剂量处理后续试验中的中华蜜蜂采集蜂。
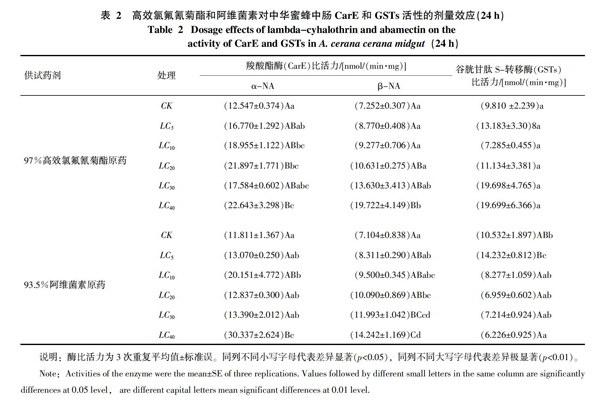
2.2 高效氯氟氰菊酯和阿维菌素对中华蜜蜂CarE、GSTs的剂量效应
如表2所示,用高效氯氟氰菊酯亚致死浓度处理中华蜜蜂后,CarE的活性变化较大且始终处于激活水平。以α-NA为底物时,CarE活性在LC5和LC30的剂量下与对照组差异不显著;在LC10的剂量时,CarE活性显著提高,是对照组的1.511倍;在LC20和LC40的剂量时,CarE活性与对照相比达到极显著性差异,分别是对照组的1.745和1.805倍。以β-NA为底物时,CarE活性随着浓度增加而增加,但当剂量为LC5~LC30时,CarE活性与对照组差异不显著,只有当为剂量LC40时,CarE活性极显著提高,是对照组的2.720倍。蜜蜂取食不同浓度的高效氯氟氰菊酯蔗糖溶液24 h后,LC10处理组中华蜜蜂体内GSTs比活力低于对照组,LC5、LC20、LC30、LC40处理组GSTs比活力分别是对照组的1.344、1.135、2.007、2.008倍。
用阿维菌素LC5~LC40蔗糖溶液饲喂中华蜜蜂24 h后,阿维菌素明显诱导CarE活性增强(表2)。以α-NA为底物时,LC10和LC40处理组CarE比活力与对照组之间差异极显著(p<0.01),分别为对照的1.706和2.569倍。以β-NA为底物时,CarE比活力随着处理浓度增加而增强,其中LC20处理组CarE比活力显著高于对照,为对照的1.420倍;LC30和LC40处理组CarE比活力与对照组之间差异极显著(p<0.01),分别为对照的1.688和2.005倍。用LC5浓度的阿维菌素饲喂蜜蜂24 h时,GSTs活性显著提高,其酶活性为对照的1.351倍;GSTs活性在LC5以后处于受抑制状态,酶活性为对照的0.786~0.591倍;在LC40的剂量下受到的抑制作用达到最大,其酶活性仅为对照的0.591倍。
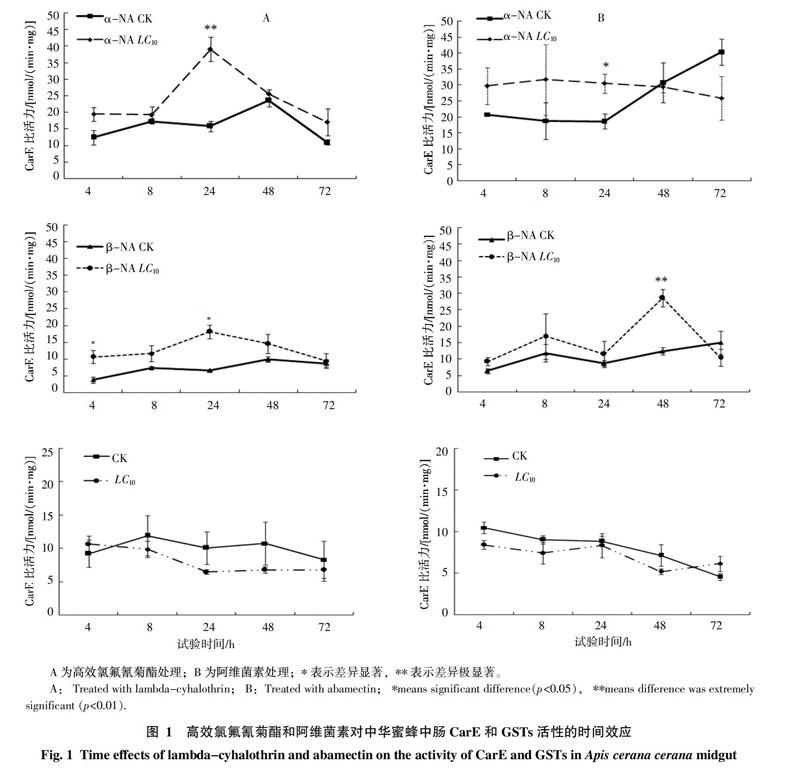
2.3 高效氯氟氰菊酯和阿维菌素对中华蜜蜂CarE、GSTs的时间效应
如图1-A所示,采用LC10浓度的高效氯氟氰菊酯饲喂中华蜜蜂72 h,其体内CarE随时间的延长而呈现升高-降低的变化趋势。以α-NA为底物时,中肠CarE活性被诱导,8 h后逐渐提高,24 h后增加至对照的2.462倍,随后酶活性逐渐降低,72 h时为对照的1.546倍,与对照无显著性差异。以β-NA为底物时,CarE的活性在72 h内都处于激活状态,在4、24 h酶活性分别增加至对照的2.828和2.736倍。GSTs活性变化情况与CarE刚好相反,4 h时处于激活状态,为对照的1.154倍,随后活性迅速降低,一直到72 h处于受抑制状态。
阿维菌素亚致死浓度LC10对中华蜜蜂CarE和GSTs的时间效应如图1-B所示。以α-NA为底物时,CarE的活性呈现先升高后下降的趋势。饲喂24 h后,CarE活性显著高于对照组,为对照的1.637倍;饲喂48 h后,CarE活性逐漸被抑制;达到72 h时,CarE活性仅为对照的0.639倍。以β-NA为底物时,4~48 h CarE活性被诱导,48 h时其活性增至对照的2.297倍,极显著高于对照组;随后活性逐渐下降,72 h时仅为对照的0.690倍。GSTs活性的变化趋势和对照基本一致,4~48 h酶活性低于对照,均处于受抑制状态,72 h时其酶活性高于对照,为对照的1.349倍,但各时间点酶活性与对照均无显著性差异。
3 讨论与结论
高效氯氟氰菊酯和阿维菌素是当前杀虫剂市场上的主导产品。本研究表明,高效氯氟氰菊酯对中华蜜蜂的经口毒性为4.635 mg/L(48 h),为高毒;阿维菌素对中华蜜蜂的经口毒性为0.028 mg/L(48 h),为剧毒,此结果与文献报道相一致[12-16]。因此,为避免蜜蜂在采集花蜜和花粉时急性中毒死亡,施用时应避开蜜源植物花期。
化学农药对蜜蜂及其它非靶标生物的安全性已成为全球普遍关注的环境污染与生物安全问题。由于蜜蜂在蜂巢周围1.5~3 km的范围内密集的采集活动,能接触到大量的污染物,常被作为可靠的环境污染生物指示器[21-22]。近年来,世界各地的蜜蜂出现了严重的种群衰退现象,致使各国采取积极措施监测和诊断蜂群健康[23]。研究证实,采集蜂体内的生化酶可作为监测环境污染最有效的工具[7,22]。
CarE是蜜蜂重要的解毒酶,存在于头部和中肠内,共有八个亚家族,其中保幼激素酯酶、α和β酯酶是CarE的主要催化酶,其主要作用就是催化水解进入体内的外源性物质[24-25]。据Badiou-Bénéteau等[7]报道,接触亚致死剂量的杀虫剂后,CarE活性改变,其每种亚型都可作为重要的生化指示物。以CarE作为生化指示物在蜜蜂对马拉硫磷、甲基对硫磷、噻虫嗪、氟虫腈、溴氰菊酯、多杀菌素等的监测中均有研究报道[7,26-27]。本研究结果表明,高效氯氟氰菊酯和阿维菌素亚致死剂量明显诱导中华蜜蜂中肠内CarE活性的提高。用LC10剂量阿维菌素和高效氯氟氰菊酯处理中华蜜蜂,72 h内CarE的活性整体呈现先增强后降低的变化趋势,存在一定的时间效应。
GSTs在对内源性和外源性毒物(药物、杀虫剂等)的解毒中发挥着重要作用[28]。蜜蜂的GSTs主要存在于脂肪体、中肠、马氏管等组织中,主要通过催化亲电基团与GSH结合,产生水溶性强、无毒的代谢产物而排出体外[29]。除解毒作用,GSTs还具有保护细胞防御氧化损伤的作用[9]。本研究中GSTs的活性在阿维菌素LC10~LC40的剂量下处于受抑制状态,而在高效氯氟氰菊酯LC5~LC40的剂量处于激活状态。分别用LC10浓度阿维菌素和高效氯氟氰菊酯处理中华蜜蜂,72 h内其GSTs的活性均处于受抑制状态,究其原因,可能与杀虫剂的靶标部位以及杀虫剂的毒性相关[30],如啶虫脒、吡蚜酮、啶虫丙醚、噻虫嗪、乐果、毒死蜱、多杀菌素提高采集蜂GSTs活性[7,11,27,31],而呋虫胺、氟氯苯菊酯、吡虫啉则抑制采集蜂GSTs活性[26,32-33]。
蜜蜂接触到亚致死剂量的杀虫剂后,会调控体内不同的酶,以此来对生理及行为发生改变的生理过程做出反应,因此评估杀虫剂对蜜蜂种群和环境健康的影响时,选择生化指示酶是关键的一步。本研究表明,应用CarE和GSTs作为生化指示酶评估高效氯氟氰菊酯和阿维菌素亚致死剂量对中华蜜蜂种群健康的影响是合理的。关于高效氯氟氰菊酯和阿维菌素诱导中华蜜蜂CarE和GSTs活性改变的分子机理有待于进一步研究。
参考文献
[1] VanEngelsdorp D, Meixner M D. A historical review of managed honey bee populations in Europe and the United States and the factors that may affect them[J]. Journal of Invertebrate Pathology, 2010, 103: S80-S95.
[2] Brittain C A, Vighi M, Bommarco R, et al. Impacts of a pesticide on pollinator species richness at different spatial scales[J]. Basic and Applied Ecology, 2010, 11(2): 106-115.
[3] Porrini C, Sabatini A G, Girotti S, et al. Honey bees and bee products as monitors of the environmental contamination[J]. Apiacta, 2003, 28: 63-70.
[4] 孟 飞, 胥保华, 郭兴启. 中华蜜蜂重要生物学特性相关功能基因研究进展[J]. 应用昆虫学报, 2012, 49(5): 1 338-1 344.
[5] 王瀛寰, 张艳峰, 张 旭, 等. 五种农药对中华蜜蜂和意大利蜜蜂工蜂的经口毒性比较[J]. 农药学学报, 2012, 14(4): 453-456.
[6] 刁青云, 章力建, 蔡典雄, 等. 蜜蜂生化标记物技术在农业立体污染防治中的应用[J]. 中国蜂业, 2006, 57(4): 6-8.
[7] Badiou-Bénéteau A, Carvalho S M, Brunet J L, et al. Development of biomarkers of exposure to xenobiotics in the honey bee Apis mellifera: Application to the systemic insecticide thiamethoxam[J]. Ecotoxicology and Environmental Safety, 2012, 82: 22-31.
[8] Stone D, Jepson P, Laskowski R. Trends in detoxification enzymes and heavy metal accumulation in ground beetles (Coleoptera: Carabidae)inhabiting a gradient of pollution[J]. Comparative Biochemistry and Physiology Part C: Toxicology & Pharmacology, 2002, 132: 105-112.
[9] 刘小民, 李 杰, 郭 巍, 等. 棉铃虫羧酸酯酶基因cDNA的克隆、 表達及活性分析[J]. 中国农业科学, 2011, 44(4): 730-737.
[10] Zhang Y, Yan H, Lu W, Li Y, et al. A novel Omega-class glutathione S-transferase gene in Apis cerana cerana: molecular characterisation of GSTO2 and its protective effects in oxidative stress[J]. Cell Stress and Chaperones, 2013, 18(4): 503-516.
[11] Carvalho S M, Belzunces L P, Carvalho G A, et al. Enzymatic biomarkers as tools to assess environmental quality: A case study of exposure of the honeybee Apis mellifera to insecticides[J]. Environmental Toxicology and Chemistry, 2013, 32(9): 2 117-2 124.
[12] 赵怡楠, 高景林, 王玉洁, 等. 6种农药对海南中蜂的急性毒性测定[J]. 热带作物学报, 2014, 35(2): 339-343.
[13] 王成菊, 邱立红, 郑明奇, 等. 阿维菌素及其混配制剂对蜜蜂的安全性评价[J]. 农业环境科学学报, 2006, 25(1): 229-231.
[14] 何伟志, 蒋红云, 张燕宁, 等. 甲基阿维菌素苯甲酸盐及混配制剂对意大利蜜蜂的安全性评价[J]. 中国蜂业, 2012, 63(4): 44-47.
[15] Costa E M, Araujo E L, Maia A V P, et al. Toxicity of insecticides used in the Brazilian melon crop to the honey bee Apis mellifera under laboratory conditions[J]. Apidologie, 2013, 45: 34-44.
[16] 赵怡楠, 高景林, 王玉洁, 等. 阿维菌素及其混剂对海南中蜂的急性毒性测定及风险评估[J]. 环境昆虫学报, 2014, 36(5): 744-748.
[17] Desneux N, Decourtye A, Delpuech J M. The sublethal effects of pesticides on beneficial arthropods[J]. Annual Review of Entomology, 2007, 52(1): 81-106.
[18] Van Aspern K. A study of housefly esterases by means of a sensitive colorimetric method[J]. J Insect Physiol, 1962, 8(4): 401-406.
[19] Habig W H, Pabst M J, Jakoby W B. Glutathione-S-transferases AA form rat liver[J]. Archives of Biochemistry and Biophysics, 1976, 175: 710-716.
[20] Bradford M M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein dye binding[J]. Analytical Biochemistry, 1976, 72: 248-254.
[21] Chauzat M P, Carpentier P, Martel A C, et al. Influence of pesticide residues on honey bee (Hymenoptera: Apidae)colony health in france[J]. Environmental Entomology, 2009, 38(3): 514-523.
[22] Badiou-Bénéteau A, Benneveau A, Géret F, et al. Honeybee biomarkers as promising tools to monitor environmental quality [J]. Environment International, 2013, 60: 31-41.
[23] Nguyen B K, Saegerman C, Pirard C, et al. Does imidacloprid seed-treated maize have an impact on honey bee mortality ?[J]. Journal of economic entomology, 2009, 102: 616-623.
[24] Ranson H, Claudianos C, Ortelli F, et al. Evolution of supergene families associated with insecticide resistance[J]. Science, 2002, 298(5 591): 179-181.
[25] Satoh T,Hosokawa M. Structure, function and regulation of carboxylesterases[J]. Chemico Biological Interactions, 2006, 162(3): 195-211.
[26] Attencia V M, Ruvolo-Takasuki M C C, Toledo V A A D. Esterase activity in Apis mellifera after exposure to organophosphate insecticides(Hymenoptera Apidae)[J]. Sociobiology, 2005, 45: 587-595.
[27] Badawy M E I, Nasr H M, Rabea E I. Toxicity and biochemical changes in the honey bee Apis mellifera exposed to four insecticides under laboratory conditions[J]. Apidologie, 2015, 46(2): 177-193.
[28] Huang Y, Xu Z, Lin X, et al. Structure and expression of glutathione S-transferase genes from the midgut of the Common cutworm, Spodoptera litura(Noctuidae) and their response to xenobiotic compounds and bacteria[J]. Journal of Insect Physiology, 2011, 57: 1 033-1 044.
[29] Enayati A A, Ranson H, Hemingway J. Insect glutathione transferases and insecticide resistance[J]. Insect Molecular Biology, 2005, 14(1): 3-8.
[30] Badiou A, Meled M, Belzunces L P. Honeybee Apis mellifera acetylcholinesterase-biomarker to detect deltamethrin exposure[J]. Ecotoxicology and Environmental Safety, 2008, 69(2): 246-253.
[31] Singh M, Sandhir R, Kiran R. Erythrocyte antioxidant enzymes in toxicological evaluation of commonly used organophosphate pesticides[J]. Indian Journal of Experimental Biology, 2006, 44(7): 580-583.
[32] Berenbaum M R, Johnson R M. Xenobiotic detoxification pathways in honey bees[J]. Current Opinion in Insect Science, 2015, 10: 51-58.
[33] 孟麗峰. 吡虫啉对蜜蜂解毒酶和生长发育的影响[D]. 北京. 中国农业科学院, 2013.
