类泛素介导和热激响应协同提高酿酒酵母的热稳定性
2016-07-07肖冰李珺李春北京理工大学生命学院北京100081
肖冰,李珺,李春(北京理工大学生命学院,北京 100081)
类泛素介导和热激响应协同提高酿酒酵母的热稳定性
肖冰,李珺,李春
(北京理工大学生命学院,北京 100081)
摘要:通过调节类泛素和热激响应介导的酿酒酵母内部的活性蛋白质平衡,提高酵母细胞的热稳定性和乙醇发酵性能,从而达到工业生产中降低控温能耗的目的。将5个蛋白质平衡相关基因分别与调控基因FBA1p组合构建耐热元器件,并将其导入酿酒酵母 Saccharomyces cerevisiae INVSC1,通过梯度升温培养筛选得到能赋予酵母细胞较好耐热性的类泛素元器件FBA1p-atg8和热激蛋白元器件FBA1p-hsp104;其对应的工程菌S.c-ATG8和S.c-HSP104在40℃恒定培养下,OD660值均比对照高50%以上(84 h),细胞存活率分别是对照的1.64倍和3.01倍(72 h),且都具有较好的细胞壁完整性及海藻糖合成量。将atg8与hsp104组合构建成双功能耐热元器件,其工程菌S.c-ATG8-HSP104在40℃恒定发酵的生长能力、细胞活力和乙醇生产能力都明显优于S.c-ATG8与S.c-HSP104。结果表明,通过类泛素介导与热激蛋白响应协同调节胞内活性蛋白质平衡可以有效地提高酿酒酵母的热稳定性。
关键词:合成生物学;发酵;生物技术;类泛素;热激蛋白;蛋白质平衡;热稳定性
2015-11-26收到初稿,2016-01-14收到修改稿。
联系人:李春。第一作者:肖冰(1991—),女,硕士研究生。
Received date: 2015-11-26.
Foundation item: supported by the National Natural Science Foundation of China (21376028, 21576027) and the Science Fund for Distinguished Youth Scholars of China (21425624).
引 言
工业微生物发酵过程中,由于细胞密度较高、新陈代谢旺盛而产生大量热,会导致发酵温度持续升高,对菌体生长和生产造成不利影响[1],因此需要冷却降温,造成大量能耗。酿酒酵母最适生长温度为30℃,是微生物发酵的常用菌种,所以提高酿酒酵母的耐热性,使其可以在较高的发酵温度下保持正常的生长代谢,成为改进发酵工业的重中之重[2-3]。
热胁迫导致酵母细胞内功能蛋白的变性失活,造成蛋白质内稳态失衡,从而使细胞的结构和功能遭到破坏,严重影响细胞的生长与代谢[4-5]。因此维持胞内蛋白质平衡是提高细胞在高温条件下的生存能力与耐受性的关键。酵母细胞内存在着多种热防御机制来维持热胁迫状态下的蛋白质平衡,包括自噬系统、泛素蛋白酶系统与热激蛋白[6-7]。自噬系统与泛素蛋白酶系统通过清除因高温环境而变性的蛋白质,为新生多肽合成提供原料,从而帮助细胞维持蛋白质平衡[8-9]。除此之外,热激蛋白是一类功能相似的蛋白质,在细胞受到高温诱导时大量表达,具有维持新合成多肽的稳定性,以及阻止变性蛋白聚集并帮助变性蛋白复性的功能[10]。但目前通过维持胞内蛋白质平衡从而提高耐热性的研究鲜有报道。Hiraishi等[11]通过过表达泛素连接酶Rsp5使酿酒酵母在41℃持续生产并在43℃具有更强的鲁棒性。Chen等[12]通过过表达同源小热激蛋白,发现双歧杆菌在55℃热激存活率高于对照,说明加强小热激蛋白表达可以提高热耐受性。高温条件下需要加强酵母蛋白质平衡网络,以帮助细胞提高生长活力以应对热胁迫带来的损伤[13-14]。
本研究将通过对蛋白质平衡相关基因进行发掘,利用分子生物学和合成生物学的方法,将来自酵母自噬系统的atg8(类泛素蛋白)、泛素蛋白酶系统的ubc4(E2泛素接合酶)、ump1(蛋白酶体亚基)以及热激蛋白的kar2和hsp104分别与酵母组成型强启动子FBA1p组装成具有蛋白质平衡功能的耐热元器件。将筛选出的耐热效果稳定且良好的元器件进行组合、表征以增强高温下的蛋白质稳态平衡并提高细胞生长活力,以期得到具有协同增效的耐热酵母工程菌,从而达到工业微生物发酵节能降耗的目的。
1 材料与方法
1.1主要仪器
PCR仪(Veriti)9902:美国ABI公司;电泳仪:美国Bio-rad有限公司;高速冷冻离心机D37520:美国Thermo Heraeus公司;恒温培养箱GHX-9050B-2:上海福玛实验设备有限公司;电转化仪Bio-Rad:美国Bio-Rad公司;SBA生物传感分析仪SBA-40C:山东省科学院生物技术研究室。
1.2菌株与质粒
酿酒酵母(Saccharomyces cerevisiae INVSC1)为实验室保藏菌株,用于质粒构建的宿主为本实验室保藏的大肠杆菌Top10。所用质粒pRS42K从德国法兰克福的EUROSCARF购买。
1.3试剂和培养基
质粒提取试剂盒及DNA凝胶回收试剂盒分别为北京博迈德生物技术有限公司和北京百泰克生物技术有限公司产品。Prime star DNA聚合酶、限制性内切酶、T4 DNA连接酶为TaKaRa公司产品。RNA提取试剂盒、反转录试剂盒及qRT-PCR试剂盒分别为OMGA、TaKaRa和罗氏公司生产。丙酮酸激酶酶活试剂盒购于南京建成生物工程研究室。
YPD+G418培养基:20 g·L−1胰蛋白胨,10 g·L−1酵母提取物,20 g·L−1葡萄糖,含有300 mg·ml−1的遗传霉素(G418),用于酿酒酵母转化子筛选和培养。
1.4酿酒酵母工程菌的构建及筛选
功能基因(atg8、ubc4、ump1、kar2、hsp104)与启动子(FBA1p)都以酿酒酵母基因组为模板,通过Prime Star DNA聚合酶进行扩增,回收产物经过酶切,与多拷贝的穿梭载体pRS42K连接,转入大肠杆菌TOP10菌株进行阳性克隆筛选。对阳性克隆进行重组质粒的提取,将提取的质粒转入酿酒酵母INVSC1,筛选阳性重组子。挑取酿酒酵母工程菌阳性克隆到40 ml 的YPD液体培养基中,30℃、170 r·min−1培养36 h进行活化,将活化后的酿酒酵母工程菌按初始OD660= 0.1进行转接。酵母在30℃培养12 h后,将培养温度调至35℃,并每12 h提高2℃,直到培养温度为45℃,整个发酵过程持续84 h。每12 h进行取样,用紫外可见分光光度计测量OD660,绘制出生长曲线,以此表征酿酒酵母的耐热性。
1.5恒定高温培养
种子液活化及转接方法同1.4节,将酿酒酵母在30℃培养12 h后,将培养温度提高到40℃进行培养,整个发酵过程持续84 h。每12 h取样测定OD660,绘制生长曲线。在48、60 h分别进行取样,选取合适的稀释度,取100 μl菌液进行涂板,在30℃培养2 d后进行菌落计数(每个固体平板菌落个数为30~300个时有效)。每个实验组重复 3 次。
1.6qRT-PCR
种子液活化后,将酿酒酵母在30℃培养12 h,继续在40℃条件下培养24 h,收集细胞,用RNA提取试剂盒提取RNA。以相同初始量的RNA作为模板反转录合成cDNA。采取相对定量qRT-PCR,选择持家基因act1为内参基因,用罗氏96孔荧光定量PCR仪进行反应。
1.7丙酮酸激酶活性测定
种子液经过活化,将酿酒酵母在30℃培养12 h,再在40℃条件下培养24 h,收集细胞,将收集的细胞悬浮于100 mmol·L−1Tris-HCl(pH = 7. 0,1 mmol·L−1DTT,10 mmol·L−1MgCl2,1mmol·L−1EDTA)中,冰浴条件下超声破碎细胞(工作2 s,间歇2 s,全程15 min,功率80 W),4℃,10000 r·min−1离心5 min,取上清液即为酶蛋白溶液。按照丙酮酸激酶酶活试剂盒说明书进行酶活测定。
1.8双功能酿酒酵母工程菌的构建
利用DNA assemble的方法进行双功能元器件的组装。质粒pRS42K经过限制性内切酶EcoRⅠ和SalⅠ双酶切后经琼脂糖凝胶回收,单功能耐热元器件经过PCR扩增回收后,经过Nanodrop测定浓度,根据计算,将基因片段与质粒混合(基因片段达到300 ng,质粒达到500 ng),加入两倍体积的无水乙醇,置于−20℃冰箱4~5 h;将上清弃去后,进行低温旋蒸除去多余无水乙醇。加入5 μl ddH2O溶解混合基因片段,电转导入酿酒酵母。
1.9乙醇发酵
种子液活化及转接方法同1.4节,30℃培养12 h,将温度升至40℃进行发酵,每24 h补加40%葡萄糖溶液4 ml,整个发酵过程为72 h。每12 h取样,用紫外可见分光光度计测量OD660,SBA测量乙醇浓度。
2 结果与讨论
2.1单功能耐热酿酒酵母工程菌的构建及筛选
将来自酿酒酵母的与蛋白质平衡相关的基因kar2(hsp70)、hsp104(hsp100)、atg8(类泛素)、ubc4(E2泛素接合酶)、ump1(蛋白酶体亚基)构成核心功能元器件,结合调控元器件(选自酵母本身的组成型强启动子FBA1p),利用合成生物学方法对其进行设计、组装,成为耐热元器件,将其转入酿酒酵母,得到酿酒酵母工程菌(表1)。

表1 耐热元器件与酿酒酵母工程菌Table 1 Heat-resistant devices and S.cerevisiae engineered strains
本文通过使酿酒酵母工程菌在梯度升温(35~45℃)条件下生长来模拟没有温控的发酵过程,从而考察菌株的耐热性。从图1中可以看出,所有酿酒酵母工程菌的生长情况均优于对照菌株,由此初步筛选得到两株热稳定性良好的耐热工程菌,分别为S.c-ATG8与S.c-HSP104。ATG8被认为是类泛素,与自噬体形成有关[15-16]。HSP104可以使错误折叠的蛋白解凝集,恢复其原始的构象和功能,对维持热胁迫条件下胞内蛋白平衡十分重要[17-18]。
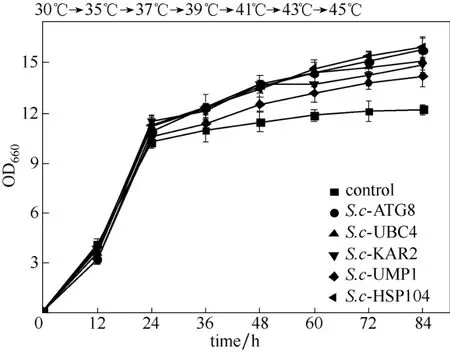
图1 酿酒酵母工程菌在35~45℃培养条件下的生长能力Fig.1 Growth ability of S.cerevisiae engineered strains cultured at temperature from 35℃ to 45℃
37℃是酿酒酵母的热激温度,41℃为野生酵母的生长上限[19]。本文选择将S.c-ATG8与S.c- HSP104在相对较高的40℃进行恒定高温发酵。结果[图2(a)]显示,不同工程菌在40℃高温条件下的生长能力不同,在培养24 h后S.c-ATG8与S.c-HSP104的生长能力逐渐高于对照,且随着时间的推移生长情况差距变大,84 h时S.c-ATG8与S.c-HSP104的OD660均高于对照50%以上。存活率结果显示[图2(b)],48 h时S.c-ATG8与S.c-HSP104存活率分别是对照的1.39倍和2.87倍;72 h时S.c-ATG8与S.c-HSP104的存活率分别是对照的1.64倍和3.01倍。梯度升温培养、恒定高温培养共同证明了S.c-ATG8与S.c-HSP104具有良好的耐热性,这些耐热元器件的导入可以提高酵母的热稳定性。
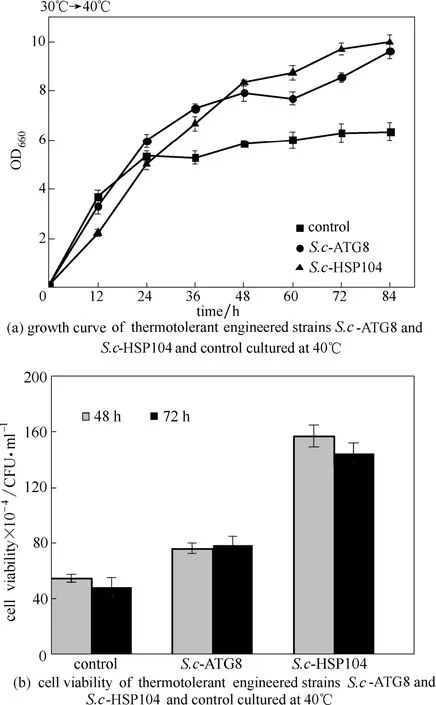
图2 耐热工程菌在40℃的生长能力及细胞存活率Fig.2 Growth ability and cell viability of thermotolerant engineered strains cultured at 40℃
2.2耐热酵母工程菌的生理特性
以持家基因ACT1作为内参,通过qRT-PCR考察相关基因的相对转录水平,结果如图3(a),可知导入的ATG8与HSP104基因均正常表达,但在相同启动子调控下,其转录水平并不一致。
细胞壁的完整性对酵母热胁迫的耐受至关重要[20]。几丁质是细胞壁的重要组成成分,而chs1是编码酵母几丁质合酶的基因,因此chs1表达水平的高低对细胞壁完整性意义重大。从图3(b)可以看出,S.c-ATG8与S.c-HSP104中chs1的转录水平分别是对照的1.62倍和1.43倍,说明耐热元器件的导入可能通过上调chs1基因从而提高酵母在热胁迫下细胞壁的完整性,进而使工程菌在高温培养下保持较好的生长能力。
海藻糖是一种重要的能量贮藏物质,不仅能够维持热胁迫环境下细胞膜稳定性,而且能维持细胞活性[21-23]。耐热工程菌S.c-ATG8与S.c-HSP104中编码海藻糖-6-磷酸合成酶的tps1表达水平均优于对照[图3(c)],这与热胁迫下酿酒酵母以海藻糖作为细胞保护剂的观点一致[24]。
2.3双功能耐热工程菌的构建及表征
将表现优良的类泛素atg8与热激蛋白hsp104组合成双功能元器件[图4(a)],导入酿酒酵母得到双功能耐热工程菌S.c-ATG8-HSP104,以期在变性蛋白降解和变性蛋白复性双重层次上缓解高温对酿酒酵母的胁迫。40℃恒定高温发酵结果表明[图4(b)],前24 h生长无明显差异,24 h后工程菌生长能力均逐渐高于对照,84 h时S.c-ATG8-HSP104的OD660为对照的1.73倍,且约为单功能工程菌S.c-ATG8与S.c-HSP104的1.22倍。可见双功能耐热元器件能进一步赋予酵母耐热性。
酵母代谢途径中的关键酶活性可以作为衡量细胞活力的指标。丙酮酸激酶(PK)是糖酵解过程中的主要限速酶之一,催化磷酸烯醇式丙酮酸和ADP变为ATP和丙酮酸,为细胞代谢提供能量,PK的酶活在一定程度上可以表征细胞的生理状况。由图4(d)发现,构建的耐热酵母工程菌的PK酶活力均比对照高,且双功能酵母工程菌S.c-ATG8-HSP104的酶活最高,为对照的1.95倍。可知类泛素元器件和热激蛋白元器件对维持热胁迫下细胞活力有一定作用,且双功能耐热元器件的效果更好,可能由于同时通过自噬降解与热激蛋白复性两个途径共同加强了细胞维持蛋白质平衡的能力,使细胞保持较高的活力,从而更好地提高了酵母的热稳定性。
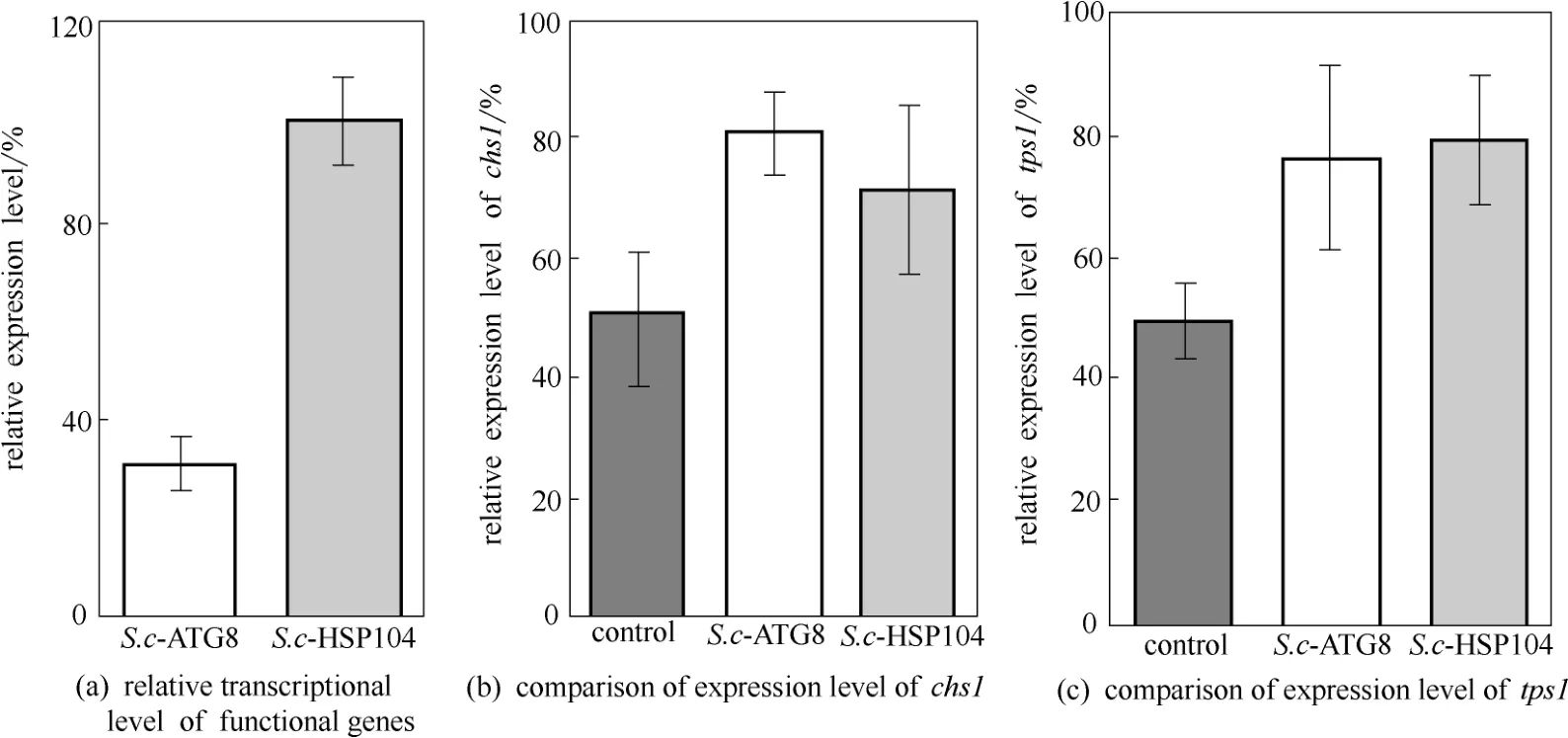
图3 40℃时耐热相关基因的表达水平Fig.3 Expression level of thermotolerance related gene at 40℃

图4 双功能耐热元器件的构建及双功能酵母工程菌的耐热性表征结果Fig.4 Construction of bifunctional gene device and thermotolerant characterization results of bifunctional engineered S. cerevisiae
2.4耐热工程菌在乙醇发酵中的应用
将S.c-ATG8、S.c-HSP104与S.c-ATG8-HSP104三株耐热工程菌进行40℃补料分批发酵。结果显示(图5), 40℃高温发酵的早期(36 h时),耐热工程菌的细胞生长优势并没有展现;40℃发酵60 h时,耐热工程菌株酵母细胞的生长与对照在30℃常规温度生长情况无明显差异(OD660)。检测40℃高温发酵下的乙醇产量发现,三株耐热工程菌的产乙醇能力有一定提高,其中发酵60 h时,工程菌S.c-ATG8-HSP104的乙醇产量比对照在30℃常规条件下发酵的乙醇产量有显著性提高。结果说明耐热元器件的引入可以赋予酵母耐热性,使酵母能够在较高的发酵温度下进行乙醇生产,从而节约能耗。

图5 酿酒酵母工程菌40℃生产的生长情况及乙醇产量的比较Fig.5 Comparison of growth ability and ethanol yield of engineered strain cultured at 40℃**, * mean significant difference at 1% and 5% level
3 结 论
本研究克隆了多个与蛋白质平衡机制紧密相关的,分别来自自噬系统、泛素蛋白酶系统和热激蛋白的基因,并与调控基因FBA1p组合构成耐热元器件,分别将其导入酿酒酵母Saccharomyces cerevisiae INVSC1。通过梯度升温培养筛选到能稳定赋予酵母良好耐热性的类泛素元器件FBA1p-atg8和热激蛋白元器件FBA1p-hsp104,其相应的工程菌S. c-ATG8和S.c-HSP104在40℃恒定培养时,细胞存活率明显好于对照,OD660值提高50%。进而将这两种耐热元器件组合获得的双功能耐热工程菌S.c-ATG8-HSP104,在相同条件下培养,其生长能力、细胞活力以及高温补料发酵时的乙醇生产能力皆具显著优势;特别是用丙酮酸激酶表征的细胞活力达对照的1.95倍,印证了蛋白质稳态平衡的维持有助于增强细胞活力的理论。类泛素介导与热激响应协同作用可以更好维护热胁迫条件下酵母胞内的蛋白质平衡,使工程化的酿酒酵母的热稳定性更强。本文为提高酿酒酵母耐热性,降低乙醇发酵成本,节能降耗提供了重要的理论依据和研究思路。
References
[1]AMILLASTRE E, ACEVES-LARA C A, URIBELARREA J L, et al. Dynamic model of temperature impact on cell viability and major product formation during fed-batch and continuous ethanolic fermentation in Saccharomyces cerevisiae [J]. Bioresource Technology, 2012, 117 (4): 242-250.
[2]SHAHSAVARANI H, HASEGAWA D, YOKOTA D, et al. Enhanced bio-ethanol production from cellulosic materials by semi-simultaneous saccharification and fermentation using high temperature resistant Saccharomyces cerevisiae TJ14 [J]. Journal of Bioscience & Bioengineering, 2013, 115 (1): 20-23.
[3]ZHU L, YAN Z, ZHANG Y, et al. Engineering the robustness of industrial microbes through synthetic biology [J]. Trends in Microbiology, 2012, 20 (2): 94-101.
[4]BUSTAMANTE C J, KAISER C M, MAILLARD R A, et al. Mechanisms of cellular proteostasis: insights from single-molecule approaches [J]. Annual Review of Biophysics, 2014, 43 (5): 119-140.
[5]MORIMOTO R. Cell stress and proteostasis networks in biology, aging, and disease [J]. Biophysical Journal, 2014, 106 (2): 34a.
[6]ZHANG S X, SANDERS E, FLIESLER S J, et al. Endoplasmic reticulum stress and the unfolded protein responses in retinal degeneration [J]. Experimental Eye Research, 2014, 125: 30-40.
[7]BENYAIR R, RON E, LEDERKREMER G Z. Protein quality control, retention, and degradation at the endoplasmic reticulum [J]. International Review of Cell & Molecular Biology, 2011, 292: 197-280.
[8]SMITH S E, KOEGL M, JENTSCH S. Role of the ubiquitin/ proteasome system in regulated protein degradation in Saccharomyces cerevisiae [J]. Biological Chemistry, 1996, 377 (7/8): 437-446.
[9]FINLEY D, ULRICH H D, SOMMER T, et al. The ubiquitinproteasome system of Saccharomyces cerevisiae [J]. Genetics, 2012, 192 (2): 319-360.
[10]HARTL H U, MANAJIT H. Molecular chaperones in the cytosol: from nascent chain to folded protein [J]. Science, 2002, 295 (6): 1852-1858.
[11]HIRAISHI H, MOCHIZUKI M, TAKAGI H. Enhancement of stress tolerance in Saccharomyces cerevisiae by overexpression of ubiquitin ligase Rsp5 and ubiquitin-conjugating enzymes [J]. Bioscience Biotechnology & Biochemistry, 2006, 70 (11): 2762-2765.
[12]KHASKHELI G B, ZUO F L, YU R, et al. Overexpression of small heat shock protein enhances heat-and salt-stress tolerance of Bifidobacterium longum NCC2705 [J]. Current Microbiology, 2015, 71: 1-8.
[13]TROTTER E W, CAMILLA M-F K, LUDMILLA B, et al. Misfolded proteins are competent to mediate a subset of the responses to heat shock in Saccharomyces cerevisiae [J]. Journal of Biological Chemistry, 2002, 277 (47): 44817-44825.
[14]HIPP M S, PARK S H, HARTL F U. Proteostasis impairment in protein-misfolding and -aggregation disease [J]. Trends in Cell Biology, 2014, 24 (9): 506-514.
[15]XIE Z, NAIR U, KLIONSKY D. Atg8 controls phagophore expansion during autophagosome formation [J]. Molecular Biology of the Cell, 2008, 19 (8): 3290-3298.
[16]NAKATOGAWA H, ICHIMURA Y, OHSUMI Y. Atg8, a ubiquitin-like protein required for autophagosome formation, mediates membrane tethering and hemifusion [J]. Cell, 2007, 130 (1): 165-178.
[17]SANCHEZ Y, TAULIEN J, BORKOVICH K A, et al. Hsp104 is required for tolerance to many forms of stress [J]. EMBO Journal, 1992, 11 (6): 2357-2364.
[18]TESSARZ P, MOGK A, BUKAU B. Substrate threading through the central pore of the Hsp104 chaperone as a common mechanism for protein disaggregation and prion propagation [J]. Molecular Microbiology, 2008, 68 (1): 87-97.
[19]SHI D J, WANG C L, WANG K M. Genome shuffling to improve thermotolerance, ethanol tolerance and ethanol productivity of Saccharomyces cerevisiae [J]. Journal of Industrial Microbiology & Biotechnology, 2009, 36 (1): 139-147.
[20]MAGALI M, STÉPHANIE W, FLORENCE D B, et al. Adaptation of the wine bacterium Oenococcus oeni to ethanol stress: role of the small heat shock protein Lo18 in membrane integrity [J]. Applied & Environmental Microbiology, 2014, 80 (10): 2973-2980.
[21]PLOURDE-OWOBI L, DURNER S, GOMA G, et al. Trehalose reserve in Saccharomyces cerevisiae: phenomenon of transport, accumulation and role in cell viability [J]. International Journal of Food Microbiology, 2000, 55 (1/2/3): 33-40.
[22]ODUMERU J A, D’AMORE T, RUSSELL I, et al. Alterations in fatty acid composition and trehalose concentration of Saccharomyces brewing strains in response to heat and ethanol shock [J]. Journal of Industrial Microbiology & Biotechnology, 1993, 11 (2): 113-119.
[23]MAHMUD S A, HIRASAWA T, SHIMIZU H. Differential importance of trehalose accumulation in Saccharomyces cerevisiae in response to various environmental stresses [J]. Journal of Bioscience & Bioengineering, 2010, 109 (3): 262-266.
[24]VIRGILIO C D, HOTTIGER T, DOMINGUEZ J, et al. The role of trehalose synthesis for the acquisition of thermotolerance in yeast [J]. European Journal of Biochemistry, 1994, 219 (1/2): 179-186.
Synergistically enhanced thermostability of Saccharomyces cerevisiae by ubiquitin-like protein mediation and heat shock response
XIAO Bing, LI Jun, LI Chun
(School of Life Science, Beijing Institute of Technology, Beijing 100081, China)
Abstract:To improve the thermostability and fermentation performance of Saccharomyces cerevisiae to reduce the energy consumption of the cooling progress in industrial fermentation, the protein homeostasis was regulated through ubiquitin-like protein mediation and heat shock response. In this study, many heat-resistant gene devices were mined out from genes related to protein homeostasis and constructed with the regulatory device FBA1p,and then transformed into Saccharomyces cerevisiae INVSC1. Outstanding heat-resistant devices FBA1p-atg8 and FBA1p-hsp104 were screened through gradually increased temperature incubation. Compared with the control, the OD660of the engineered yeast strains S.c-ATG8 and S.c-HSP104 were both over 50% higher (84 h) and their cell viability were 1.64 to 3.01 times higher (72 h) when cultured at 40℃. The physiological characteristics implied that the thermotolerant strains possessed better cell wall integrity and higher trehalose content. In order to strengthening the regulatory mechanisms of both ubiquitin-proteasome system pathway and heat-shock responses within the network of protein homeostasis, atg8 and hsp104 were assembled to construct bifunctional engineered strain S.c-ATG8-HSP104, which showed better growth ability, stronger cell activity and higher ethanol yield at 40℃. The results revealed that the synergistic effect of ubiquitin-like protein and heat shock protein could enhanceyeast thermotolerance and improve strain activity.
Key words:synthetic biology; fermentation; biotechnology; ubiquitin-like protein; heat shock protein; protein homeostasis; thermostability
中图分类号:TQ 028.8
文献标志码:A
文章编号:0438—1157(2016)06—2503—07
DOI:10.11949/j.issn.0438-1157.20151778
基金项目:国家自然科学基金项目(21376028,21576027);国家杰出青年科学基金项目(21425624)。
Corresponding author:Prof. LI Chun, lichun@bit.edu.cn
