阳春砂基于转录组的萜类合酶基因挖掘及一个单萜合酶基因的克隆
2016-07-07邓可杨锦芬王腾王虹王焕苏金锋詹若挺
邓可,杨锦芬,王腾,王虹,王焕,苏金锋,詹若挺
(1.广州中医药大学中药资源科学与工程研究中心,岭南中药资源教育部重点实验室,国家中成药工程技术研究中心南药研发实验室,广东广州 510006;2.广州中医药大学中药学院,广东广州 510006)
阳春砂基于转录组的萜类合酶基因挖掘及一个单萜合酶基因的克隆
邓可1,杨锦芬1,王腾1,王虹1,王焕1,苏金锋2,詹若挺1
(1.广州中医药大学中药资源科学与工程研究中心,岭南中药资源教育部重点实验室,国家中成药工程技术研究中心南药研发实验室,广东广州510006;2.广州中医药大学中药学院,广东广州510006)
摘要:【目的】深入挖掘阳春砂转录组中挥发性萜类合酶相关基因,为全面认识阳春砂挥发性萜类代谢途径和分子调控模式奠定基础。【方法】整理前期工作获得的阳春砂2个转录组的数据,筛选已注释的及利用本地blast方法再注释的萜类合成途径的unigene;并通过对部分候选unigene的表达量与挥发性萜类化合物含量的相关性分析及生物信息学分析,进一步筛选出相关基因;采用PCR及重组载体构建的方法克隆其中一个单萜合酶基因,并对其编码蛋白序列进行分析。【结果】筛选得到10个挥发性萜类合成上游途径相关unigene及11个下游萜类合酶基因;相关性分析证明候选基因与阳春砂主要挥发性萜类有较强相关性;并成功克隆得到AvTPS1基因,其序列包含1 803 bp的开放阅读框,编码600个氨基酸;其编码蛋白含有单萜合酶蛋白特有的DDXXD、RRX8W和NSE/DTE等保守基序,N端含有一段叶绿体转运肽;系统进化分析表明AvTPS1属于TPS-b亚家族。【结论】结合转录组、表达谱数据的深入挖掘和与挥发性萜类化合物数据的关联,有效筛选出了阳春砂多个值得后续研究的萜类合酶基因;其中对AvTPS1的克隆及生物信息学分析为后续功能鉴定提供了基础。
关键词:阳春砂;转录组;萜类合酶基因;基因克隆
砂仁是芳香化湿类中药,也是我国“四大南药”之一,其性温,味辛,具有化湿开胃、温脾止泻、理气安胎等功效[1]。阳春砂Amomum villosum Lour.是砂仁的主流品种,广东阳春所产的道地药材阳春砂品质最佳[2-3]。挥发油是阳春砂芳香化湿、行气止痛的主要物质基础。道地药材阳春砂果实挥发油中含有丰富的挥发性萜类,主要由单萜、倍半萜及其衍生物组成,如乙酸龙脑酯、樟脑、龙脑、芳樟醇和双环大根香叶烯等,其中乙酸龙脑酯含量最高,具有显著的药理活性[4-7]。因此,挥发性萜类化合物在阳春砂药效方面发挥着重要作用。
植物萜类的合成途径主要分4个阶段[8]:首先是异戊烯基焦磷酸(isopentenyl pyrophosphate,IPP)及其双键异构体二甲基丙烯焦磷酸(dimethylally pyrophosphate,DMAPP)的合成。其合成途径主要有2条,即细胞质中的甲羟戊酸(mevalonate pathway,MVA)途径和质体中的脱氧木酮糖-5-磷酸(1-deoxy-D-xylulose-5-phosphatepathway,DXP)途径[9 -11]。IPP和DMAPP在异戊烯基转移酶(isoprenyl transferases)作用下经头对尾或头对头融合形成不同长度的异戊二烯焦磷酸链。之后经萜类合酶,也称萜环化酶(terpenoid synthases/cyclases,TPS)催化环化和重排生成萜骨架。最后,细胞中内质网上的一些酶如P450单加氧酶等对萜骨架进行羟基化、甲基化等修饰。最终萜类产物的种类、产量和比例都受到多个关键酶的调控。对阳春砂药效成分挥发性萜类生物合成途径及相关酶基因进行研究,将为全面深入认识阳春砂挥发性萜类代谢途径和分子调控机制奠定基础。
本课题组前期已获得2个阳春砂转录组及相应多个表达谱[12-13]。本研究将通过各类生物信息学方法对转录组及表达谱数据进行整理,初步筛选出部分阳春砂挥发性萜类代谢途径相关基因;并通过关联阳春砂基因表达谱数据和对应样品挥发性萜类含量变化数据,更全面地发掘萜类合酶基因。另一方面,也对筛选所得的其中1个萜类合酶基因进行克隆,并分析其编码蛋白序列,为进一步的基因功能鉴定和应用于阳春砂挥发性萜类代谢工程的研究奠定基础,现报道如下。
1 材料与方法
1.1植物材料所用阳春砂材料种植于广州中医药大学大学城校区时珍山,移栽自广东阳春,经广州中医药大学杨锦芬研究员鉴定为阳春砂Aomomum villosum Lour.。
1.2主要试剂植物RNA提取试剂盒购自艾德莱生物有限公司;第一链cDNA合成试剂盒及pLB平末端克隆载体购自天根生化科技有限公司;高保真PrimeSTAR酶、ExTaq酶和其他PCR所需试剂、电泳所需Marker、感受态细胞及纯化回收试剂盒均购自大连宝生物有限公司;引物合成和基因测序由广州华大基因有限公司完成。
1.3转录组数据分析本课题组前期已获得阳春砂果实发育不同时期的转录组(命名为AvD)和茉莉酸甲酯(MeJA)诱导的转录组(AvM)数据,统计KEGG注释数据中挥发性萜类相关通路的unigene并筛选代表基因(基因长度≥700 bp,表达量较高)。结合阳春砂中含有的主要挥发性萜类成分相关的生物合成途径中的酶基因,在美国国立生物技术信息中心(NCBI)中查找并下载其他物种中已鉴定的挥发性萜类合酶氨基酸序列,作为探针序列,通过本地BLAST软件blast-2.2.30+在2个阳春砂转录组数据中进行blastp比对,对unigene进行再注释,以相似度≥40%、比对长度≥100、比对分数≥100、基因长度≥1 000 bp为条件筛选出候选unigene。利用本地BLAST软件进行blastn比对,关联2个转录组间的unigene。
1.4相关性分析采用SPSS 17.0统计软件的Pearson算法对课题组前期获得的MeJA诱导实验中阳春砂挥发性萜类含量数据[13]及转录组AvM中候选基因的表达量进行双变量线性相关系数计算;所得相关系数利用R语言软件包中的pheatmap软件绘制热图,热图绘制由广州基迪奥生物科技有限公司协助完成。
1.5AvTPS1的克隆阳春砂叶片总RNA的提取参照艾德莱EASYspin Plus植物RNA提取试剂盒说明书进行。取1 μg总RNA按照天根cDNA第1链合成说明书进行cDNA第1链的合成。从转录组数据中提取候选AvTPS1核酸序列,根据ORFfinder预测所得开放阅读框,使用Primer Premier 5软件在5’端与3’端非编码区设计引物AvF1:5’-TT TTATCCCACATTTCAC-3’与AvR1:5’-GCTCCATG TAGATAGATTATC-3’,使用高保真PrimeSTAR酶通过2轮PCR从阳春砂cDNA中克隆基因编码区全长。PCR第1轮反应程序为:95℃变性10 s,53.5℃退火15 s,72℃延伸10 s,35个循环;取第1轮PCR产物进行第2轮扩大PCR:95℃变性10 s,53.5℃退火15 s,72℃延伸10 s,40个循环,72℃延伸5min。扩增产物用10 g/L琼脂糖凝胶电泳检测,回收纯化后连接到pLB平末端克隆载体上,转化感受态大肠杆菌,进行抗性筛选,挑取阳性克隆单菌落用于检测和测序。
1.6生物信息学分析运用在线工具ORFfinder进行ORF预测;使用NCBI在线工具进行blastp比对查找并下载同源相似性较高的相似序列信息;使用本地软件ClustalX 2.1进行多序列比对;利用Mega 5.1软件的Neighbor-Joining算法绘制系统发育树进行遗传进化分析。使用在线工具ProtParam对蛋白理化性质进行预测;ChloroP 1.1 Server和TargetP 1.1 Server进行亚细胞定位;ProtScale的Kyte & Doolittle算法进行亲疏水性分析。使用SWISS-MODEL Workspace在线数据库对编码蛋白进行同源建模。
2 结果与分析
2.1阳春砂挥发性萜类合成上游途径关键基因的转录组分析DXP途径和MVA途径中的关键酶——1-去氧-D-木酮糖-5-磷酸合成酶(1-deoxy-D-xylulose-5-phosphatesynthase,DXS)、1-去氧-D-木酮糖-5 -磷酸还原异构酶(1 -deoxy -D -xylulose-5-phosphate reductoisomerase,DXR)和3-羟基-3-甲基戊二酰辅酶A还原酶(3-hydroxy-3-methylglutaryl coenzyme A reductase,HMGR),以及异戊烯基转移酶中催化合成香叶基焦磷酸(GPP)与法呢基二磷酸(FPP)的香叶基二磷酸合酶(geranyl diphosphate synthase,GPPS)和法呢基二磷酸合酶(farnesyl diphosphate synthase,FPPS)是本研究重点关注的萜类合成上游途径关键酶。萜类相关的unigene在经MeJA诱导的转录组AvM中较未经诱导的转录组AvD中得到更多的注释[13],因此对该部分转录组AvM的数据进行重点展示。挥发性萜类合成上游途径在KEGG数据库中对应到萜类骨架生物合成途径(terpenoid backbone biosynthesis,ko00900),该通路共注释21个酶基因共160个unigene;其中注释到7个HMGR,10 个DXR,30个DXS,3个GPPS和1个FPPS unigene。本研究对筛选长度最长、表达量较高的10个unigene进行展示并重命名,结果见表1。
其中,本研究中筛选得到的AvHMGR1、AvDXR1 和AvDXS1(Unigene0057019、Unigene0056545和Unigene0077967),与课题组前期通过同源克隆3个关键基因AvHMGR(FJ455511.1)、AvDXR (FJ459894.1)和AvDXS(FJ455512.1)[14-17],序列相似度分别达到99.95%、99.88%和99.57%;推测这3个unigene即对应前期克隆所得的上述3个关键基因。从2个转录组数据推测,阳春砂基因组中有多个HMGR、DXR和DXS基因,尤其是DXS,在转录组AvD中注释到60个unigene[12],结合前期研究发现的AvDXS在多种器官中的高表达量[15],更可确认其具有看家基因的特性。
2.2阳春砂挥发性萜类合酶基因的转录组分析
2.2.1已注释挥发性萜类合酶相关基因的整理萜类合酶基因(TPS)为挥发性萜类合成下游途径的关键酶基因,对应到KEGG数据库中的单萜生物合成途径(monoterpenoid biosynthesis,ko00902)及倍半萜生物合成途径(sesquiterpenoid and triterpenoid biosynthesis,ko00909)2个通路中。其中转录组AvD仅在单萜通路中注释到1个unigene,而经MeJA诱导转录组AvM在单萜合成通路中共注释3个单萜合酶基因(12个unigene),在倍半萜及三萜生物合成途径中注释到2个三萜合酶基因(13个unigene),但并未注释到倍半萜合成相关酶基因,故不在本文中赘述。综合2个阳春砂转录组,被直接注释到的3个单萜酶基因分别是月桂烯/罗勒烯合酶(myrcene/ocimene synthase,MS/OS,下简称MS)、芳樟醇合酶[(3S)-linalool synthase,LIS]和新薄荷醇脱氢酶[(+)-neomenthol dehydrogenase,NDS]基因,其中LIS与NDS为转录组AvM中首次被注释到的单萜合酶基因;筛选得长度最长、表达量较高的10个unigene,结果表2。
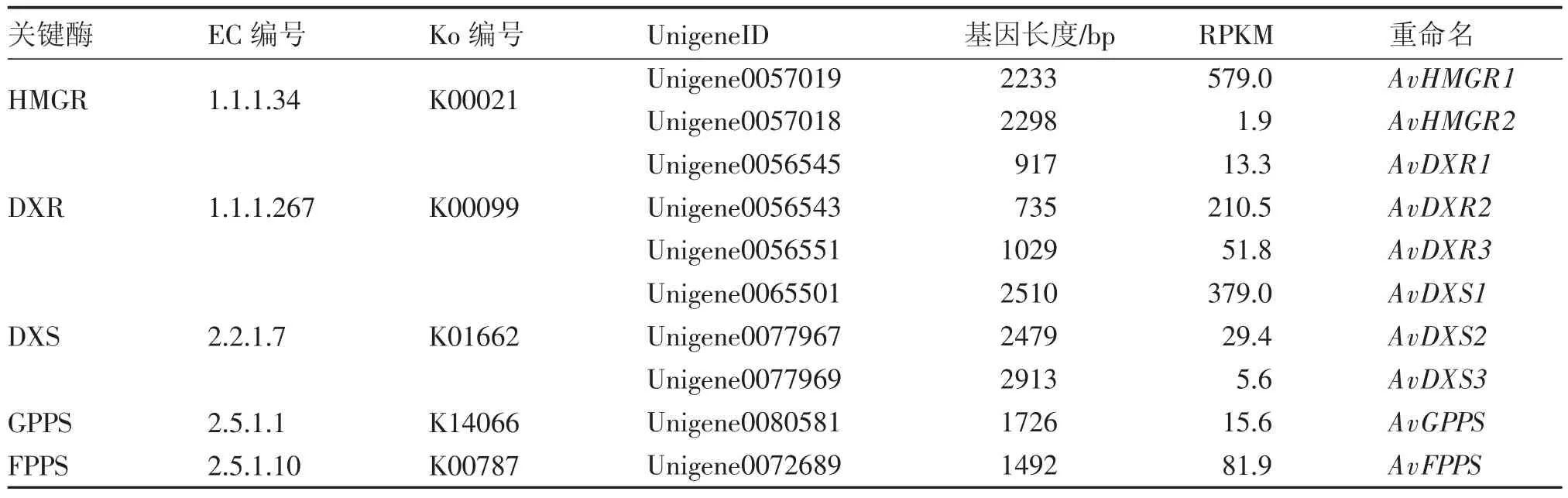
表1 已注释的阳春砂萜类骨架合成通路候选基因整理Table 1 Data of the annotated candidate genes involved in terpenoid backbone biosynthesis pathway of A.villosum
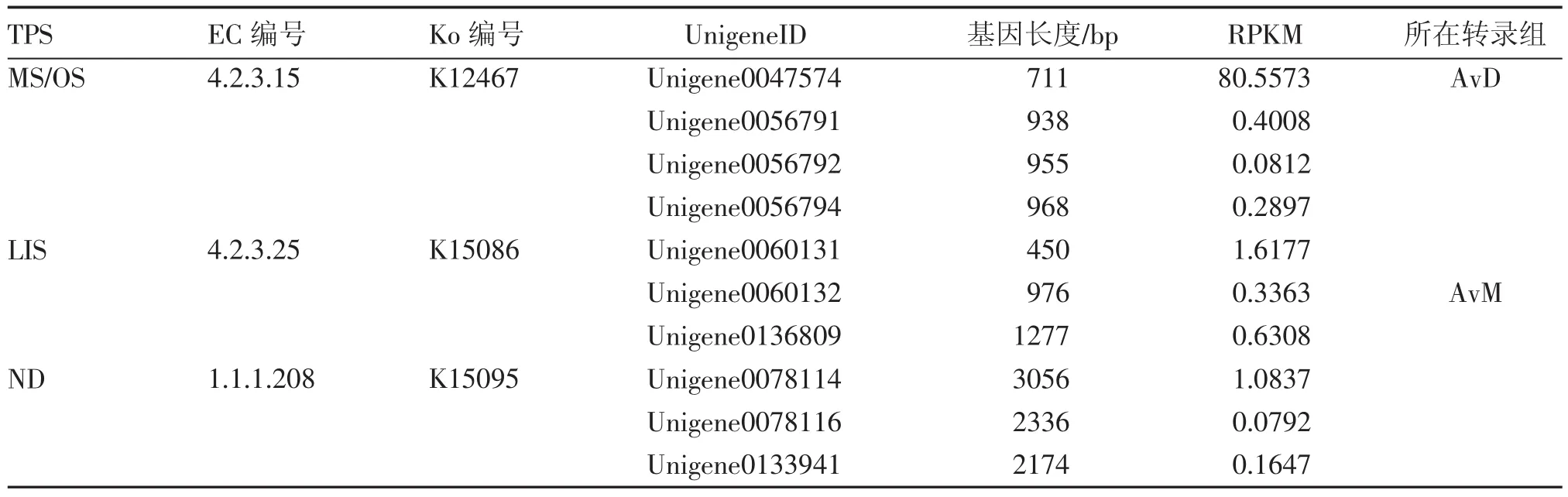
表2 已注释的阳春砂单萜合成通路候选基因整理Table 2 Data of the annotated candidate genes involed in monoterpenoid biosynthesis pathway of A.villosum
2.2.2本地blast再注释挥发性萜类合酶相关基因的整理根据本课题组对阳春砂果实挥发性萜类的测定结果[13],阳春砂种子团及果皮中含量较高的单萜有乙酸龙脑酯、樟脑、龙脑、芳樟醇、β-蒎烯、α-蒎烯、月桂烯和松油醇等;倍半萜类则以双环大根香叶烯为主。其中芳樟醇及月桂烯合酶相关基因已被注释(表2),本部分主要关注其他7个化合物对应的合酶基因,包括龙脑基二磷酸合酶[(+)-bornyl diphosphate synthase,BDS]、β-蒎烯合酶[(-)-beta-pinene synthase,BPS]、α-蒎烯合酶[(-)-alpha-pinene synthase,APS]、松油烯合酶(1,8-cineole synthase,TPS-Cin)和双环大根香叶烯合酶(bicyclogermacrene synthase,BGS)5个合酶基因。从NCBI下载上述基因序列(具体序列信息详见表3),以这些序列作为探针,在转录组AvD 和AvM中进行本地blast再注释,筛选出5个合酶(包括4个单萜合酶及1个倍半萜合酶)基因共17 个unigene,转录组信息及比对结果如表4所示。
2.2.3候选AvTPS的确定将2.2.1和2.2.2所得的来源于不同转录组却被同一单萜合酶基因注释上的unigene进行blastn关联比对,部分来自于不同转录组被注释的unigene具有极高的相似度,当相似度达到99%以上、比对分数大于1 000时,认为这些来源于不同转录组的相似unigene对应阳春砂中的同一基因(表4)。综合上述结果,对筛选到的挥发性萜类合酶下游基因(AvTPS)进行重命名,确定其代表unigene(表5),以测序长度较长的转录组AvDunigene作为AvTPS的核酸序列参考,以检测部位及组别较多的转录组AvMunigene作为AvTPS的表达量参考以供后续分析使用。
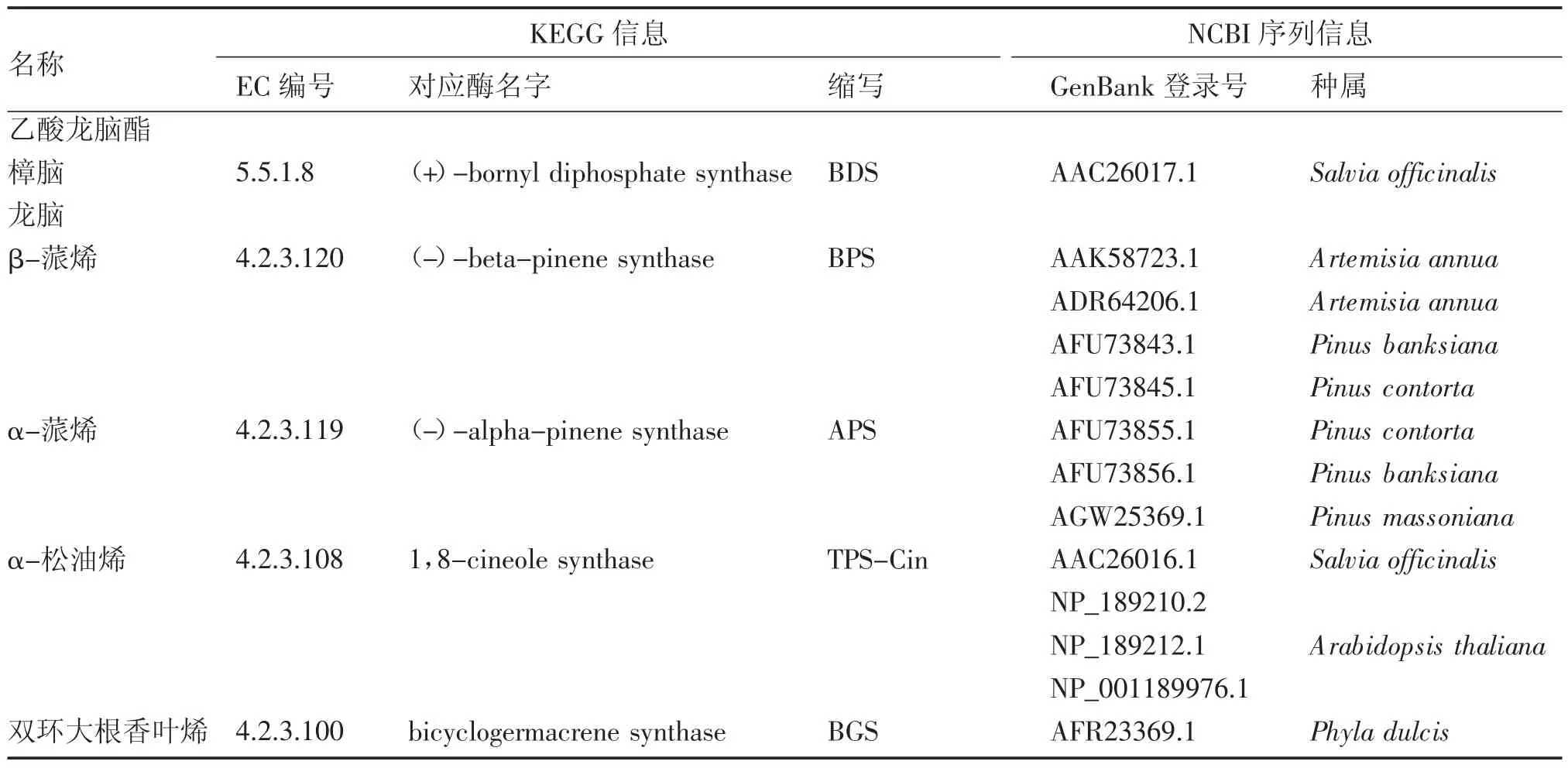
表3 阳春砂主要成分相关酶序列下载信息Table 3 Information of enzymes related to main volatile terpenes in A.villosum

表4 再注释的阳春砂挥发性萜类合酶候选基因整理Table 4 Data of the reannotated candidate genes of volatile terpene synthase of A.villosum
2.3候选基因表达量与主要挥发性萜类含量相关性分析提取上述2.1和2.2筛选所得春砂的主要挥发性萜类成分含量进行相关分析,计算得到的Pearson相关系数如图1所示,其中AvTPS3和AvTPS4的代表unigene由于在考察组别均未能测得表达量,故不参与分析。图1结果显示:大部分阳春砂候选基因与除了α-蒎烯外的阳春砂主要挥发性萜类均表现出相关系数绝对值大于0.6的较强相关性,表明筛选得到的这些阳春砂候选基因有较大可能参与挥发性萜类的合成过程。
图1显示:基因表达量与化合物含量的相关模式大体分为2种:第1种是与芳樟醇、β-蒎烯等阳春砂果皮中主要成分正相关,与乙酸龙脑酯、樟脑、双环大根香叶烯等种子团中的主要成分[13]负相关;第2种则与种子团中成分正相关,与果皮主要成分负相关。在上游候选基因的相关分析中(图1-a),与单萜合成直接相关的DXP途径的关键基因AvDXR和AvDXS基本与阳春砂果皮中的主要成分正相关,而与种子团中主要成分负相关;而AvDXS1则与MVA途径的关键基因AvHMGR一样呈现第2种相关模式;不仅印证了阳春砂内含有多个DXS基因的猜想,同时体现出,这2个途径在阳春砂果实不同部位中参与不同有效成分的合成。而在TPS候选基因的相关性分析(图1-b)显示:不同的AvTPS基因呈现出不一样的相关模式,如果根据相关模式划分,则相同模式的AvTPS5与AvTPS9、或AvTPS6与AvTPS11可能含有相似功能。
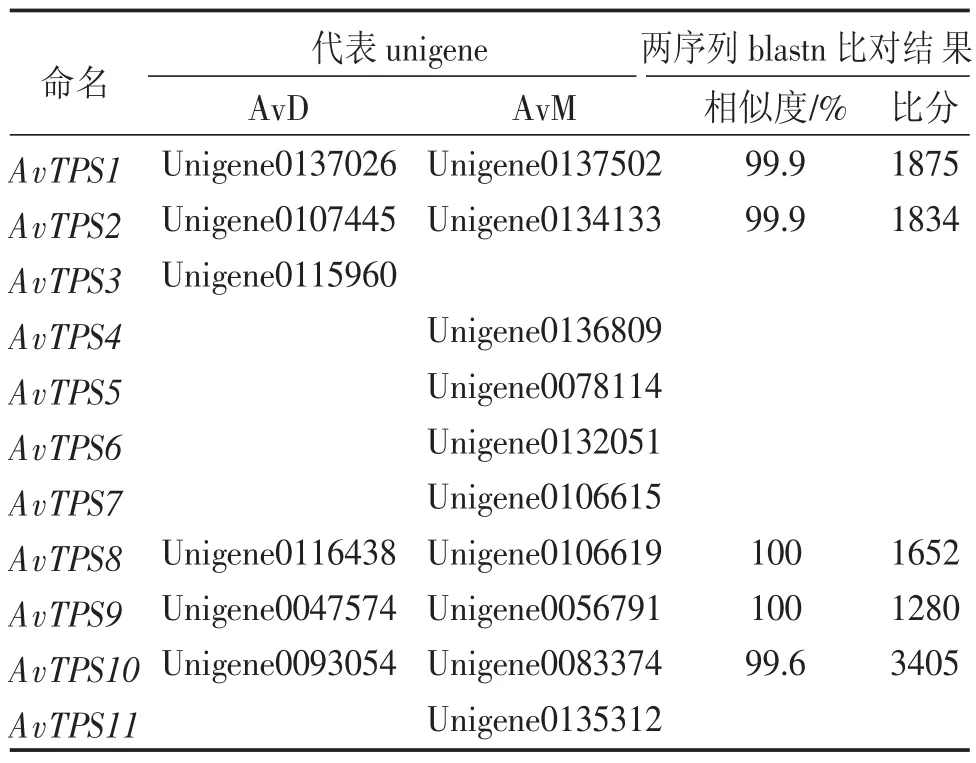
表5 AvTPS的命名与代表unigene的确定Table 5 AvTPS name and the candidate unigenes data
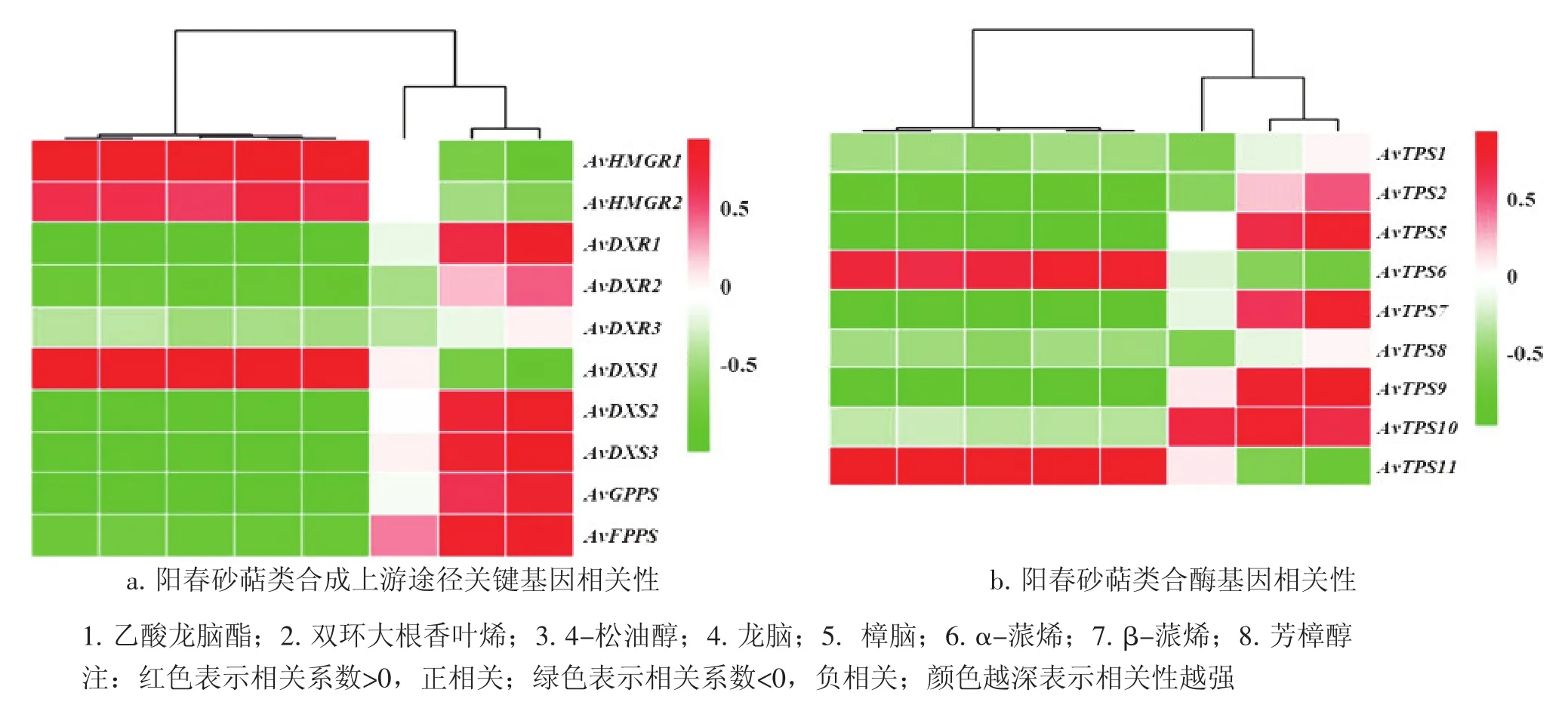
图1 候选基因表达量与主要挥发性萜类含量相关系数热图Figure 1 Heat map of the correlation coefficient of candidate unigenes expression levels and main volatile terpene contents
2.4AvTPS1克隆及编码蛋白序列分析根据AvTPS1(转录组Unigene0137026)的核苷酸序列设计引物,以阳春砂叶片cDNA为模板,克隆AvTPS1含全长ORF DNA片段;测序结果显示:克隆所得的AvTPS1全长cDNA共1 881 bp,开放阅读框为1 803 bp,编码600个氨基酸,所得氨基酸序列与Unigene0137026的预测氨基酸序列一致。
AvTPS1编码蛋白(以下简称AvTPS1)预测分子量为68.92 kDa,等电点为5.56,分子式为C3086H4776N840O914S21,与已有的TPS蛋白序列性质相似。经ChloroP及TargetP预测,AvTPS1编码蛋白N端含有一段叶绿体转运信号肽,信号肽的剪切位点在42号位;而AvTPS1多肽链中亲水区域大于疏水区域,预测该蛋白属于亲水性蛋白。利用SWISS-MODEL Workspace对AvTPS1进行同源建模,与来源于留兰香(Menthaspicata)的4S-柠檬烯合酶[20]及来源于鼠尾草(Salvia officinalis)的(+)-龙脑基二磷酸合酶[21]同源相似性分别为41.26%及42.96%,具有相似的蛋白结构与功能区。
取AvTPS1序列进行NCBI blastp比对,比对上大量单萜或倍半萜合酶基因,其中与姜花叶绿体单萜合酶基因同源相似度最高,达到87%;选取相似度大于50%的序列进行多序列比对分析,发现AvTPS1氨基酸序列中含有多个已知萜类合酶序列的保守模体(conserved motifs),如RRX8W、RXR、DDXXD和NSE/DTE[即(N,D)D(l,I,V)X(S,T)XXXE],如图2所示。其中,天冬氨酸富集区DDXXD和NSE/DTE这2个保守区,通过与金属离子(如Mg2+和Mn2+)的络合来结合催化底物(GPP等),是单萜、倍半萜以及二萜合成酶所属的离子化依赖的萜类合酶共有的功能结构域[22-23];精氨酸保守区RRX8W能通过异构作用间接催化生成环状萜类[20];而RXR区域则可能参与萜品烯的催化反应[24]。这些保守模体的分析,更提示AvTPS1极有可能参与挥发性萜类的合成。

图2 AvTPS1相似序列比对及功能结构域展示Figure 2 Similar sequence alignment and functional domain of AvTPS1
将AvTPS1与已发表的植物萜类合酶氨基酸序列构建系统进化树,结果见图3。图3中涉及的TPS亚家族的划分参照Chen等[25]在2011年划分的新标准,分为TPS-a~TPS-h 7个亚家族,其中TPS-h亚家族未在图中展示。图3显示:单萜及倍半萜合酶多集中于TPS-b、a、g和d 4个亚家族;而AvTPS1所在的TPS-b亚家族不仅是被子植物中显花植物特有的家族,也是单萜合酶基因特有的亚家族,该家族的单萜合酶主要用于催化环状单萜的合成[18,25]。
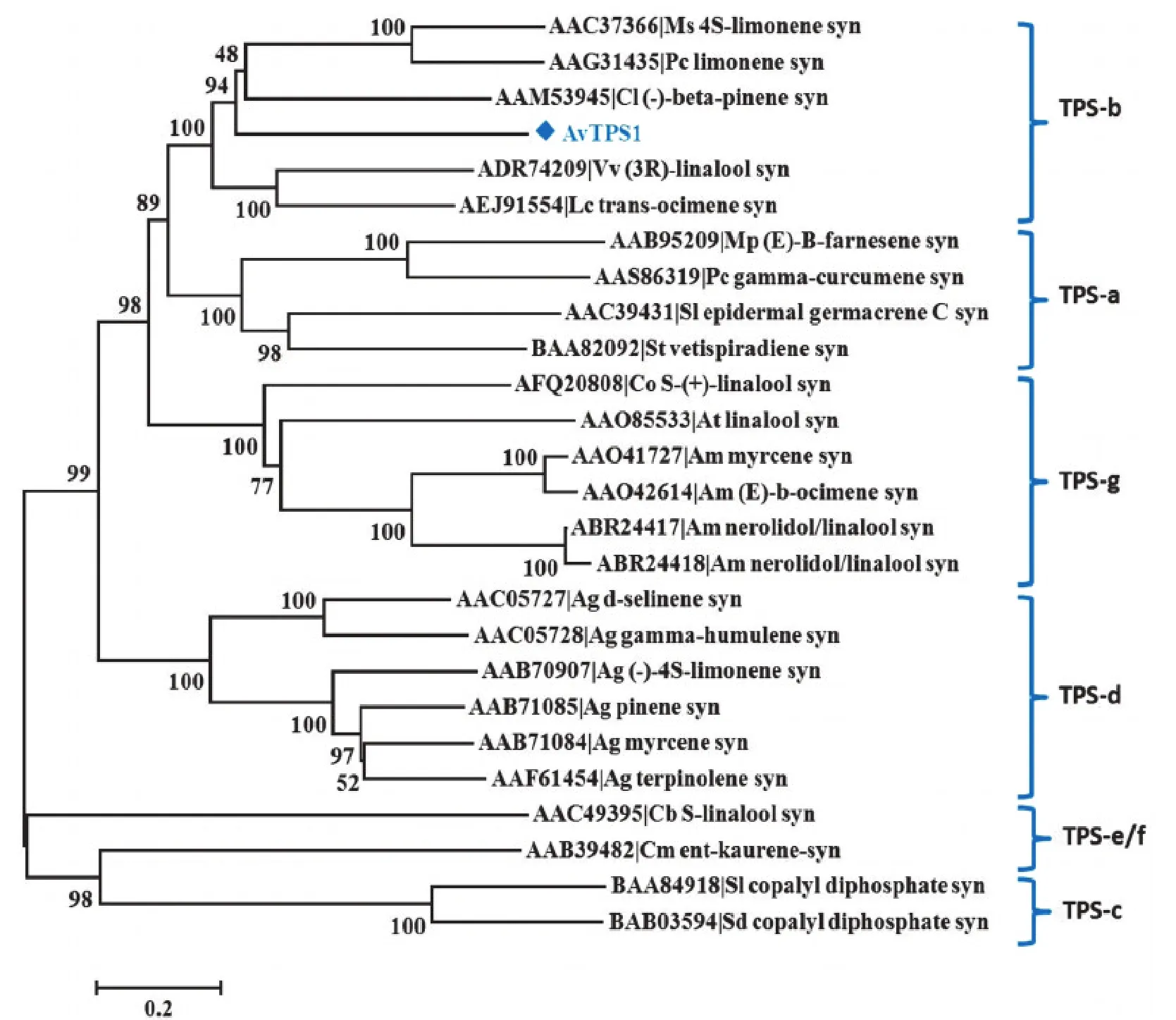
图3 AvTPS1与其他已知萜类合酶(TPS)的系统进化树分析Figure 3 Phylogenetic analysis of AvTPS1 and other known terpene synthases
3 讨论
本研究对阳春砂转录组中阳春砂挥发性萜类合成途径相关基因进行了深入挖掘,对已注释到的挥发性萜类合成相关KEGG通路中的unigene进行了提取和筛选,共获得10个上游途径候选unigene 和11个下游途径合酶候选unigene,对已注释基因的挖掘是目前在无参转录组中寻找目的基因的最常用方法[26]。但在阳春砂转录组中,仅被注释上3个下游的单萜合酶基因,同时还存在大量的未注释基因,这些未被注释的unigene可能包含阳春砂中特异表达的功能基因[27]。所以利用本地blast反向比对的方法对阳春砂转录组中的基因进行再注释,得到多个萜类合酶相关的17个再注释unigene,后续的相关性分析和生物信息学分析也证明了这些unigene与萜类合成相关,从而验证了该方法的有效性。
在进行本地blast再注释的过程中发现,不同的探针序列会对相同的unigene进行注释,如表4 中Unigene0137026、Unigene0107445等unigene能同时被BDS、BPS、TPS-cin注释上。推测原因有二:①是由于TPS酶和底物多样性的特点[28],很多萜类合酶能催化生成多种产物,如从鼠尾草中分离的龙脑基二磷酸合酶,除了生成(+)-龙脑基焦磷酸外,还能生成大量的(+)-α-蒎烯,(+)-莰烯和(±)-柠檬烯,同时具有龙脑二磷酸合酶和蒎烯合酶的功能[29]。②被子植物TPS的系统发育和谱系分化与植物自然分类系统联系更密切,相同物种来源的TPS相似性远高于功能相同而来源不同的TPS,所以基于序列相似性的查找仅可以判断其是否萜类合酶,却不能预测其产物[18-19],需要进一步实验功能验证。萜类合酶基因在植物中多以基因家族的形式存在[30],所以在unigene间关联比对时,发现筛选得到的候选基因中存在不少序列相似的unigene,这些unigene可能是一个基因家族中的不同成员,是同一萜类合酶的不同剪接,在阳春砂中行使相似的功能。
本研究中无论是基因表达量与挥发性萜类含量的相关性分析,还是对克隆基因AvTPS1的生物信息学分析,均只是功能预测;但基因表达与化合物的生成中间还要经过蛋白、激素等多方面调控,并非简单的线性相关关系,还须对候选基因进行基于原核或真核的表达功能的功能鉴定。本课题组后续将克隆本研究筛选到的其他AvTPS,并通过基于原核和真核表达系统的功能鉴定,进一步确认AvTPS的催化功能及其在挥发性萜类合成过程中的作用。
参考文献:
[1]国家药典委员会.中华人民共和国药典(一部)[M].北京:中国医药科技出版社,2015.
[2]丁平,刘军民,徐鸿华.商品砂仁的质量评析[J].中国中药杂志,2002,27(10):786.
[3]陈蔚文,徐鸿华.岭南道地药材研究[M].广州:广东科技出版社,2007.
[4]余竞光,孙兰,周立东,等.中药砂仁化学成分研究[J].中国中药杂志,1997,22(4):39.
[5]丁平,杜景峰,魏刚,等.砂仁与长序砂仁挥发油化学成分的研究[J].中国药学杂志,2001,36(4):19.
[6]吴晓松,李晓光,肖飞.砂仁挥发油中乙酸龙脑酯镇痛抗炎作用的研究[J].中药材,2004,27(6):438.
[7]胡玉兰,张忠义,林敬明.中药砂仁的化学成分和药理活性研究进展[J].中药材,2005,28(1):72.
[8]Kumari S,Priya P,Misra G .Structural and biochemical perspectives in plant isoprenoid biosynthesis[J].Phytochem Rev,2013,12(2):255.
[9]张长波,孙红霞,巩中军,等.植物萜类化合物的天然合成途径及其相关合酶[J].植物生理学通讯,2007,43(4):779.
[10]Rohmer M.From molecular fossils of bacterial hopanoids to the formation of isoprene units:discovery and elucidation of the methylerythritol phosphate pathway[J].Lipids,2008,43(12):1095.
[11]Bouwmeester H J.Engineering the essence of plants[J].Nat Biotechnol,2006,24(11):1359.
[12]于安民.基于RNA-Seq的阳春砂果实发育过程中糖和萜类代谢的研究[D].广州:广州中医药大学,2014.
[13]王焕,杨锦芬,邓可,等.茉莉酸甲酯影响阳春砂挥发性萜类代谢和基因转录[J].世界科学技术—中医药现代化,2014 (7):1528.
[14]杨锦芬.阳春砂萜类成分生物合成上游功能基因的克隆及表达分析[D].广州:广州中医药大学,2008.
[15]Yang J,Adhikari M N,Liu H,et al.Characterization and functional analysis of the genes encoding 1-deoxy-D-xylulose-5 -phosphate reductoisomerase and 1 -deoxy -D -xylulose -5 -phosphate synthase,the two enzymes in the MEP pathway,from Amomum villosum Lour.[J].Mol Biol Rep,2012,39(8):8287.
[16]魏洁书.基于阳春砂HMGR和DXR基因的萜类化合物生物合成调控研究[D].广州:广州中医药大学,2013.
[17]魏洁书,杨锦芬,凌敏,等.茉莉酸甲酯调控阳春砂HMGR、DXR和DXS基因表达[J].广州中医药大学学报,2013,30 (1):88.
[18]Bohlmann J,Meyer -Gauen G,Croteau R.Plant terpenoid synthases:molecular biology and phylogenetic analysis[J].Proc Natl Acad Sci U S A,1998,95(8):4126.
[19]徐应文,吕季娟,吴卫,等.植物单萜合酶研究进展[J].生态学报,2009,29(6):3188.
[20]Hyatt D C,Youn B,Zhao Y,et al.Structure of limonene synthase,a simple model for terpenoid cyclase catalysis[J].Proc Natl Acad Sci U S A,2007,104(13):5360.
[21]Whittington D A,Wise M L,Urbansky M,et al.Bornyl diphosphate synthase:structure and strategy for carbocation manipulation by a terpenoid cyclase[J].Proc Natl Acad Sci U S A,2002,99(24):15375.
[22]Christianson D W.Structural biology and chemistry of the terpenoid cyclases[J].Chem Rev,2006,106(8):3412.
[23]Oldfield E,Lin F Y.Terpene biosynthesis:modularity rules [J].Angew Chem Int Ed Engl,2012,51(5):1124.
[24]Aubourg S,Lecharny A,Bohlmann J.Genomic analysis of the terpenoid synthase(AtTPS)gene family of Arabidopsis thaliana [J].Mol Genet Genomics,2002,267(6):730.
[25]Chen F,Tholl D,Bohlmann J,et al.The family of terpene synthases in plants:a mid-size family of genes for specialized metabolism that is highly diversified throughout the kingdom[J].Plant J,2011,66(1):212.
[26]郭溆.基于转录组测序的石斛生物碱和人参皂苷生物合成相关基因的发掘、克隆及鉴定[D].北京:北京协和医学院,2013.
[27]Galata M,Sarker L S,Mahmoud S S.Transcriptome profiling,and cloning and characterization of the main monoterpene synthases of Coriandrum sativum L[J].Phytochemistry,2014,102:64.
[28]Tholl D.Terpene synthases and the regulation,diversity and biological roles of terpene metabolism[J].Curr Opin Plant Biol,2006,9(3):297.
[29]Wise M L,Savage T J,Katahira E,et al.Monoterpene synthases from common sage(Salvia officinalis).cDNA isolation,characterization,and functional expression of(+)-sabinene synthase,1,8-cineole synthase,and(+)-bornyl diphosphate synthase[J].J Biol Chem,1998,273(24):14891.
[30]李路路,王欢,孙明,等.岷江百合单萜合酶基因克隆与表达分析[J].福建农林大学学报(自然科学版),2014(4):397.
【责任编辑:黄玲】
Mining of Genes Involved in Terpenoid Synthases Based on Transcriptome Analysis and Cloning of Monoterpene Synthase from Amomum villosum Lour.
DENG Ke1,YANG Jinfen1,WANG Teng1,WANG Hong1,WANG Huan1,SU Jinfeng2,ZHAN Ruoting1
(1.Research Center of Chinese Medicinal Resource Science and Engineering,Ministry of Education Key Laboratory of Chinese Medicinal Resources from Lingnan,Joint Laboratory of National Engineering Research Center for the Pharmaceutics of Traditional Chinese Medicine,Guangzhou University of Chinese Medicine,Guangzhou 510006 Guangdong,China;2.School of Chinese Herbal Medicine,Guangzhou University of Chinese Medicine,Guangzhou 510006 Guangdong,China)
Abstract:Objective To dig out the related volatile terpene synthase genes from transcriptome of Amomum villosum Lour.,so as to lay the foundation for comprehensive understanding of volatile terpenoid biosynthesispathway and molecular regulation mode.Methods Based on the obtained results of the two transcriptome of Amomum villosum Lour.,we screened out the unigenes involved in volatile terpenoid biosynthesis pathway which had been annotated or was reannotated by blast method.After analyzing the correlation of the expression of partial candidate unigenes with the contents of volatile terpenoids and their bioinformatics,we selected out the relative unigenes.One monoterpene synthase gene of them was cloned by polymerase chain reaction(PCR)and recombinant vector construction methods,and then the protein coding sequences of the monoterpene synthase gene were analyzed.Results Ten candidate terpenoid biosynthesis upstream pathway unigenes and 11 candidate downstream pathway genes were obtained from the transcriptome of Amomum villosum Lour..The data proved that the expression of the candidate genes had a strong relationship with main volatile terpenes of Amomum villosum Lour..AvTPS1 had been cloned successfully,which contained 1 803 bp open reading frame(ORF),encoding 600 amino acids.The encoded protein of AvTPS1 contained the specific conservative sequences DDXXD,RRX8W and NSE/DTE which were special for terpene synthase protein,and N-terminal of the encoded protein had a chloroplast transit peptide.Phylogenetic analysis showed that AvTPS1 belonged to the subfamily of TPS-b terpene synthase.Conclusion Based on the results of transcriptome and gene expression profile of Amomum villosum Lour.,and on the correlation of gene expression profile with the content of volatile terpenoids,we found out several valuable candidate terpene synthases genes from Amomum villosum Lour..And the analysis results of clone and bioinformatics of AvTPS1 will supply evidence for the future study of gene function characterization.
Key words:Amomum villosum Lour.;transcriptome;terpene synthases gene;gene clone
中图分类号:R284.1
文献标志码:A
文章编号:1007-3213(2016)03 - 0395 - 09
DOI:10.13359/j.cnki.gzxbtcm.2016.03.026
收稿日期:2015-12-21
作者简介:邓可(1991-),女,硕士研究生;E-mail:745074686@qq.com
通讯作者:杨锦芬(1978-),女,研究员;E-mail:yangif@gzucm.edu.cn
基金项目:国家自然科学基金青年科学基金项目(编号:81303163);广东省高等学校优秀青年教师培养计划项目(编号:Yq2013042);广州中医药大学青年英才培养项目(编号:AAC414124A08)
