淫羊藿苷联合齐墩果酸对RAW264.7小鼠巨噬细胞迁移和M1极化的影响
2016-07-07明康文洪创雄姜涛王剑
明康文,洪创雄,姜涛,王剑
(1.广州市中医医院,广东广州 510301;2.广州中医药大学,广东广州 510405)
淫羊藿苷联合齐墩果酸对RAW264.7小鼠巨噬细胞迁移和M1极化的影响
明康文1,洪创雄2,姜涛2,王剑2
(1.广州市中医医院,广东广州510301;2.广州中医药大学,广东广州510405)
摘要:【目的】探讨淫羊藿苷与齐墩果酸联合使用对RAW264.7巨噬细胞迁移及极化的影响,并探究雌激素受体在此过程中的作用。【方法】培养RAW264.7巨噬细胞,随机分为空白组[不加脂多糖(LPS)及药物]、LPS组(加入终浓度为20 μg/L 的LPS)、1.5 μmol/L淫羊藿苷+1.5 μmol/L齐墩果酸组、3.0 μmol/L淫羊藿苷+3.0 μmol/L齐墩果酸组、雌激素受体拮抗剂ICI182780(终浓度1×10-3mmol/L)+1.5 μmol/L淫羊藿苷+1.5μmol/L齐墩果酸组、ICI182780(终浓度1×10-3mmol/L)+3.0 μmol/L淫羊藿苷+3.0 μmol/L齐墩果酸组。应用Transwell小室迁移实验观察淫羊藿苷与齐墩果酸联合使用对LPS诱导的巨噬细胞迁移效应的影响;应用流式细胞术观察淫羊藿苷与齐墩果酸联合使用对LPS诱导的巨噬细胞M1极化的抑制作用,并用雌激素受体阻断剂ICI183780观察雌激素受体在这个过程中的作用。【结果】Transwell小室迁移实验结果表明:与空白组比较,LPS组可显著促进RAW264.7巨噬细胞的迁移(P<0.05);与LPS组比较,ICI182780+1.5 μmol/L淫羊藿苷+1.5 μmol/L齐墩果酸组、ICI182780+3.0 μmol/L淫羊藿苷+3.0 μmol/L齐墩果酸组均可显著抑制LPS诱导的RAW264.7巨噬细胞的迁移(P<0.05),且ICI182780+3.0 μmol/L淫羊藿苷+3.0 μmol/L齐墩果酸组作用优于ICI182780+1.5 μmol/L淫羊藿苷+1.5 μmol/L齐墩果酸组(P<0.05)。流式细胞术检测结果显示:与空白组比较,LPS组CD11c+表达显著升高(P<0.05),说明20 μg/L的LPS可以刺激RAW264.7巨噬细胞,使其向M1极化;与LPS组比较,1.5 μmol/L淫羊藿苷+ 1.5 μmol/L齐墩果酸组、3.0 μmol/L淫羊藿苷+3.0 μmol/L齐墩果酸组可协同LPS作用于RAW264.7巨噬细胞,使其向M1极化(P<0.05);与LPS组比较,ICI182780+1.5 μmol/L淫羊藿苷+1.5 μmol/L齐墩果酸组、ICI182780+3.0 μmol/L淫羊藿苷+3.0 μmol/L齐墩果酸组均可显著抑制LPS诱导的RAW264.7巨噬细胞向M1极化(P<0.05),且ICI182780+3.0μmol/L淫羊藿苷+3.0μmol/L齐墩果酸组作用优于ICI182780+1.5μmol/L淫羊藿苷+1.5μmol/L齐墩果酸组(P<0.05)。【结论】淫羊藿苷与齐墩果酸联合使用可能通过雌激素受体产生促进RAW264.7巨噬细胞的迁移和M1极化的作用,并在雌激素受体受到抑制后产生相反的作用。
关键词:淫羊藿苷;动脉粥样硬化/中药疗法;齐墩果酸;巨噬细胞/病理学;迁移;极化;雌激素受体;细胞培养
淫羊藿苷是中草药淫羊藿的主要活性成分,属于黄酮苷类化合物[1]。齐墩果酸是中药女贞子的主要成分[2]。两者皆为加味二至丸(淫羊藿、女贞子、墨旱莲)的重要组成药物,其中女贞子和淫羊藿均被证实有植物雌激素样作用[3-4]。本研究采用体外培养RAW264.7小鼠巨噬细胞,通过脂多糖(LPS)刺激诱导其迁移及M1极化,以雌激素受体拮抗剂ICI182780拮抗雌激素受体,探究淫羊藿苷与齐墩果酸联合使用对巨噬细胞迁移和极化过程中的作用,并探讨其与雌激素受体之间的关系,现报道如下。
1 材料与方法
1.1细胞株小鼠巨噬细胞系RAW 264.7(由本实验室保存),加入含10%(体积分数)胎牛血清、100 U/mL青霉素、链霉素的高糖DMEM,置于体积分数5%CO2、37℃培养箱中生长。细胞生长至70%~80%融合后传代,一般2~3 d传代1次。
1.2药物齐墩果酸(广州齐云生物技术有限公司提供,批号:110709,纯度>980 mg/g)、淫羊藿苷(上海市融禾医药公司提供,批号:20081478,纯度>980 mg/g)。采用二甲基亚砜(DMSO)助溶,-4℃保存,实验前用培养基稀释至所需浓度,DMSO终浓度小于体积分数0.1%。雌激素受体拮抗剂ICI182780以DMSO配置成50 mmol/L的储存液,-20℃避光保存备用。
1.3试剂与仪器脂多糖(LPS,美国Sigma公司产品,批号:L2880);四甲基偶氮唑盐(MTT)、DMSO(上海翊圣生物科技有限公司产品);雌激素受体拮抗剂ICI182780(购自齐云生物技术有限公司,货号:M182780);异硫氰酸荧光素(FITC)标记CD11c+抗体(美国BD公司产品);结晶紫染色液(碧云天公司产品);Transwell 24孔板(美国Corning公司产品,孔径为8 μm);ORMA 371型CO2细胞培养箱(美国Thermo Fisher公司产品);iMark型酶标仪16138、C6流式细胞仪(美国Bio-Rad公司产品)。
1.4RAW264.7细胞活力检测调整RAW264.7细胞悬液浓度为1×105/mL,加入96孔培养板内,每孔体积为100 μL,置于5%(体积分数)CO2、37℃培养箱中培养至贴壁。吸出旧的培养基,分别加入淫羊藿苷与齐墩果酸混合培养基,终浓度分别为1.5 μmol/L、3.0 μmol/L。空白组加含0.1%(体积分数)DMSO的培养基,每组设6个复孔,继续培养24 h。每孔加入MTT 20 μL,37℃培养4 h后,每孔加入150 μL的DMSO,于490 nm处检测各孔的吸光度值。实验重复3次以上。
1.5Transwell小室迁移实验调整RAW264.7细胞悬液浓度为1×106/mL,上室每孔加入100 μL细胞悬液,下室加入600 μL含10%(体积分数)的胎牛血清的DMEM培养基培养至细胞贴壁,换无血清DMEM培养基培养24 h(使细胞同步化),加入药物干预。实验分组:空白组(不加LPS及药物)、LPS组(加入终浓度为20 μg/L的LPS)、给药1组(1.5 μmol/L淫羊藿苷+ 1.5 μmol/L齐墩果酸组)、给药2组(3.0 μmol/L淫羊藿苷+3.0 μmol/L齐墩果酸组)、给药3组(ICI182780+1.5 μmol/L淫羊藿苷+ 1.5 μmol/L齐墩果酸组)、给药4组(ICI182780+3.0 μmol/L淫羊藿苷+3.0 μmol/L齐墩果酸组)。除空白组和LPS组外,各给药组均在加药后4 h加入终浓度为20 μg/L的LPS作用24 h。取出小室,用棉签擦去上室的细胞,以40 g/L多聚甲醛固定15 min,再用PBS清洗1次,结晶紫染色10 min,显微镜下拍照并统计迁移至下室的细胞数量(随机选取3个视野)。
1.6流式细胞术检测RAW264.7细胞CD11c+的表达调整RAW 264.7细胞悬液浓度为1×106/mL,接种至12孔板。待细胞贴壁后换无血清DMEM培养基培养24 h(使细胞同步化),加入药物干预。实验分组同1.5项。除空白组和LPS组外,各给药组均在加药后4 h加入终浓度为20 μg/L的LPS作用24 h。消化收集细胞于250 μL的离心管中PBS清洗2~3次,离心,加入200 μL PBS重悬细胞后,加入1 μL大鼠抗小鼠的流式抗体CD11c+,4℃避光孵育30 min。采用流式细胞分析仪检测,以CD11c+标记百分率代表M1极化的比例。
1.7统计方法采用SPSS 17.0 for Windows软件进行分析。数据以均数±标准差(±s)表示,多组间比较采用方差分析(ANOVA),以P<0.05为差异有统计学意义。
2 结果
2.1各组RAW264.7细胞活力检测结果比较表1结果显示:与空白组比较,分别给予1.5 μmol/L淫羊藿苷+1.5 μmol/L齐墩果酸、3.0 μmol/L淫羊藿苷+ 3.0 μmol/L齐墩果酸均未显示出细胞毒性作用(P>0.05)。
表1 各组RAW264.7细胞活力检测结果比较Table 1 RAW264.7 macrophage viability of various groups (±s)
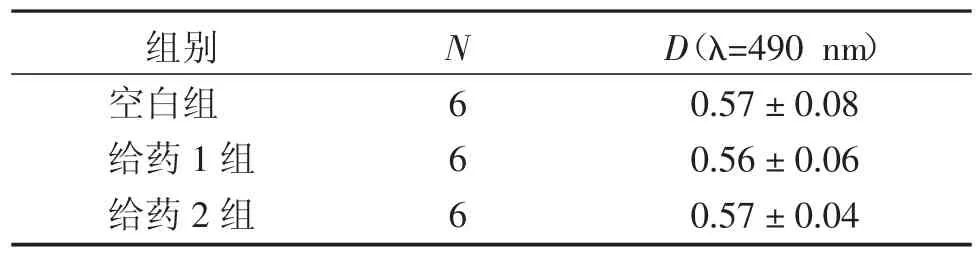
表1 各组RAW264.7细胞活力检测结果比较Table 1 RAW264.7 macrophage viability of various groups (±s)
组别空白组给药1组给药2组N666 D(λ=490 nm)0.57±0.08 0.56±0.06 0.57±0.04
2.2各组对RAW264.7巨噬细胞迁移能力的影响比较表2、图1结果显示:与空白组比较,20 μg/L 的LPS组刺激24 h可显著促进RAW264.7巨噬细胞的迁移(P<0.05);与空白组比较,1.5 μmol/L淫羊藿苷+ 1.5 μmol/L齐墩果酸、3.0 μmol/L淫羊藿苷+3.0 μmol/L齐墩果酸也可促进RAW264.7巨噬细胞的迁移(P<0.05),但与LPS组比较,差异无统计学意义(P>0.05)。与LPS组比较,ICI182780+1.5 μmol/L淫羊藿苷+ 1.5 μmol/L齐墩果酸组、ICI182780 + 3.0 μmol/L淫羊藿苷+ 3.0 μmol/L齐墩果酸组均可显著抑制LPS诱导的RAW264.7巨噬细胞的迁移(P<0.05),且ICI182780+3.0 μmol/L淫羊藿苷+3.0 μmol/L齐墩果酸组作用优于ICI182780 + 1.5 μmol/L淫羊藿苷+ 1.5 μmol/L齐墩果酸组(P<0.05)。说明在雌激素受体拮抗剂ICI182780存在的情况下,淫羊藿苷与齐墩果酸联合使用可以抑制RAW264.7巨噬细胞的迁移,其作用可能与雌激素受体相关。
表2 各组对RAW264.7巨噬细胞迁移能力的影响比较Table 2 Comparison of macrophage migration of various groups (±s)

表2 各组对RAW264.7巨噬细胞迁移能力的影响比较Table 2 Comparison of macrophage migration of various groups (±s)
①P<0.05,与空白组比较;②P<0.05,与LPS组比较;③P<0.05,与给药3组比较
组别N n迁移至下室的细胞/(个·视野-1)空白组LPS组给药1组给药2组给药3组给药4组333333 133.0±6.66 194.0±4.93①198.0±8.50①183.7±17.95①161.3±2.91②93.3±2.60②③
2.3各组对RAW64.7巨噬细胞CD11c+表达的影响表3、图2结果显示:与空白组比较,LPS组CD11c+表达显著升高(P<0.05),20 μg/L的LPS组可以刺激RAW264.7巨噬细胞,使其向M1极化;与LPS组比较,1.5 μmol/L淫羊藿苷+ 1.5 μmol/L齐墩果酸、3.0 μmol/L淫羊藿苷+ 3.0 μmol/L齐墩果酸组可协同LPS作用于RAW264.7巨噬细胞,使其向M1极化(P<0.05);与LPS组比较,ICI182780+ 1.5 μmol/L淫羊藿苷+ 1.5 μmol/L齐墩果酸组、ICI182780 + 3.0 μmol/L淫羊藿苷+ 3.0 μmol/L齐墩果酸组均可显著抑制LPS诱导的RAW264.7巨噬细胞向M1极化(P<0.05),且ICI182780 + 3.0 μmol/L淫羊藿苷+3.0 μmol/L齐墩果酸组作用优于ICI182780 + 1.5μmol/L淫羊藿苷+ 1.5 μmol/L齐墩果酸组(P<0.05)。说明雌激素受体在雌激素受体拮抗剂ICI182780存在的情况下,淫羊藿苷与齐墩果酸联合使用可以抑制RAW264.7巨噬细胞向M1极化,其作用可能与雌激素受体相关。
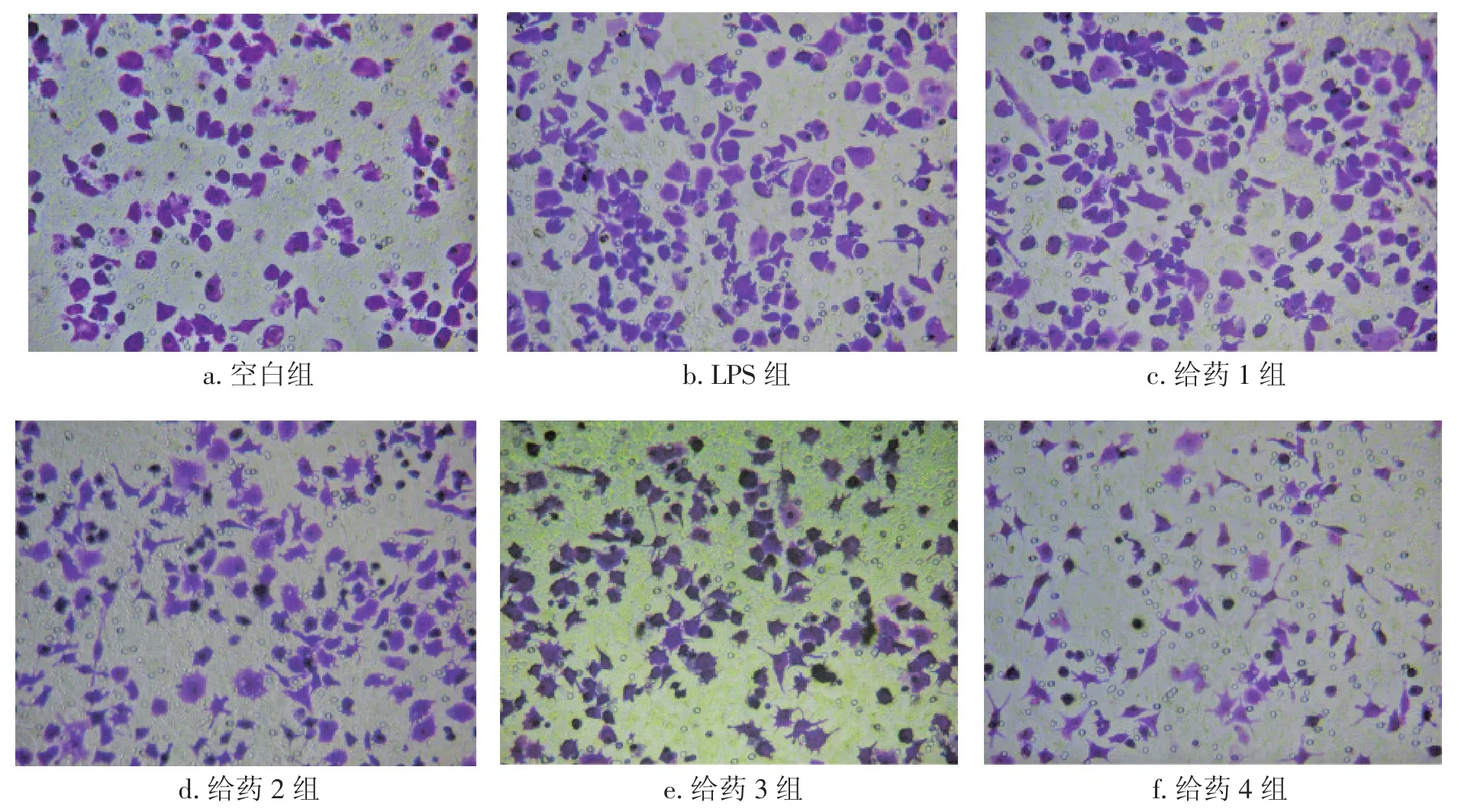
图1 各组对RAW264.7巨噬细胞迁移能力的影响(结晶紫染色,×20)Figure 1 RAW264.7 macrophage polarization in various groups(by crystal violet staining,×20)
表3 各组对LPS诱导RAW264.7巨噬细胞CD11c+表达的影响比较Table 3 The percentage of CD11c+positive labeling in LPS-induced RAW264.7 macrophages of various groups (±s)
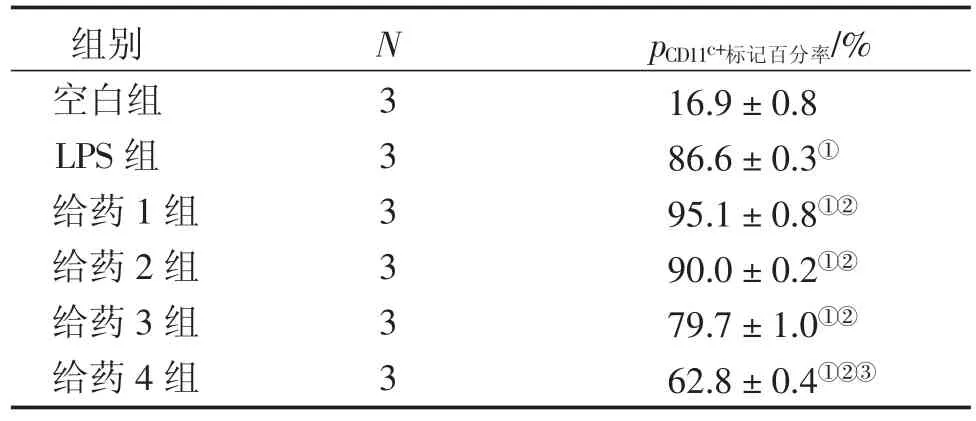
表3 各组对LPS诱导RAW264.7巨噬细胞CD11c+表达的影响比较Table 3 The percentage of CD11c+positive labeling in LPS-induced RAW264.7 macrophages of various groups (±s)
①P<0.05,与空白组比较;②P<0.05,与LPS组比较;③P<0.05,与给药3组比较
组别空白组LPS组给药1组给药2组给药3组给药4组N333333 pCD11c+标记百分率/% 16.9±0.8 86.6±0.3①95.1±0.8①②90.0±0.2①②79.7±1.0①②62.8±0.4①②③
3 讨论
动脉粥样硬化(AS)是一个复杂的代谢性心血管疾病,在针对其形成的研究中,提出了各种学说,如罗素发现动脉粥样硬化斑块内巨噬细胞的浸润,提出了动脉粥样硬化炎症学说、损伤应答学说以及德国病理学家威尔啸提出的脂质浸润学说[5]。在上述各种学说中,巨噬细胞的作用可以说是贯穿了动脉粥样硬化整个发生发展的过程中。巨噬细胞按照其表现和分泌的细胞因子可以分为2种极化类型,即经典活化的M1型和选择性活化的M2型巨噬细胞[6]。其中,M1型巨噬细胞在炎症的发生发展过程中通过分泌促炎性的细胞因子如肿瘤坏死因子-α等和趋化因子参与炎症进程,表现为促进炎症反应。而M2型巨噬细胞则通过分泌抑制性细胞因子如白细胞介素-10等下调免疫应答,表现为抑制炎症反应[7]。在AS进程中,M1型巨噬细胞主要存在于不稳定斑块中[8],CD11c+为其表面特异性标志物,可作为其M1极化的检测标志。
雌激素通过雌激素受体(ER)参与体内生理和病理相关过程,在AS进程中,雌激素可直接作用于内皮细胞、平滑肌细胞、血管外膜的成纤维细胞,对心血管系统有直接的保护作用。如雌激素可以通过非基因途径激活ERK1/2途径上调cyclin D1的表达促进内皮细胞增殖与修复[9];在血管平滑肌细胞则可通过膜雌激素受体激活ERK1/2信号通路而抑制平滑肌细胞的增殖,这一过程受caveeolin-1蛋白介导[10-12];雌激素还可以抑制球囊损伤术后血管外膜成纤维细胞的增殖[13-14]。但国外流行病学研究[15-16]结果显示:在50~59岁妇女中(对应中医中绝经期前)通过补充雌激素或具有雌激素效应的药物可以降低心肌梗死发病风险,但在70~79岁时(对应中医绝经期后),补充雌激素反而会增加心肌梗死的发病风险。所以说,雌激素的作用在女性动脉粥样硬化的进程中呈抛物线形作用。ICI172780是一种甾体类选择性雌激素受体调节剂,是ER的特异性拮抗剂,它通过ER降解而下调雌激素受体,影响ER二聚体化、干扰ER细胞核定位等方式减少与ER的结合。ERα和ERβ都对特异性拮抗剂ICI172780反应,ICI172780基本可以完全阻断雌激素的效应[17]。
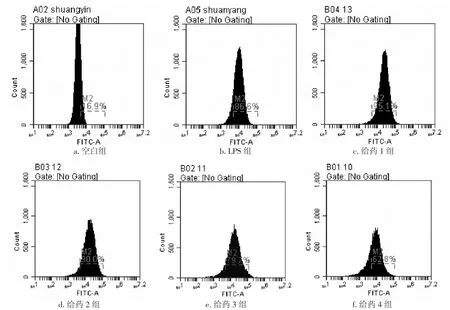
图2 各组经LPS诱导RAW264.7巨噬细胞CD11c+表达流式细胞图Figure 2 Flow cytometry results of CD11c+expression in LPS-induced RAW264.7 macrophages of various groups
本课题组发现临床上加味二至丸在防治更年期妇女动脉粥样硬化中有着较好的疗效,并通过卵巢切除更年期大鼠模型,以加味二至丸进行干预。预实验结果提示加味二至丸可以改善卵巢切除大鼠动脉管周脂肪收缩功能。因淫羊藿与女贞子为具有植物雌激素效应的中药,推测加味二至丸可能通过雌激素受体产生作用。本研究RAW264.7巨噬细胞活力检测结果显示:1.5 μmol/L淫羊藿苷+1.5 μmol/L齐墩果酸、3.0 μmol/L淫羊藿苷+ 3.0 μmol/L齐墩果酸对细胞生长增殖无任何毒性作用,可用于实验后续研究。Transwell小室迁移实验结果表明:在LPS刺激下巨噬细胞迁移数量明显增加,加入淫羊藿苷与齐墩果酸后,其效应反而是增加的,表明淫羊藿苷与齐墩果酸联合使用可促进巨噬细胞的迁移。此实验结果与预期不相符,推测原因可能是在体内与体外药物作用浓度不一致所导致的。但当雌激素受体拮抗剂ICI183780存在时,淫羊藿苷与齐墩果酸联合使用却能显著抑制巨噬细胞的迁移,提示淫羊藿苷与齐墩果酸联合使用在雌激素受体受到拮抗时发挥作用,而且随着浓度的增加抑制巨噬细胞迁移的能力逐渐增强。流式细胞术检测巨噬细胞M1极化实验结果表明:LPS可以诱导巨噬细胞向M1极化,且作用明显。加入淫羊藿苷与齐墩果酸后,M1极化的比例是增加的,表明淫羊藿苷与齐墩果酸联合使用可促进巨噬细胞向M1极化。但当雌激素受体拮抗剂ICI183780存在时,淫羊藿苷与齐墩果酸联合使用却能显著抑制巨噬细胞向M1极化,提示淫羊藿苷与齐墩果酸联合使用在雌激素受体受到拮抗时产生作用,并随浓度的增加作用增强。
2个实验的结果相符,共同证实雌激素受体在巨噬细胞的迁移和M1极化中有着重要的作用,而淫羊藿苷与齐墩果酸联合使用可能通过雌激素受体产生促进巨噬细胞迁移和向M1极化。而当雌激素受体拮抗剂ICI182780阻断了雌激素受体后,淫羊藿苷与齐墩果酸联用可以抑制RAW264.7巨噬细胞和M1极化。本研究结果提示加味二至丸在防治女性动脉粥样硬化中不仅是通过雌激素受体产生作用,还可通过其他途径产生作用,具体机制有待进一步研究。
参考文献:
[1]李梨,周岐新.淫羊藿苷药理作用研究进展[J].中国药房,2005,16(12):952.
[2]程晓芳,何明芳,张颖,等.女贞子化学成分的研究[J].中国药科大学学报,2000,31(3):169.
[3]李柄如,佘运初.补肾药对下丘脑垂体性腺轴功能的影响[J].中医杂志,1984,25(7):6365.
[4]赵澎,刘名彦,马惠珍.从含雌、雄激素类化合物的中药看中医的双向调节作用[J].北京中医学院学报,1988,11(6):4142.
[5]Ross R.Atherosclerosis--an inflammatory disease[J].N Engl J Med,1999,340(2):115.
[6]Gordon S.Alternative activation of macrophages[J].Nat Rev Immunol,2003,3(1):23.
[7]Van Ginderachter J A,Movahedi K,Hassanzadeh Ghassabeh G,et al.Classical and alternative activation of mononuclear phagocytes:picking the best of both worlds for tumor promotion [J].Immunobiology,2006,211(6-8):487.
[8]Stoger J L,Gijbels M J,vander Velden S,et al.Distribution of macrophage polarization markers in human atherosclerosis[J].Atherosclerosis,2013,225:461.
[9]Fu X D,Cui Y H,Lin G P,et al.Non-genomic effects of 17beta-estradiol in activation of the ERK1/ERK2 pathway induces cell proliferation through upregulation of cyclin D1 expression in bovine artery endothelial cells[J].Gynecol Endocrinol,2007,23(3):131
[10]刘海梅,赵晓峰,徐进文,等.17β-雌二醇对新生牛血清诱导的血管平滑肌细胞增殖反应的影响及其机制[J].汕头大学医学院学报,2009,22(2):75.
[11]Liu H M,Zhao X F,Guo L N,et al.Effects of caveolin-1 on the 17beta-estradiol-mediated inhibition of VSMC proliferation induced by vascular injury[J].Life Sci,2007,80(8):800.
[12]刘海梅,赵晓峰,林桂平,等.iNOS及ERK1/2信号转导通路在17β-雌二醇抑制血管平滑肌细胞增殖中的作用[J].心脏杂志,2009,21(6):761.
[13]胡飞雪,王庭槐.17β-雌二醇抑制碱性成纤维细胞生长因子诱导的血管外膜成纤维细胞增殖[J].中华老年心脑血管病杂志,2006,8(2):122.
[14]胡飞雪,王庭槐.17β-雌二醇抑制血管球囊损伤后血管外膜增殖[J].中华老年心脑血管病杂志,2005,7(5):337.
[15]Clarkson T B.Estrogen effects on arteries vary with stage of reproductive life and extent of subclinical atherosclerosis progression[J].Menopause,2007,14(3,Pt 1):373.
[16]Saren P,Welgus H G,Kovanen P T.TNF-alpha and IL-1beta selectively induce expression of 92 -kDa gelatinase by human macrophages[J].J Immunol,1996,157(9):4159.
[17]朱晓峰,张荣华.淫羊藿苷通过雌激素受体和p38MAPK信号诱导MC3T3-E1Subclone14细胞的分化[J].中国老年学杂志,2012,3(32):957.
【责任编辑:黄玲】
Effect of Combined Use of Icariin and Oleanolic Acid on Migration and M1 Polarization of RAW264.7 Macrophages
MING Kangwen1,HONG Chuangxiong2,JIANG Tao2,WANG Jian2
(1.Guangzhou Hospital of Traditional Chinese Medicine,Guangzhou 510301 Guangdong,China;
2.Guangzhou University of Chinese Medicine,Guangzhou 510405 Guangdong,China)
Abstract:Objective To investigate the effect of the combined use of icariin and oleanolic acid on the migrationand polarization of RAW264.7 macrophages,and to explore the role of estrogen receptor in the migration and polarization process.Methods The cultured RAW264.7 macrophages were randomized into blank control group,lipopolysaccharide(LPS)group(with a final concentration of 20 μg/L of LPS added),low-dose medication group (1.5 μmol/L of both icariin and oleanolic acid),high-dose medication group(3.0 μmol/L of both icariin and oleanolic acid),low-dose medication and ICI182780 group(estrogen receptor antagonist ICI182780 at final concentration of 1×10-3mmol/L+1.5 μmol/L of icariin and oleanolic acid),and high-dose medication and ICI182780 group(ICI182780 at final concentration of 1×10-3mmol/L + 3.0 μmol/L of both icariin and oleanolic acid).Transwell chamber culture was applied to observe the effect of combined use of icariin and oleanolic acid on the migration of macrophages induced by LPS.Flow cytometry was applied to observe the inhibitory effect of the combined use of icariin and oleanolic acid on M1 macrophage polarization induced by LPS,and ICI183780 was applied to observe the effect of estrogen receptor on the migration and polarization process.Results The result of Transwell chamber culture showed that LPS(20 μg/L)could significantly promote the migration of RAW264.7 macrophages.Compared with LPS group,LPS-induced RAW264.7 macrophage migration was obviously inhibited in low- and high-dose medication and ICI182780 groups(P<0.05),and inhibition of high-dose medication and ICI182780 group was superior to that of the low dose group(P<0.05).Flow cytometry results showed that CD11c +was highly expressed in LPS group(P<0.05 compared with the control group),indicating that 20 μg/L of LPS stimulated RAW264.7 macrophages and induced it to become M1 polarization.Compared with LPS group,low- and high-dose medication groups had synergistic action on LPS in inducing the M1 polarization of RAW264.7 macrophages(P<0.05).Compared with LPS group,low- and high-dose medication and ICI182780 groups had inhibitory effect on LPS-induced M1 polarization in RAW264.7 macrophages(P<0.05),and the effect of high-dose medication and ICI182780 group was superior to that of the low-dose group (P<0.05).Conclusion The combined use of icariin and oleanolic acid can promote the migration and M1 polarization of RAW264.7 macrophages probably mediated by estrogen receptors,and has the opposite effect when estrogen receptor is inhibited.
Key words:icariin;atherosclerosis/TCD therapy;oleanolic acid;macrophages/pathology;migration;polarization;estrogen receptors;cell culture
中图分类号:R285.5
文献标志码:A
文章编号:1007-3213(2016)03 - 0366 - 06
DOI:10.13359/j.cnki.gzxbtcm.2016.03.020
收稿日期:2015-10-23
作者简介:明康文(1976-),女,副主任中医师,硕士研究生导师;E-mail:mkw1976828@sina.com
基金项目:国家自然科学基金资助项目(编号:81373799);广东省自然科学基金资助项目(编号:S201201001040967)
