荔枝核有效部位群对实验性非酒精性脂肪肝的治疗作用及机制
2016-07-07黄玉影李常青陈斯泰黄志刚郭洁文李小翚屈喜玲
黄玉影,李常青,陈斯泰,黄志刚,郭洁文,李小翚,屈喜玲
(1.广州中医药大学中药学院,广东广州 510006;2.广州中医药大学热带医学研究所,广东广州 510405;3.惠州市九惠制药股份有限公司,广东惠州516007;4.广州市中医医院,广东广州510130)
荔枝核有效部位群对实验性非酒精性脂肪肝的治疗作用及机制
黄玉影1,李常青2,陈斯泰2,黄志刚3,郭洁文4,李小翚1,屈喜玲3
(1.广州中医药大学中药学院,广东广州510006;2.广州中医药大学热带医学研究所,广东广州510405;3.惠州市九惠制药股份有限公司,广东惠州516007;4.广州市中医医院,广东广州510130)
摘要:【目的】观察荔枝核有效部位群(SLEC)对大鼠非酒精性脂肪肝(NAFLD)的治疗作用,并探讨其作用机制。【方法】选用SPF级大鼠,雌雄各半,采用高脂饲料加高脂乳液灌胃8周复制NAFLD模型,造模成功后将造模组大鼠根据体质量和血糖值随机分为模型组、SLEC低剂量组(剂量为0.74 g·kg-1·d-1)、SLEC高剂量组(剂量为1.48 g·kg-1·d-1)和二甲双胍组(剂量为100 mg·kg-1·d-1),每组8只,雌雄各半,并设正常组为对照。给药4周后,腹主动脉采血、取肝组织。采用全自动生化分析仪检测血清甘油三酯(TG)、胆固醇(CHOL)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)、谷丙转氨酶(ALT)、谷草转氨酶(AST)、空腹血糖(FBG);采用比色法检测血清游离脂肪酸(NEFA)、放射免疫法检测血清胰岛素(Ins)含量,计算稳态模型胰岛素抵抗指数(HOMA-IR)、胰岛素敏感性指数(ISI);采用甘油磷酸氧化酶—过氧化物酶偶联(GPO-PAP)法、胆固醇氧化酶—过氧化物酶偶联(COD-PAP)法、水溶性四氮唑(WST-1)法、硫代巴比妥酸(TBA)法分别检测肝组织TG、CHOL、超氧化物歧化酶(SOD)和丙二醛(MDA)含量;观察大鼠肝脏组织病理变化,采用实时荧光定量PCR 和Western-blot法分别检测大鼠肝组织固醇调节元件结合蛋白-1c(SREBP-1c)mRNA和蛋白的表达。【结果】SLEC高剂量组能显著降低NAFLD大鼠血清TG、LDL-C、NEFA和肝脂质含量,提高大鼠血清SOD含量,明显改善大鼠HOMA-IR、提高ISI,与模型组比较差异均有统计学意义(P<0.05),且SLEC高剂量组改善肝细胞脂质沉积作用明显。与模型组比较,SLEC高、低剂量均能显著降低大鼠肝组织SREBP-1c mRNA及蛋白表达(P<0.05)。【结论】SLEC对NAFLD大鼠肝细胞脂质沉积的病理状况具有明显改善作用,作用机制与调节脂质代谢、降低NEFA水平,改善IR、抗氧化应激和下调SREBP-1c基因与蛋白表达有关。
关键词:荔枝核有效部位群/药理学;非酒精性脂肪肝/中药疗法;胰岛素抵抗;肝/病理学;基因表达调控;疾病模型,动物;大鼠
非酒精性脂肪性肝病(nonalcoholic fatty liver disease,NAFLD)是一种与胰岛素抵抗(insulin resistance,IR)有关、以弥漫性肝细胞脂肪变性为主要特征的临床病理综合征,与肝硬化和肝细胞癌的发生密切相关[1]。NAFLD在我国发病增长迅速,成人患病率在15%左右[1]。荔枝核系无患子科植物荔枝Litchi chinensis Sonn.的干燥成熟种子。研究表明荔枝核能提高胰岛素敏感性,调整高脂血症—脂肪肝所致的糖脂代谢紊乱[2-3]。总皂苷、黄酮和鞣质均是荔枝核发挥降糖调脂、改善IR作用的有效部位[4-6]。研究[7]显示,由荔枝核总皂苷、黄酮和鞣质组成的有效部位群(Semen Litchi effective constituents,SLEC),对3T3-L1脂肪细胞胰岛素抵抗具有显著的改善作用。本研究采用高脂饲料加高脂乳液建立的大鼠NAFLD-IR模型,进一步评价SLEC的药效作用,并探讨其作用机制,现报道如下。
1 材料与方法
1.1动物、饲料及高脂乳液SPF级SD大鼠90只,雌雄各半,体质量(200±20)g,由广东省医学实验动物中心提供,许可证号SCXK(粤)2013-0002。高脂饲料(质量分数):73.8%基础饲料、10%猪油、10%蛋黄粉、1%胆固醇、5%蔗糖、0.2%胆盐,由广东省医学实验动物中心提供,许可证号SCXK(粤)2013-0002。高脂乳液自制,每100 mL含猪油20 g、花生油30 g、胆固醇15 g、猪胆盐3 g、吐温-80 5 mL、丙二醇5 mL、双蒸水适量。基础鼠料:SPF级包装,由广州中医药大学实验动物中心提供。
1.2药物荔枝核药材购于广州市药材公司(批号:YPA3C001),经广东省生物制品与药物研究所钟世顺副主任药师鉴定为无患子科植物荔枝(Litchi chinensis Sonn.)的干燥成熟种子;荔枝核有效部位群提取方法参照文献[7],提取物为粉末,使用前用双蒸水配成混悬液(SLEC低剂量0.074 g/mL,SLEC高剂量0.148 g/mL);盐酸二甲双胍片(0.5 g/片,批号:1409082)由中美上海施贵宝制药有限公司生产,研磨后用双蒸水配成溶液(10 mg/mL)。
1.3主要试剂及仪器甘油三酯测试盒(批号:140761)、胆固醇测试盒(批号:141151)、谷丙转氨酶测试盒(批号:140611)和谷草转氨酶测试盒(批号:140561)均由中生北控生物科技有限公司生产;高密度脂蛋白胆固醇测试盒(批号:806RCL)和低密度脂蛋白胆固醇测试盒(批号:810RLK)均由日本积水株式会社生产;葡萄糖测试盒(批号:20141022)由上海科华生物工程股份有限公司生产;甘油三酯测试盒(用于测定肝脂质,批号:20150423)、胆固醇测试盒(用于测定肝脂质,批号:20150325)、游离脂肪酸测试盒(批号:20150326)、总超氧化物歧化酶测试盒(批号:20150407)、丙二醛测试盒(批号:20150324)和总蛋白定量测试盒(批号:20150407)均由南京建成生物工程研究所生产;碘[125I]胰岛素放射免疫分析盒(批号:20150502)由北京北方生物技术研究所生产;SYBR Green qPCR SuperMix(批号:C11744500)由美国Invitrogen公司生产;SREBP-1c兔多克隆一抗(批号:YT5508)由美国Immunoway公司生产,相应二抗Goat Anti-Rabbit IgG(H+L)、Mouse/Human ads-HRP(批号:4050-05)由美国Southern biotech公司生产;辣根过氧化物酶(HRP)标记的GAPDH内参(批号:KC-5G5)由上海康成生物工程有限公司生产;猪胆盐(批号:3202090)、胆固醇(批号:2102013)由广东环凯微生物科技有限公司生产;吐温-80、丙二醇均为食品级,购于广州东征化玻仪器有限公司;卓越金瑞血糖试纸(批号:473282)由德国罗氏诊断有限公司生产。AU5421全自动生化分析仪(日本Olympus光学株式会社);XDS-2倒置显微镜(中国广州光学仪器厂);ABIPRISMR7500 Sequence Detection System(美国ABI公司);EnSpireRMultimode Plate Reader 2000(美国Perkin Elmer公司);Accu-ChekRPerforma卓越型血糖仪(德国Roche公司)。
1.4造模方法[8]90只SPF级SD大鼠饲养于广州中医药大学实验动物中心,许可证号:SYXK(粤)2013-0001,适应性饲养7 d后根据体质量随机分为2组,正常对照组8只、造模组82只,每组雌雄各半,分笼饲养,每周称量体质量1次。正常对照组用基础鼠料喂养,造模组用高脂饲料喂养的同时,按以下顺序灌胃相应体积的高脂乳液:第1周2.5 mL/kg、第2周5.0 mL/kg、第3周7.5 mL/kg、第4~8周10 mL/kg,以50 mL/kg为上限。造模持续8周,2组均给予自由饮水及相应饮食。8周后,禁食不禁水16 h,用血糖仪测定大鼠尾部末端血糖后,立即灌以10 mL/kg的0.2 g/mL葡萄糖溶液,然后测定120 min时的血糖值,检测糖耐量。从造模组中随机抽取雌雄大鼠各1只,用0.2 g/L戊巴比妥钠以2.0 mL/kg腹腔注射麻醉,腹主动脉取血后观察肝脏病变情况确认造模成功[8]。
1.5动物分组及给药取造模组存在糖调节受损(空腹血糖≥6.1 mmol/L,或餐后2 h血糖≥7.8 mmol/L)[9]的32只大鼠,根据体质量和血糖值随机分成模型组、SLEC低剂量组(剂量为0.74 g·kg-1· d-)1、SLEC高剂量组(剂量为1.48 g·kg-1·d-1)和二甲双胍组(剂量为100 mg·kg-1·d-)1,每组8只,雌雄各半。正常组和模型组每日灌胃10 mL/kg双蒸水,其他组分别灌胃10 mL/kg的相应药物。全部大鼠给予普通鼠料和正常饮水。4周后,禁食不禁水16 h,用0.2 g/L戊巴比妥钠以2 mL/kg腹腔注射麻醉,用真空采血管从腹主动脉采血,取肝称质量,迅速切取肝组织放于冻存管、置于液氮中备用,切取肝右叶组织放于体积分数为10%的中性福尔马林中固定、送检,切取肝组织放于离心管中置-20℃冰箱备用。
1.6检测指标及方法
1.6.1血脂、血糖及肝功能采血后静置1 h,3 000 r/min离心10 min,采用全自动生化分析仪检测血清中的甘油三酯(TG)、胆固醇(CHOL)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)、空腹血糖(FBG)、谷丙转氨酶(ALT)和谷草转氨酶(AST)含量。
1.6.2血清胰岛素(Ins)含量采用放射免疫法测定,并用HOMA稳态模型计算胰岛素抵抗指数(HOMA-IR)、胰岛素敏感指数(ISI)。计算公式[8]:HOMA-IR = FBG×Ins/22.5,ISI = 1/(FBG×Ins)。
1.6.3血清游离脂肪酸(NEFA)含量采用比色法测定。
1.6.4肝脂质含量称取0.2 g肝组织,加入9倍体积的无水乙醇(分析纯),用电动匀浆器制成100 g/L肝匀浆,根据试剂盒说明书分别用甘油磷酸氧化酶—过氧化物酶偶联(GPO-PAP)法、胆固醇氧化酶—过氧化物酶偶联(COD-PAP)法测定100 g/L肝匀浆中TG、CHOL的含量。
1.6.5肝组织总超氧化物歧化酶(SOD)、丙二醛(MDA)含量称取0.2 g肝组织,加入9倍体积的生理盐水,用电动匀浆器制成100 g/L肝匀浆,根据试剂盒说明书分别用水溶性四氮唑(WST-1)法、硫代巴比妥酸(TBA)法测定100 g/L肝匀浆中的SOD、MDA含量。
1.6.6肝组织病理学取体积分数为10%的中性福尔马林固定后的肝组织,常规石蜡包埋、切片和苏木素—伊红(HE)染色,光镜下观察肝组织病理改变;取冷冻肝组织切片,油红O染色,光镜下观察肝脏脂肪病变情况。
1.6.7肝组织固醇调节元件结合蛋白-1c(SREBP-1c)mRNA及蛋白的表达各组随机抽取4只大鼠,取肝组织,分别用实时荧光定量PCR(qRT-PCR)法和蛋白质印迹法(Western-blot)检测SREBP-1c mRNA和蛋白的表达水平。
1.6.7.1 SREBP-1c mRNA检测引物由广州莱德尔生物科技有限公司合成。检测序列片段大小:内参片段β-actin 150 bp、目的片段SREBP-1c 184 bp。以Trizol法提取大鼠肝组织总RNA,Dnase I (Rnase Free)去除基因组DNA,分别测定260、280 nm处吸光度(D)值,并计算其比值,D260/D280比值均大于1.8。每样本取1 μL RNA进行逆转录反应(合成cDNA),按说明书操作步骤进行。以cDNA为模板的荧光定量PCR检测按20 μL体系,SREBP-1c样本引物序列:SREBP-1c-F:5’-GTAGAGCACATTCCCCAAGT-3’,SREBP-1c-R:5’-CAGTTGATGTAGAGGCTAAGCT-3’,β-actin-F:5’-AGGGAAATCGTGCGTGACAT-3’,β-actin-R:5’-GAACCGCTCATTGCCGATAG-3’,以18sr RNA为内参。反应体系内含cDNA模板5.0 μL,SYBR Green PCR Master Mix 10 μL,上、下游引物各0.5 μL,dH2O 4.0 μL;95℃预变性5 min,95℃变性15 s,60℃退火15 s,72℃延伸32 s,共40个循环。熔解曲线分析:温度60℃~95℃。利用ABI公司自带的PCR系统软件分析,观察扩增曲线,计算样本归一化的每个反应管内荧光信号到达设定的域值时所经历的循环数(Ct值)、目的基因Ct值与内参Ct值之差△Ct、各组△Ct与正常对照组△Ct之差得△△Ct,以△△Ct值的负数为指数计算2-△△Ct,并进行比较。
1.6.7.2 SREBP-1c蛋白表达检测采用无线电免疫沉淀法(RIPA)裂解液裂解大鼠肝组织,提取各组蛋白;二喹啉甲酸(BCA)法进行蛋白定量,按照总蛋白浓度一致进行聚丙烯酰胺凝胶(SDSPAGE)电泳,用湿转方法转至聚偏二氟乙烯(PVDF)膜上;以50 g/L的脱脂奶粉室温闭液1 h,分别加入一抗(SREBP-1c兔多抗,稀释倍数1∶500),4℃孵育过夜;加辣根过氧化物酶(HRP)标记的二抗羊抗兔多抗(Goat Anti-Rabbit IgG,稀释倍数1∶20 000),室温1 h;彻底洗膜后进行化学发光,最后进行显影、定影。使用IPWIN60图像分析软件对条带灰度进行分析,计算目的蛋白与内参GAPDH条带灰度的比值(p)作为SREBP-1C蛋白表达的相对值。
1.7统计方法采用SPSS 10.0对各实验组数据进行单因素方差分析,方差齐时采用LSD法检验,方差不齐时进行个案排秩后再使用LSD检验法分析。各组数据均以均数±标准差(±s)表示。以P<0.05为差异有统计学意义。
2 结果
2.1大鼠一般情况的观察正常组大鼠毛发整洁光泽,行动灵活,饮食饮水正常,排泄物正常,体质量持续稳定增长。造模组大鼠毛发稍欠整洁光泽,较不喜活动,饮食饮水正常,排泄物油腻,体质量增长比正常组多。雌鼠较雄鼠饮食饮水量少且活泼好动。更换饲料及撤除高脂乳液灌胃后给药期间,模型组及各给药组大鼠毛发较造模期间整洁、活动稍增多,各给药组大鼠排泄物较正常。
2.2造模8周后大鼠情况造模8周后,随机抽取的造模组大鼠肝脏表面呈油腻黄色状,各肝叶边缘较钝,肝脏脂质沉积明显,显示脂肪肝模型已建立。大鼠尾部末梢血糖检测结果显示:正常组大鼠空腹血糖为(5.19±0.46)mmol/L(极小值为4.6,极大值为5.8),餐后2 h血糖为(5.81±0.80)mmol/L(极小值为4.4,极大值为6.8)。造模组共有32只大鼠空腹血糖≥6.1 mmol/L或/和2 h血糖≥7.8 mmol/L,为造模组大鼠总数的39%。结果表明32只大鼠存在较明显的糖调节受损,此为胰岛素抵抗表现之一,提示NAFLD-IR大鼠模型成立。
2.3各组大鼠血脂、血清NEFA含量比较表1结果显示:与正常组比较,模型组大鼠血清TG、LDL-C、NEFA水平均显著升高(P<0.05);与模型组比较,SLEC高剂量组血清TG、LDL-C、NEFA水平均显著降低(P<0.05)。
表1 各组大鼠血脂、血清NEFA的比较Table 1 Comparison of blood lipids and serum NEFA level of rats in different groups (±s)

表1 各组大鼠血脂、血清NEFA的比较Table 1 Comparison of blood lipids and serum NEFA level of rats in different groups (±s)
①P<0.05,与正常组比较;②P<0.05,与模型组比较
组别正常组模型组SLEC高剂量组SLEC低剂量组二甲双胍组N88888 cTG/(mmol·L-1)0.61±0.16 0.92±0.33①0.47±0.14②0.88±0.44 0.71±0.11 cCHOL/(mmol·L-1)1.54±0.27 1.78±0.39 1.61±0.53 1.66±0.27 1.55±0.50 cLDL-C/(mmol·L-1)0.18±0.03 0.26±0.10①0.18±0.03②0.22±0.04 0.18±0.02②cHDL-C/(mmol·L-1)0.62±0.11 0.58±0.10 0.55±0.10 0.55±0.14 0.51±0.11 cNEFA/(μmol·L-1)423.29±45.65 570.91±81.92①487.43±53.32②504.25±81.40 489.27±67.26②
2.4各组大鼠肝功能比较表2结果显示:与正常组比较,模型组大鼠ALT、AST含量差异均无统计学意义(P>0.05),说明造模大鼠没有肝损伤发生。与模型组比较,SLEC高、低剂量组ALT、AST含量差异均无统计学意义(P>0.05)。
2.5各组大鼠胰岛素抵抗程度比较表3结果显示:与正常组比较,模型组大鼠HOMA-IR显著升高(P<0.05),ISI显著降低(P<0.05),提示模型组大鼠存在明显的胰岛素抵抗和胰岛素敏感性降低。与模型组比较,SLEC高、低剂量组大鼠HOMAIR均显著降低(P<0.05),SLEC高剂量组ISI显著升高(P<0.05),提示SLEC高剂量组具有明显的改善胰岛素抵抗和提高胰岛素敏感性作用。
2.6各组大鼠肝脂质及肝脏氧化应激程度比较
表4结果显示:与正常组比较,模型组大鼠肝组织中TG、CHOL含量均显著升高(P<0.05);与模型组比较,SLEC高剂量组大鼠肝组织中的TG含量显著降低(P<0.05)。与正常组比较,模型组大鼠肝组织的SOD含量显著降低(P<0.05);与模型组比较,SLEC高剂量组SOD含量显著升高(P<0.05)。各组大鼠的MDA含量比较差异均无统计学意义(P>0.05)。
表2 各组大鼠肝功能的比较Table 2 Comparison of liver function of rats in different groups [±s,J/(U·L-1)]

表2 各组大鼠肝功能的比较Table 2 Comparison of liver function of rats in different groups [±s,J/(U·L-1)]
①P<0.05,与正常组比较;②P<0.05,与模型组比较
组别正常组模型组SLEC高剂量组SLEC低剂量组二甲双胍组N88888 ALT 24.88±4.16 28.88±5.87 24.12±5.51 28.00±8.04 22.38±6.84 AST 165.70±21.95 168.12±15.28 146.88±17.54 159.25±28.35 112.62±21.65①②
表3 各组大鼠胰岛素抵抗程度的比较Table 3 Comparison of insulin resistance of rats in different groups (±s)
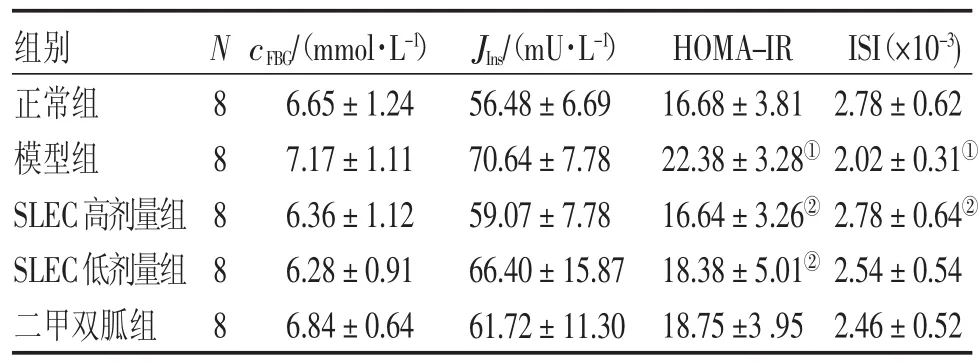
表3 各组大鼠胰岛素抵抗程度的比较Table 3 Comparison of insulin resistance of rats in different groups (±s)
①P<0.05,与正常组比较;②P<0.05,与模型组比较
组别正常组模型组SLEC高剂量组SLEC低剂量组二甲双胍组N88888 cFBG/(mmol·L-1)6.65±1.24 7.17±1.11 6.36±1.12 6.28±0.91 6.84±0.64 JIns/(mU·L-1)56.48±6.69 70.64±7.78 59.07±7.78 66.40±15.87 61.72±11.30 HOMA-IR 16.68±3.81 22.38±3.28①16.64±3.26②18.38±5.01②18.75±3 .95 ISI(×10-3)2.78±0.62 2.02±0.31①2.78±0.64②2.54±0.54 2.46±0.52
表4 各组大鼠肝脂质及氧化应激程度的比较Table 4 Comparison of liver lipids and oxidative stress of rats in different groups (±s)
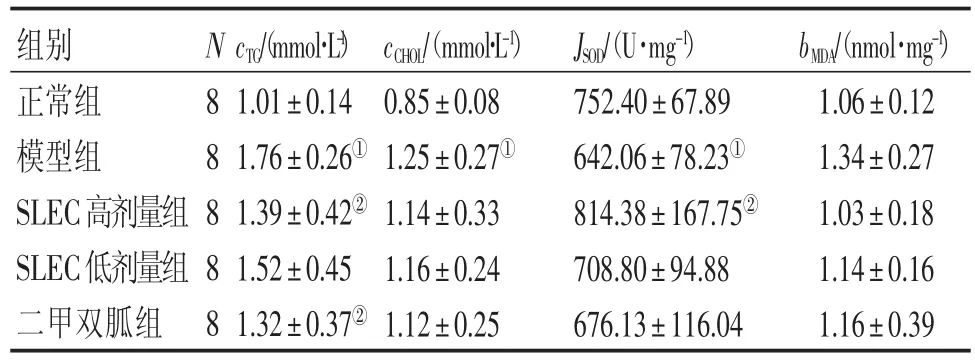
表4 各组大鼠肝脂质及氧化应激程度的比较Table 4 Comparison of liver lipids and oxidative stress of rats in different groups (±s)
①P<0.05,与正常组比较;②P<0.05,与模型组比较
组别正常组模型组SLEC高剂量组SLEC低剂量组二甲双胍组N88888 cTG/(mmol·L-1)1.01±0.14 1.76±0.26①1.39±0.42②1.52±0.45 1.32±0.37②cCHOL/(mmol·L-1)0.85±0.08 1.25±0.27①1.14±0.33 1.16±0.24 1.12±0.25 JSOD/(U·mg-1)752.40±67.89 642.06±78.23①814.38±167.75②708.80±94.88 676.13±116.04 bMDA/(nmol·mg-1)1.06±0.12 1.34±0.27 1.03±0.18 1.14±0.16 1.16±0.39
2.7各组大鼠肝组织切片HE染色及油红O染色病理观察图1结果显示:正常组大鼠肝细胞大小相仿、形态相似、细胞核清晰且位于细胞中央;模型组大鼠肝细胞内弥漫性脂肪变性明显,细胞大小不均,脂肪变性使细胞核移位;各给药组脂肪变性显著减少,细胞形态较均匀。图2结果显示:正常组大鼠肝细胞未见明显红色脂泡出现;模型组大鼠肝细胞内红色脂泡广泛分布,说明细胞内存在大量脂质;各给药组肝细胞内红色脂泡均显著减少,表明SLEC能在一定程度上改善肝脂质沉积的病理状态。

图1 各组大鼠肝脏组织病理状态比较(HE染色,×250)Figure 1 Comparison of liver pathologic feature of rats in different groups(by HE staining,×250)

图2 各组大鼠肝脏组织病理变化比较(油红O染色,×250)Figure 2 Comparison of liver pathologic feature of rats in different groups(by Oil Red O staining,×250)
2.8各组大鼠肝组织SREBP-1c mRNA及蛋白的表达比较表5、图3结果显示:与正常组大鼠比较,模型组大鼠肝组织的SREBP-1c mRNA及蛋白的表达量均显著升高(P<0.05);与模型组比较,SLEC高、低剂量组大鼠肝组织的SREBP-1c mRNA及蛋白的表达量均显著降低(P<0.05)。
3 讨论
研究表明:几乎所有的NAFLD患者都存在肝脏和周围组织的胰岛素抵抗(insulin resistance,IR)[10]。NAFLD病理机制主要是指肥胖、高脂血症等因素导致IR产生及肝细胞脂肪变性[1]。NAFLD患者由于存在IR,肝脏和脂肪组织等胰岛素敏感性降低使脂肪分解增加,血中NEFA含量增加,进而导致肝脏NEFA摄取增加,肝内TG从头合成增加,导致了TG在肝脏的聚积[11]。
表5 各组大鼠肝组织SREBP-1c mRNA及蛋白相对表达量的比较Table 5 Comparison of relative expression values of SREBP-1c mRNA and protein in rats of different groups (±s)

表5 各组大鼠肝组织SREBP-1c mRNA及蛋白相对表达量的比较Table 5 Comparison of relative expression values of SREBP-1c mRNA and protein in rats of different groups (±s)
组别正常组模型组SLEC高剂量组SLEC低剂量组二甲双胍组N44444 1.31±0.79 4.69±3.00①1.66±1.40②1.92±1.55②0.88±0.65②p 0.120±0.002 0.240±0.002①0.058±0.002②0.225±0.002②0.169±0.004②n2-ΔΔCt
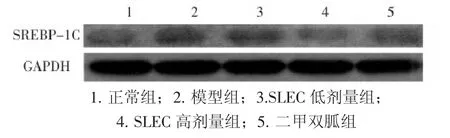
图3 各组大鼠SREBP-1c蛋白表达凝胶电泳图Figure 3 Gel electrophoresis results of SREBP-1c protein expression of rats in different groups
随着肝脏摄取NEFA的增多,肝细胞发生脂肪变性后产生过量的活性氧簇(reactive oxygen species,ROS),超出机体抗氧化系统清除能力,导致氧化应激(oxidative stress,OS)及过氧化产物产生[12]。氧化应激可以进一步诱发内质网应激(endoplasmic reticulum stress,ERS)反应,它可以启动固醇调节级联反应,激活固醇调节元件结合蛋白(sterolregulatory element binding proteins,SREBPs),使SREBPs与SREBPs裂解激活蛋白形成复合物后经酶解作用成为转录因子,进入细胞核与脂肪酸、胆固醇等靶向因子结合,使脂肪酸合成大量增加,造成肝细胞脂肪代谢紊乱[12]。
SREBP-1c属于SREBPs家族成员,对脂肪合成酶的编码基因表达具有正向调控作用,其表达升高可导致肝细胞的脂肪酸合成增加[13-15]。SREBP-1c还可通过抑制极低密度脂蛋白(VLDL)的组装使肝脏TG排出减少造成脂质聚积。因此,SREBP-1c是机体脂质代谢中的关键调控靶点[16]。
荔枝核性味甘、温,微苦涩,入肝肾,具有温中、理气、止痛的功效。研究显示荔枝改善糖脂质代谢和逆转IR作用明显,荔枝核有效部位群含皂苷、黄酮和鞣质,是荔枝核发挥调脂降糖活性的主要有效部位[2,4,7]。
本研究结果显示:模型组大鼠血清TG、LDLC、NEFA含量及肝脂质含量较正常组均显著升高(P<0.05);病理组织观察显示肝细胞脂肪变性明显,且模型组大鼠HOMA-IR显著升高(P<0.05)、ISI显著降低(P<0.05),表明高脂饲料喂养加高脂乳液灌胃建立的NAFLD-IR大鼠模型成立,但模型组大鼠血清ALT和AST含量均在正常范围,且与正常组比较差异均无统计学意义(P>0.05),表明造模大鼠主要以肝脏脂质沉积为主,没有明显的非酒精性脂肪肝炎(nonalcoholic steatohepatitis,NASH)发生。经SLEC治疗后,SLEC高剂量组能显著降低NAFLD-IR大鼠血清TG、LDL-C、NEFA水平,减轻肝脂质沉积,降低HOMA-IR、提高ISI以及血清SOD含量,且SLEC高、低剂量组SREBP-1c mRNA及蛋白相对表达水平均显著低于模型组(P<0.05),提示SLEC抗NAFLD脂质沉积的作用机制,与调节脂质代谢、降低NEFA水平,改善IR、抗氧化应激和下调SREBP-1c基因与蛋白表达有关。
参考文献:
[1]中华医学会肝病学分会脂肪肝和酒精性肝病学组.非酒精性脂肪性肝病诊疗指南(2010年修订版)[J].胃肠病学和肝病学杂志,2010,19(6):483.
[2]张巍,甘宏发,马若兰,等.荔枝核提取物对非酒精性脂肪性肝炎大鼠肝功能的保护作用[J].实用肝脏病杂志,2011,3:167.
[3]徐婷,吴青,高骏伟.荔枝核提取物及其阳离子树脂分离物体外降血糖作用[J].食品与机械,2012(4):113.
[4]郭洁文,李丽明,潘竞锵,等.荔枝核拮抗2型糖尿病大鼠胰岛素抵抗的药理学机制[J].中药材,2004,27(6):435.
[5]姜振国,任珅,林喆,等.荔枝核降血糖有效部位的研究(一)[J].长春中医药大学学报,2011,27(1):14.
[6]钟世顺,郭洁文,陈剑梅,等.荔枝核鞣质类型分析及提取方法[J].今日药学,2011,21(11):672.
[7]廖向彬,李常青,李小翚,等.荔枝核有效部位群改善3T3-L1脂肪细胞胰岛素抵抗作用及机制[J].中药材,2014,37(7):1247.
[8]杨道炬,李常青,廖向彬,等.消脂汤对非酒精性脂肪性肝病模型大鼠治疗的作用及机制[J].中国实验方剂学杂志,2014,18:159.
[9]陈妍,刘建国,徐磊,等.空腹血糖、餐后2h血糖及糖化血红蛋白对糖尿病的诊断价值[J].郑州大学学报(医学版),2012,47(4):534.
[10]Marchesini G,Brizi M,Bianchi G,et al.Nonalcoholic fattey liver disease:a feature of the metabolic syndrome[J].Dia Betes,2001,50(8):1844.
[11]廖海林,肖新华.甘油三酯在非酒精性脂肪肝沉积的机制研究进展[J].临床与病理杂志,2014(6):831.
[12]林秋香,周冬生,梁志清.氧化应激与非酒精性脂肪肝病的研究进展[J].热带医学杂志,2013(5):657.
[13]Shimano H .Sterol regulatory element - binding proteins (SREBPs):transcriptional regulators of lipid synthetic genes [J].Prog Lipid Res,2001,40:439.
[14]Horton J D,Goldstein J L,Brown M S.SREBPs:activators of the complete program of cholesterol and fatty acid synthesis in the liver[J].J Clin Invest,2002,109:1125.
[15]Kohjima M,Higuchi N,Kato M,et al.SREBP-1C,regulated by the insulin and AMPK signaling pathways,plays a role in nonalcoholic fatty liver disease[J].Int J Mol Med,2008,21 (4):507.
[16]Li X,Li Y,Yang W,et al.SREBP-1c overexpression induces triglycerides accumulation through increasing lipid synthesis and decreasing lipid oxidation and VLDL assembly in bovine hepatocytes[J].J Steroid Biochem Mol Biol,2014,143:174.
【责任编辑:黄玲】
Therapeutic Effect of Semen Litchi Effective Constituents for Nonalcoholic Fatty Liver Disease in Rats and Its Mechanism
HUANG Yuying1,LI Changqing2,CHEN Sitai2,HUANG Zhigang3,GUO Jiewen4,LI Xiaohui1,QU Xiling3
(1.School of Chinese Herbal Medicine,Guangzhou University of Chinese Medicine,Guangzhou 510006 Guangdong,China;2.Tropical Medicine Institute,Guangzhou University of Chinese Medicine,Guangzhou 510405 Guangdong,China;3.Huizhou Jiuhui Pharmaceutical Co.,Ltd,Huizhou 516007 Guangdong,China;4.Guangzhou Hospital of Traditional Chinese Medicine,Guangzhou 510130 Guangdong,China)
Abstract:Objective To observe the therapeutic effect of Semen Litchi effective constituents(SLEC)for rats with nonalcoholic fatty liver disease(NAFLD)and to explore its mechanism.Methods SPF rats,male in half,were fed with high fat diet for 8 weeks to induce NAFLD model.And then the modeled rats were randomly divided into 4 groups according to body mass and blood glucose level,namely model group,low-dose SLEC group (0.74 g·kg-1·d-1),high-dose LSEC group(1.48 g·kg-1·d-1),and metformin group(100 mg·kg-1·d-1),8 rats in each group,male in half.A normal group was also set up.After medication for 4 weeks,blood was sampled from the abdominal aorta,and liver tissues were taken out for the test.The serum levels of triglyceride(TG),cholesterol(CHOL),high- density lipoprotein cholesterol(HDL-C),low- density lipoprotein cholesterol(LDL-C),alanine aminotransferase(ALT),aspartase aminotransferase(AST)and fasting blood-glucose(FBG)were detected by automatic biochemical analyzer.Serum content of non-esterified fatty acid(NEFA)was detected by colorimetry,and serum insulin content was detected by radioimmunoassay(RIA).Homeostasis model of assessment for insulin resistence index(HOMA-IR)and insulin sensitivity index(ISI)were calculated.The content of TG,CHOL,superoxide dismutase(SOD),malondialdehyde(MDA)in liver tissues were detected respectively by glycerol phosphate oxidase-peroxidase(GPO-PAP),cholesterol oxidase - peroxidase(COD-PAP),water-soluble tetrazolium(WST-1),thiobarbituric acid(TBA)methods.Pathological changes of liver tissues were observed.The sterol-regulatory element binding protein-1c(SREBP-1c)mRNA expression level in liver tissues was detected by reverse transcription polymerase chain reaction(RT-PCR),and the hepatic SREBP-1c protein expression was detected by Western blot.Results Compared with the model group,TG,LDL-C,NEFA and liver lipids contents in high-dose SLEC group were decreased,SOD was increased,HOMA-IR was improved,and ISI was enhanced,the difference being significant(P<0.05),and the degree of hepatic steatosis was alleviated obviously,too.Compared with the model group,the mRNA and protein expression levels of SREBP-1c in high- and low-dose SLEC groups were obviously down-regulated(P<0.05).Conclusion SLEC show obvious therapeutic effect on hepatic steatosis in NAFLD rats,which might be related to regulating lipid metabolism,decreasing NEFA level,improving IR and oxidative stress,and down -regulating SREBP -1c mRNA and protein expression.
Key words:Semen Litchi effective constituents/pharmacology;non-alcoholic fatty liver disease/TCD therapy;insulin resistance;liver/pathology;gene expression regulation;disease models,animal;rats
中图分类号:R285.5
文献标志码:A
文章编号:1007-3213(2016)03 - 0346 - 07
DOI:10.13359/j.cnki.gzxbtcm.2016.03.016
收稿日期:2015-09-03
作者简介:黄玉影(1991-),女,硕士研究生;E-mail:Cheryl-hyy@qq.com
通讯作者:李小翚,女,副教授;E-mail:546647632@qq.com
基金项目:广东省重大科技专项(编号:2012A080202010);广东省自然科学基金资助项目(编号:S2013010012998);广州市科技计划应用研究基础专项(编号:2013J4100088);广东省中医药局基金项目(编号:20122004)
