颌骨骨髓基质细胞对牙周膜细胞生物学特性的影响
2016-07-07金振宇刘宏伟
金振宇, 刘宏伟
(同济大学口腔医学院,上海 200072)
·基础研究·
颌骨骨髓基质细胞对牙周膜细胞生物学特性的影响
金振宇, 刘宏伟
(同济大学口腔医学院,上海 200072)
目的 观察间接共培养犬颌骨骨髓基质细胞(canine maxillary bone marrow stromal cells, cM-BMSCs)对犬牙周膜细胞(canine periodontal ligament cells, cPDLCs)生物学特性的影响。方法 原代培养犬颌骨骨髓基质细胞和犬牙周膜细胞。MTT法检测犬牙周膜细胞增殖速率;利用Transwell结构建立犬颌骨骨髓基质细胞与犬牙周膜细胞共培养体系;qPCR法检测犬牙周膜细胞矿化相关基因核心结合因子2(Runx2)、碱性磷酸酶(ALP)、骨钙素(OCN)的变化;Western印迹法检测Runx2和OCN蛋白的表达变化。构建牙片/细胞膜片复合体植入裸鼠皮下。结果 两种细胞体外均贴壁生长,呈纺锤状外形;颌骨骨髓基质细胞间接共培养下对牙周膜细胞增殖有抑制作用;共培养组牙周膜细胞ALP活性高于对照组;qPCR和Western印迹法均能检测到牙周膜细胞Runx2、OCN的表达,共培养组牙周膜细胞的Runx2和OCN的表达均高于对照组。经过颌骨骨髓基质细胞条件培养液诱导后的牙周膜细胞与牙本质片复合形成了排列更加有序的牙周膜/牙骨质样结构,单纯的牙周膜细胞膜片不能新生类似的牙周组织复合结构。结论 犬颌骨骨髓基质细胞间接共培养情况下可能会限制牙周膜细胞的增殖,促进牙周膜细胞向成骨样细胞分化。
颌骨骨髓基质细胞; 牙周膜细胞; 共培养; 条件培养液
牙周炎作为厌氧菌为主的慢性感染性疾病,是成人牙齿脱落的主要原因。牙周治疗的理想目的是实现牙槽骨、牙骨质和牙周膜再生。基础治疗和引导组织再生术配合药物使用暂不能实现该目的。目前牙周再生主要集中在联合使用高效的生长因子、具有多向分化潜能的种子细胞和体内可吸收无免疫排斥的材料上。选择理想种子细胞是牙周组织完整再生的关键。牙周膜细胞和颌骨骨髓基质细胞是构成牙周组织的两种重要的细胞[1]。牙周膜细胞因部位的不同而存在生物特性差异。牙骨质附着的牙周膜细胞成骨分化潜能弱于牙槽骨表面的牙周膜细胞[2]。本实验通过建立犬牙周膜细胞(canine periodontal ligamentcells, cPDLCs)与犬颌骨骨髓基质细胞(canine maxillary bone marrow stromal cells, cM-BMSCs)间接共培养系统,探讨犬颌骨骨髓基质细胞对牙周膜细胞诱导分化的影响,为深入分析在颌骨微环境中,牙周膜细胞的生物学行为以及分化奠定基础。
1 材料与方法
1.1 实验动物和材料
12月龄雄性Beagle犬2只,体质量约12kg,购自第二军医大学动物研究中心。改良型ɑ-MEM培养基、提取RNA试剂TRIzol Reagent购自美国Invitrogen公司;0.25%胰蛋白酶、胎牛血清购自美国HyClone公司;Transwell培养器(0.4μm孔径)购自美国Millipore公司;SABC试剂盒购自武汉博士德生物工程有限公司;反转录试剂盒、PCR试剂盒购自日本TaKaRa公司;SDS-PAGE凝胶配制试剂盒购自上海威奥生物科技有限公司;5×蛋白上样缓冲液、RIPA蛋白裂解液购自江苏碧云天生物科技有限公司;蛋白Marker购自美国Thermo公司;兔抗Runx2多克隆抗体(bs-0026R)购自北京博奥森生物技术有限公司;抗波形丝蛋白抗体(sc-3737117)购自美国Santa Cruz公司;鼠抗OCN多克隆抗体(ab-13418)购自英国Abcam公司;GAPDH小鼠单克隆抗体(SAM1003)购自南京生兴生物公司;羊抗鼠IgG(GMI01)购自杭州启泰生物技术有限公司;羊抗兔IgG(ZB-2301)购自北京中杉金桥技术有限公司;离心管购自美国Corning公司;各型号培养板购自美国Costar公司;其他试剂均为国产分析纯。
超净工作台购自Forma Scientific公司;Odyssey双色红外荧光成像系统、照相系统购自日本Nikon公司;Mastercycler Personal PCR仪购自德国Eppendorf公司;Coic倒置相差显微镜购自重庆光电设备厂;实时荧光定量PCR仪(Rotor Gene 3000)购自澳大利亚Corbett公司;分光光度计购自英国Amersham bioscience公司;SDS-PAGE电泳仪和转膜仪购自美国Bio-Rad公司。
1.2 方法
1.2.1 犬牙周膜细胞的分离培养 选取1岁雄性比格犬,以3%戊巴比妥静脉注射,行全身麻醉,无菌条件下拔除上前磨牙。剥离根中1/3牙周膜软组织,剪碎成约1.0mm3小块,平铺于胎牛血清预处理的培养瓶底。加入完全培养液4.5ml,放入细胞培养孵箱。在37℃、5%CO2、100%湿度条件的孵箱中培养,倒置显微镜下观察细胞爬出情况[3]。当增殖后密度约占瓶底80%时,含EDTA胰酶消化,1∶2或1∶3传代(取决于细胞数量)。取3~4代细胞进行实验。制备细胞爬片,波形丝蛋白抗体行免疫染色鉴定。
1.2.2 犬颌骨骨髓基质细胞原代培养 犬上颌骨前磨牙区(前磨牙已于3个月前拔除,拔牙区软组织完全愈合)切开黏膜、剥离全厚粘骨膜瓣、露出骨面,种植机结合取骨钻(直径3.5mm)钻取骨松质块[4]。无菌生理盐水反复冲洗8~10次,组织研磨器磨碎松质骨块,接种于血清预处理的六孔板中,于 37℃、5%CO2、100%湿度条件的细胞培养箱中静置。3d后换50%培养液,5d后换全部培养液。当细胞铺满瓶底约80%时,用质量分数0.25%的胰酶消化,1∶2传代。第3~4代细胞用于实验。
1.2.3 实验分组 (1) 对照组: 单独培养cPDLCs;(2) 实验组: Transwell共培养组: 先接种cM-BMSCs于六孔板中,待细胞融合至70%时,按MilliporeTranswell的操作步骤,放入Transwell小室,培养液能交换互通,但内外细胞不能直接接触,小室中为融合度70%的贴壁cPDLCs(图1)。
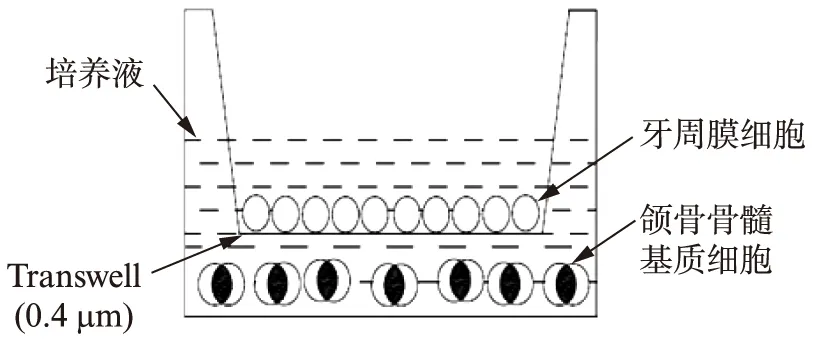
图1 细胞共培养模型Fig.1 Model of cells, co-culture system
1.2.4 犬颌骨骨髓基质细胞条件培养液的制备 第三代犬颌骨骨髓基质细胞传代于T25细胞培养瓶中。待细胞铺满约85%瓶底后,弃去含血清培养基,PBS洗2遍,更换成无血清ɑ-MEM培养液4.5ml。24h后收集上清液,离心半径30cm,2500r/min,离心5min,上清液即为颌骨骨髓基质细胞条件培养液(cM-BMSCs-CM),-20℃保存备用。
1.2.5 MTT检测 犬牙周膜细胞分实验组、对照组,分别接种于96孔板中,每孔植入约2000个细胞,两组细胞贴壁后更换培养液,记为第1天。对照组、实验组加含10%血清的培养基200μl,处理组取cM-BMSCs-CM与含20%FBS的培养液1∶1混合,加200μl于孔中,连续培养7d。每日取各3孔两组细胞,加20μl MTT试剂(5g/L),避光孵育4h,去上清液,各孔加DMSO 150μl,摇床避光振荡 10min,酶标仪在490nm波长下读取各孔D490值,取均数以时间为横轴、光度值为纵轴记录生长曲线。
1.2.6 qPCR检测犬牙周膜细胞Runx2和ALP、OCN的mRNA表达 细胞总RNA的提取和反转录: 2个六孔板的Transwell小室的牙周膜细胞为一组。用TRIzol裂解细胞提取总RNA,紫外吸收法测定RNA纯度和浓度。500ng RNA用随机引物Oligo(dT)12-18行反转录。依照qPCR试剂盒说明,加入引物序列,使用实时qPCR仪进行反应,合成所需的目的基因(表1)。
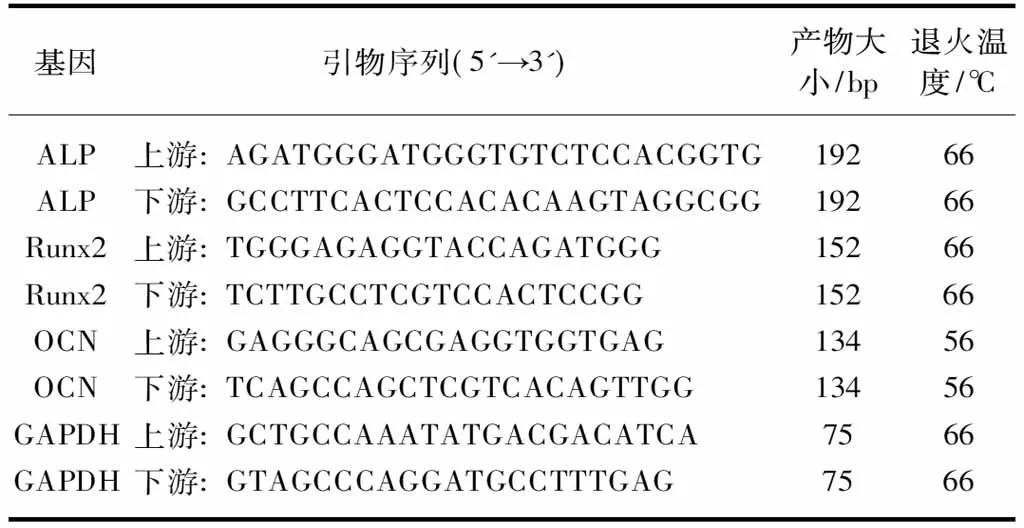
表1 qPCR引物序列
1.2.7 Western印迹法检测犬牙周膜细胞Runx2和OCN蛋白表达 采用RIPA法提取细胞蛋白,依BCA法检测蛋白浓度并统一上样蛋白量,15%分离胶和5%浓缩胶行SDS-PAGE凝胶电泳、转至PVDF膜、放入BSA封闭液中摇床上封闭2h,一抗孵育过夜,二抗孵育2h,行化学发光反应。分析犬牙周膜细胞OPN和Runx2蛋白表达情况。
1.2.8 牙片/细胞膜片复合体的构建与裸鼠植入 cPDLCs膜片形成后,细胞刮刮起膜片小心包裹牙本质片3层[5],形成牙本质片/膜片复合体,植入裸鼠皮下,每只左右各植入一移植物,共6只裸鼠。术后7周取样,4℃多聚甲醛固定,脱钙包埋切片,H-E染色。(1) 实验组: 颌骨骨髓基质细胞条件培养液诱导的牙周膜细胞膜片+牙本质片;(2) 对照组,单纯牙周膜细胞膜片+牙本质片。
1.3 统计学处理
应用软件SPSS 17.0行数据统计分析,组间样本比较用独立样本t检验。P<0.05为差异有统计学意义。
2 结 果
2.1 倒置显微镜观察结果
实验中组织块法培养cPDLCs,接种后6h组织块贴壁,培养第6天可见贴壁组织块周缘少量原代细胞陆续游出,随着时间延续,细胞围绕组织块呈放射状生长,细胞逐渐密集。15~20d后,部分区域融合度达到70%,可消化传代记为P1。传代后细胞呈长梭形,成纤维细胞样外形(图2A),生长旺盛。取第3代犬牙周膜细胞参照SABC免疫组化检测抗波形蛋白阳性,确认培养细胞是源于中胚层的成纤维样细胞(图2B)。
2.2 犬颌骨骨髓基质细胞
翻开全厚瓣,暴露犬上颌骨骨面,取骨环钻钻取骨松质块,5d后贴壁骨块周缘有细胞移出。5d后换液。当细胞爬满瓶底约75%时,胰酶消化,1∶3传代。取第2~3代细胞(图3)行体外试验。
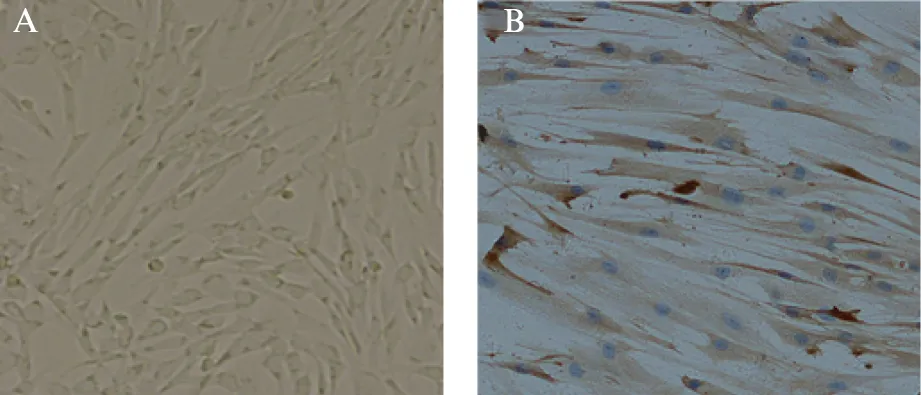
图2 犬牙周膜细胞形态与染色Fig.2 Morphology of canine periodontal ligament cells on SABC stainingA(×100): 犬牙周膜细胞形态;B(×100): 犬牙周膜细胞波形丝蛋白染色

图3 犬颌骨骨髓基质细胞原代培养(×100)Fig.3 Primary culture of canine maxillary bone marrow stromal cells(×100)原代培养第二代,细胞呈梭形,贴壁生长
2.3 cM-BMSCs-CM对cPDLCs增殖的影响
依据生长曲线可以看出,第1天时,两组细胞增殖差异无统计学意义;未处理的牙周膜细胞在第2天开始快速增殖,而实验组牙周膜细胞经颌骨骨髓基质细胞诱导后增殖缓慢;第5~7天时,未处理组牙周膜细胞增殖较快,实验组细胞分裂缓慢(图4)。
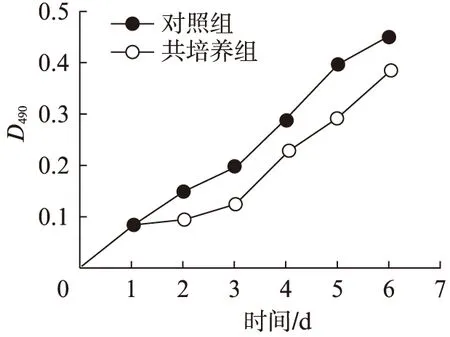
图4 MTT检测两组细胞增殖情况Fig.4 Cell proliferation tested measured by MTT method
2.4 共培养的犬牙周膜细胞在第3、7天ALP、Runx2、OCN的mRNA表达变化
荧光定量PCR检测目的基因Runx2、ALP及OCN结果显示: 与对照组相比,实验组相关基因的表达均高于对照组,存在显著差异。实验组Runx2、ALP及OCN的表达第3、7天均高于未诱导的牙周膜细胞,但第3天较第7天高(表2)。
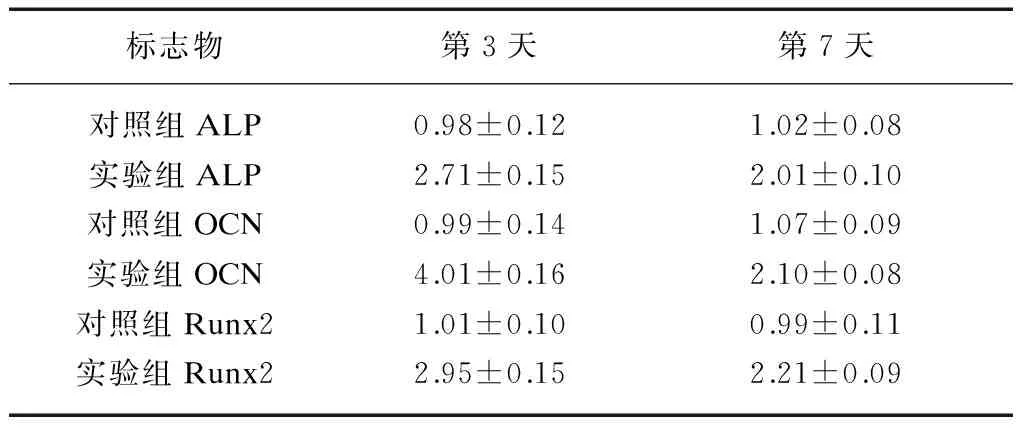
表2 各标志物mRNA的RQ值
2.5 犬牙周膜细胞相关蛋白的表达
采用Western印迹法检测牙周膜细胞间接共培养后第0、3、7天的蛋白表达水平。结果显示: 共培养的第3天,OCN和Runx2蛋白表达水平最高,第 3~7天蛋白水平有所下降,但均较对照组高(图5)。

图5 Western印迹法检测相关蛋白的表达Fig.5 Detection of related proteins by Western blotting
2.6 H-E切片染色结果
对照组可见到较少的与牙片表面平行的胶原纤维和成纤维细胞的存在,与牙片之间分离(图6A)。实验组可见到牙片表面有类似钙化物沉积并可见大量的成纤维细胞和胶原纤维,期间可见再生的血管(图6B)。
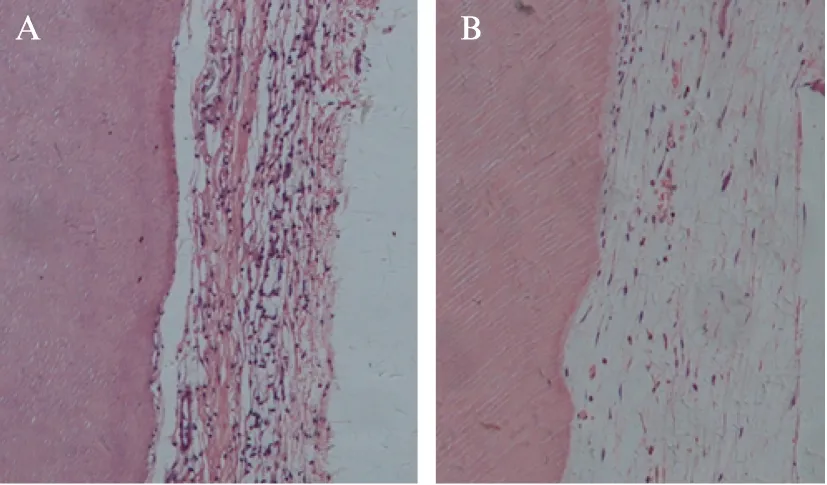
图6 牙周膜细胞膜片复合牙本质片裸鼠皮下移植H-E染色观察Fig.6 H-E staining of the indirect co-cultured PDLCs or PDLCs alone after transplant in nude miceA: 对照组H-E染色,新生胶原纤维;B: 实验组H-E染色,新生类牙周膜纤维、类牙骨质
3 讨 论
牙周炎症控制后,牙周组织会有以下不同的愈合方式: (1) 牙龈结缔组织附着,根面吸收;(2) 长上皮结合;(3) 牙槽骨与根面牙骨质直接接触;(4) 牙周膜细胞的修复,重新形成新附着[3]。牙周膜细胞含前体细胞,表现出多向分化潜能,可诱导形成成纤维细胞、成骨细胞和成牙骨质细胞。牙周膜细胞和颌骨骨髓基质细胞都是牙周组织的重要组成成分。本研究参考Park等[6]的取材及细胞培养方式,钻取颌骨骨松质块,组织块法培养颌骨骨髓基质细胞。
牙周膜细胞是一组异质性的细胞群,由成牙骨质细胞、成纤维细胞、微血管内皮细胞及未分化的间充质干细胞等组成。研究[2]发现,牙周膜干细胞较多存在于附着在牙槽骨面的牙周膜中,牙槽骨侧的牙周膜细胞较根面的牙周膜细胞具有更强的增殖能力和成骨分化的潜能。Mizuno等[7]通过共培养人PDLCs和BMSCs,发现促进了骨髓基质间充质细胞的增殖和成骨分化。Kelm等[8]发现长骨骨髓腔内的BMSCs与PDLSCs在体外共培养之后植入裸鼠,获得了牙周膜样组织结构并免疫组化切片证实骨桥蛋白低表达,高表达骨钙素。牙周膜细胞参与牙周组织再生离不开颌骨微环境。源于神经嵴的颌骨骨髓间充质细胞和中胚层来源的胫骨骨髓间充质细胞呈现出不同的生物学特征,颌骨骨髓间充质细胞表现为更强的成骨能力。本实验采用颌骨骨髓基质细胞与牙周膜细胞建立Transwell共培养模型,希望模拟活体中颌骨环境对牙周膜细胞的分化影响。
骨髓基质细胞旁分泌作用可通过分泌多种细胞因子、干细胞归巢因子,下调促凋亡蛋白等多种途径。更为普遍的看法则是认为直接和间接共培养均可诱导干细胞的定向分化。本研究通过细胞共培养技术[9],观察颌骨骨髓基质细胞释放的因子对牙周膜成纤维细胞的影响,在一定程度上,进一步模拟了细胞分化的微环境[10],能更好地观察颌骨骨髓基质细胞对牙周膜细胞增殖和分化的影响。
本研究发现,在犬颌骨骨髓基质细胞诱导作用下,实验组牙周膜细胞增殖开始时慢于单纯牙周膜细胞,且两组之间差异有统计学意义(P<0.05)。表明颌骨骨髓基质细胞抑制了牙周膜细胞的增殖。颌骨骨髓基质细胞条件培养液有利于牙周膜细胞功能态的维持。
ALP、Runx2是成骨样细胞分化的早期重要标志之一[11],其基因水平和蛋白量表达高低可衡量细胞的钙化能力和成骨潜能。矿化诱导液诱导牙周膜细胞,牙周膜细胞的Runx2、ALP值会升高。本研究发现,在与颌骨来源的骨髓基质细胞间接共培养诱导下,虽然牙周膜细胞的增殖初始受到抑制,但却诱导其向成骨样细胞分化。共培养第3天,牙周膜细胞的ALP水平明显升高,但在共培养第7天,牙周膜细胞的ALP水平有所下降,但仍高于单纯牙周膜细胞,这可能与牙周膜细胞的成骨分化机制与骨髓基质细胞不同有关。OCN又称C-羧基谷氨酸蛋白[12],是成骨细胞合成和分泌的高度特异性的非胶原蛋白,细胞间液和细胞质均可发现,是成骨样细胞分化到晚期的标志。本研究发现,共培养第3天,OCN蛋白水平出现上调。
当然,颌骨骨髓基质细胞对牙周膜细胞的作用还包括直接接触、由膜蛋白介导[13]的交互作用等途径,这些调控方式对牙周膜细胞的影响尚有待于进一步研究。综上所述,本实验发现犬颌骨骨髓基质细胞限制牙周膜细胞的增殖,促进其分化,为了解牙周膜细胞在颌骨环境中的生物学行为奠定基础,但牙周膜细胞分化的确切机制尚须进一步探讨。
[1] Taba M Jr, Jin Q, Sugai JV, et al. Current concepts in periodontal bioengineering[J].Orthod Craniofac Res, 2005,8(4): 292-302.
[2] Wang L, Shen H, Zheng W, et al. Characterization of stem cells from alveolar periodontal ligament[J].Tissue Engineering: Part A, 2011,17(7-8): 1015-1026.
[3] 李文星,陈静,侯文捷,等.三种形貌静电纺丝膜片的制备及其与牙周膜细胞的相容性[J].同济大学学报: 医学版,2014,35(4): 46-49.
[4] Isaka J, Ohazama A, Kobayashi M, et al. Participation of periodontal ligament cells with regeneration of alveolar bone[J]. J Periodontal,2001,72(3): 314-323.
[5] 卢玉旺,刘宏伟,王晓宇.预培养比格犬干细胞的牙本质片复合牙周膜细胞膜片裸鼠体内移植研究 [J].实用口腔医学杂志,2014,30(5): 598-602.
[6] Park JC, Kim JC, Kim YT, et al. Acquisition of human alveolarbone-derived stromal cells usingmini-mally irrigated implantosteotomy:invitroand in vivoevalua-tions[J].J Clin Periodontol, 2012, 39(5): 495-505.
[7] Mizuno N, Ozeki Y, Shiba H, et al. Humoral factors released from human periodontal ligament cells inuence calcication and proliferation in human bone marrow mesenchymal stem cells[J].J Periodontol, 2008, 79(12): 2361-2370.
[8] Kelm JM, Breitbach M, Fischer G, et al. 3D microtissue formation of undifferentiated bone marrowmesenchymal stem cells leads to elevated apoptosis[J]. Tissue Eng Part A, 2012, 18(7-8): 692-702.
[9] Li F, Whyte N, Niyibizi C. Differentiating multipotentmesenchymal stromal cells generate factors that exert paracrine activities on exogenous MSCs: implications for paracrine activities in bone regeneration[J].Biochem Biophys Res Commun , 2012, 426(4): 475-479.
[10] Choi EJ, Yim JY, Koo KT, et al. Biological effects of a semiconductor diode laser on human periodontal ligament fibroblasts [J].J Periodontal Implant Sci,2010,40(3): 105-110.
[11] Andersen RK, Zaher W, Larsen KH, et al. Association between in vivo bone formation and ex vivo migratory capacity of human bone marrow stromal cells[J]. Stem Cell Res Ther,2015,6: 196.
[12] Zhang P, Men J, Fu Y, et al. Contribution of SATB2 to the stronger osteogenic potential of bone marrow stromal cells from craniofacial bones[J].Cell Tissue Res,2012,350(3): 425-437.
[13] Yeh Y, Yang Y, Yuan K. Importance of CD44 in the proliferation andmineralization of periodontal ligament cells[J].J Periodont Res, 2014,49(6): 827-835.
Inductive effects of canine maxillary bone marrow stromal cells on biological features of canine periodontal ligament cells
JINZhen-yu,LIUHong-wei
(School of Stomatology, Tongji University, Shanghai 200072, China)
Objective To investigate the effect of canine maxillary bone marrow stromal cells (cM-BMSCs) on biological features of canine periodontal ligament cells (cPDLCs). Methods Primary cM-BMSCs were co-cultured with cPDLCs, the cell proliferation was examined by MTT method. Total mRNA and protein were extracted at d0, d3 and d7, the expression of ALP, Runx2 and OCN mRNAs was detected by qPCR; the protein levels of Runx2 and OCN were measured by Western-blotting. cM-BMSCs conditioned medium (cM-BMSCs-CM) was used to mimic the environment of maxilla and to induce the differentiation of cPDLCs. A cell sheetstrategy was chosen for the construction of periodontal tissueinvivo. Results Both cPDLCs and cM-BMSCs showed spindle-like morphology. Conditioned medium of cultured maxillary bone marrow stromal cells retarded the proliferation of cPDLCs. The expressions of ALP, Runx2 and OCN mRNAs were up-regulated in co-cultured group; and the protein levels of Runx2 and OCN in test group were higher than those in control group. cPDLCs treated by the cM-BMSCs-CM produced a cementum/PDL-like structure; however, cPDLCs alone failed to form the similar cementum/PDL-like structure in nude mice. Conclusion Conditioned medium of cM-BMSCs may hinder the proliferation of cPDLCs and promote the differentiation of cPDLCs.
maxillary bone marrow stromal cells; periodontal ligament cells; co-culture; condi-tioned medium
10.16118/j.1008-0392.2016.01.005
2015-10-15
金振宇(1984—),男,博士研究生.E-mail: jzyaq2003@163.com
刘宏伟.E-mail: hwliu@tongji.edu.cn
R 781.4
A
1008-0392(2016)01-0022-06
