RNA干扰YAP基因对人乳腺癌MDA-MB-231细胞生物学行为的影响
2016-07-07花开尧宋洪明宋佳璐李登峰
花开尧, 宋洪明, 宋佳璐, 李登峰, 房 林
(同济大学附属第十人民医院甲状腺乳腺外科,上海 200072)
·基础研究·
RNA干扰YAP基因对人乳腺癌MDA-MB-231细胞生物学行为的影响
花开尧, 宋洪明, 宋佳璐, 李登峰, 房 林
(同济大学附属第十人民医院甲状腺乳腺外科,上海 200072)
目的 探讨RNA干扰YAP基因对人乳腺癌MDA-MB-231细胞生物学行为的影响。方法 使用阳离子脂质体转染试剂LipofectamineTM2000将靶向沉默YAP基因的siRNA序列转染至乳腺癌MDA-MB-231细胞中,采用qRT-PCR和Western印迹法分别检测转染后MDA-MB-231细胞中YAP基因及蛋白的表达水平,噻唑蓝(MTT)实验和细胞平板克隆实验检测转染前后细胞增殖的变化,Transwell小室和划痕实验观察转染对细胞侵袭及迁移的影响,流式细胞术评价转染后细胞周期及凋亡的变化情况。结果 转染siRNA后,YAP RNA和蛋白的表达量相对于空白对照及阴性对照组均明显下降(P<0.01)。MTT实验及细胞平板克隆实验显示,siRNA干扰YAP表达可以显著抑制乳腺癌MDA-MB-231细胞的增殖活性;Transwell小室及划痕试验显示,siRNA干扰YAP的表达可以明显抑制乳腺癌MDA-MB-231细胞的侵袭及迁移能力;细胞周期实验显示,沉默YAP后,细胞周期出现G0/G1期阻滞,细胞凋亡检测证实沉默YAP后细胞凋亡率并未出现明显上升。结论 抑制YAP在乳腺癌细胞的表达可有效降低细胞的增殖、迁移和侵袭能力,改变细胞周期分布,但对细胞凋亡无明显影响。
乳腺肿瘤; Yes相关蛋白; siRNA; 细胞功能
YAP是近年发现的位于Hippo信号通路下游的转录因子[1-2]。研究[3-4]认为,YAP基因可能是一种致癌基因,在许多肿瘤中高表达。研究[5-7]显示YAP基因在乳腺癌中异常表达并且与肿瘤分期、分级、病理类型及预后显著相关。siRNA是一种由21~25个核苷酸组成的小分子RNA,由Dicer酶(RNase Ⅲ家族特异性双链RNA酶)处理,可以与靶基因的mRNA结合从而起到沉默特定靶基因的作用。近年来siRNA作为一种可能的癌症治疗新途径正引起更多的关注[8]。本研究通过siRNA特异性下调YAP基因,观察YAP基因下调后对乳腺癌MDA-MB-231细胞功能的变化。
1 材料与方法
1.1 材料
人乳腺癌MDA-MB-231细胞购自中国科学院上海生命科学研究院;DMEM培养基及胎牛血清购自美国Gibco公司;siRNA试剂盒购自上海吉玛制药技术有限公司;LipofectamineTM2000购自美国Invitrogen公司;Annexin-V/PI凋亡检测试剂盒购自BD公司;YAP抗体购自Cell Signaling Technology公司;RIPA细胞裂解液、BCA蛋白定量试剂盒购自江苏碧云天生物科技有限公司。靶向沉默YAP基因的siRNA顺义链为: 5′-GCAUCUUCGACAG-UCUUCUTT-3′;反义链为: 5′-AGAAGACUGUC-GAAGAUGCTT-3′。以siRNA NC的序列作为与人类基因组序列无任何匹配的阴性对照,siRNA NC顺义链为: 5′-UUCUCCGAAC-GUGUCACGUTT-3′;反义链为: 5′-ACGUGACACGUUCGGAGA-ATT-3′。
1.2 方法
1.2.1 细胞培养及MDA-MB-231细胞转染 人乳腺癌MDA-MB-231细胞培养于含10%胎牛血清及100U/ml双抗的DMEM培养液中,培养环境为: 37℃、5%CO2、100%湿度,2~3d换全培养基一次。选取指数生长期的细胞进行试验,细胞计数后以 1×105个MDA-MB-231细胞每孔的密度将细胞分种于6孔培养板中并置于培养箱中继续培养。当细胞密度达30%~50%后,应用阳离子脂质载体LipofectamineTM2000将siRNA转染入MDA-MB-231细胞,每孔siRNA的终浓度为50nmol/L,转染siRNA NC组作为阴性对照组,未做任何处理组细胞作为空白对照组。
1.2.2 qRT-PCR检测 总RNA提取试剂(TRIzol reagent)提取各实验组MDA-MB-231细胞的总RNA,紫外分光光度计准确定量。将提取的总RNA进行反转录获取cDNA后进行实时定量PCR反应。反应条件为95℃变性30s,57℃退火 1min,72℃延伸1min,循环32次,最后72℃温育10min。qRT-PCR引物YAP基因顺义链为: 5′-ACCCACAGCTCAGCATCTTCG-3′;反义链为: 5′-TGGCTTGTTCCCATCCATCAG-3′;β-actin基因顺义链为: 5′-CGTCTTCCCCTCCATCGT-3′;反义链为: 5′-GAAGGTGTGGTGCCAGATTT-3′。
1.2.3 Western印迹法分析 转染后48~72h收集细胞,利用RIPA细胞裂解液提取总蛋白,BCA蛋白定量试剂盒测定蛋白浓度。每孔加30μg的蛋白样品,用10%SDS-PAGE凝胶进行电泳,转膜、封闭,按1∶1 000稀释一抗孵育,置于4℃冰箱过夜。TBST洗膜3次,每次10min,按1∶1 500稀释二抗孵育1h,TBST洗膜3次,每次10min。通过Odyssey荧光成像系统扫描并进行蛋白条带灰度分析。
1.2.4 MTT试验 取对数生长期MDA-MB-231细胞,按2000个/孔接种于96孔板,每孔200μl,边缘加200μl磷酸盐缓冲液(PBS),在培养箱中培养18h后转染siRNA,转染浓度为50nmol/L。转染后细胞培养24、48、72和96h。每个检测时间点每孔加入MTT溶液(5mg/ml)20μl,继续培养4h后终止培养,小心吸弃孔内培养上清液,每孔加入150μl DMSO,振荡10min,使结晶物充分溶解。在酶联免疫检测仪上选择490nm波长,测定各孔吸光度值(D490),记录结果并绘制细胞生长曲线。
1.2.5 细胞平板克隆形成试验 各组转染后细胞重悬后计数,按300个/孔接种于6孔板,轻轻晃动使细胞分散均匀,在培养箱中培养7~10d,当出现肉眼可见的克隆时终止培养,弃除上清液,PBS浸洗2次,用95%乙醇固定10min,用0.1%结晶紫染色10min,蒸馏水冲洗3次,风干后拍照。
1.2.6 划痕试验 取对数生长期MDA-MB-231细胞,按1×105个/孔接种于96孔板,培养24h后转染siRNA,继续培养,当细胞铺满6孔板后,用枪头在细胞表面笔直划一条直线,PBS清洗两次去除脱落细胞,继续培养12、24h后,镜下观察各组划痕的愈合情况。
1.2.7 Transwell侵袭试验 将已转染的状态良好的MDA-MB-231细胞消化后离心,细胞计数后加入培养基,调整细胞密度为5×105个/ml,取 0.2ml 接种于Transwell小室内,将小室置于24孔板内,上室为含2%灭活血清的培养基,下室为含10%灭活血清的培养基。于培养箱内培养24h后用棉签轻轻擦去小室内细胞,95%乙醇固定,0.1%结晶紫染色,蒸馏水冲洗3次,风干后荧光倒置显微镜200倍视野下拍照。
1.2.8 细胞周期和凋亡试验 将已转染的状态良好的MDA-MB-231细胞消化后离心,一部分用预冷的PBS洗涤3次后离心,加入预冷的70%乙醇固定过夜,再次离心后用含RNase及碘化丙啶(PI)的染色液室温下避光孵育30min,流式细胞仪分析细胞周期。另一部分加500μl的结合缓冲液重悬细胞,再加1μl Annexin V-PI荧光染料充分混匀,室温下避光孵育15min,1h内进行流式细胞仪检测,分析软件计算细胞凋亡率。
1.3 统计学处理

2 结 果
2.1 qRT-PCR及Western印迹法检测siRNA转染后YAP基因及蛋白的表达
qRT-PCR和Western印迹法结果显示,与空白对照组和NC组相比,siRNA处理组MDA-MB-231细胞的YAP基因的mRNA(P<0.01)及蛋白(P<0.01)的表达均被显著抑制,见图1。

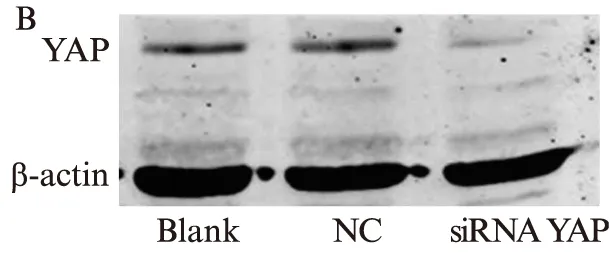
图1 转染siRNA后乳腺癌MDA-MB-231细胞中YAP mRNA及蛋白表达量Fig.1 Relative expression of YAP mRNA and protein were detected by qRT-PCR and Western blotting in MDA-MB-231 breast cancer cells after transfected with siRNAA: qRT-PCR;B: Western印迹法
2.2 MTT法和平板克隆实验检测siRNA转染后细胞增殖活性的变化
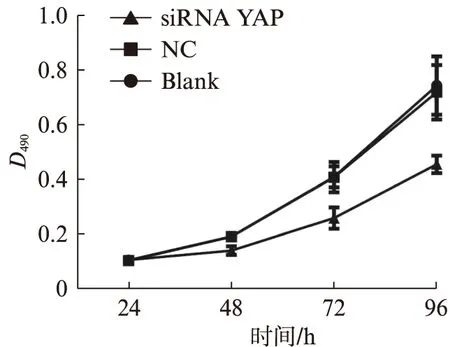
图2 MTT检测转染siRNA后乳腺癌MDA-MB-231细胞的增殖活性Fig.2 Cell proliferation was detected by MTT assay n MDA-MB-231 breast cancer cells
MTT法测定空白转染组、NC组、siRNA-YAP组不同时间的D490值,随着细胞生长时间的延长,空白组与NC组增殖能力无明显差异,而YAP-siRNA转染组随着时间延长,细胞增殖能力与前两组相比明显减缓,差异有统计学意义(P<0.05),见图2。 平板克隆试验同样显示空白组与NC组细胞克隆数无明显差异,而YAP-siRNA转染组克隆数明显减少,差异有统计学意义(P<0.05),见图3。因此,YAP基因可以调控乳腺癌细胞的增殖能力。
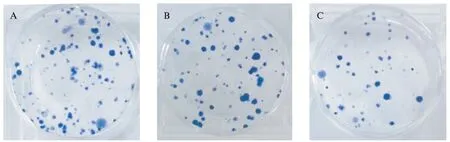
图3 平板克隆形成实验测定转染siRNA后乳腺癌MDA-MB-231细胞增殖能力Fig.3 Cell proliferation was detected detected by colony formation assay in breast cancer MDA-MB-231 cellsA: Blank;B: Nc;C: siRNA YAP
2.3 划痕试验和Transwell小室实验检测siRNA转染后细胞迁移和侵袭能力的变化
划痕试验显示,随着时间的推移,空白对照组和NC组的划痕愈合速度较快,而siRNA-YAP组的愈合速度较慢(P<0.05),见图4。Transwell侵袭试验显示,在200倍视野下,空白对照组和NC组的细胞数目明显多于siRNA-YAP组(P<0.05),见图5。因而siRNA沉默YAP基因后可以抑制MDA-MB-231细胞迁移和侵袭能力。

图4 划痕试验检测转染siRNA后乳腺癌MDA-MB-231细胞的迁移能力Fig.4 Migration of MDA-MB-231 cells detected by cell scratch assay

图5 Transwell小室实验检测转染siRNA后乳腺癌MDA-MB-231细胞的侵袭能力Fig.5 Invasion of MDA-MB-231 cells detected by transwell assayA: Blank;B: Nc;C: siRNA YAP
2.4 流式细胞仪检测siRNA转染后细胞周期的变化
流式细胞仪分析显示,与空白对照组(45.90±0.83)%和NC组(47.63±2.48)%相比,siRNA-YAP组(51.45±1.86)%处于G0/G1期的细胞比例明显上升(P<0.01),而处于S期和G2/M期的细胞比例则明显下降,见图6。该结果表明siRNA沉默YAP基因后可以使MDA-MB-231细胞周期阻滞于G0/G1期。
2.5 流式细胞化检测siRNA转染后细胞凋亡率的变化
流式细胞仪分析显示,空白对照组、NC组及siRNA-YAP组细胞凋亡率的差异无统计学意义(P>0.05),即siRNA沉默YAP基因后对MDA-MB-231细胞的凋亡水平无明显影响,见图7。


图6 流式细胞仪检测各组MDA-MB-231细胞周期分布

图7 流式细胞仪检测各组MDA-MB-231细胞凋亡率Fig.7 Cell apoptosis rate detected byflow cytometry in MDA-MB-231 cells右下象限AnnexinV(+) PI(-)代表早期凋亡细胞群,右上象限AnnexinV(+) PI(+)代表晚期凋亡细胞群或死亡细胞群A: Blank;B: Nc;C: siRNA YAP
3 讨 论
恶性肿瘤的发生、增殖和转移是多因素、多信号通路共同作用的结果。RNA干扰技术是近年来兴起的一项新兴的基因阻断技术,利用siRNA沉默相关关键基因的表达从而治疗恶性肿瘤,目前已经取得了一定的进展。
Hippo通路是近几年发现的重要信号通路,主要通过调节细胞增殖和凋亡进行器官发育的调控,众多研究表明Hippo通路与肿瘤的发病密切相关[1]。YAP蛋白是Hippo通路下游重要的信号分子,YAP转位入核是该通路激活的核心过程,与细胞内众多激酶的活性以及蛋白酶体系统的激活等因素有关,YAP主要通过磷酸化修饰发挥其生物学活性[9-10]。研究[11-14]表明,YAP基因在结肠癌、肝癌、肺癌、宫颈癌、膀胱癌等恶性肿瘤中存在过表达。YAP基因在乳腺癌细胞中同样表达异常,但其表达量是否与乳腺癌患者的肿瘤分期、淋巴结转移及预后相关目前还存在一定争议[15-16]。Tschaharganeh等[17]在肝癌的裸鼠成瘤实验中发现,过表达YAP基因能促进肿瘤的生长,并发现在肝癌细胞中YAP能够上调Notch信号通路的配体Jagged-1(Jag-1)从而激活Notch信号通路,调控肝癌细胞的增殖、迁移以及侵袭,这说明YAP蛋白不仅作为Hippo信号通路上的关键调控因子而独立存在,还与相关的信号通路间存在复杂的调控关系。与YAP基因在肝癌中的作用类似,过表达的YAP基因在乳腺癌中同样可以起到促进上皮细胞间质转化以及抑制凋亡的作用,并且在管腔型乳腺癌中可以促进癌肿的发生与发展[18-19]。
为了探究YAP基因在乳腺癌细胞中发挥的作用,本实验首次通过siRNA下调人乳腺癌MDA-MB-231细胞中YAP基因表达以观察细胞功能的变化情况。转染siRNA-YAP后,qRT-PCR和Western印迹法结果显示,无论在mRNA水平还是蛋白水平,YAP基因表达量均被显著抑制,随后的一系列细胞功能试验进一步说明,YAP基因下调后,MDA-MB-231细胞的增殖能力、迁移能力和侵袭能力均受到抑制,细胞周期阻滞在G1期,但对细胞凋亡并无明显影响。综合来看,本实验只是应用阳离子脂质体转染试剂介导的YAP特异性siRNA的乳腺癌细胞的瞬时转染,对基因的抑制状态不够稳定;此外,该实验只在乳腺癌MDA-MB-231细胞这一种细胞系中进行了验证,且未进行动物实验,因此无法明确其在体内的作用情况,相关的研究有待进一步展开。
综上所述,siRNA能特异性沉默人乳腺癌 MDA-MB-231细胞的YAP基因,下调mRNA及蛋白的表达水平,抑制癌细胞的增殖、迁移和侵袭能力,为乳腺癌的基因治疗提供了新的实验依据。
[1] Shi P, Feng J, Chen C. Hippo pathway in mammary gland development and breast cancer[J]. Acta Bio-chim Biophys Sin(Shanghai), 2015,47(1): 53-59.
[2] Dong J, Feldmann G, Huang J, et al. Elucidation of a universal size-control mechanism in Drosophila and mammals[J]. Cell, 2007,130(6): 1120-1133.
[3] Liu JY, Li YH, Lin HX, et al. Overexpression of YAP 1 contributes to progressive features and poor prognosis of human urothelial carcinoma of the bladder[J]. BMC Cancer, 2013,13: 349.
[4] Yeung B, Yu J, Yang X. Roles of the Hippo pathway in lung development and tumorigenesis[J]. Int J Cancer, 2016,138(3): 533-539.
[5] Kim SK, Jung WH, Koo JS. Expression of Yes-associated protein (YAP) in breast phyllodes tumor[J]. Int J Clin Exp Pathol, 2014,7(9): 5997-6005.
[6] Jaramillo-Rodriguez Y, Cerda-Flores RM, Ruiz-Ramos R, et al. YAP expression in normal and neoplastic breast tissue: an immunohistochemical study[J]. Arch Med Res, 2014,45(3): 223-228.
[7] Kim SK, Jung WH, Koo JS. Yes-associated protein (YAP) is differentially expressed in tumor and stroma according to the molecular subtype of breast cancer[J]. Int J Clin Exp Pathol, 2014,7(6): 3224-3234.
[8] Størvold GL, Andersen TI, Perou CM, et al. siRNA: a potential tool for future breast cancer therapy?[J]. Crit Rev Oncog, 2006,12(1-2): 127-150.
[9] Pan D. The hippo signaling pathway in development and cancer[J]. Dev Cell, 2010, 19(4): 491-505.
[10] Sanchez IM, Aplin AE. Hippo: hungry, hungry for melanoma invasion[J]. J Invest Dermatol, 2014,134(1): 14-16.
[11] Wang L, Shi S, Guo Z, et al. Overexpression of YAP and TAZ is an independent predictor of prognosis in colorectal cancer and related to the proliferation and metastasis of colon cancer cells[J]. PLoS One, 2013,8(6): e65539.
[12] Perra A, Kowalik MA, Ghiso E, et al. YAP activation is an early event and a potential therapeutic target in liver cancer development[J]. J Hepatol, 2014,61(5): 1088-1096.
[13] Wang Y, Dong Q, Zhang Q, et al. Overexpression of yes-associated protein contributes to progression and poor prognosis of non-small-cell lung cancer[J]. Cancer Sci, 2010,101(5): 1279-1285.
[14] Liu T, Liu Y, Gao H, et al. Clinical significance of yes-associated protein overexpression in cervical carcinoma: the differential effects based on histotypes[J]. Int J Gynecol Cancer, 2013,23(4): 735-742.
[15] Sheen-Chen SM, Huang CY, Tsai CH, et al. Yes-associated protein is not an independent prognostic marker in breast cancer[J]. Anticancer Res, 2012, 32(8): 3321-3325.
[16] Maugeri-Sacca M, Barba M, Pizzuti L, et al. The Hippo transducers TAZ and YAP in breast cancer: oncogenic activities and clinical implications[J]. Expert Rev Mol Med, 2015,17: e14.
[17] Tschaharganeh DF, Chen X, Latzko P, et al. Yes-associated protein up-regulates Jagged-1 and activates the Notch pathway in human hepatocellular carcinoma[J]. Gastroenterology, 2013,144(7): 1530-1542.
[18] Overholtzer M, Zhang J, Smolen GA, et al. Transforming properties of YAP, a candidate oncogene on the chromosome 11q22 amplicon[J]. Proc Natl Acad Sci U S A, 2006,103(33): 12405-12410.
[19] Wang X, Su L, Ou Q. Yes-associated protein promo-tes tumour development in luminal epithelial derived breast cancer[J]. Eur J Cancer, 2012,48(8): 1227-1234.
Effect of RNA interference targeting YAP gene on breast cancer MDA-MB-231 cells
HUAKai-yao,SONGHong-ming,SONGJia-lu,LIDeng-feng,FANGLin
(Dept. of Breast and Thyroid Surgery, Tenth People’s Hospital, Tongji University, Shanghai 200072, China)
Objective To investigate the effect of small interfering RNA (siRNA) targeting YAP gene on breast cancer MDA-MB-231 cells. Methods siRNA targeting YAP gene was transfected in human breast cancer MDA-MB-231 cells with LipofectamineTM2000. The effect of siRNA on cell proliferation was assessed by MTT assay; cell migration and invasion were examined by colony formation assay, Transwell migration assay and wound healing assay; cell cycle and apoptosis were evaluated by flow cytometry; the expression of YAP mRNA and protein in MDA-MB-231 cells was detected by quantitative Real-Time-polymerase chain reaction (qRT-PCR) and Western blotting analysis, respectively. Results Expression of YAP mRNA and protein was suppressed after trans-fected with siRNA verified by qRT-PCR and Western blotting (P<0.01). MTT assay and colony formation assay showed that the proliferation of MDA-MB-231 cells was inhibited in transfected MDA-MB-231 cells compared with blank control and negative control. Transwell and wound healing test demonstrated that migration and invasion of MDA-MB-231 cells were significantly inhibited. Flow cytometry showed that MDA-MB-231 cells arrested at G0/G1phase but cell apoptosis was not changed after iRNA interference. Conclusion This study demonstrates that YAP gene may play important role in biological behaviors of human breast cancer MDA-MB-231 cells.
breast cancer; Yes associated protein; siRNA; cellular function
10.16118/j.1008-0392.2016.01.003
2015-07-31
国家自然科学基金(81272240)
花开尧(1991—),男,硕士研究生.E-mail: huakaiyao111@163.com
房 林.E-mail: fanglin_f@126.com
R 737.9
A
1008-0392(2016)01-0012-06
