麻黄-桂枝配伍对麻黄类生物碱、桂皮酸及桂皮醇在大鼠体内药动学的影响
2016-07-07陈飞龙马钦海任孟月罗佳波
卫 平,陈飞龙,马钦海,任孟月,罗佳波
(1. 南方医科大学中医药学院,广东省中药制剂重点实验室,广东 广州 510515;2. 深圳市坪山新区妇幼保健院药剂科,广东 深圳 518122)
麻黄-桂枝配伍对麻黄类生物碱、桂皮酸及桂皮醇在大鼠体内药动学的影响
卫平1,2,陈飞龙1,马钦海1,任孟月1,罗佳波1
(1. 南方医科大学中医药学院,广东省中药制剂重点实验室,广东 广州510515;2. 深圳市坪山新区妇幼保健院药剂科,广东 深圳518122)
摘要:目的建立UPLC-MS/MS法,对麻黄-桂枝药对提取物、单味麻黄提取物和单味桂枝提取物中麻黄类生物碱、桂皮醇及桂皮酸的血浆药动学进行比较研究,探讨中药复方配伍对药效成分体内过程的影响。方法实验大鼠分别灌胃麻黄、桂枝及麻黄-桂枝提取物,测定不同时间点大鼠血浆中麻黄类生物碱、桂皮醇和桂皮酸的浓度,采用DAS3.0软件计算药动学参数,SPSS13.0对两组的药动学参数进行统计分析。结果麻黄-桂枝组中去甲基麻黄碱、去甲基伪麻黄碱、麻黄碱、伪麻黄碱和甲基麻黄碱的达峰浓度(Cmax)均明显大于麻黄组(P<0.05);麻黄-桂枝组中去甲基伪麻黄碱的药时曲线下面积(AUC0-t)明显大于麻黄组(P<0.05);麻黄-桂枝组中去甲基麻黄碱、麻黄碱、伪麻黄碱和甲基麻黄碱的平均驻留时间(MRT0-t)均明显小于麻黄组(P<0.05);麻黄-桂枝组中去甲基麻黄碱、麻黄碱和甲基麻黄碱的半衰期(T1/2z)明显小于麻黄组(P<0.05)。麻黄-桂枝组中桂皮醇、桂皮酸的AUC0-t和MRT0-t均明显大于桂枝组(P<0.05)。结论麻黄与桂枝配伍后,增加了5种麻黄生物碱在体内的吸收浓度,延缓了去甲麻黄碱、麻黄碱、伪麻黄碱和甲基麻黄碱在体内的消除,提高了桂皮醇和桂皮酸的生物利用度。
关键词:麻黄;桂枝;麻黄-桂枝药对;麻黄类生物碱;桂皮酸;桂皮醇;血浆药动学;UPLC-MS/MS
药对又叫“对药”,具备方剂的基本作用,是中医遣方用药的特色之一,是最简单、最基本和最常见的中药配伍形式[1]。麻黄-桂枝药对在多个经典方剂中都有应用,如麻黄汤、小青龙汤等,临床上也具有较高的配伍使用频率,具有发汗解表、疏风散寒、止咳平喘功效[2]。课题组前期对麻黄-桂枝药对的化学成分、药理作用、代谢组学以及最佳配比等进行了大量研究[3-4]。但麻黄-桂枝药对体内过程、单方及复方中各成分的药动学相互作用的影响还不明确,有待进一步研究。麻黄为麻黄科植物草麻黄EphedrasinicaStapf、中麻黄EphedraintermediaSchrenk et C. A. Mey. 或木贼麻黄EphedraequisetinaBge.的干燥草质茎,其主要含多种生物碱和少量的挥发油等[5]。桂枝为樟科植物肉桂CinnamomumcassiaPresl.的干燥嫩枝,主要含有桂皮醛、桂皮醇、桂皮酸和香豆素等[6]。本实验运用现代技术手段,UPLC-MS/MS法检测分析麻黄提取物中具有代表性的麻黄类生物碱(甲基麻黄碱(norephedrine, NME)、去甲基伪麻黄碱(norpseudoephedrine, NMP)、麻黄碱(ephedrine, E)、伪麻黄碱(pseudoephedrine, PE)和甲基麻黄碱(methylephedrine, ME))和桂枝提取物中具有代表性的桂皮醇(cinnamic alcohol, CAL)、桂皮酸(cinnamic acid, CA)的浓度,研究麻黄-桂枝配伍前后血浆药动学特征的变化,探讨复方中药配伍对麻黄类生物碱、桂皮酸和桂皮醇代谢的影响,为该药对更深层次的开发利用提供科学依据。
1仪器与材料
1.1仪器
1290Infinity-G6410型UPLC-MS/MS联用仪(美国Agilent公司);XW-80A型旋涡混合仪(上海沪西分析仪器厂);KQ5200型超声波清洗器(昆山市超声仪器有限公司);HC-3018R型高速冷冻离心机(安徽中科中佳科学仪器有限公司);CP225D型十万分之一天平(美国Denver公司);CP3243型万分之一天平(美国Denver公司);自制氮气吹干装置。
1.2试剂与试药
盐酸麻黄碱(批号:171241-201007),盐酸伪麻黄碱(批号:171237-200807),盐酸甲基麻黄碱(批号:171247-200301),桂皮酸(批号:110786-200503),盐酸金刚烷胺(IS1,批号:100426-201002)和盐酸苯海拉明(IS2,批号:100066-200506)均购自中国食品药品检定研究院;桂皮醇对照品(批号:30794),购自阿拉丁公司;盐酸去甲基麻黄碱及盐酸去甲基伪麻黄碱对照品(含量≥98%,赤峰艾克制药科技股份有限公司,批号:20100412);乙腈(色谱纯,Merck公司),甲酸(色谱纯,Tedia公司);乙醚、二氯甲烷均为分析纯;双蒸水由南方医科大学纯水中心提供;单味麻黄、单味桂枝和麻黄-桂枝提取物均为实验室自制(批号:20140110),经“2.1”项下方法测定得单味麻黄提取液中NME、NMP、E、PE和ME的浓度分别为0.12、0.22、2.70、1.12和0.27 g·L-1,麻黄-桂枝提取液中5种成分的浓度相应为0.10、0.19、2.76、1.23和0.28 g·L-1;单味桂枝提取液中CAL和CA的浓度分别为34.25和352.48 mg·L-1,麻黄-桂枝提取液中2种成分的浓度相应为31.30和334.30 mg·L-1。
1.3试验动物
健康Sprague-Dawley (SD)大鼠18只,♂,体质量(250±20)g,由南方医科大学实验动物中心提供,许可证号:SCXK(粤) 2011-0015。
1.4数据处理与分析
2方法
2.1液质联用检测条件
2.1.1检测麻黄生物碱的条件[10]色谱柱:Agilent Zorbax SB-C18 columm(3.5 μm, 2.1×100 mm);流动相:乙腈(A)-0.1%的甲酸水溶液(B),程序洗脱(0~3 min:97% B;3~5 min:97%~96% B;5~7 min:96% B;7~7.5 min:96%~82% B;7.5~9 min:82% B;9~9.1 min :82%~97% B);流速:0.40 mL·min-1;柱温:35 ℃;进样量:1 μL。离子源:ESI源;毛细管电压:4 000 V,雾化器压力:30 psi;干燥气流温度:350 ℃;干燥气流速度:8.0 L·min-1;碰撞气为高纯氮气;采集模式:多反应监测(MRM)模式;扫描离子:正离子。用于定量分析的离子对分别为:NME与NMPm/z152.1>134.1,E与PEm/z166.1>148.1,MEm/z180.1>162.1,ISm/z152.2>135.1。Fragmentor分别为75、88、110、95;碰撞能分别为8、12、12、20 V。
2.1.2检测桂皮酸及桂皮醇的条件色谱柱:Agilent Zorbax SB-C18 columm(3.5 μm, 2.1×100 mm);流动相:乙腈(A) ∶0.1%的甲酸水溶液(B)=30 ∶70,等梯度洗脱;流速:0.40 mL·min-1;柱温:35 ℃;进样量:2 μL;洗脱时间:3.9 min。离子源:ESI源;毛细管电压:4 000 V,雾化器压力:30 psi;干燥气流温度:350 ℃;干燥气流速度:10.0 L·min-1;碰撞气为高纯氮气。采集模式:多反应监测(MRM)模式。扫描离子:正离子。用于定量分析的离子对分别为:CAL m/z 117.1>117.1、CA m/z 149.1>131.1、IS m/z 256.2>167.1。Fragmentor分别为100、80、85;碰撞能均为7 V。
2.2对照品溶液的配制
精密称取NME、NMP、E、PE和ME对照品适量于10 mL容量瓶中,用甲醇溶解并定容至刻度,得混合对照品储备液。其中含NME、NMP、E、PE和ME分别为212.4、219.9、2044.1、1022.4和407.1 mg·L-1。精密称取CA、CAL对照品适量于10 mL容量瓶中,用甲醇溶解并定容至刻度,得混合对照品储备液。其中含CA和CAL分别为125.00、200.00 mg·L-1。上述对照品储备液依次稀释得系列对照品溶液,于4 ℃冰箱保存备用。精密称取盐酸金刚烷胺(amantadine, IS1)对照品适量于50 mL容量瓶中,用甲醇溶解并定容至刻度,得11.32 mg·L-1的IS1对照品溶液。精密称取盐酸苯海拉明(diphenhydramine, IS2)对照品适量于50 mL容量瓶中,用甲醇溶解,并定容至刻度,得103.00 mg·L-1的IS2对照品溶液,于4 ℃冰箱保存备用。
2.3血浆样品预处理
2.3.1含麻黄生物碱的血样预处理[10]5 mL EP管中加入血浆样品100 μL,IS1溶液30 μL,甲醇100 μL,涡流30 s,加入40 μL的饱和碳酸钠溶液,涡流30 s,加入1.2 mL乙醚-二氯甲烷(6 ∶4,V/V)溶液,涡流2 min,14 000 r·min-1离心10 min,分取上层溶液;再以1.2 mL乙醚-二氯甲烷(6 ∶4,V/V)溶液重复萃取1次,合并上层溶液于N2流下吹干,残留物用200 μL 流动相初始配比溶液(乙腈 ∶0.1%甲酸水溶液=3 ∶97,V/V)复溶,涡流2 min,14 000 r·min-1离心20 min,取上清进行UPLC-MS/MS检测分析。
2.3.2含桂皮醇及桂皮酸的血样预处理2 mL EP管中加入血浆样品100 μL,IS2溶液20 μL,甲醇100 μL,涡流10 s,加入0.5 mL乙腈,涡流2 min,14 000 r·min-1离心10 min,分取上层溶液,于N2流下吹干,残留物用100 μL流动相复溶,涡流2 min,14 000 r·min-1离心10 min,取上清进行UPLC-MS/MS检测分析。
2.4药动学试验
将18只健康SD大鼠,按体重随机分为单味麻黄提取物组、单味桂枝提取物组和麻黄-桂枝提取物组,给药前禁食12 h,但可自由饮水。大鼠口服给予8.10 g·kg-1单味麻黄提取物,13.50 g·kg-1麻黄-桂枝提取物,5.4 g·kg-1单味桂枝提取物[4](根据给药量进行折合,前两组均相当于NME 0.95 mg·kg-1,NMP 1.81 mg·kg-1,E 21.98 mg·kg-1,PE 9.03 mg·kg-1,ME 2.15 mg·kg-1;后两组均相当于CAL 0.04 mg·kg-1,CA 1.09 mg·kg-1),分别于给药前和给药后0.08、 0.25、 0.5、 0.75、 1.5、 3、 4、 6、 8、 12、 24、 48 h(其中单味桂枝组和麻黄-桂枝组增采36 h时间点)经眼眶静脉丛采血约0.5 mL于肝素化的EP管中,4 000 r·min-1离心10 min,分离血浆置-20 ℃冰箱中保存。
3结果
3.1专属性考察
取空白血浆、空白血浆加麻黄生物碱混合对照品溶液和IS1溶液以及给药后大鼠的含药血浆,分别按“2.3.1”项下预处理方法处理样品,在“2.1.1”项下条件进样,获得色谱图Fig 1;另取空白血浆、空白血浆加CAL、CA混合对照品溶液和IS2溶液以及给药后大鼠的含药血浆,分别按“2.3.2”项下预处理方法处理样品,在“2.1.2”项下条件进样,获得色谱图Fig 2。由结果可见,空白血浆的内源性物质在待测物出峰时间处干扰小,专属性强;待测物LLOQ的血浆样品出峰时间合适,峰型良好、分离度恰当;适合大鼠血浆样品的测定。
3.2线性关系考察
取空白血浆100 μL,加入系列对照品混合溶液100 μL,除不加100 μL甲醇外,按“2.3.1”项下处理,每一浓度进行3样本分析,按“2.1.1”项方法测定,记录样品峰面积,以待测物与内标物的峰面积比为纵坐标Y,待测物的浓度为横坐标X,用加权(1/C2)最小二乘法进行回归分析,得标准曲线NME:Y=0.0014X+0.0039(r2=0.9919)、NMP:Y=0.0016X-0.0035(r2=0.9971)、E:Y=0.0010X+0.1212(r2=0.9982)、PE:Y=0.0015X+0.0439(r2=0.9995)、ME:Y=0.0006X+0.0037(r2=0.9998),线性范围分别为0.11~1062.00、0.11~1099.50、1.23~12205.00、0.51~5112.00、0.21~2035.50 μg·L-1,定量下限分别为0.11、0.11、1.23、0.51、0.21 μg·L-1。同法得标准曲线CA:Y=0.0008X+0.0836(r2=0.9977)、CAL:Y=0.0012X+0.0531(r2=0.9955),其线性范围分别为1.61~6042.00、2.11~211.20 μg·L-1,定量下限分别为1.61、2.11 μg·L-1。
3.3精密度和准确度
取空白血浆100 μL,加入系列对照品混合溶液,制备麻黄类生物碱高、中、低浓度(NME:531.00、53.10、1.06 μg·L-1;NMP:549.75、54.98、1.10 μg·L-1;E:6102.50、610.25、12.21 μg·L-1;PE:2556.00、255.60、5.11 μg·L-1;ME:1017.75、101.78、2.04 μg·L-1)的质控样品(QC),每一浓度进行5样本分析,连续测定3日,根据当日的随行标曲算得QC样品浓度,与配制浓度对照,计算日内、日间精密度(RSD)和准确度(RE),结果5种麻黄类生物碱的日内RSD均小于10.9%、RE为-6.6%~8.2%,日间RSD均小于13.1%、RE为-8.1%~2.3%。同法制得CA:3222.40、161.12、6.04 μg·L-1;CAL:105.60、21.12、5.28 μg·L-1高、中、低浓度的质控样品(QC),得CA和CAL的日内RSD均小于9.6%,、RE为-3.8%~-1.1%,日间RSD均小于7.3%、RE为-6.5%~-2.3%。由上述结果可见,均符合生物样品分析方法的要求。

Fig 1 Representative UPLC-MS/MS chromatograms of plasma samples
A:Rat blank plasma; B:Rat blank plasma spiked with standard solutions in LLOQ; C:The rat plasma sample collected at 1.5h after oral administration of Ephedrae extract; D:The rat plasma sample collected at 1.5 h after oral administration of Ephedrae-Cinnamomi extract; 1.NME/NMP; 2.E/PE; 3.ME; 4. IS1
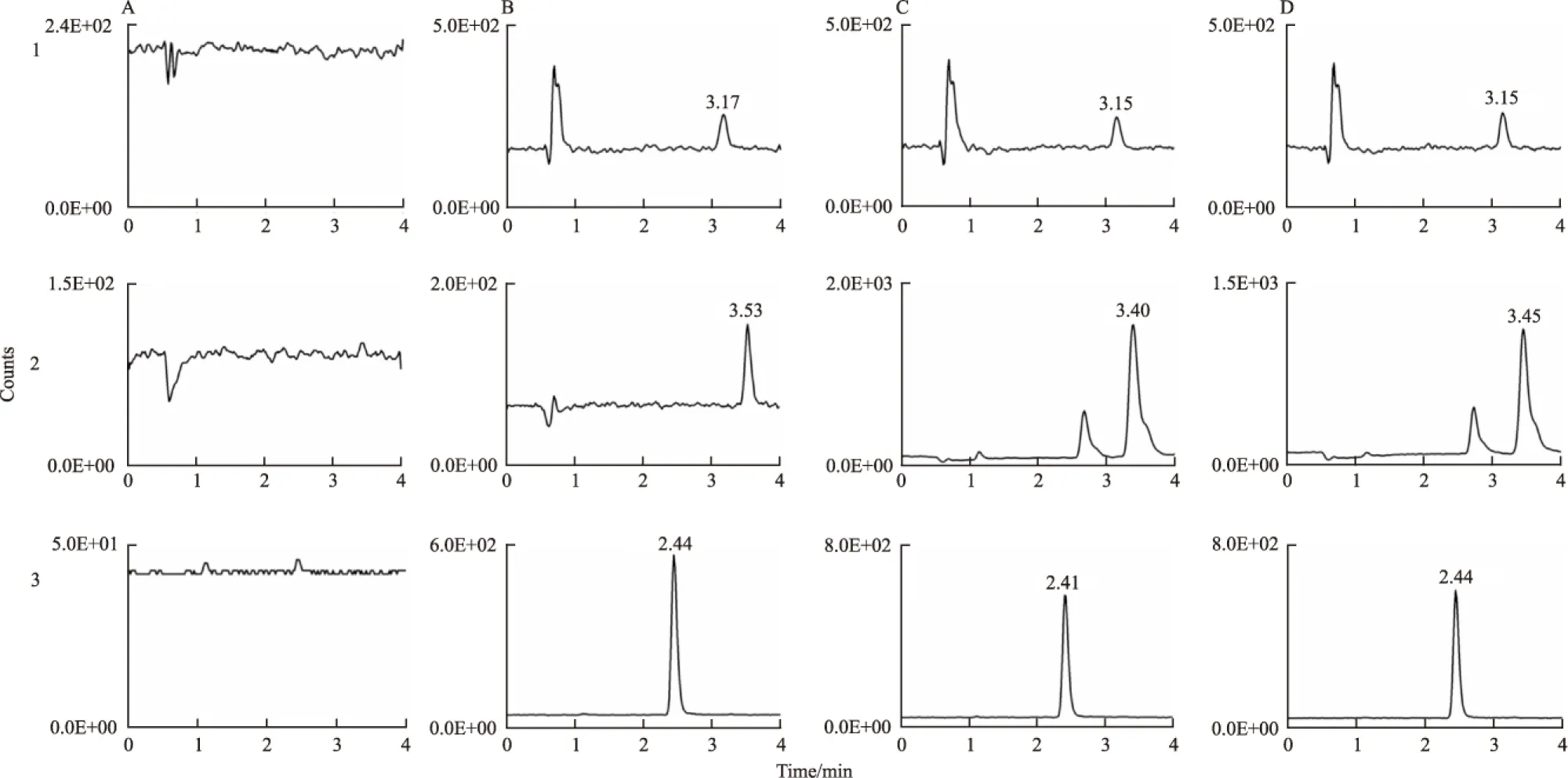
Fig 2 Representative UPLC-MS/MS chromatograms of plasma samples
A: Rat blank plasma; B: Rat blank plasma spiked with standard solutions in LLOQ; C: The rat plasma sample collected at 0.75h after oral administration of Cinnamomi extract; D: The rat plasma sample collected at 0.75 h after oral administration of Ephedrae-Cinnamomi extract; 1.CAL; 2.CA ; 3.IS2.
3.4基质效应和提取回收率
取空白血浆100 μL,经“2.3.1”项下处理后分别加入高、中、低浓度QC样品溶液复溶,进样后所得峰面积为分子,对应浓度的对照品溶液直接进样后所得峰面积为分母,计算得基质效应;另取高、中、低浓度QC样品,经“2.3.1”项下处理后,所得峰面积与空白血浆经“2.3.1”项下处理后加相应对照品溶液进样所得的峰面积相比,计算得提取回收率。各成分3种浓度的基质效应为NME:94.06%~100.96%、NMP:91.23%~100.98%、E:89.02%~96.16%、PE:87.17%~94.91%、ME:96.87%~102.41%(n=5,RSD均小于9.7%),IS1:95.52%(n=5,RSD=6.9%);3种浓度下的提取回收率为NME:94.6%~96.4%、NMP:90.9%~98.6%、E:89.3%~96.3%、PE:81.9%~99.5%、ME:82.8%~96.1%(n=5,RSD均小于5.6%),IS1:91.8%(n=5,RSD=2.8%)。同法得3种浓度下CA和CAL的基质效应分别为86.00%~95.50%、89.11%~90.40%(n=5,RSD均小于9.6%),IS2:89.67%(n=5,RSD=5.4%);3种浓度下的提取回收率为CA:81.96%~92.83%、CAL:82.64%~87.44%(n=5,RSD均小于9.4%),IS2:92.48%(n=5,RSD=6.2%)。由结果可见,该方法无明显离子增强或抑制效应;IS的提取回收率与分析物的回收率相近,平行性好,起到了很好的校正作用,提高了方法的准确度。
3.5稳定性考察
取空白血浆100 μL,按“3.1.3”项下制备含待测物高、中、低浓度的血浆样品各5份,考察样品处理前3次反复冻融,置于-20 ℃保存30 d和经处理后室温放置10 h的稳定性。结果表明,样品处理前3次反复冻融后血浆中麻黄类生物碱浓度的RE为-5.6%~3.8%,-20 ℃保存30 d后血浆浓度的RE为-2.8%~1.0%,经处理后室温放置10 h后血浆浓度的RE为-3.9%~1.2%。同法得样品处理前3次反复冻融血浆中桂皮醇、桂皮酸浓度的RE为-9.7%~-1.3%,-20 ℃保存30 d后血浆浓度的RE为-8.5%~1.7%,经处理后室温放置10 h后血浆浓度的RE为-9.0%~1.0%。由结果可见,在以上条件下,待测物均能保持稳定。
3.6药动学试验
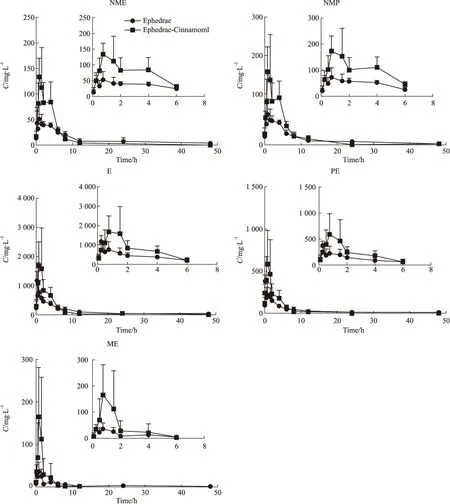
麻黄类生物碱、桂皮醇和桂皮酸的平均C-T曲线分别见Fig 3和Fig 4,采用DAS3.0软件对药动学参数进行拟合,结果见Tab 1,Tab 2。
4讨论
在桂枝与麻黄-桂枝提取物血浆药动学的研究中,桂枝的检测成分选择了桂皮酸和桂皮醇,而没有选择桂皮醛。因为在研究的前期摸索阶段,发现桂皮醛对照品极不稳定,很难达到生物样品检测方法学的要求;另由相关研究报道,桂皮醛进入体内后迅速氧化为桂皮酸,经β-氧化作用后生成苯甲酸[7],并与甘氨酸结合,再在ATP与酰基转移酶的作用下生成代谢物马尿酸,经尿液排出体外[8]。

Tab 1 Pharmacokinetic parameters for NME, NMP, E, PE, ME in rats plasma after oral administration of Ephedrae and Ephedrae-Cinnamomi±s,n=6)
*P<0.05vsEphedrae
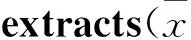
Tab 2 Pharmacokinetic parameters for CAL, CA in rats plasma after oral administration of Cinnamomi and Ephedrae-Cinnamomi±s,n=6)
*P<0.05vsCinnamomi
生物样品检测方法的建立和验证是药代动力学研究的基础,由于在药动学研究中,生物药品存在浓度较低,基质环境复杂等问题,因此,建立快速、灵敏可靠的生物样品测定方法是本课题拟解决的关键问题之一,以实现高通量的生物样品分析,满足药动学研究大样本量的要求[9]。本文麻黄类生物碱UPLC-MS/MS检测方法采用了本课题组前期的分析方法[10]。为了改善色谱分离并同时提高质谱响应,在检测桂皮酸和桂皮醇时,借鉴了麻黄类生物碱的研究方法对流动相进行了优化。分别对甲醇-水及乙腈-水系统进行了探索,并向其中加入一定量的甲酸,这样有利于提高待测物在正离子检测方式下的质谱响应。分析时发现含乙腈的流动相更能提高待测物的响应,改善了峰形以及降低了背景噪音,最终选择了乙腈-0.1%甲酸水(30 ∶70)等梯度洗脱来检测分析桂皮酸和桂皮醇。在内标物的选择上,根据文献的报道,分别对盐酸苯海拉明、苯丙酸、对羟基苯甲酸甲酯等[11-14]进行了考察,最终确定了盐酸苯海拉明为检测的内标物。
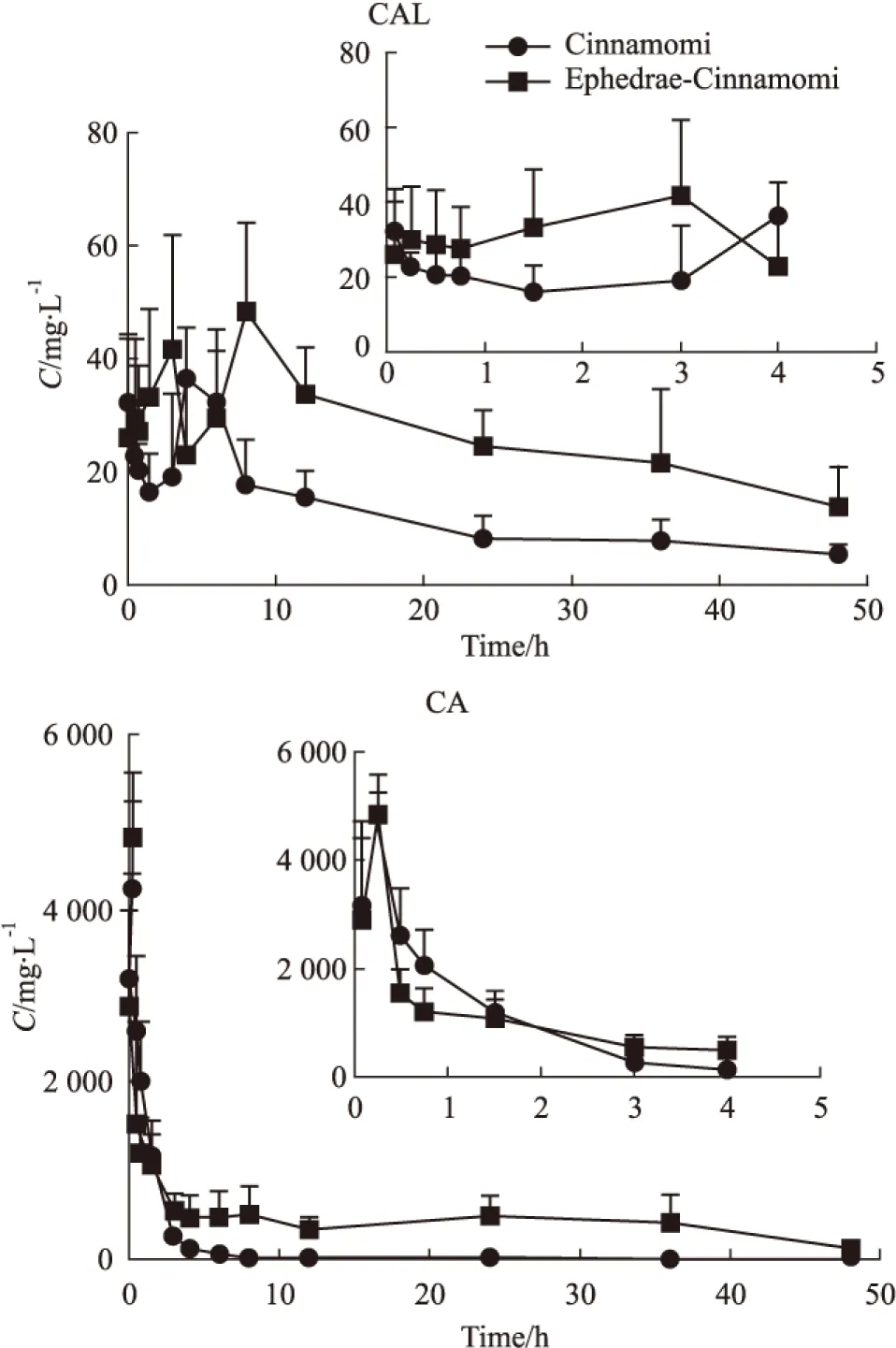
Fig 4 Mean plasma concentration-time profiles of CAL and CA after oral administration of Cinnamomi and Ephedrae-Cinnamomi±s,n=6)
结果显示,麻黄类生物碱在麻黄-桂枝药对和单味麻黄给药的情况下,两者的药动学参数Cmax、MRT0-t(NMP除外)、T1/2z(NMP和PE除外)、Vz/F(NMP和PE除外)差异具有显著性,NMP的AUC0-t和CLz/F差异具有显著性,其中NME、E和ME具有相似的药动学趋势。提示麻黄-桂枝药对中的其他成分在药物的吸收上起到了促进作用,而在药物的消除上有起到了延缓作用。另麻黄类生物碱的药动学趋势还与本身的药物结构存在一定的关系。桂皮酸和桂皮醇在麻黄-桂枝药对和单味桂枝给药的情况下,两者的药动学参数AUC0-t、MRT0-t、Vz/F和CLz/F差异均具有显著性,提示麻黄-桂枝药对中的其他成分可提高桂皮酸和桂皮醇的生物利用度,延缓二者在体内的分布和消除。
中药复方在中国具有悠久的使用历史,在临床上中药配伍给药有其内在的合理性。本研究从血浆药动学的角度,探讨了麻黄与桂枝配伍使用后,效应成分起到了协同的作用,复方配伍给药可能影响其他药物有效成分的吸收程度及消除速率,其内在的作用机制有待大量的实验研究。
(致谢:感谢广东省中药制剂重点实验室为本实验的开展提供相关实验耗材与仪器设备。真诚感谢实验室各位同学、老师在实验中给予我的指导和帮助。)
参考文献:
[1]胥庆华. 中药药对大全[M]. 北京:中国中医药出版社, 1997, 1.
[1]Xu Q H.EncyclopediaoftraditionalChineseMedicine[M].Beijing: Chinese Press of Traditional Chinese Medicine, 1997, 1.
[2]陈华章.《千金方》麻黄与桂枝相伍探析[J]. 中医药通报, 2006, 4(5): 23-5.
[2]Chen H Z. Analysis on the combined Ephedra with Cinnamomi in thousand golden prescriptions[J].TraditChinMedJ, 2006, 4(5): 23-5.
[3]徐文杰, 陈飞龙, 谢颖, 罗佳波. 不同配伍配比对麻黄-桂枝药对有效成分含量的影响[J]. 中国实验方剂学杂志, 2012, 10(18):84-8.
[3]Xu W J, Chen F L, Xie Y, Luo J B. Content of active compounds in water extracts of ephedra with cinnamomi by compatibility of different ratio[J].ChinJExpTraditMedForm, 2012, 10(18):84-8.
[4]徐文杰. 麻黄类药对组成规律的基础研究—麻黄桂枝药对I[D]. 广州:南方医科大学, 2012.
[4]Xu W J. Basic Research on the composition rules of herba ephedrae couplet medicines—couplet medicines of Herba Ephedrae-Ramulus Cinnamomi I[D]. Guangzhou: Southern Medical University, 2012.
[5]李佳莲, 方磊, 张永清,等. 麻黄的化学成分和药理活性的研究进展[J]. 中国现代中药, 2012, 7(14):21-7.
[5]Li J L, Fang L, Zhang Y Q, et al. Research progress on chemical constituents and pharmacological activities of Ephedra[J].ModChinMed, 2012, 7(14):21-7.
[6]刘江云, 杨学东, 徐丽珍, 杨世林. 桂枝的化学成分研究[J]. 中草药, 2002, 8(33):681-3.
[6]Liu J Y, Yang X D, Xu L Z, Yang S L. Studies on chemical constituents in dried tender stem of Cinnamomum cassis[J].ChinTraditHerbDrugs, 2002, 8(33):681-3.
[7]Yuan J H, Dieter M P, Bucher J R. Toxicokinetics of cinnamic aldehyde in F344 rats[J].FoodChemToxicol, 1992, 30(12):997.
[8]杨军, 郑法雷. 马尿酸与尿毒症[J]. 国外医学泌尿系统分册, 1989, 9(4):145.
[8]Yang J, Zheng F L. Hippuric acid and Uremia[J].UrolNephrolForeignMedSci, 1989, 9(4):145.
[9]甘萍, 霍仕霞, 白鹏, 等. 类叶升麻苷在大鼠体内的药代动力学及组织分布研究[J]. 中国药理学通报, 2014, 30(3):417-20.
[9]Gan P, Huo S X, Bai P, et al. Pharmacokinetics and tissue distribution study on acetoside in rats[J].ChinPharmacolBull, 2014, 30(3):417-20.
[10]Wei P, Huo H Y, Ma Q H, et al. Pharmacokinetic comparisons of five ephedrine alkaloids following oral administration of four different Mahuang-Guizhi herb-pair aqueous extracts ratios in rats[J].JEthnopharmacol, 2014, 155(1):642-8.
[11]王睿, 孙天慧, 景丹,等. 高效液相色谱法测定家兔血浆中桂皮酸的浓度及其药代动力学初探[J]. 色谱, 2005, 23(3):273-5.
[11]Wang R, Sun T H, Jing D, et al. High performance liquid chromatographic determination of cinnamic acid in rabbit plasma and application in study of pharmacokinetics[J].ChinJChromatogr, 2005, 23(3):273-5.
[12]陈莹蓉, 马越鸣, 张宁,等. 高效液相色谱法测定大鼠血浆中桂皮酸和马尿酸[J]. 药物分析杂志, 2009, 29(2):212-6.
[12]Chen Y R, Ma Y M, Zhang N, et al. HPLC determination of cinnamic acid and hippuric acid in rat plasma[J].JPharmAnal, 2009, 29(2):212-6.
[13]Bogan D P, Kennedy R. Simultaneous determination of coumarin, 7-hydroxycoumarin and 7-hydroxycoumarin glucuronide in human serum and plasma by high-performance liquid chromatography[J].JChromatogrBiomedAppl, 1996, 686:267-73.
[14]Zhang J, Chen M, Ju W Z, et al. Liquid chromatograph/tandem mass spectrometry assay for the simultaneous determination of chlorogenic acid and cinnamic acid in plasma and its application to a pharmacokinetic study[J].JPharmBiomedAnal, 2010, 51:685-90.
Effects of combined administration of Ephedrae-Cinnamomi on pharmacokinetics of ephedra alkaloids, cinnamic acid and cinnamic alcohol in rats
WEI Ping1,2, CHEN Fei-long1, MA Qin-hai1, REN Meng-yue1, LUO Jia-bo1
(1.KeyLaboratoryofChineseDrugsPharmaceuticsofGuangdongProvince,CollegeofChineseTraditionalMedicine,SouthernMedicalUniversity,Guangzhou510515,China; 2.ShenzhenPingshanMaternalandChildHealthHospital,Shenzhen518122,China)
Abstract:AimsTo compare the pharmacokinetics of ephedra alkaloids, cinnamic acid and cinnamic alcohol in Ephedrae, Cinnamomi and Ephedrae-Cinnamomi herb couple through UPLC-MS/MS in rats respectively, and to investigate the effect of combination on physiological disposition.MethodsPlasma samples were collected at different times after oral administration of Ephedrae, Cinnamomi and Ephedrae-Cinnamomi herb couple extracts. The concentrations of ephedra alkaloids, cinnamic acid and cinnamic alcohol in plasma samples were determined by UPLC-MS/MS. DAS 3.0 was used to calculate pharmacokinetic parameters. The differences of samples in two groups were conducted with univariate statistical analysis using SPSS 13.0.ResultsCompared with Ephedrae group, theCmaxof norephedrine hydrochloride, norpseudoephedrine hydrochloride, ephedrine hydrochloride, pseudoephedrine hydrochloride, and methylephedrine hydrochloride in Ephedrae-Cinnamomi herb couple group were significantly greater (P<0.05); the AUC0-tof norpseudoephedrine hydrochloride was significantly greater (P<0.05); the MRT0-tof norephedrine hydrochloride, phedrine hydrochloride, pseudoephedrine hydrochloride, and methylephedrine hydrochloride were significantly less (P<0.05); theT1/2zof norephedrine hydrochloride, phedrine hydrochloride, and methylephedrine hydrochloride were significantly less (P<0.05). The AUC0-tand MRT0-tof cinnamic acid and cinnamic alcohol were significantly greater than those in Cinnamomi group(P<0.05).ConclusionThe combination of Ephedrae and Cinnamomi improves the absorption concentration of five ephedra alkaloids, Slows down the elimination of norephedrine hydrochloride, phedrine hydrochloride, pseudoephedrine hydrochloride, and methylephedrine hydrochloride, and increases the bioavailability of cinnamic acid and cinnamic alcohol.
Key words:Ephedrae; Cinnamomi; Ephedrae-Cinnamomi herb couple; ephedra alkaloids; cinnamic acid; cinnamic alcohol; plasma pharmacokinetics; UPLC-MS/MS
收稿日期:2016-01-11,修回日期:2016-02-26
基金项目:国家自然科学基金资助项目(No 81030066)
作者简介:卫平(1981-), 女, 博士, 主管药师, 研究方向: 药物分析及中药药代动力学, Tel:0755-66858751,E-mail:weiping1238@126.com;
doi:10.3969/j.issn.1001-1978.2016.06.026
文献标志码:A
文章编号:1001-1978(2016)06-0873-08
中国图书分类号:R-332;R284.1;R282.71;R289.1;R969.1
网络出版时间:2016-5-25 15:39网络出版地址:http://www.cnki.net/kcms/detail/34.1086.R.20160525.1539.052.html
罗佳波(1947-), 男, 教授, 研究方向:中药复方制剂组方原理及配伍规律,Tel:020-61648266,E-mail: Luojb_smu@163.com
