丹参素衍生物对斑马鱼促血管新生作用的研究
2016-07-07崔国祯徐燕玲孙安露单璐琛王玉强李铭源
崔国祯,徐燕玲,孙安露,单璐琛,王玉强,李铭源
(1. 遵义医学院珠海校区生物工程系,珠海市中药基础及应用研究重点实验室,广东 珠海 519041;2. 澳门大学中华医药研究院中药质量研究国家重点实验室,澳门 999078; 3. 暨南大学药学院新药研究所,广东 广州 510632)
丹参素衍生物对斑马鱼促血管新生作用的研究
崔国祯1,2,徐燕玲2,孙安露1,单璐琛3,王玉强3,李铭源2
(1. 遵义医学院珠海校区生物工程系,珠海市中药基础及应用研究重点实验室,广东 珠海519041;2. 澳门大学中华医药研究院中药质量研究国家重点实验室,澳门999078; 3. 暨南大学药学院新药研究所,广东 广州510632)
摘要:目的观察丹参素衍生物(ADTM)对斑马鱼胚胎血管新生的影响,并探讨其可能作用的信号通路。方法选择正常血管转基因斑马鱼和血管生长因子受体酪氨酸激酶抑制剂(VRI)诱导血管损伤转基因斑马鱼两种模型,分别给予50、100、200 μmol·L-1的ADTM干预处理,以0.1%的DMSO为空白对照,分别观察不同浓度的ADTM对斑马鱼肠下静脉血管(SIVs)的直径和内皮细胞数以及节间血管(ISVs)生长的影响,并对VRI和ADTM处理后的斑马鱼做转录组学研究。用荧光定量PCR的方法对转录组测序的4个基因进行验证。结果>对于正常转基因斑马鱼模型,ADTM处理后,斑马鱼的SIVs血管直径明显增加,内皮细胞的数目轻微增加;在VRI损伤模型中,ADTM表现出修复ISVs损伤的效果。转录组分析表明,19个明显变化的基因富集在胰岛素信号通路。荧光定量PCR的结果与转录组中获得的序列吻合。结论对于正常和血管损伤的斑马鱼模型,ADTM均有促血管新生的效果,其作用机制可能与胰岛素信号通路的激活有关。
关键词:丹参素衍生物;血管新生;血管修复;斑马鱼;转录组;胰岛素信号通路
川芎和丹参是我国传统医学中广泛应用的中药,我们的meta分析研究结果表明,丹参川芎注射液对心绞痛有良好的治疗效果[1],其中的主要成分丹参素(DSS)和川芎嗪(TMP)是预防或治疗心脑血管疾病的活性物质。但是,这些中药单体疗效不强,且作用机制不明确,限制了其进一步的应用。为了提高丹参素的治疗效果,充分发挥其药效特色,我们对川芎嗪和丹参素进行了系统的化学结构修饰、药效和作用机制研究。我们发现丹参素与活性分子川芎嗪偶联修饰后得到的化合物ADTM(Fig 1A)[2],其化合物的作用与临床上用的药物治疗效果相似,但具有比临床的药物作用范围更广阔和毒性小等特点[3]。同时,本课题组尚未发表的实验结果表明,ADTM在体内外对神经毒素6-羟基多巴胺诱导的帕金森综合症有明显的保护作用。其次,利用化学蛋白质组学的方法,找到了该化合物的药物作用靶点[4-5]。
斑马鱼是一种用来研究器官发育和疾病模型的常见模式生物之一,具有胚胎透明、可直接观察内部器官、受试品用量少、筛选周期短和实验操作简便等独特优势。作为小型体内实验动物模型,斑马鱼在分子水平上85%与人类相同,心血管系统早期发育极为相似。48 hpf(受精后小时)背动脉与轴静脉形成简单循环网,72 hpf功能性管脉系统形成,肠下静脉血管(SIVs)呈现,在促血管新生药物筛选方面得到广泛的应用[6,7]。本研究用转基因斑马鱼研究ADTM对血管新生的干预作用。
1材料与方法
1.1动物
血管转基因斑马鱼Tg(fli1:EGFP)和Tg(fli1:nEGFP)购于国际斑马鱼资源中心,斑马鱼按照发表的方法饲养与繁殖[8]。这两种转基因斑马鱼分别在血管和血管的内皮细胞核表达绿色荧光蛋白。
1.2化合物
丹参素衍生物ADTM按照发表的文章合成(纯度>98%)[2];血管内皮生长因子受体酪氨酸激酶抑制剂(VRI)购于Calbiochem公司(货号:676481)。
1.3动物分组与药物处理
1.3.1ADTM对正常斑马鱼模型的影响选择状态良好,发育至48 h受精后的血管转基因斑马鱼Tg(fli1:EGFP)胚胎,将其放入28.5℃培养基的12孔培养板中,每孔12个胚胎。以0.1%的DMSO为空白对照,以50、100、200 μmol·L-1的ADTM为药物处理组。药物作用48 h后,在荧光显微镜下观察不同浓度ADTM对斑马鱼SIVs的影响(Fig 1B)。
1.3.2ADTM对VRI诱导血管损伤斑马鱼模型的影响选择状态良好、发育至22 h的血管转基因斑马鱼胚胎,将其放入28.5℃培养液的12孔板中,每孔12个胚胎。预先加入VRI 300 nmol·L-1,在28.5 ℃培养箱内孵育3 h,用培养液洗3遍后,加入培养基继续培养21 h后(此时,VRI处理后的斑马鱼,表现为SIV缺失),分别加入50、100、200 μmol·L-1的ADTM为药物处理组,以单独加0.1% DMSO为空白对照组。培养48 h后,在荧光显微镜下观察药物对斑马鱼ISVs的影响。
1.3.3观察方法按照本课题组发表的方法观察血管生成情况,并进行定量分析[9-10],用软件AxiovisionLE 4.1测量随机选取的3条斑马鱼的SIVs直径(Fig 1C)。关于斑马鱼SIVs内皮细胞的数量的计算,采用直接计数的方法实现。在VRI诱导血管损伤模型中,我们将从主动脉(DA)或者脊椎主静脉(PCV)发芽延伸并连接到背部脊索血管(DLAVs)的ISVs定义为完整血管(intact),而一些已经从DA或者PCV延伸出,但是并无与DLAVs相连的ISVs定义为缺陷型血管(defective),然后分别对每条斑马鱼的完整型和缺陷型血管进行统计分析。
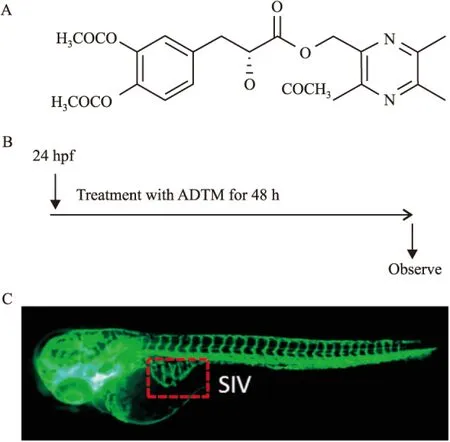
Fig 1 Schematic illustration of experimental plan in normal zebrafish
A:Chemical structure of ADTM;B:A schematic illustration of drug treatment in normal zebrafish;C:Lateral view of vascular-specific transgenic zebrafish, the part indicated by dashed line represents SIV.

Fig 2 Effects of ADTM on diameters of zebrafish±s,n=12)
A: embryo treated with 0.1% DMSO at 24 hpf for 48 h;B~D: embryo treated with 50,100,200 μmol·L-1ADTM, respectively;E:ADTM significantly increased SIVs diameter in a concentration-dependent manner.#P<0.05vscontrol group
1.4提取斑马鱼幼鱼的总RNA
药物处理后,用总RNA抽提试剂盒(RNeasy Mini kit, QIAGEN,德国)进行RNA提取,提取药物处理组(VRI+ADTM)与模型组(VRI)各30条斑马鱼幼鱼总RNA。质量鉴定合格后,进行斑马鱼幼鱼转录组的测定。
1.5斑马鱼转录组的测定及其分析
参照本课题组前期报道的方法[11],对斑马鱼的转录组进行测序和生物信息学数据分析。首先在Illumina Hi-2000基因组分析平台上进行双端测序;对末端RNA序列进行了配对,用Illumina基因组分析仪的fasta格式处理数据;用Cuffdiff软件进行差异基因分析;在DAVID数据库中对差异表达基因进行GO功能注释、分析和KEGG pathway显著性富集分析。
1.6斑马鱼转录组测序数据的验证
为了验证斑马鱼转录组测序数据的准确性,从转录组的基因表达谱中选取了4个基因(GSK-3β、BRAF、Sema3ab和IL1B),按照报道的方法[11],用RNA为模版,用随机引物进行反转录,合成cDNA第一条链,然后设计特异性引物进行荧光定量PCR(qPCR)分析。
2结果
2.1ADTM对正常斑马鱼血管新生的影响
不同浓度药物处理组斑马鱼胚胎48 h后,SIVs的直径明显增加,并呈现剂量依赖关系(Fig 2)。药物处理组与对照组比较有统计学意义(P<0.05),该结果初步表明ADTM具有促血管生成活性的作用。血管内皮细胞是构成血管的最主要的细胞之一,我们采用内皮细胞核转基因斑马鱼研究ADTM对内皮细胞数量的影响。结果表明(Fig 3),不同浓度药物处理组斑马鱼胚胎48 h后,SIVs内皮细胞数量微弱增加,药物处理组与对照组比较没有统计学意义(P>0.05)。
2.2ADTM对VRI诱导血管损伤斑马鱼模型的恢复干预作用
VRI诱导血管损伤转基因斑马鱼模型实验(Fig 4)发现,VRI处理后,ISVs和SIVs以及DLAVs都出现了明显的缺失。在不同浓度ADTM处理斑马鱼幼鱼48 h后,显示了明显的修复ISVs的效果,而且对SIVs区域也有一定程度上保护效果,并呈浓度依赖性(Fig 5)。
2.3ADTM对斑马鱼促血管新生信号通路的调控
为了更深入地了解ADTM在斑马鱼内的促进血管新生的分子机制,我们通过转录组学的技术分析经过ADTM处理后,斑马鱼体内的基因表达水平的变化。由于血管新生是一个全身性、整体性的机体调节的过程,所以我们研究斑马鱼整体的基因表达的变化。本研究中,模型组(VRI组)和药物处理组(VRI+ADTM)基因表达库中,每个库有核苷酸序列标签的总数量为4.6~6.8百万个。两个库中的核苷酸序列标签对应VEGA数据库,发现已有注释的基因大约是2.1~3.2百万个(约占整体的46%)。
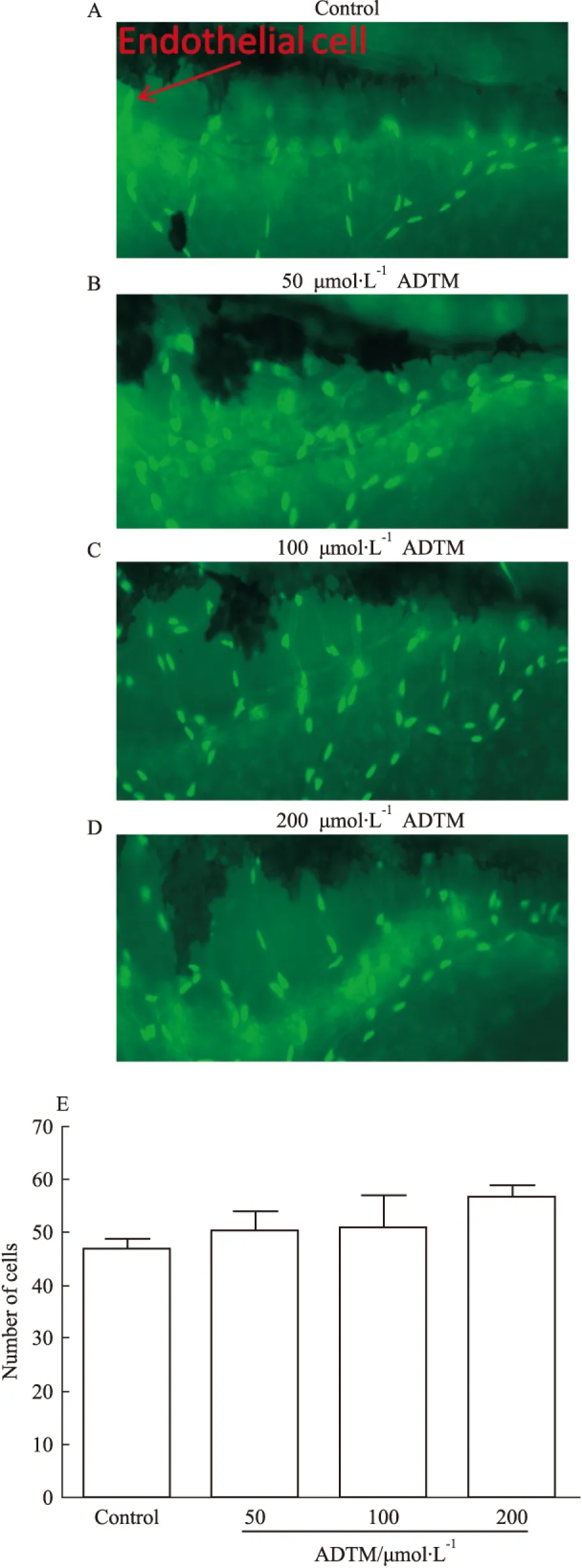
Fig 3 Effects of ADTM on number of zebrafish SIVs endothelial±s,n=12)
A:embryo treated with 0.1% DMSO at 24 hpf for 48 h;B~D:embryo treated with 50,100,200 μmol·L-1ADTM, respectively;E:ADTM slightly increased endothelial cells of zebrafish SIVs.
然后,我们通过DEGseq分析,得到两组之间基因表达差异有显著性(P<0.01)的有1 513个基因。KEGG pathway富集分析发现,胰岛素信号通路富集最为明显,19个明显变化的基因(P<0.01)富集在该通路,结果见Fig 6,上调基因:Cb1、CrkⅡ、GRF2、INSR、IRS、P13K、FOXO1、GSK-3β、FBP、PHK、PKA、LAR、SOS、MNK;下调基因:GK、PEPCK、GYS、PP1、S6。文献报道[12],胰岛素激活IRSR、PI3K和GSK-3β等可引起胰岛素信号通路的活化,由此确定ADTM激活胰岛素信号通路。
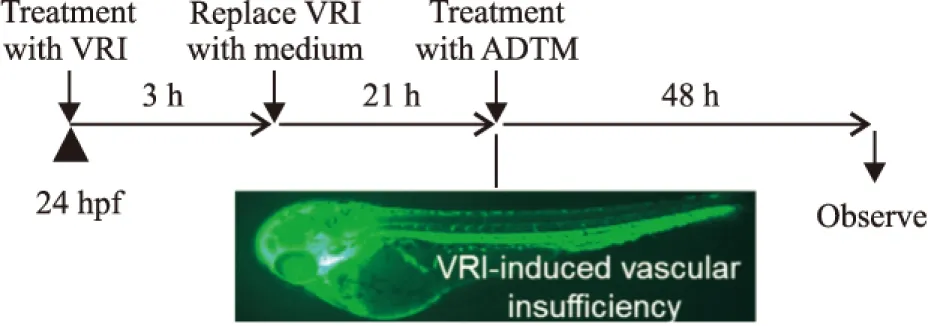
Fig 4 Schematic illustration of experimental plan on VRI induced vascular insufficiency in zebrafish
2.4用qPCR的方法对转录组测序数据的验证
对挑选的4个关键基因(GSK-3β、BRAF、Sema3ab和IL1B)进行荧光定量PCR验证。实验结果表明(Tab 1),4个基因的PCR结果变化趋势与转录组中获得的序列完全吻合,说明这4个基因确实在斑马鱼体内表达,并且斑马鱼转录组测序结果准确可靠。
3讨论
血管创伤、缺血性心脏病、伤口愈合缓慢和闭塞性脉管炎等都是临床常见病,是影响人类健康的重要因素之一,而血管生长不足则是这些疾病共同的重要病理生理基础。因此,开展促血管新生作用的研究对诸多血管新生不足相关疾病的防治有着重要意义。我们先前建立的斑马鱼模型,用来评价药物对斑马鱼血管生成的作用效果,其中特定增强型绿色荧光蛋白(EGFP)表达在内皮细胞,允许实时观察血管系统体内动态变化的过程。斑马鱼凭借其独特的优势成为干预血管新生药物筛选的理想模型。VRI是一种可以抑制血管内皮生长因子受体1-2的化合物,在抗血管新生和抗癌方面有潜在的开发价值[13]。用VRI来模拟血管新生功能缺陷的模型,具有靶点清晰、针对性强等优势[8]。本研究以斑马鱼为模型,探讨丹参素衍生物对斑马鱼正常血管新生的干预作用,以及对VRI损伤血管的修复效果。研究发现,ADTM处理48 h后,明显增加正常斑马鱼的SIVs血管直径,对VRI诱导的血管损伤有明显的修复作用。以上结果表明,ADTM有促血管新生的作用。其次,转录组学研究表明,ADTM的促血管新生作用可能与胰岛素信号通路的激活有关。

Fig 5 Effects of ADTM on VRI induced vascular insufficiency in±s,n=12)
A:Embryo treated with 0.1% DMSO at 48 hpf for 48 h;B: Embryo treated with 300 nmol·L-1VRI at 48 hpf for 48 h;C~E:Embryo treated with 50,100,200 μmol·L-1ADTM, respectively before VRI exposure;F:ADTM restored VRI-induced vascular insufficiency in zebrafish.#P<0.05vscontrol group;*P<0.05vsVRI group
转录组是特定细胞在某一功能状态下所能转录出的所有RNA的总和,主要包括mRNA和非编码RNA。转录组测序(RNA-Seq)是最近发展起来的利用深度测序技术进行转录分析的方法,这种技术已经改变了我们对真核转录认识的程度和复杂性,与其它技术相比,RNA-Seq能更准确地测量哺乳动物转录水平[14]。我们的研究结果表明,ADTM的促血管新生作用可能与胰岛素信号通路的调控有关。近几年胰岛素抵抗综合征的发病率和死亡率在不断增加,其中大部分是由于心血管疾病的影响而增加的风险[15]。文献报道表明,血管内皮细胞是胰岛素作用的重要细胞,胰岛素在维持血管内皮正常功能中起重要作用。对胰岛素耐受或血管内皮细胞功能紊乱进行治疗,可以降低心血管疾病的病变和死亡率[16]。因此,ADTM通过激活胰岛素信号通路,发挥促血管新生和血管修复的效果。
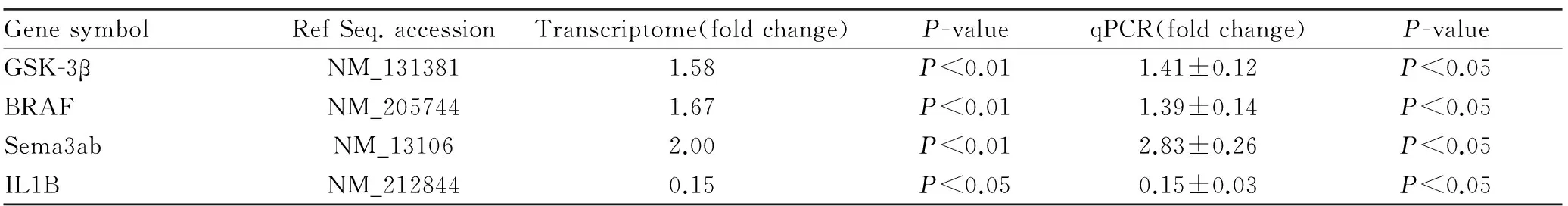
Tab 1 Comparison of fold change in expression of selected genes by transcriptome and qPCR
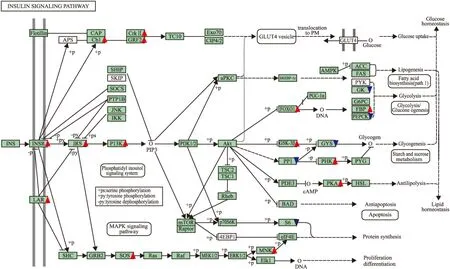
Fig 6 Analysis of insulin signaling pathway in gene expression profile of ADTM and VRI treated zebrafish
The insulin signaling pathway is overlaid with gene expression color criteria and ratios of gene expression from KEGG pathway: red triangle, significantly upregulated by ADTM(ADTM+VRvsVRI,P<0.01); blue triangle, significantly downregulated by ADTM(ADTM+VRIvsVRI,P<0.01); no triangle, not significantly changed or not detected.
综上所述,ADTM对正常和血管损伤的斑马鱼模型,均有促血管新生的效果,其作用机制可能与胰岛素信号通路的激活有关。ADTM表现出心脏保护、神经保护和促血管新生的药理学作用,具有“脑心同治”的功效,其一药多种功能的作用机制及其多种功能间是否存在共同的药物靶点或信号通路,值得进一步研究和探索。
参考文献:
[1]Jia Y L, Leung S W, Lee M Y, et al. The efficacy of guanxinning injection in treating angina pectoris: systematic review and meta-analysis of randomized controlled trials[J].EvidBasedComplementAlternatMed, 2013, 2013:282707.
[2]Cui Q B, Chen Y H, Zhang M J, et al. Design, synthesis, and preliminary cardioprotective effect evaluation of danshensu derivatives[J].ChemBiolDrugDes, 2014, 84(3): 282-91.
[3]Cui G Z, Shan L C, Hung M W, et al. A novel Danshensu derivative confers cardioprotection via PI3K/Akt and Nrf2 pathways[J].IntJCardiol, 2013, 168(2): 1349-59.
[4]Cui G Z, Shan L C, Guo L, et al. Novel anti-thrombotic agent for modulation of protein disulfide isomerase family member ERp57 for prophylactic therapy[J].SciRep, 2015, 5:10353.
[5]Cui G Z, Shan L C, Chu I K, et al. Identification of disulfide isomerase ERp57 as a target for small molecule cardioprotective agents[J].RSCAdv, 2015, 5(91): 74605-10.
[6]Cross L M, Cook M A, Lin S, et al. Rapid analysis of angiogenesis drugs in a live fluorescent zebrafish assay[J].ArteriosclerThrombVascBiol, 2003, 23(5): 911-2.
[7]金秋, 刘华钢, 蒙怡, 等. 氯化两面针碱对斑马鱼胚胎血管生成的影响[J]. 中国药理学通报, 2013,29(11): 1602-5.
[7]Jin Q, Liu H G, Meng Y, et al. Effects of nitidine chloride on angiogenesis in zebrafish embryos development[J].ChinPharmacolBull, 2013,29(11):1602-5.
[8]Li S, Dang Y Y, Oi Lam Che G, et al. VEGFR tyrosine kinase inhibitor Ⅱ(VRI) induced vascular insufficiency in zebrafish as a model for studying vascular toxicity and vascular preservation[J].ToxicolApplPharmacol, 2014, 280(3): 408-20.
[9]Tang J Y, Li S, Li Z H, et al. Calycosin promotes angiogenesis involving estrogen receptor and mitogen-activated protein kinase (MAPK) signaling pathway in zebrafish and HUVEC[J].PLoSOne, 2010, 5(7): e11822.
[10]李菲, 黄晓慧, 龚其海, 等. 淫羊藿苷对受损斑马鱼胚胎血管发生的促进作用[J]. 遵义医学院学报, 2014, 37(4): 397-9.
[10]Li F, Huang X H, Gong Q H, et al. Effect of icariin on the angiogenesis of impaired-vessel of zebra fish embryo[J].JZunyiMedUniv,2014,37(4):397-9.
[11]Li S, Lou S, Lei B U, et al. Transcriptional profiling of angiogenesis activities of calycosin in zebrafish[J].MolBiosyst, 2011, 7(11): 3112-21.
[12]Taniguchi C M, Emanuelli B, Kahn C R. Critical nodes in signalling pathways: insights into insulin action[J].NatRevMolCellBiol, 2006, 7(2): 85-96.
[13]Furet P, Bold G, Hofmann F, et al. Identification of a new chemical class of potent angiogenesis inhibitors based on conformational considerations and database searching[J].BioorgMedChemLett, 2003, 13(18): 2967-71.
[14]Mortazavi A, Williams B A, McCue K, et al. Mapping and quantifying mammalian transcriptomes by RNA-Seq[J].NatMethods, 2008, 5(7): 621-8.
[15]Laakso M, Kuusisto J. Insulin resistance and hyperglycaemia in cardiovascular disease development[J].NatRevEndocrinol, 2014, 10(5): 293-302.
[16]Munir K M, Chandrasekaran S, Gao F, et al. Mechanisms for food polyphenols to ameliorate insulin resistance and endothelial dysfunction: therapeutic implications for diabetes and its cardiovascular complications[J].AmJPhysiolEndocrinolMetab, 2013, 305(6): E679-86.
Effect of Danshensu derivative on angiogenesis in zebrafish
CUI Guo-zhen1,2,XU Yan-ling2,SUN An-lu1,SHAN Lu-chen3,WANG Yu-qiang3,LI Ming-yuan2
(1.ZhuhaiKeyLaboratoryofBasicandAppliedResearchinChineseMedicine,DeptofBioengineering,ZhuhaiCampusofZunyiMedicalCollege,ZhuhaiGuangdong519041,China; 2.StateKeyLaboratoryofQualityResearchinChineseMedicineandInstituteofChineseMedicalSciences,UniversityofMacau,Macao999078,China; 3.InstituteofNewDrugResearch,CollegeofPharmacy,JinanUniversity,Guangzhou510632,China)
Abstract:AimTo investigate the pro-angiogenic effects of Danshensu derivative ADTM and explore its underlying possible signaling pathway using zebrafish embryos asinvivomodels.MethodsThe angiogenesis activities of ADTM were determined in experimental models of normal and VEGFR tyrosine kinase inhibitor Ⅱ(VRI)-induced vascular defective zebrafish embryos. Embryos were treated with various concentrations(50,100,200 μmol·L-1) of ADTM for indicated time. The diameter and the numbers of endothelial cells of zebrafish SIVs were evaluated, respectively. In VRI model, the number of intact and defective ISVs in each zebrafish embryo was counted. The total RNA of zebrafish embryos was extracted and transcriptional profiling was analyzed by deep sequencing. Quantitative real-time PCR(qPCR) was performed to 4 genes selected from transcriptional profiling to validate the data collected from transcriptome analysis.ResultsADTM significantly increased subintestinal vessels (SIVs) diameter in a concentration-dependent manner in normal zebrafish as well as restored VRI-induced blood vessels defect in VRI-exposed zebrafish. The transcriptome data analysis demonstrated that 19 significantly changed genes were mapped to insulin signaling pathway.The qPCR data are in good agreement with those obtained by deep sequencing and support the consistency between the two methods for determining relative expression levels in the zebrafish model.ConclusionIn zebrafish model, ADTM exhibits the effects of angiogenesis and blood vessel restoration. The underlying mechanism may be involved in the activation of insulin signaling pathway.
Key words:Danshensu derivative; angiogenesis; vascular repair; zebrafish, transcriptome; insulin signaling pathway
收稿日期:2016-01-19,修回日期:2016-02-26
基金项目:国家自然科学基金资助项目(No 81460552,81328025);珠海市优势学科建设项目资助和澳门科技发展基金资助项目(No 078/2011/A3,134/2014/A3)
作者简介:崔国祯(1978-),男,博士,副教授,硕士生导师,研究方向:心脑血管药理学,E-mail: cgzum@hotmail.com;
doi:10.3969/j.issn.1001-1978.2016.06.012
文献标志码:A
文章编号:1001-1978(2016)06-0795-06
中国图书分类号:R-332;R322.123;R364.3;R347.8;R394.2
网络出版时间:2016-5-25 15:39网络出版地址:http://www.cnki.net/kcms/detail/34.1086.R.20160525.1539.024.html
李铭源(1972-),男,博士,教授,博士生导师,研究方向:心脑血管药理学,通讯作者,E-mail: simonlee@umac.mo
