纳米颗粒对人食管癌EC-9706、EC-109细胞增殖和凋亡的影响
2016-07-07韩鹏黎吕朋举龚芬芬朱怡然
韩鹏黎,孙 蕾,吕朋举,龚芬芬,马 超,陈 国,朱怡然,夏 天,曹 巍
(1.郑州大学附属郑州中心医院转化医学中心,河南 郑州 450007;2.华中师范大学生命科学学院,湖北 武汉 430000)
纳米颗粒对人食管癌EC-9706、EC-109细胞增殖和凋亡的影响
韩鹏黎1,孙蕾1,吕朋举1,龚芬芬1,马超1,陈国1,朱怡然2,夏天1,曹巍1
(1.郑州大学附属郑州中心医院转化医学中心,河南 郑州450007;2.华中师范大学生命科学学院,湖北 武汉430000)
摘要:目的研究氧化铜(CuO)、氧化锌(ZnO)、二氧化钛(TiO2)纳米颗粒在体外对人食管鳞状癌细胞系EC-9706和EC-109增殖的影响及其部分作用机制。方法使用透射电镜(TEM)、动态光散射(DLS)鉴定纳米颗粒物的理化性质,然后将不同浓度的TiO2、CuO、ZnO(5~80 mg·L-1)与体外培养的EC-9706和EC-109细胞孵育,四甲基偶氮唑盐(MTT)法检测细胞生长抑制率,流式细胞术(FCM)法检测细胞周期及凋亡率,Transwell小室法检测细胞侵袭能力,蛋白免疫印迹法检测细胞中Bcl-2和caspase-3蛋白表达情况。结果实验所用的纳米CuO、ZnO、TiO2颗粒为球形,粒径分别为12、20.6、12 nm。在水中与细胞培养液中聚集成较大颗粒并带负电。随着纳米颗粒浓度的增加,纳米CuO和ZnO颗粒可剂量依赖性抑制食管鳞癌细胞的增殖,G0/G1期细胞的比率上调,G2/M期的比率下降,并促进凋亡率增加,侵袭力下降;纳米颗粒处理48 h后,与对照组相比,活化caspase-3表达量明显升高,Bcl-2表达量明显下降(P<0.05)。纳米TiO2颗粒对食管鳞癌细胞的增殖、凋亡和侵袭能力无明显的影响。结论与纳米TiO2相比,一定浓度的CuO和ZnO纳米颗粒可有效抑制食管鳞癌细胞的生长,阻滞细胞周期于G0/G1期,并诱导其凋亡,这可能是其抑制食管癌细胞功能的作用机制之一。
关键词:食管癌;氧化铜纳米颗粒;氧化锌纳米颗粒;二氧化钛纳米颗粒;细胞增殖;凋亡
食管癌是我国最为高发的恶性肿瘤之一,世界范围内食管癌的发生率位列恶性肿瘤的第8位,死亡率为第6位[1],5年生存率低于15%[2]。在我国大部分地区,尤其是高发区河南省林州市,仍然是导致人死亡的主要原因之一[3]。而我国食管癌的发病率居世界第1位,发病人数占世界总数的60%。研究表明,基因突变、抑癌基因失活、等位基因高频率杂合性缺失等都可促进食管癌的发生发展[4]。近年来,虽然人们对食管癌的分子发生机制有了不少的认识,对食管癌的治疗方法也不断进步,但是,其5年治愈率仍在10%~15%。因此,研究食管癌的发生发展机制,寻求新的治疗方法显得尤为重要。
纳米颗粒在人们的生活中随处可见,由于它们具有独特的理化性质,有别于微米级的颗粒,可以明显提高产品功能。目前,纳米颗粒已经在日常用品、医疗卫生、电子产品、食品药物中广泛应用。例如,ZnO和TiO2纳米颗粒被应用在防晒霜中,CuO被用于杀虫剂与油漆中。然而,这些独特的理化性质一方面有可能在接触人体后会对人体造成危害,另一方面可以应用它们的这些理化特性来治疗疾病,如癌症。ZnO、TiO2和CuO对细胞的毒性作用已有研究报道,例如氧化铜纳米颗粒通过诱导自噬反应,诱导非小细胞肺癌A549细胞死亡[5],氧化铜纳米颗粒可与自噬抑制剂结合并诱导乳腺癌MCF-7细胞的凋亡[6],二氧化钛纳米颗粒在急性照射下会对A549细胞产生毒性[7]等,但是对食管癌细胞的影响目前还研究甚少。因此,研究纳米颗粒对食管癌的杀伤机制显得极为重要。本研究将探讨3种不同纳米颗粒CuO、ZnO、TiO2在体外对人食管鳞状细胞癌EC-9706和EC-109细胞增殖及凋亡的影响,并探讨部分的作用机制,为进一步开发纳米颗粒为抗食管癌药物提供理论依据。
1材料与方法
1.1细胞
人食管癌细胞株EC-9706和EC-109购自中国科学院上海细胞库,EC-9706和EC-109都是人食管高分化鳞状细胞株。
1.2试剂
3种纳米CuO、ZnO、TiO2颗粒购自Sigma Aldrich;RPMI 1640培养液、胎牛血清均购自HyClone公司; DMSO和四甲基偶氮唑蓝(MTT)购自美国Sigma公司;Annexin-Ⅴ-FITC 凋亡试剂盒和PI单染周期试剂盒购自上海碧云天公司;蛋白提取试剂盒和ECL 发光试剂盒购自上海碧云天生物技术有限公司;Bcl-2、caspase-3、β-actin抗体、 山羊抗兔 IgG均购于Abcam公司。
1.3纳米CuO、ZnO、TiO2悬液的制备
称取一定量的3种纳米CuO、ZnO、TiO2颗粒,用不含内毒素的无菌水溶解纳米干粉材料,超声处理30 s,制成颗粒储备液(8 g·L-1),应用此储备液配制所需的细胞培养悬浮液,配置之前用超声处理后立即用于细胞实验。
1.4CuO、ZnO、TiO2纳米颗粒的表征
透射电镜(TEM)用于确定纳米材料初级颗粒的大小和形态,动态光散射(DLS)描述纳米颗粒在水中及细胞培养液中的流体动力学大小、同时检测纳米材料悬浮液的zeta电位。
1.5MTT法检测细胞生长抑制率
取对数生长期的细胞,调整细胞密度为5×107·L-1,接种于96孔培养板中,每孔100 μL,培养24 h后,实验组分别加入CuO、ZnO、TiO2溶液,每个浓度均设3个复孔。同时设空白组、阴性对照组。培养48 h后,每孔加入MTT(5 g·L-1)溶液20 μL,继续培养4h。吸弃上清液,加入DMSO每孔150 μL,震荡混匀后,用酶联免疫检测仪测570 nm波长下各孔的吸光度(A)值,按以下公式计算细胞的生长抑制率。
细胞生长抑制率/%=(1-实验组平均A值/对照组平均A值)×100%。
1.6碘化丙啶PI单染法检测细胞周期
取对数生长期的细胞,以2×105个/孔接种于6孔板中,培养24 h后,实验组分别加入CuO、ZnO、TiO2(杀伤率均为75%的剂量),对照组加入等体积培养液,培养48 h后收集细胞,用PBS洗涤细胞2次,1 000×g离心5 min,弃上清液。加入预冷的70%乙醇固定,于4℃下保存过夜。用流式细胞仪分析,按Cell Quest软件检测并分析细胞周期情况。
1.7AnnexinⅤ-FITC/PI 双染色法检测细胞凋亡
实验分组同上,培养48 h后收集细胞,按Annexin Ⅴ-FITC/PI凋亡试剂盒说明书操作,于1 h内上流式细胞仪,用Cell Quest软件检测并分析细胞凋亡和死亡的情况。结果判断:FITC-/PI-为活细胞,FITC-/PI+为坏死细胞,FITC+/PI-为凋亡细胞,FITC+/PI+为凋亡后继发死亡的细胞。按以下公式计算细胞凋亡率。
细胞凋亡率/%=(凋亡细胞数+继发死亡细胞数)/全部细胞数×100%。
1.8Transwell小室法检测细胞侵袭力
用预冷不含血清的DMEM培养基稀释Matrigel胶,铺于8 μm小孔聚碳酸酯滤膜的培养小室内,接种200 μL无血清培养基稀释的各组EC-9706、EC-109细胞(1×108·L-1),下室加入900 μL含10%血清的DMEM培养液。37℃、5% CO2条件下培养24 h后,取出培养小室,用甲醇固定20 min。风干,0.1%结晶紫染色20 min,用湿棉签擦去上室底部基质胶及未侵袭细胞,将培养小室倒置,在光学显微镜下观察,并随机选取5个视野计数每高倍视野滤膜底面的平均细胞数。
1.9Western blot检测细胞中Bcl-2和caspase-3蛋白的表达
实验分组同上,提取作用48 h后的EC-9706、EC-109细胞总蛋白,Bradford法测定蛋白含量。取蛋白 30 μg,12% SDS-PAGE 凝胶电泳,恒压80 V电泳至分离胶,恒压120 V至电泳结束,电转印至甲醇激活的硝酸纤维素膜(PVDF)上(25 V、10 min);TBST配制5%脱脂牛奶室温封闭2 h,加入抗β-actin、抗Bcl-2、抗caspase-3一抗(1 ∶1 000)室温孵育1 h,TBST冲洗3次,每次10 min;二抗(1 ∶1 000) 室温孵育1 h,TBST冲洗3次,每10 min;ECL发光,CCD成像。图像用 Image J 1.48软件对各蛋白条带进行光密度值定量分析,用各目的蛋白条带光密度值同内参蛋白条带光密度值比较,得到的比值统计分析各蛋白的相对表达水平。实验重复3 次。
1.10统计学处理
2结果
2.1CuO、ZnO、TiO2纳米颗粒的表征
用TEM表征纳米CuO、ZnO、TiO2的粒径大小及晶体形状(Fig 1),结果说明纳米CuO、ZnO、TiO2的单一晶体颗粒的主要粒子大小为12、20.6、12 nm,呈球状;用DLS和激光粒度分布仪表征纳米CuO、ZnO、TiO2颗粒的流体动力学大小及悬浮液的zeta电位。见Tab 1。

Fig 1 Photos of CuO, ZnO and TiO2nanoparticles by TEM
2.23种不同纳米颗粒对EC-9706、EC-109细胞增殖的抑制作用
CuO和ZnO纳米颗粒在作用细胞EC-9706和EC-109 48 h后,随着纳米颗粒剂量的增大,细胞的增殖抑制率明显增加(P<0.05);而TiO2纳米颗粒对EC-9706和EC-109细胞的增殖无明显的抑制作用。见Fig 2。

Tab 1 Hydrodynamic size and zeta potential of CuO, ZnO and TiO2nanoparticles
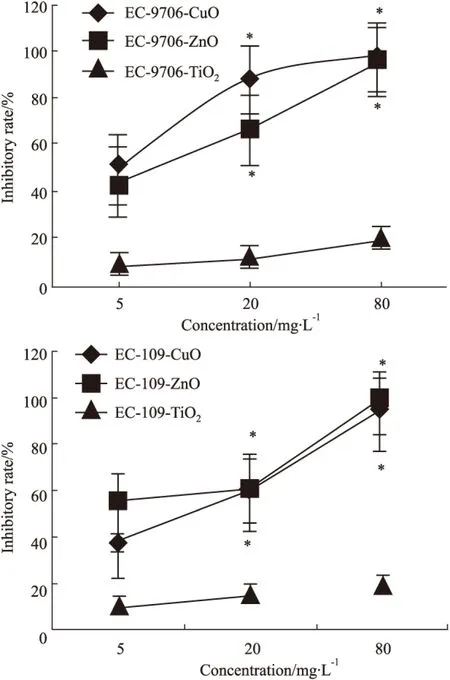
Fig 2 Inhibitory effects of three different nanoparticles in EC-9706 and EC-109 cells by MTT
*P<0.05vs5 mg·L-1
2.33种不同纳米颗粒对EC-9706、EC-109细胞周期的影响
选取抑制率75%左右的纳米颗粒浓度作用于EC-9706和EC-109细胞48 h后,PI单染法检测结果显示,CuO和ZnO纳米颗粒G0/G1期的细胞比率上升、G2/M期比率下降,与对照组相比,差异有统计学意义;TiO2纳米颗粒G0/G1期细胞比例、S期细胞比例、G2/M期细胞比例均变化不大,与对照组相比,差异没有统计学意义。见Fig 3。
2.43种不同纳米颗粒对EC-9706、EC-109细胞凋亡的影响
选取抑制率75%左右的纳米颗粒浓度作用于EC-9706和EC-109细胞48 h后,Annexin Ⅴ-FITC/PI 双染色法检测结果显示,CuO和ZnO纳米颗粒处理后与对照组相比,细胞凋亡率明显增加,差异有统计学意义(P<0.05);TiO2纳米颗粒组细胞凋亡率变化不大,与对照组相比,差异没有统计学意义。见Fig 4。
2.5Transwell体外侵袭实验
EC-9706和EC-109对照组侵袭细胞数分别为(152.70±15.64)和(126.58±20.37)个,和正常对照组相比,CuO和ZnO纳米颗粒处理组穿越Matrigel胶的细胞数明显减少(P<0.05),而TiO2纳米颗粒处理组与对照组之间差异均无统计学意义(P>0.05)。见Fig 5。
2.6Western blot检测凋亡相关蛋白表达
3种纳米颗粒作用EC-9706和EC-109细胞 48 h后,Western blot 检测caspase-3和Bcl-2的表达。分析结果显示,与对照组相比,实验组caspase-3表达量明显升高(P<0.05),Bcl-2表达量明显降低(P<0.05)。见Fig 6。
3讨论
纳米颗粒是一种人工制造的、大小不超过100纳米的微型颗粒。近年来,纳米科学的发展极大地促进了科学的进步,也给医学带来新的生机和挑战。纳米医学作为纳米科学与医学的交叉学科,给疾病的诊疗带来新的思路和方法。德国环境健康研究中心Moschini等[7]研究开发出了一种新型纳米颗粒载体,其可以在人类和小鼠的肺部肿瘤位点实现位点选择性地释放药物分子,这种方法或可增加当前癌症药物对肺癌的作用效果,提高药物的作用效率,而且可降低药物浓度,继而降低副作用。本研究发现,TiO2对食管癌细胞无明显毒性,表明可以作为药物载体治疗ESCC。
细胞增殖是通过细胞周期的运转来实现的,细胞周期调控异常与肿瘤的发生密切相关。在细胞周期进程中有两个限制点:G1/S期限制点和G2/M期限制点。G1/S期限制点作用主要是控制细胞从G1期进入S期,能防止受损的碱基复制,修复染色体中的突变。本实验结果显示,随着CuO和ZnO纳米颗粒浓度的增加,细胞EC-9706和EC-109的G0/G1期细胞比率上升,S期细胞百分比率逐渐下降。结果提示,纳米CuO和ZnO颗粒可以使细胞阻滞在G0/G1期,导致进入S期细胞数减少,不能进行DNA的合成,最终导致生长抑制。而纳米TiO2颗粒对细胞EC-9706和EC-109的G0/G1期细胞比率无明显影响。有研究证实,纳米Fe3O4颗粒可致细胞微管和微丝的破裂[10-11],将会直接影响细胞的有丝分裂,这可能是造成细胞阻滞的中心环节,我们推测这也可能是纳米CuO和ZnO颗粒影响细胞周期进程的一个重要途径,下一步我们将进行验证。
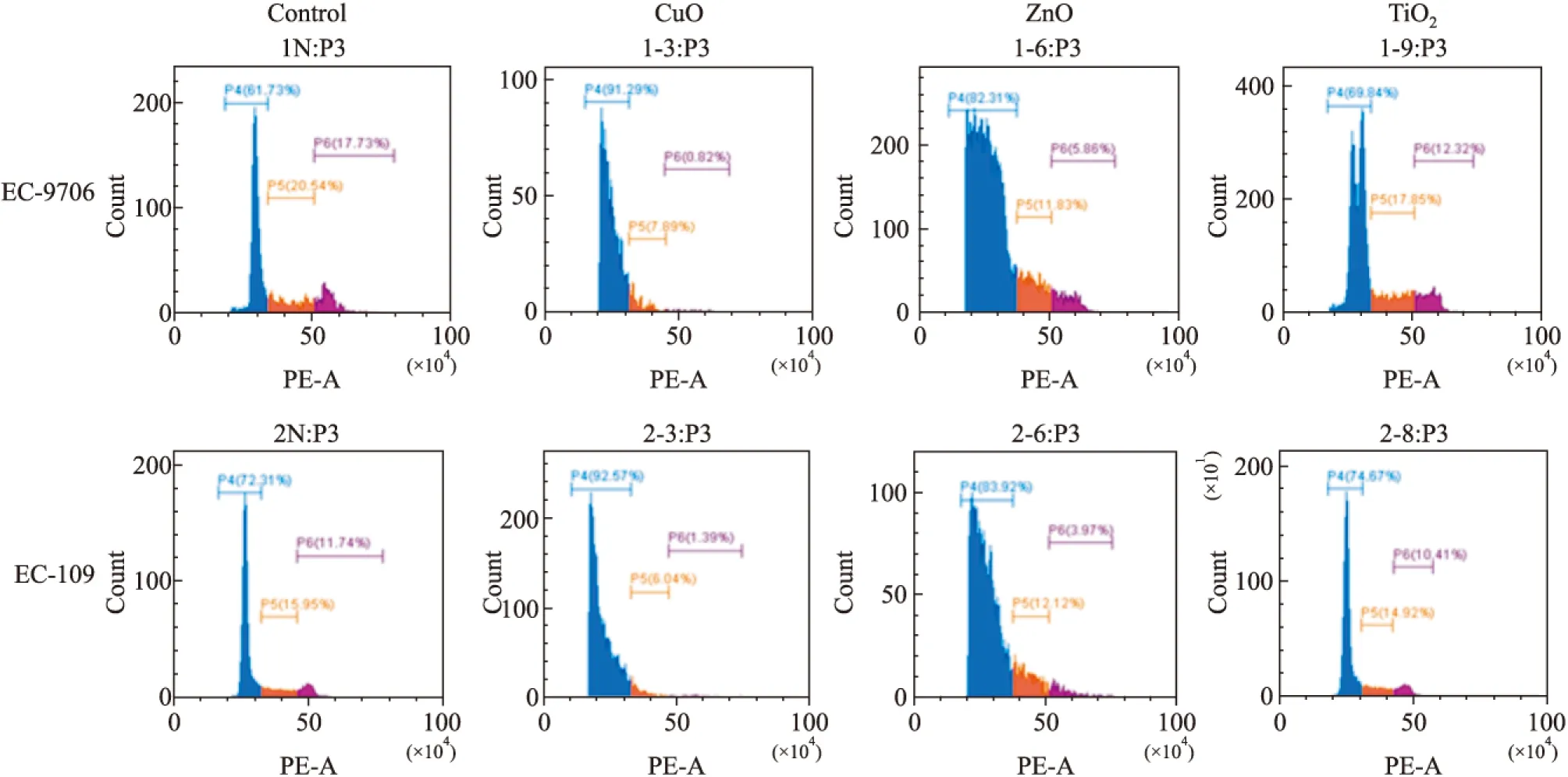
Fig 3 Effects of three different nanoparticles on cell cycle of EC-9706 and EC-109 cells

Fig 4 Effects of three different nanoparticles on cell apoptosis of EC-9706 and EC-109 cells
细胞凋亡在肿瘤的发生发展中起重要作用,细胞凋亡被视为评估肿瘤治疗疗效的一项指标。诱导细胞凋亡的刺激信号有很多,如DNA损伤、离子稳态失衡等。有研究证实,超顺磁氧化铁纳米材料可造成细胞线粒体膜电位下降,从而引起线粒体膜内外一系列的生化改变,如释放细胞色素C、Bcl-2家族及caspase活化等,引起细胞凋亡的级联反应,最终导致细胞凋亡[12],这可能将是纳米ZnO和CuO诱导细胞凋亡的一个重要途径。caspase 家族是一类半胱氨酸蛋白酶,在细胞凋亡过程中起着重要的作用[9],caspase-3是哺乳动物细胞凋亡中的关键蛋白酶。当接收到细胞凋亡信号的刺激,Bcl-2表达降低,线粒体外膜通透性升高,引起细胞色素C释放到胞质中,激活Apaf-1,裂解相应的胞质胞核底物,活化 caspase-3,最终导致细胞凋亡。本实验证实,纳米颗粒处理细胞48 h后,与对照组相比,活化caspase-3表达量明显升高,抑凋亡基因Bcl-2表达下降,从而造成细胞凋亡增加,这与流式检测凋亡结果也是一致的。提示诱导肿瘤细胞凋亡可能是CuO和ZnO纳米颗粒抗肿瘤的作用机制。纳米CuO和ZnO颗粒诱导细胞凋亡可能是一个多途径参与的复杂过程,其中许多调控环节有待进一步研究。

Fig 5 Effects of three different nanoparticles on invasive ability of EC-9706 and EC-109 cells by Transwell
*P<0.05vscontrol
本研究所用ZnO和CuO杀伤细胞机制主要是溶解和释放有毒的Zn和Cu离子,这些离子可以对细胞有杀伤作用,作用机制涉及氧化应激。低水平的氧化应激引发细胞表达抗氧化蛋白如过氧化氢酶、超氧化物歧化酶等;中等水平的氧化应激引发促炎症因子的表达,如细胞因子等;高水平的氧化应激引发线粒体依赖的细胞凋亡[13-14]。本研究中ZnO和CuO对两种食管癌细胞的毒性作用机制包括细胞凋亡,同时一个新发现是它们同时抑制食管癌细胞的侵袭能力,显示可能对癌症转移有抑制作用。
综上所述,CuO和ZnO颗粒有抑制EC-9706和EC-109细胞增殖的作用,并可诱导细胞凋亡,降低细胞侵袭,可作为潜在的抗食管癌化合物;TiO2对食管癌细胞无明显毒性,考虑可以作为新型纳米颗粒载体治疗肿瘤,如装载化疗药物或核酸片段靶向杀死肿瘤细胞,以达到治疗ESCC的作用,本研究为食管癌的治疗提供了新的思路。有关CuO和ZnO颗粒杀伤肿瘤细胞的作用机制有待进一步研究。
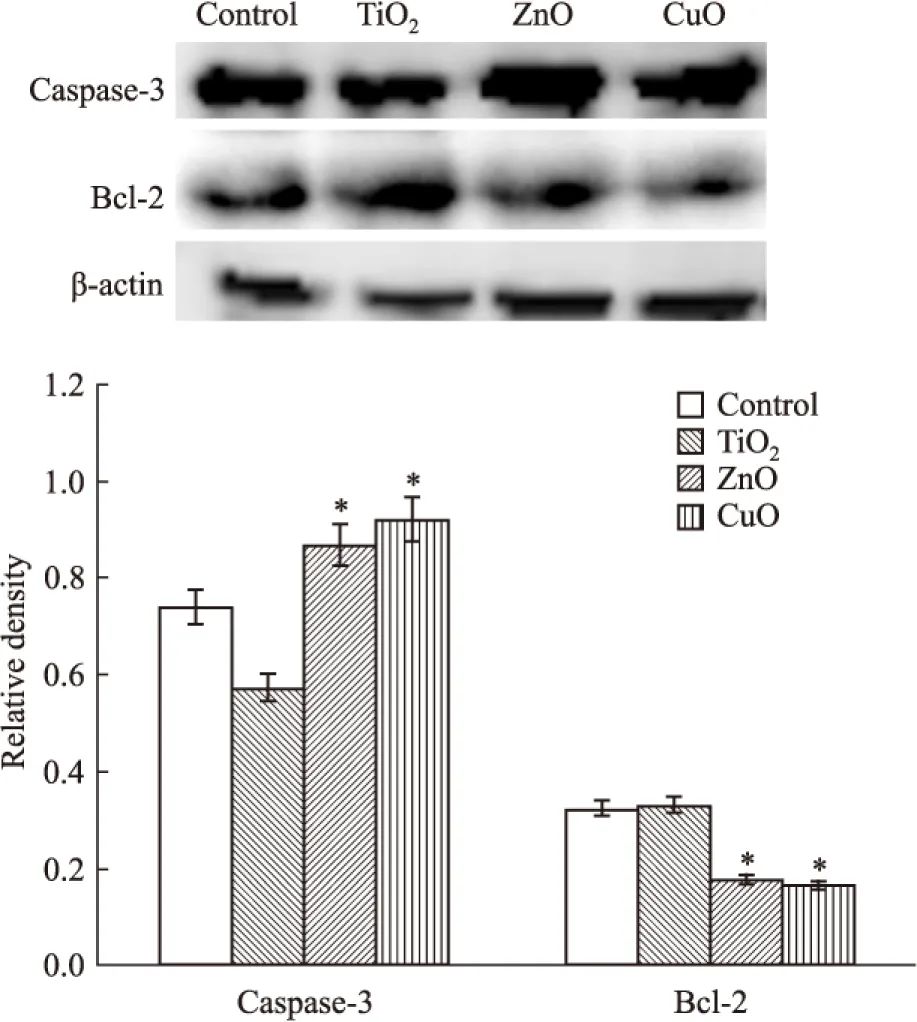
Fig 6 Effects of three different nanoparticles on expression levels of Bcl-2 and caspase-3 proteins in EC-9706 and EC-109 cells
*P<0.05vscontrol
参考文献:
[1]Enzinger P C, Mayer R J. Esophageal cancer[J].NEnglJMed, 2003, 349(23):2241-52.
[2]Jemal A, Murray T, Ward E, et al. Cancer statistics, 2005[J].CACancerJClin, 2005, 55(1):10-30.
[3]Cao W, Chen X F, Dai H F, et al. Mutation spectra of P53 in geographically localized esophageal cancer groups in China[J].Cancer, 2004, 101(4):834-44.
[4]李昀, 张军航, 安军, 等. PLCE1调控p53诱导食管癌细胞凋亡的实验研究[J]. 中国药理学通报, 2015, 31(1):82-6.
[4]Li Y, Zhang J H, An J, et al. PLCE1 modulates p53 expression and apoptosis in esophageal cancer cells[J].ChinPharmacolBull, 2015, 31(1):82-6.
[5]Sun T, Yan Y, Zhao Y, et al. Copper oxide nanoparticles induce autophagic cell death in A549 cells[J].PLoSOne,2012,7(8):e43442.
[6]Laha D, Pramanik A, Maity J, et al. Interplay between autophagy and apoptosis mediated by copper oxide nanoparticles in human breast cancer cells MCF7[J].BiochimBiophysActa,2014,1840(1):1-9.
[7]Moschini E, Gualtieri M, Colombo M, et al. The modality of cell-particle interactions drives the toxicity of nanosized CuO and TiO2in human alveolar epithelialcells[J].ToxicolLett,2013,222(2):102-16.
[8]van Rijt S H, Bölükbas D A, Argyo C, et al. Protease-mediated release of chemotherapeutics from mesoporous silica nanoparticles to ex vivo human and mouse lung tumors[J].ACSNano, 2015,9(3):2377-89.
[9]Chopra M, Das P, Sharma A C. caspase-3 knock-down reverses contractile dysfunction induced by sepsis in adult rat ventricular myocytes[J].BrJPharmacol, 2010, 160(1):93-100.
[10]Berry C C, Wells S, Charles S, et al. Dextran and albumin derivatised iron oxide nanoparticles: influence on fibroblastsinvitro[J].Biomaterials,2003,24(25):4551-7.
[11]Auffau M, Decome L, Rose J, et al.Invitrointeractions between DMSA-coated maghemite nanoparticles and human fibroblasts: a physicochemical and cyto-genotoxical study[J].EnvironSciTechnol,2006,40(14):4367-73.
[12]李俊峡, 张卓立, 张莉代, 等. 超顺磁性氧化铁纳米粒子成肌细胞及其对细胞活性的影响[J]. 河北医药,2007, 29(2):102-4.
[12]Li J X, Zhang Z L, Zhang L D, et al. Experimented study on cell viability of SPIO-labeled myoblasts[J].HebeiMedJ, 2007, 29(2): 102-4.
[13]Xia T, Kovochich M, Liong M, et al. Comparison of the mechanism of toxicity of zinc oxide and cerium oxide nanoparticles based on dissolution andoxidative stress properties[J].ACSNano,2014,2(10):2121-4.
[14]Li R, Ji Z, Qin H, et al. Interference in autophagosome fusion by rare earth nanoparticles disrupts autophagic flux and regulation of an interleukin-1β producing inflammasome[J].ACSNano,2014,8(10):10280-92.
Effects of three kinds of nanoparticles on proliferation and apoptosis of esophageal squamous carcinoma cells
HAN Peng-li1, SUN Lei1, LYU Peng-ju1, GONG Fen-fen1,MA Chao1, CHEN Guo1,ZHU Yi-ran2, XIA Tian1, CAO Wei1
(1.TranslationalMedicineCenter,ZhengzhouCentralHospitalAffiliatedtoZhengzhouUniversity,Zhengzhou450007,China;2.SchoolofLifeScience,CentralChinaNormalUniversity,Wuhan430000,China)
Abstract:AimTo study the effects of CuO, ZnO and TiO2nanoparticles on the viability and metastatic potential of EC-9706 and EC-109 esophageal squamous carcinoma cell lineinvitro. MethodsCharacteristics of CuO, ZnO and TiO2nanoparticles were detected using transmission electron microscope(TEM) and dynamic light scattering(DLS). EC-9706 and EC-109 cells were treated with different concentrations of CuO, ZnO and TiO2(5~80 mg·L-1). The cell proliferation was analyzed by MTT assay. The cell cycle and apoptotic rates were determined by flow cytometry(FCM). The cell invasion was assayed in Transwell chambers. The expression of Bcl-2 and caspase-3 protein in cells was detected by Western blot method.ResultsCuO, ZnO and TiO2nanoparticles were spherical with primary particle size 12, 20.6, 12 nm. The particles were agglomerated in water and cell culture medium with negative charge. CuO and ZnO nanoparticles induced decreases in EC-9706 and EC-109 cell viability dose-dependently. After exposed to increasing concentrations of CuO and ZnO nanoparticles, the cell cycle analysis revealed a decreasing proportion of cells in G2/M and S phase, and up-regulation of the cells in G0/G1phase. Apoptotic cells also increased along with decreased cell invasion upon CuO and ZnO treatment. Nanoparticles treatment after 48 h, the activated caspase-3 expression quantity increased significantly and the Bcl-2 expression quantity decreased obviously(P<0.05) compared with control group. TiO2nanoparticles had no obvious effect on the EC-9706 and EC-109 cell proliferation, cell cycle, apoptosis and invasion.ConclusionCompared with TiO2, CuO and ZnO nanoparticles can inhibit EC-9706 and EC-109 cell viability and metastatic potential, the mechanism of action involves cell cycle arrest in G0/G1phase and apoptosis. These findings can help the development of nanoparticles as anti-cancer therapeutics for esophageal cancer.
Key words:esophageal cancer; CuO nano; ZnO nano; TiO2nano; cell proliferation; apoptosis
收稿日期:2016-01-21,修回日期:2016-03-02
基金项目:国家自然科学基金资助项目(No 31570899);河南省医学科技攻关计划项目(No 201403273)
作者简介:韩鹏黎(1987-),女,硕士,研究方向:肿瘤药理学,E-mail:hanpengli2013@163.com; 曹巍(1963-),男,博士,教授,研究方向:肿瘤病理学,通讯作者,E-mail:caoweiyu@hotmail.com
doi:10.3969/j.issn.1001-1978.2016.06.011
文献标志码:A
文章编号:1001-1978(2016)06-0789-06
中国图书分类号:R329.24;R329.25;R735.102.2;R916.3
网络出版时间:2016-5-25 15:39网络出版地址:http://www.cnki.net/kcms/detail/34.1086.R.20160525.1539.022.html
