印度梨形孢真菌对干旱胁迫下紫花苜蓿生长及抗旱性的影响
2016-07-05武美燕蒿若超张文英长江大学作物抗逆技术研究中心作物学重点实验室湖北荆州434025
武美燕,蒿若超,张文英(长江大学作物抗逆技术研究中心,作物学重点实验室,湖北 荆州 434025)
印度梨形孢真菌对干旱胁迫下紫花苜蓿生长及抗旱性的影响
武美燕,蒿若超,张文英*
(长江大学作物抗逆技术研究中心,作物学重点实验室,湖北 荆州 434025)
以紫花苜蓿为材料,通过盆栽砂培的方法,设置接种(40 m L含有印度梨形孢菌丝体的菌剂)+干旱(土壤含水量为田间最大持水量的15%~20%)、未接种(40 m L无菌水)+干旱、接种+正常供水(土壤含水量保持在田间持水量的75%~80%)、未接种+正常供水4个处理,研究印度梨形孢真菌与紫花苜蓿共生对干旱胁迫下紫花苜蓿生长及抗旱性的影响。结果表明,印度梨形孢真菌在紫花苜蓿根部定殖率较高,达87.4%;与未接种+干旱处理相比,接种印度梨形孢对干旱胁迫下紫花苜蓿地上部和根系有明显影响,其中,地上部鲜重、干重、叶绿素含量、叶片相对含水量及叶片数分别比未接种处理显著增加了63.4%,69.2%,12.5%,17.1%和5.7片,根系鲜重、干重、主根长及侧根数分别增加了33.3%,57.1%,5.1 c m和5条(P<0.05);与未接种+干旱处理相比,接种后的紫花苜蓿叶片超氧化物歧化酶(S O D)、过氧化物酶(P O D)、过氧化氢酶(C A T)、脯氨酸(Pro)和可溶性糖(SS)含量明显增强,分别是未接种处理的1.71,1.27,1.22,1.49和1.48倍(P<0.05),而超氧阴离子(O2-)与丙二醛(M D A)含量大幅度降低。因此,印度梨形孢真菌与紫花苜蓿共生可以促进干旱胁迫下紫花苜蓿生长,主要是通过刺激抗氧化酶活性和渗透调节物质的累积来抵抗干旱逆境。而在正常供水条件下,接种印度梨形孢没有明显的促进生长的作用。
紫花苜蓿;苗期;印度梨形孢;促进生长;抗旱
http://cyxb.lzu.edu.cn
武美燕,蒿若超,张文英.印度梨形孢真菌对干旱胁迫下紫花苜蓿生长及抗旱性的影响.草业学报,2016,25(5):78-86.
WU M ei-Yan,HAO Ruo-Chao,ZHANG W en-Ying.Effects of Piriformosporaindica fungus on growth and drought resistancein alfalfa under water deficit stress.Acta Prataculturae Sinica,2016,25(5):78-86.
随着温室效应的加剧,旱灾将进一步加重。目前,全球有1/3的土地处于干旱、半干旱状态,我国近50%的耕地处于干旱、半干旱地区[1]。干旱胁迫作为一种突出的非生物逆境,导致作物生长受到抑制、产量降低[2-3]。
紫花苜蓿(Medicagosativa)是世界范围广泛栽培的优质多年生豆科牧草之一[4],在我国主要分布在西北和华北的干旱、半干旱地区[5],其生长所需的水分主要依靠自然降水。水分供应不足成为产量形成的重要因素。尤其是在苗期遭遇干旱少雨,将严重影响紫花苜蓿出苗及成苗[6]。已有研究表明,接种丛枝菌根真菌、根瘤菌等根部共生菌可以提高紫花苜蓿抵抗干旱的能力[7-13]。
印度梨形孢(Piriformosporaindica)是印度科学家Verm a等[14]于1998年在印度西北部的塔尔沙漠中发现的,属担子菌门(Basidio m ycota),层菌纲(H y m eno m yeetes),梨形孢属(Piriformospora),该属真菌特点是只形成厚垣孢子,典型的厚垣孢子是梨形,目前,该属只有一个种,即印度梨形孢。该真菌的作用在很多方面与丛枝菌根真菌相似,它能够广泛定殖于单子叶和双子叶植物的根部,促进植物生长,并能够诱导植物产生系统抗性[15],提高作物对逆境胁迫的忍耐性。不同的是,印度梨形孢能在许多复杂的合成或半合成培养基上生长,不仅有助于理解该菌与植物间的互作机制,而且能为遗传育种、作物品种改良提供候选功能基因。而丛枝菌根真菌是营专性寄生的,不能进行纯培养[16]。目前,关于印度梨形孢真菌的研究主要集中在对植物的生长促进、提前开花和提高产量及病虫害防治等方面[15,17-26],在诱导植物逆境抗性方面,主要集中在抗旱、抗盐等,涉及的植物主要为大麦(Hordeum vulgare)、小麦(Triticum aestivum)、拟南芥(Arabidopsisthaliana)、小白菜(Brassica chinensis)、番茄(Lycopersiconesculentum)、烟草(Nicotiana tabacum)等[15,19,27-30],但在紫花苜蓿抗旱方面仅有本课题组在2013年进行了初步研究[31],研究结果表明,干旱胁迫条件下,接种印度梨形孢真菌有促进紫花苜蓿生长的作用,但其机理还不清楚。因此,本试验目的是在前期试验的基础上,进一步验证印度梨形孢真菌对干旱胁迫下紫花苜蓿生长的作用,并对其生理机理进行探讨,为印度梨形孢真菌在紫花苜蓿旱地栽培中的应用提供理论依据。
1 材料与方法
1.1 试验材料
供试菌株和供试紫花苜蓿品种农菁1号分别由德国耶拿大学Ralf Oelm üller博士和黑龙江省农业科学院草业研究所提供。
将印度梨形孢接种在P D A(马铃薯培养基配方:马铃薯200 g/L,葡萄糖20 g/L,琼脂粉15 g/L)固体培养基上,在30℃培养箱中黑暗培养72 h进行活化培养。切取P D A固体培养基上的小块真菌菌丝块,接种到曲霉(Aspergillus)液体培养基进行增殖培养,置于恒温摇床,转速为150 r/min,温度为30℃,黑暗培养7 d。过滤菌丝,用无菌水冲洗3~5次,1 g鲜重菌丝悬浮在100 m L无菌水中,放在三角瓶中备用。
1.2 试验方法
1.2.1 试验设计 试验于2014年5月实施,采用盆栽沙培方法,设干旱和接种2个试验因素,干旱设置干旱(保持土壤含水量为田间最大持水量的15%~20%)和正常供水(保持土壤含水量为田间最大持水量的75%~80%)2个处理水平,接种设置接种和不接种2个处理水平,完全随机设计,共4个处理组合,分别为接种+干旱、未接种+干旱、接种+正常供水、未接种+正常供水,每个处理重复4次。接菌方法:将1 kg高温灭菌河沙(121℃,3 h)与40 m L含有印度梨形孢菌丝体的菌剂混匀装入高12 c m、上口径15 c m、底径10 cm 的营养钵;不接种印度梨形孢处理则将等量无菌水与灭菌河沙混匀。将精选的紫花苜蓿种子用0.1%升汞灭菌处理后,播于装好的营养钵内,覆盖1 c m厚灭菌沙。每钵播种20粒,于培养室进行培养温度为(23±2)℃,光照时间16 h。
1.2.2 根样染色方法及定殖观测 出苗后15 d,随机选取紫花苜蓿幼苗根系,用自来水冲洗干净后再用蒸馏水冲洗3遍,剪成1 c m长小段,经10%Na O H浸泡4 h后洗净,再经1%H Cl浸泡5 min后洗净,最后用0.05%乳酸石炭酸棉蓝染色液染色制片,观察印度梨形孢真菌定殖情况并拍照[30]。
1.2.3 干旱处理方法 出苗后20 d进行间苗和定苗,每钵保留10株大小均匀一致的紫花苜蓿幼苗。采用干旱-复水方法进行胁迫处理,从出苗21 d(第3周)开始控水,通过称重法控制土壤水分到田间最大持水量的15%~20%,之后浇水至田间最大持水量的75%~80%,然后再次进行干旱胁迫,连续胁迫3个周期(每个周期10 d)。
1.2.4 测定指标 第3次干旱胁迫结束复水前,测定紫花苜蓿的主根长、侧根数、根鲜重、根干重、地上部鲜重、地上部干重、叶片数、叶绿素含量及叶片相对含水量。叶绿素含量采用SP A D-502型叶绿素仪测定;叶片相对含水量(R W C)采用烘干法,分别取各处理同等叶位叶片,用万分之一的电子天平称其鲜重,然后用蒸馏水浸泡24 h,取出后擦净叶片表面的水,再称饱和鲜重,最后在烘箱内105℃下烘8 h称干重,根据公式计算:
R W C(%)=(原始鲜重-干重)/(饱和鲜重-干重)
叶片超氧化物歧化酶(S O D)活性采用氮蓝四唑(N B T)光氧化还原法测定[32];过氧化物酶(P O D)活性采用愈创木酚法测定[32];过氧化氢酶(C A T)活性采用紫外吸收法测定[32];丙二醛(M D A)和可溶性糖含量采用双光组分光光度计法测定[32];叶片游离脯氨酸含量采用茚三酮法测定[32];超氧阴离子含量采用Elstner和H eupel[33]的方法测定。
1.3 数据分析
采用S A S 8.02版本软件进行数据处理及分析。
2 结果与分析
2.1 印度梨形孢真菌在紫花苜蓿幼苗根系定殖
印度梨形孢真菌与紫花苜蓿幼苗根系共生15 d后,经台盼蓝染色,在400×生物显微镜下可清晰的观察到该真菌在紫花苜蓿根部的细胞间和细胞内非常密集地定殖有椭圆形的厚垣孢子,如图1箭头所示。共检测135段1 c m长度印度梨形孢处理的紫花苜蓿根段,检测到孢子的小段数有118段,定殖率为87.4%。
2.2 印度梨形孢真菌对干旱胁迫下紫花苜蓿生长的影响
2.2.1 印度梨形孢真菌对干旱胁迫下紫花苜蓿地上部生长的影响 表1为不同处理对紫花苜蓿地上部生长的影响。可以看出,与未接种+干旱处理相比,接种对干旱胁迫下紫花苜蓿的地上部生长影响明显。接种+干旱处理地上部鲜重、干重、叶片数、叶绿素含量(SP A D值)和叶片相对含水量分别为0.116 g、0.026 g、16.7片、42.4 和80.5%,比未接种+干旱处理显著增加了69.2%、63.4%、5.7片、12.5%和17.1%(P<0.05)。从图2可以很直观地看到两个处理间的长势差别。与未接种+正常供水处理相比,接种+干旱处理明显提高了紫花苜蓿地上部生长,可以达到未接种且正常供水情况下的生长效果,但接菌+正常供水处理对紫花苜蓿地上部的促生效果不明显。
2.2.2 印度梨形孢真菌对干旱胁迫下紫花苜蓿根系生长的影响 表2为接种印度梨形孢对干旱胁迫下紫花苜蓿根系生长的影响。结果表明,与未接种+干旱处理相比,接菌对干旱胁迫下紫花苜蓿的根系生长影响较大。接种+干旱处理根系鲜重、干重、主根长和侧根数分别为0.120 g,0.021 g,15.3 c m和38条,比未接种处理显著增加了33.3%,57.1%,5.1 c m和5条,差异达到显著水平(P<0.05)。与未接种+正常供水处理相比,接种+干旱处理明显提高了紫花苜蓿根系的生长,可以达到未接种且正常供水情况下的生长效果,但接菌+正常供水处理没有明显促进紫花苜蓿根部生长的作用。
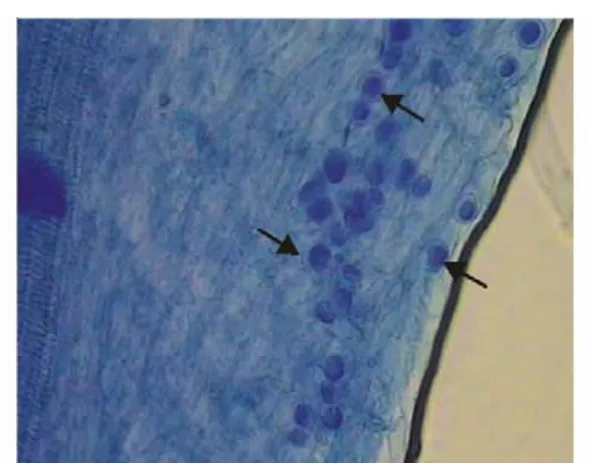
图1 印度梨形孢在紫花苜蓿根部定殖Fig.1 Colonization of P.indica spores in the root of alfalfa
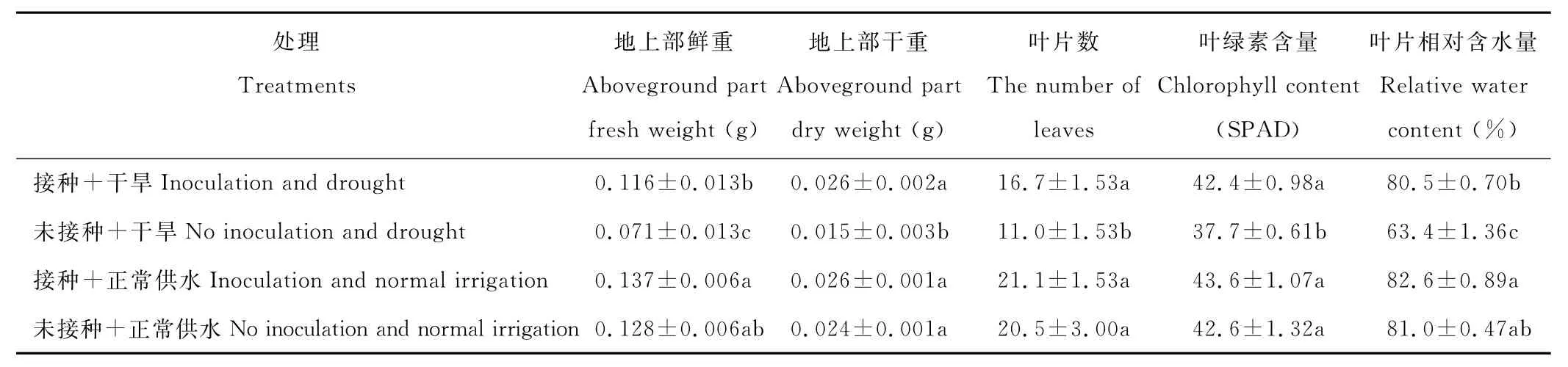
表1 印度梨形孢对干旱胁迫下紫花苜蓿地上部生长的影响Table 1 Effects of P.indica on aboveground part of alfalfa under drought stress
2.3 印度梨形孢真菌对干旱胁迫下紫花苜蓿抗旱生理特性的影响
2.3.1 印度梨形孢真菌对干旱胁迫下紫花苜蓿叶片保护酶活性的影响 图3为接种印度梨形孢对干旱胁迫下紫花苜蓿叶片超氧化物歧化酶(S O D)、过氧化物酶(P O D)及过氧化氢酶(C AT)活性的影响。结果表明,与未接种+干旱处理相比,接种+干旱处理显著增加了紫花苜蓿叶片S O D、P O D、C AT活性,三者分别为14.2 U/g F W,23.3 U/(m g·min),87.3 U/(g·min),是未接种+干旱处理的1.71,1.27和1.22倍(P<0.05)。与未接种+正常供水处理相比,接种+干旱处理也明显提高了紫花苜蓿叶片S O D、P O D、C A T活性,但接种+正常供水处理对3种酶活性影响不大。
2.3.2 印度梨形孢真菌对干旱胁迫下紫花苜蓿叶片超氧阴离子和丙二醛(M D A)含量的影响 由图4可以看出,与未接种+干旱处理相比,接种+干旱处理显著降低了紫花苜蓿叶片超氧阴离子与M D A含量(P<0.05),二者分别为43.6μg/g F W和3.8μm ol/g,比未接种+干旱处理分别降低了47.5%和55.3%,与未接种+正常供水处理的叶片超氧阴离子和M D A含量相差不大。正常供水条件下,接种处理的紫花苜蓿叶片超氧阴离子与M D A含量比未接种处理略有降低,但差异不显著。

图2 干旱胁迫下接种(+P.indica)与不接种(C K)紫花苜蓿生长状况Fig.2 Growth of alfalfa with P.indica inoculation and non-inoculation under drought stress
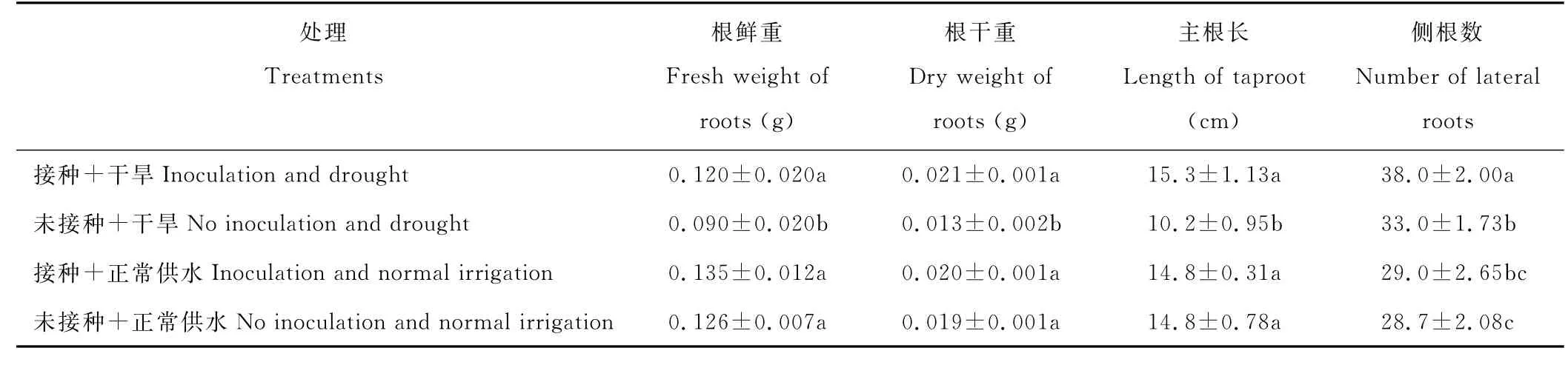
表2 印度梨形孢对干旱胁迫下紫花苜蓿根系生长的影响Table 2 Effects of P.indica on the root of alfalfa under drought stress
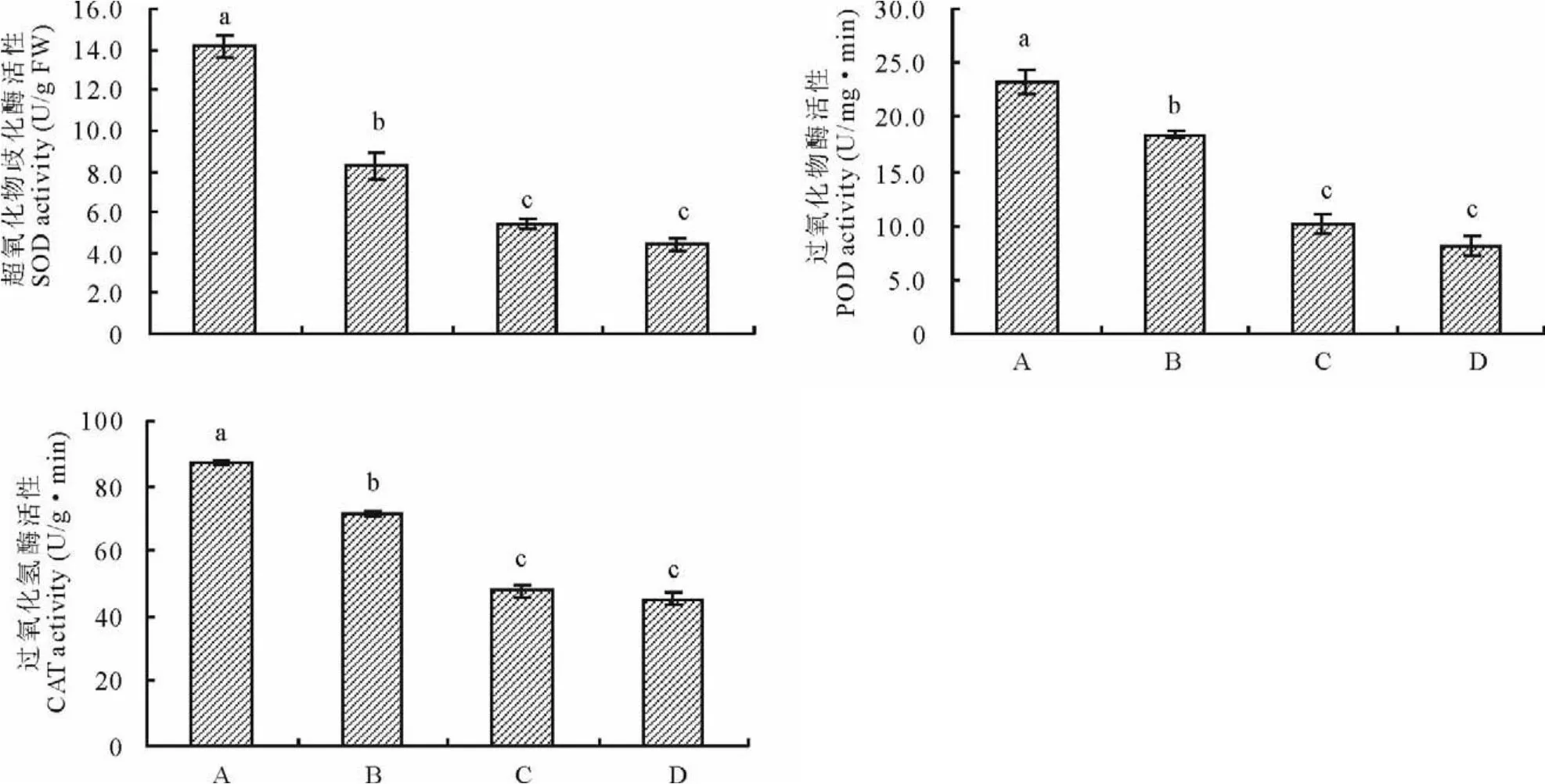
图3 印度梨形孢对干旱胁迫下紫花苜蓿叶片保护酶活性的影响Fig.3 Effects of P.indica on protective enzyme activities in the leaves of alfalfa under drought stress
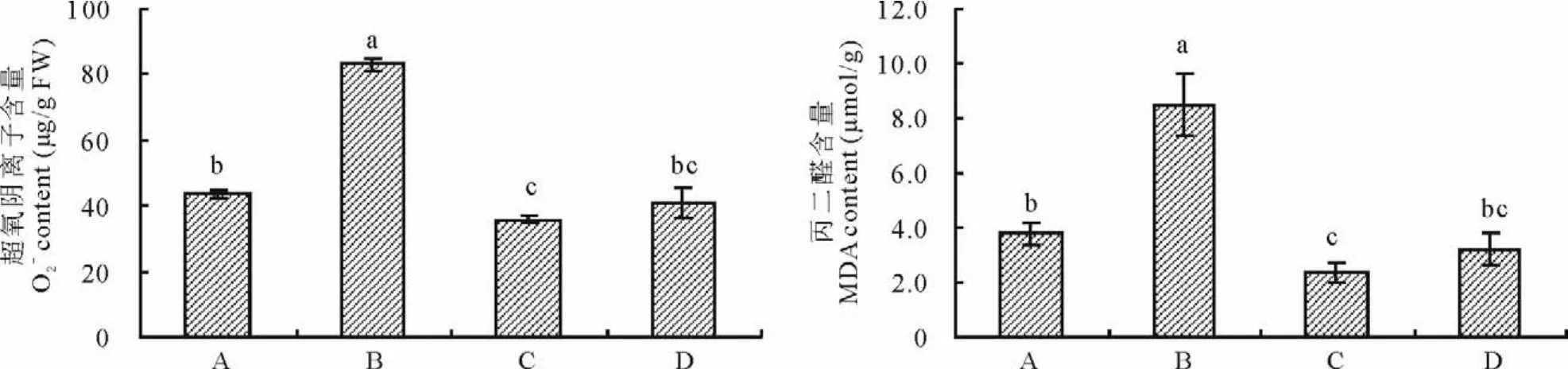
图4 印度梨形孢对干旱胁迫下紫花苜蓿叶片超氧阴离子和丙二醛含量的影响Fig.4 Effects of P.indica on the O2-and M D A content in the leaves of alfalfa under drought stress
2.3.3 印度梨形孢真菌对干旱胁迫下紫花苜蓿叶片渗透调节物质的影响 图5结果表明,与未接种+干旱处理相比,接种+干旱处理显著增加了紫花苜蓿叶片脯氨酸和可溶性糖含量,二者分别为146.6μg/g和374.4 μg/g F W,是未接种+干旱处理的1.49和1.48倍(P<0.05)。与未接种+正常供水处理相比,接种+干旱处理的叶片脯氨酸和可溶性糖含量明显增加,但接种+正常供水处理二者没有显著变化。

图5 印度梨形孢对干旱胁迫下紫花苜蓿叶片脯氨酸和可溶性糖含量的影响Fig.5 Effects of P.indica on the proline and soluble sugar content in the leaves of alfalfa under drought stress
3 讨论
已有研究表明,接种印度梨形孢的玉米(Zea mays)、芝麻(Sesamum indicum)等在遭受干旱胁迫后生长效果较好[34-35]。本试验结果表明,在干旱胁迫下,接种印度梨形孢的紫花苜蓿植株比未接菌的植株表现出更好的长势,这也进一步验证了本课题组在2013年得到的初步试验结果。
植物在遭受干旱胁迫时,干旱胁迫会首先导致植物脱水,进而影响其生理生化过程,同时在这个过程中,植物也会主动适应干旱胁迫,产生积极的生理生化和代谢变化[36]。叶片相对含水量反映了水分不足时,植物组织在蒸腾时的耗水程度和恢复能力的差异。有研究指出,干旱胁迫下能保持较高叶片相对含水量的紫花苜蓿其抗旱性较强[37]。本试验结果表明,接种印度梨形孢的紫花苜蓿在干旱胁迫时叶片相对含水量不但明显高于未接菌处理,而且与未接种+正常供水处理没有差异,原因可能是一些渗透调节物质(如脯氨酸、可溶性糖)的大量累积稳定了紫花苜蓿体内渗透压的平衡,增强其保水的能力[3],本试验数据也证实了这一推断,干旱胁迫下,接种后的紫花苜蓿叶片脯氨酸和可溶性糖含量是未接菌处理的1.49和1.48倍,且与未接种+正常供水处理差异不显著。这一研究结果说明印度梨形孢对维持紫花苜蓿叶片细胞含水量有很好的作用,可以在一定时间内减轻干旱胁迫的危害。因此,表现在地上部分和根系生长性状上优势明显。
此外,植物在长期进化过程中形成了包括S O D、P O D和C A T等抗氧化物酶保护系统,可以通过调节植物体内抗氧化物酶活性的含量来消除或减轻由干旱引发的活性氧伤害[38]。本研究中,接种印度梨形孢的紫花苜蓿在干旱胁迫下叶片S O D、P O D、C A T活性分别是未接菌处理的1.71,1.27和1.22倍,而超氧阴离子与M D A含量比未接种处理显著降低了47.5%和55.3%,表明印度梨形孢真菌与紫花苜蓿共生后刺激了3种保护酶活性的大幅度增加,使紫花苜蓿幼苗膜质过氧化程度减轻,抗氧化能力增强,从而使得干旱胁迫下的紫花苜蓿能够更好的生长。孙超[25]在小白菜上的研究结果表明,经印度梨形孢处理的小白菜的抗氧化酶活性急剧且快速增加,且活性峰值的出现早于或高于对照活性峰值的出现。
大量研究结果证实,正常栽培条件下,接种印度梨形孢真菌可促进作物生长[18-19,21,24-25,39],但本研究结果发现,在正常供水条件下,印度梨形孢与紫花苜蓿共生没有明显的促进生长的作用,是否不同作物有不同表现还需进一步探究。此外,印度梨形孢可诱导盐胁迫下烟草和蒺藜苜蓿(Medicagotruncatula)等抗盐相关基因的表达[40-41],因此,本试验后续相关研究主要应从紫花苜蓿抗旱相关基因及抗旱相关蛋白含量方面深入研究,进一步揭示印度梨形孢对紫花苜蓿抗旱的作用机制。
4 结论
印度梨形孢与紫花苜蓿共生可以促进干旱胁迫下紫花苜蓿地上部和根系生长,能够达到未接种且正常供水时的生长状况。接种印度梨形孢真菌主要刺激了紫花苜蓿叶片S O D、P O D、C A T活性大幅度增加,有效地减轻了超氧阴离子对叶片细胞的伤害,降低了M D A含量,渗透调节物质脯氨酸、可溶性糖含量在叶片细胞内大量累积,维持细胞相对含水量,从而提高紫花苜蓿对干旱胁迫的抗性。但在正常供水条件下,接种印度梨形孢真菌没有明显的促进生长的效果。
References:
[1]Jiang H,Bi Y F,Chen L X,etal.Physiological characteristics of alfalfa under dry-farming conditions.Acta A grestia Sinica,2012,20(6):1077-1080.
[2]Yang X L,Zhu Y J.A dvances of plant drought stress.A gricultural Engineering,2012,2(11):44-45.
[3]Q u T,Nan Z B.Research progress on responses and m echanis ms of crop and grass under drought stress.Acta Prataculturae Sinica,2008,17(2):126-135.
[4]Liu S S,Chen Y Y,Zhang D,etal.Isolation,identification,and biocontrol effects of Bacillus spp.fro m the rhizosphere of alfalfa.Acta Prataculturae Sinica,2015,24(9):96-103.
[5]Q uan R L,Y u Y X.Effects of waterlogging on antioxidant and anaerobic respiratory enzy m es in Medicagosativa varieties fro m southern and northern China.Acta Prataculturae Sinica,2015,24(5):84-90.
[6]Liu Y,Zhang C M,Xie X R,etal.Effect of drought stress on polya mine m etabolis m in the leaves and roots of alfalfa.Acta Prataculturae Sinica,2012,21(6):102-107.
[7]Kong J,Pei Z P,Du W,etal.Effects of A M fungi on the growth and drought resistance of alfalfa under water stress.Northern H orticulture,2014,(9):179-182.
[8]Ren A T,Lu W H,M a C H,etal.Effects of arbuscular m ycorrhiza fungi on drought tolerance of Medicagosativa L.Xinjiang A gricultural Sciences,2014,51(9):1677-1685.
[9]Ren A T,Narkes W,Lu W H,et al.Effects of arbuscular m ycorrhiza fungi on the dyna mic characteristics of fine roots growth and bio m ass of alfalfa.Acta Botanica Boreali-Occidentalia Sinica,2014,34(12):2535-2543.
[10]Yang P,Zhang P,Li B,etal.Effects of nodules on dehydration response in alfalfa(Medicagosativa L.).Environ m ental and Experim ental Botany,2011,86(2):29-34.
[11]Zhang P,Yang P Z,W ang W D,et al.Study on physiological change of alfalfa with sy m biotic rhizobiu m under drought stress.Acta A grestia Sinica,2013,21(5):938-944.
[12]Yang P Z.M echanis m Involved in Drought/salt Tolerance Im prove m entin Alfalfa due to Sy m biotic Interaction with Rhizobiu m[D].Yangling:North west A griculture and Forestry U niversity,2012.
[13]W ang W D.Proteo m e A nalysis on the Effect of Nodules on Alfalfa(Medicagosativa L.)Dehydration Tolerance[D].Yangling:North west A griculture and Forestry U niversity,2013.
[14]Verm a S,Varm a A,Rexer K H,etal.Piriformosporaindica,gen.et sp.Nov.,a new root-colonizing fungus.M ycologia,1998,90(5):896-903.
[15]W aller F,Achatz B,Bahruschat H,etal.The endophytie fungus Piriformospora indica reprogra ms barley to salt-stress tolerance,disease resistance and higher yield.The Proceedings of the National Acade m y of Sciences of U nited States of A-m erica,2005,102(38):13386-13391.
[16]Prasad R,Pha m G H,K u m ari R,etal.Sebacinaceae:Culturable m ycorrhiza-like endphytic fungi and their interaction with non-transform ed and roots.In:Declerck S.Root Organ Culture of M ycorrhizal Fungi[M].Germ any:Springer-Verlag,2005:293-312.
[17]K u m ari R,Kishan H,Bhoon Y K,et al.Colonization of cruciferous planta by Piriformospora indica.Current Science,2003,85(12):1672-1674.
[18]Rai M,Acharya D,Singh A,etal.Positive growth responses of the m edicinal plants Spilanthescalva and Withania somnlfera to inoculation by Piriformosporaindica in a field trial.M ycorhiza,2001,11(3):123-128.
[19]Fakhro A,A ndrade-Linares D R,Von Barren S,etal.Im pact of Piriformosporaindica on to m ato growth and on interaction with fungal and viral pathogens.M ycorrhiza,2010,20(3):191-200.
[20]Barazani O,Benderoth M,Groten K,etal.Piriformosporaindica and Sebacina vermifera increase growth perform ance at the expense of herbivore resistance in Nicotiana attenuate.Oecologia,2005,146(2):234-243.
[21]Serfling A,Wirsel S G,Lind V,etal.Perform ance of the biocontrol fungus Piriformosporaindica on w heat under greenhouse and field conditions.Phytopathology,2007,97(4):523-531.
[22]Stein E,M olitor A,Kogel K H,etal.Syste mic resistance in Arabidopsis conferred by the m ycorrhizal fungus Piriformosporaindica requires jas m onic acid signaling and the cytoplas mic function of N P Rl.Plant and Cell Physiology,2008,49:1747-1751.
[23]K u m ar M,Yadav V,Tuteja N,etal.A ntioxidant enzy m e activities in m aize plants colonized with Piriformosporaindica.Microbiology,2009,155(3):780-790.
[24]W ang F R,M ao K K,Li G J,etal.Piriformosporaindica and its related species Sebacina vermifera pro m ote growth and develop m ent and phosphorus nutrition in to m ato.Journal of Zhejiang U niversity(A griculture & Life Sciences),2011,37(1):61-68.
[25]Sun C.Disease Resistence,Drowth Pro m otion and Stress Tolerance in Chinese Cabbage Conferred by Piriformosporaindica and the Prelinary Study of M echanis ms[D].H angzhou:Zhejiang U niversity,2010.
[26]Liu J H,W ang T,Gao Q K.Influence of Piriformosporaindica on host plant selection by aphid Lipaphiserysimi(Kaltenbach).Biotechnology Bulletin,2014,(12):133-140.
[27]Ghahfarokhi R M,Goltapeh M E.Potential of the root endophytic fungus Piriformosporaindica;Sebacina vermifera and Trichoderma species in biocontrol of take-all disease of w heat Gaeumannomycesgraminis var.triticiin vitro.Journal of A gricultural Technology,2010,6(1):11-18.
[28]Baltruschat H,Fodor J,H arrach B D,etal.Salt tolerance of barley induced by the root endophyte Piriformosporaindica is associated with a strong increase in antioxidants.New Phytologist,2008,180(2):501-510.
[29]Shera m eti I,Tripathi S,Varm a A,etal.The root-colonizing endophyte Pirifomosporaindica confers drought tolerance in Arabidopsis by stim ulating the expression of drought stress-related genes in leaves.The A m erican Phytopathological Society,2008,21(6):799-807.
[30]Sun C,Johnsona J M,Cai D G,etal.Piriformosporaindica confers drought tolerance in Chinese cabbage leaves by stim ulating antioxidant enzy m es,the expression of drought-related genes and the plastid-localized C A S protein.Journal of Plant Physiology,2010,167(12):1009-1017.
[31]W u M Y,H ao R C,Zhang W Y,etal.Preliminary study on drought tolerance of alfalfa seedling induced by Piriformospora indica fungi.Acta A grestia Sinica,2013,21(6):1218-1221.
[32]Cang J,Zhang H J.Experim ental Course of Plant Physiology[M].Beijing:Higher Education Press,2013.
[33]Elstner E,H eupel A.Inhibition of nitrite form ation fro m hydroxyla m m oniu mchoride:a sim ple assay for superoxide dism utase.A nalytical Bioche mistry,1976,70(2):616-620.
[34]Zhang W Y,H ao R C,W ang Y Y,etal.Conferring drought tolerance in m aize seeding by endophytic fungus Piriformosporaindica.Journal of M aize Sciences,2013,21(5):127-130.
[35]Zhang W Y,W ang Y Y,H ao R C,etal.Endophytic fungus Piriformosporaindica pro m otes growth and confers drought tolerance in sesa m e(Sesamum indicum L.).Chinese Journal of Oil Crop Sciences,2014,36(1):71-75.
[36]Zhao J M,Zhou H,W ang X Y.Effects of water stress on physiological and bioche mical process of alfalfa varieties.Acta A grestia Sinica,2006,13(3):184-189.
[37]H an R H.Study on A daptive M echanis ms of Alfalfa(Medicagosativa)in Drought Stress at Seedling Stage[D].Beijing:Beijing Forestry U niversity,2006.
[38]Zgalla¨l H,Steppe K,Le m eur R.Effects of differentlevels of water stress on leaf water potential,sto m atalresistance,protein and chlorophyll content and certain anti-oxidative enzy m es in to m ato plants.Journal of Interactive Plant Biology,2006,48(6):679-685.
[39]Varm a A,Verm a S,Sudha A,etal.Piriformosporaindica,acultivable plant growth pro m oting root endophyte.A pplied and Environ m ental Microbiology,1999,65(6):2741-2744.
[40]H ui F Q,Peng B,Lou B G,etal.Preliminary study on effects and m echanis ms of salt and drought resistance and heavy m etals in Nicotianatobacum conferred by Piriformosporaindica.Journal of A gricultural Biotechnology,2014,22(2):168-176.
[41]Li L,W u H Q,M a Z Y,etal.Piriformosporaindica pro m otes growth and confers salt tolerance in Medicagotruncatula.Microbiology China,2015,42(8):1492-1500.
[1]姜华,毕玉芬,陈连仙,等.干旱条件下紫花苜蓿生理特性的研究.草地学报,2012,20(6):1077-1080.
[2]杨雪莲,朱友娟.植物干旱胁迫研究进展.农业工程,2012,2(11):44-45.
[3]曲涛,南志标.作物和牧草对干旱胁迫的响应及机理研究进展.草业学报,2008,17(2):126-135.
[4]刘莎莎,程园园,张丹,等.两株紫花苜蓿根际芽孢杆菌的筛选及生防效果研究.草业学报,2015,24(9):96-103.
[5]全瑞兰,玉永雄.淹水对紫花苜蓿南北方品种抗氧化酶和无氧呼吸酶的影响.草业学报,2015,24(5):84-90.
[6]刘义,张春梅,谢晓蓉,等.干旱胁迫对紫花苜蓿叶片和根系多胺代谢的影响.草业学报,2012,21(6):102-107.
[7]孔静,裴宗平,杜旼,等.水分胁迫下A M真菌对紫花苜蓿生长及抗旱性的影响.北方园艺,2014,(9):179-182.
[8]任爱天,鲁为华,马春晖,等.接种A M真菌对紫花苜蓿抗旱性的影响.新疆农业科学,2014,51(9):1677-1685.
[9]任爱天,娜丽克斯·外里,鲁为华,等.A M真菌对紫花苜蓿细根生长及其生物量动态特征的影响.西北植物学报,2014,34(12):2535-2543.
[11]张攀,杨培志,王卫栋,等.干旱胁迫下根瘤菌共生紫花苜蓿抗旱生理变化研究.草地学报,2013,21(5):938-944.
[12]杨培志.紫花苜蓿根瘤菌共生对干旱及盐胁迫的响应机制研究[D].杨凌:西北农林科技大学,2012.
[13]王卫栋.共生根瘤菌提高紫花苜蓿抗旱能力的蛋白组分析[D].杨凌:西北农林科技大学,2013.
[24]王凤让,毛克克,李国钧,等.印度梨形孢及其近似种Sebacina vermifera促进番茄生长发育及磷吸收.浙江大学学报(农业与生命科学版),2011,37(1):61-68.
[25]孙超.印度梨形孢诱导小白菜抗病、促生、抗逆的作用及其机理的初步研究[D].杭州:浙江大学,2010.
[26]刘金华,王婷,高其康.印度梨形孢定殖油菜对萝卜蚜选择油菜寄主的影响.生物技术通报,2014,12:133-140.
[31]武美燕,蒿若超,张文英,等.印度梨形孢诱导紫花苜蓿提高抗旱性研究初报.草地学报,2013,21(6):1218-1221.
[32]苍晶,赵会杰.植物生理学实验教程[M].北京:高等教育出版社,2013.
[34]张文英,蒿若超,汪嫒嫒,等.内生真菌印度梨形孢诱导提高玉米苗期抗旱性研究初探.玉米科学,2013,21(5):127-130.
[35]张文英,汪嫒嫒,蒿若超,等.印度梨形孢真菌促进芝麻生长并提高芝麻抗旱性.中国油料作物学报,2014,36(1):71-75.
[36]赵金梅,周禾,王秀艳.水分胁迫下苜蓿品种抗旱生理生化指标变化及其相互关系.草地学报,2006,13(3):184-189.
[37]韩瑞宏.苗期紫花苜蓿(Medicagosativa)对干旱胁迫的适应机制研究[D].北京:北京林业大学,2006.
[40]惠非琼,彭兵,楼兵干,等.印度梨形孢通过促进渗透调节物质的合成和诱导抗逆相关基因的表达提高烟草耐盐性.农业生物技术学报,2014,22(2):168-176.
[41]李亮,武洪庆,马朝阳,等.印度梨形孢促进蒺藜苜蓿生长及其提高耐盐性研究.微生物学通报,2015,42(8):1492-1500.
Effects of Piriformosporaindica fungus on growth and drought resistance in alfalfa under water deficit stress
W U M ei-Yan,H A O Ruo-Chao,Z H A N G W en-Ying*
Research Center of Crop Stresses Resistance Technologies and Key Laboratory of Crop Science,Yangtze University,Jingzhou 434025,China
Pot experim ents were conducted to evaluate the growth and drought resistance of alfalfa(Medicago sativa)seedlings colonized by Piriformosporaindica fungus.T he experim ent co m prised a 2×2 factorial co mbination of inoculation(inoculated,I,or un-inoculated,NI)and drought(droughted,D or not,N D)treatm ents,giving 4 co m binations:I-D,I-N D,NI-D(reference),and NI-N D.For the inoculated plants,40 m L of inoculant with P.indica m yceliu m was applied,and for control plants,40 m L of sterile water was added.Soil water content was 75%-80%of field capacity for the norm al irrigation treatm ent and 15%-20%for the drought treatm ents.Fresh shoot and root weights,root length,dry shoot and root weights,chlorophyll(SP A D),relative water content(R W C),antioxidase enzy m e activity,O2-,m ethane dicarboxylic aldehyde (M D A)and os m olytes were determined for all treatm ents.T he fungus strongly colonized the roots of alfalfa,infecting 87.4%of seedlings.W hen the colonized plants were exposed to drought stress,the fresh shoot weight,dry shoot weight,chlorophyll,relative water content and the nu m ber of leaves per plant were pro m oted significantly by 63.4%,69.2%,12.5%,17.1%and 5.7,respectively.In addition the fresh root weight,dry root weight,length of taproot and nu m ber of lateral roots were im proved significantly by 33.3%,57.1%,5.1 c m and 5 roots,respectively,co m pared to the reference plants(NI-D).Furtherm ore,the activities of super-oxide,peroxidases,catalases,and the levels of proline and of soluble sugarin the leavesincreased by 1.71,1.27,1.22,1.49 and 1.48 tim es,respectively,and the contents of O2-and M D A decreased significantly.In su m m ary,P.indica fungus enhanced the growth and drought tolerance of alfalfa in the seeding stage by stimulating the activity of antioxidant enzy m es and the content of os m olytes,w hile under norm al irrigation,the fungus had no significant effect on the growth of alfalfa.
alfalfa(Medicagosativa);seeding stage;Piriformosporaindica;growth pro m otion;drought resistance
.E-m ail:wyzhang@yangtzeu.edu.cn
10.11686/cyxb2015366
2015-07-20;改回日期:2015-10-21
国家公益性行业(农业)科研专项(201203032),长江大学作物抗逆技术研究中心开放基金(2014001)和湿地生态与农业利用教育部工程研究中心开放基金项目(K F201506)资助。
武美燕(1977-),女,内蒙古呼和浩特人,副教授,博士。E-m ail:w u m eiyan2002@163.com
