肝动脉栓塞化疗联合微波消融与单纯手术切除对小肝癌疗效比较
2016-07-05谭冠沈世强秦峰黄纯江
谭冠 沈世强 秦峰 黄纯江
·论 著·(临床实践)
肝动脉栓塞化疗联合微波消融与单纯手术切除对小肝癌疗效比较
谭冠 沈世强 秦峰 黄纯江
目的 对比肝动脉栓塞化疗(TACE)联合微波消融(MWA)与单纯手术切除对小肝癌的治疗效果。方法 回顾性分析2008年1月至2013年1月共65例小肝癌病人临床资料。65例中30例行肝动脉栓塞化疗联合微波消融,35例单纯手术切除治疗。比较两组肿瘤治疗后的总并发症发生率,术后1、2、3年生存率和复发率等情况。结果 肝动脉栓塞化疗联合微波消融组总并发症发生率为10.0%,低于手术组并发症发生率(31.4%),差异有统计学意义(χ2=4.389,P=0.036)。肝动脉栓塞化疗联合微波消融组术后1、2、3年复发率为6.7%、13.3%、23.3%,手术组术后1、2、3年复发率为11.4%、17.1%、31.4%,两组复发率比较差异无统计学意义(χ2=0.465,P=0.495)。肝动脉栓塞化疗联合微波消融组术后1、2、3年总生存率为93.3%、80.0%、60.0%,手术组术后1、2、3年总生存率为91.4%、77.1%、57.1%,两组的生存率比较差异无统计学意义(χ2=0.078,P=0.78)。结论 肝动脉栓塞化疗联合微波消融的治疗效果确切,其术后并发症发生率较低,远期疗效与手术切除相近,可考虑作为小肝癌的首选治疗。
小肝癌; 肝动脉栓塞化疗; 微波消融; 手术切除
肝癌在我国是主要的恶性肿瘤之一,近年来其发病率一直处于上升趋势,严重威胁人类的生命健康。根据中华医学会外科学分会肝脏外科学组2008年制定的标准:肿瘤最大直径>2 cm,≤5 cm的肝癌定义为小肝癌[1]。手术切除一直被认为是小肝癌治疗的首选治疗手段。近年来微波消融(microwave ablation,MWA)在肝癌的治疗中得到广泛的应用[2]。肝动脉栓塞化疗(transcatheter arterial chemoembolization,TACE)联合微波消融对小肝癌的治疗令人关注,临床鲜有报道。我们回顾性分析了肝动脉栓塞化疗联合微波消融与单纯手术切除治疗小肝癌的临床效果,现报告如下。
资料与方法
一、临床资料
病人的入选标准:①术前影像学检查,肝穿刺活检或术后病理诊断为肝细胞性肝癌;②未进行其他抗肿瘤治疗,排除肝外转移;③单发的小肝癌(直径>2 cm、≤5 cm);④肝功能分级为Child-Pugh分级A级或B级,无C级;⑤临床资料完整。收集2008年1月至2013年1月本院治疗的65例小肝癌病人临床资料,按照不同的治疗方法。肝动脉栓塞化疗联合微波消融组30例,其中男性25例,女性5例,年龄31~75岁,平均(56.1±12.1)岁,肿瘤平均直径(3.2±0.6) cm;手术组35例,其中男性31例,女性4例,年龄29~72岁,平均(55.1±11.9)岁,肿瘤平均直径(3.5±0.5) cm。两组病人在年龄、性别、肿瘤平均直径、位置、Child-Pugh分级、甲胎蛋白(AFP)、HBsAg阳性,HBV DNA水平等情况具有可比性(表1)。
二、方法
联合治疗组先行TACE,常规消毒铺巾,局麻后Seldinger方法经皮右侧股动脉穿刺插管,将导管前端插入肝固有动脉后,注入适量造影剂行数字减影血管造影(DSA)。全面了解肿瘤血供情况,明确肿瘤的部位、大小、数目。用羟喜树碱25 mg、5-氟尿嘧啶(5-Fu)1.0 g、多柔比星20~30 mg或者丝裂霉素6~10 mg行灌注化疗,若肿瘤供血丰富,超选择性插管入肿瘤供血动脉中,则注入超液态碘油或多柔比星的混合乳剂适量。若肿瘤供血动脉较粗且单一,再注入明胶海绵颗粒行栓塞治疗。栓塞化疗后透视下观察碘油的沉积情况,肝动脉造影了解肿瘤血管与正常血管情况。若碘油在瘤灶内沉积良好、肿瘤血管闭塞、肿瘤未见明确染色,视为本次操作达到预期效果。在行TACE术后2~3周静脉麻醉下经皮微波消融,微波仪器为ECO-100c型多功能微波治疗仪,输出频率为2450 MHz,输出功率0~100 W,可连续输出,可逐级调节。微波消融针规格2.0 mm,冷循环液为冰冻生理盐水。在超声引导下将微波消融针经皮穿刺至肿瘤中央合适位置,输出功率选择60 W,采用单针单点消融,且消融范围要求超过肿瘤边缘5.0 mm[3]。手术组在全麻下行开腹肝切除术,采用规则性肝切除完整地将肿瘤所在的肝端,包括原发肿瘤、卫星灶及复发的高危区域一并切除[4]。
三、疗效评价
比较两组病人术后并发症发生率,其并发症主要包括感染(切口感染、肝脓肿、腹腔感染和败血症);出血(腹腔内出血、微波消融针损伤性出血);胆道并发症(胆漏、胆管损伤狭窄);胸部并发症(胸腔积液、气胸、膈肌损伤);肝功能不全等。对两组病人术后进行术后随访(电话、通信、门诊复查),复查超声、CT、MRI、AFP及肝功能来判断病人局部及全身情况,若原病灶之外有新病灶出现或AFP升高,视为治疗后复发。以此比较其1、2、3年复发率。并比较两组病人1、2、3年的生存率。
四、统计学方法
采用SPSS(19.0版)软件进行统计学分析,计量资料的比较用t检验,计数资料的比较采用χ2检验。采用Kaplan-Meier法进行各组生存曲线分析,生存率与累积复发率的比较采用Log-rank检验。P<0.05为差异有统计学意义。
结 果
一、病人术前一般情况
两组病人术前一般情况比较差异均无统计学意义(表1)。
二、并发症发生率、复发率和生存率
1. 并发症发生率 肝动脉栓塞化疗联合微波消融组术后共有3例(10.0%)出现并发症:1例(3.3%)出现膈肌损伤;1例(3.3%)出现邻近脏器损伤;1例(3.3%)出现腹腔感染。手术组术后共有11例(31.4%)出现并发症:4例(11.4%)出现腹水;2例(5.7%)术后肝功能不全;3例(8.6%)出现黄疸;2例(5.7%)腹腔感染。上述并发症经对症处理后均缓解。两组总并发症的发生率比较,差异有统计学意义(χ2=4.389,P=0.036)。
2.复发率 对两组病人术后随访发现,肝动脉栓塞化疗联合微波消融组术后1、2、3年的累积复发率分别为6.7%、13.3%、23.3%。手术组术后1、2、3年的累积复发率分别为11.4%、17.1%、31.4%。两种治疗方法的术后复发率比较,差异无统计学意义(χ2=0.465,P=0.495)(图1)。

表1 病人术前一般情况
3.生存率 两组病人无手术死亡,两组术后死因主要为肝癌进展、肝衰竭等。肝动脉栓塞化疗联合微波消融组术后1、2、3年总生存率分别为93.3%、80.0%、60.0%,手术组术后1、2、3年总生存率分别为91.4%、77.1%、57.1%。应用Kaplan-Meier法绘制生存曲线,两组的总生存率比较,差异无统计学意义(χ2=0.078,P=0.78)(图2)。
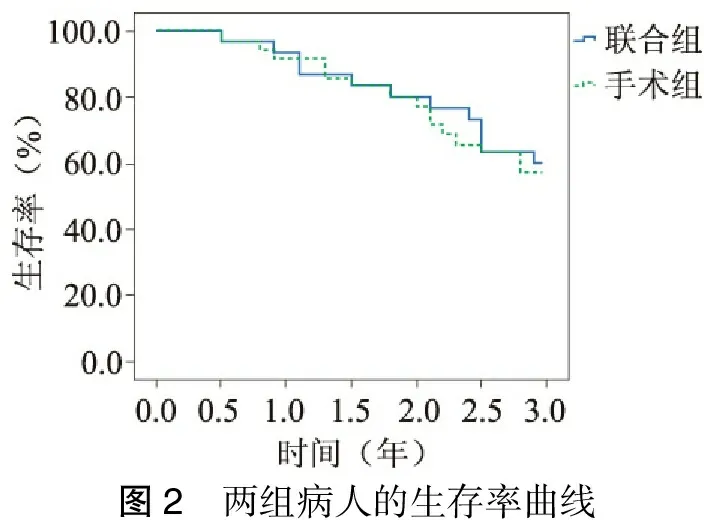
图2 两组病人的生存率曲线
讨 论
原发性肝癌在我国的发病率、病死率逐年上升。早发现早治疗可以明显提高肝癌的生存率,小肝癌多属于早期肝癌,故小肝癌的治疗尤其重要。对小肝癌的治疗特别注意其根治性。肝移植对部分病人疗效较好,但由于供肝的短缺及昂贵的费用,限制了其广泛的应用[5]。手术切除一直是小肝癌的首选治疗手段。我国肝癌病人大多数有乙型肝炎肝硬化病史,受到肿瘤部位、病人身体耐受状态以及肝硬化程度的影响,限制了肝切除范围,甚至不能手术切除[6]。同时肝癌具有侵袭性强、恶性程度高、转移复发率快以及多中心生长的生物学特点,亦制约了手术切除治疗小肝癌的地位[7-8]。黄志强院士[9]指出:当前对大小3~5 cm肝癌的治疗已趋多样化,传统外科手术只是可供选择的方法之一。1994年Seki等[10]用微波消融治疗小肝癌获得成功以来,微波消融在临床上得到越来越广泛的应用,微波消融相对于手术切除有很多的优势:作为局部微创治疗,周围肝组织无明显影响,肝功能损伤小,术后恢复时间快,住院短,对生活质量影响小,疗效肯定[11-12];创伤小,无需开腹,避免了巨大的手术创伤,也避免了切除过程中挤压、触摸肿瘤引起的转移;风险低,安全性高,术后死亡率低,并发症低;肝功能不全或者其他器官功能欠佳,无法耐受手术时,微波消融同样可以用于杀灭肿瘤;对位于肝脏中央的肿瘤因无法暴露于手术视野中,手术切除难度大,微波消融可容易处理;热消融可以诱导抗肿瘤免疫,促进抗原的释放,增加抗原呈递细胞功能,激活肿瘤特异性T细胞反应[13-14];消融后抗肿瘤免疫的增强和免疫细胞的增加有助于抑制肿瘤的复发[15];肝切除后损伤免疫力和容易感染[16],微波消融后免疫力的增强,可以带来生存获益[17-18]。但单纯微波消融治疗小肝癌最大的缺点是复发率较高。分析其复发的原因可能包括:位于肝脏周围的肿瘤,受周邻脏器影响,对准确进针有一定干扰,且为了避免损伤肝脏相邻脏器,要求进针发热点距离其他脏器有一定距离,这可能导致消融不彻底或复发。对于肝脏周围的肿瘤可以人工注入胸水、腹水的方法来解决消融过程中超声显示不清及容易损伤相邻脏器的问题。肝癌血供丰富,血流速度快,而微波消融主要依靠热量使肿瘤凝固变性坏死,血流极易带走大量热能,导致了消融不全;术前对肝癌的影像学检查(B超、CT、MRI等),所确定的肿瘤边界与实际边界不相符(小于实际边界),故在制定消融计划时,导致了消融范围的不足够[19];肿瘤周围的潜在微小卫星灶未能被术前的影像学检查发现,同样导致了消融的不完全。TACE完全弥补微波消融不全的缺陷。小肝癌中心部分血供来自肝动脉,栓塞剂阻断肝动脉血流,减少了肝癌血供,减轻了血流带走微波消融的热能,减轻了血流冷却作用。且化疗药物使小肝癌局部坏死,形成乏氧环境,增加了肿瘤的热敏感性,提高了微波消融的疗效。肝癌细胞具有嗜碘油特性,TACE后碘油沉积于肝癌组织中,我们可以发现术前影像学检查(B超、CT、MRI等)难以发现的微小卫星灶[20-21]。TACE栓塞了肿瘤的供血动脉,较少了消融针穿破血管造成肝癌血行性播散的概率。由此我们可以看出TACE联合MWA提高了治疗小肝癌的疗效。在本次回顾性研究中比较两组术后并发症的发生率,TACE联合MWA的并发症相对较少,而手术组术后并发症相对较多。本研究中联合组(TACE联合MWA)总并发症发生率为10.0%(3/30),明显低于手术组的31.4%(11/35),且差异有统计学意义。本研究中,随访两组术后1、2、3年复发率差异无统计学意义。随访两组术后1、2、3年生存率差异也无统计学意义。但本研究也有不足之处:本研究为单中心回顾性分析,样本量较少,其长期疗效还需要更长时间的随访和观察,我们需要更多的前瞻性多中心随机对照研究来对比研究两组手术方法的优劣势。
通过本次回顾性分析,我们可以发现肝动脉栓塞化疗联合微波消融与手术切除治疗小肝癌具有相近的疗效。此外联合疗法创伤小,并发症低,可以考虑作为小肝癌的首选治疗方法。
1 中华医学会外科学分会肝脏外科学组.肝细胞肝癌外科治疗方法的选择(2008年修订,第3版).中华外科杂志,2009,47:222-224.DOI:10.3760/cma.j.issn.0529-5815.2009.03.018.2 Dong B,Liang P,Yu X,et al.Percutaneous sonographieally guided microwave coagulation therapy for hepatoeellularcarcinoma:results in 234 patients.MR Am J Roentgenol,2003,180:1547-1555.DOI:10.2214/ajr.180.6.1801547.
3 Kudo M.Radiofrequency ablation for hepatocellular earcinoma:updated review in 2010.Oncology,2010,78:113-124.DOI:10.1159/000315239.
4 Ariis,Tanaka Y,Mitsunori N,et al.Surgical strategies for hepatocelluIar carcinoma with special reference to anatomical hepatic resection and Intraoperative contras- enhanced ultrasonozraphy.Oncology,2010,78:125-130.DOI:10.1159/000315240
5 Mazzaferro V,Regalia E,Doci R,et al.Liver transplantation for the treatment of small hepatocellular carcinomas in patients with cirrhosis.N Engl J Med,1996,334:693-699.DOI:10.1056/NEJM199603143341104.
6 Tsoulfas G,Agorastou P,Tooulias A,et al.Current and future challenges in the surgical treatment of hepatocellular carcinoma:a review.Int Surg,2014,99:779-786.DOI:10.9738/INTSURG-D-13-00122.1.
7 樊嘉,史颖弘,高强.小肝癌的规范化治疗路经.中国实用外科杂志,2011,31:36-38.
8 周铁,孔文韬,仇毓东,等.小肝癌射频消融治疗后病人生存及肝内肿瘤复发的有关因素分析.中国微创外科杂志,2010,10:387-390.DOI:10.3969/j.issn.1009-6604.2010.05.002.
9 黄志强.肝切除与肝癌治疗:小肝癌,传统外科过时了吗?外科医生的观点.腹腔镜外科杂志,2010,15:80l-803.DOI:10.3969/j.issn.1009-6612.2010.11.001.
10Seki T,Wakabayashi M,Nakagawa T,et al.Ultrasonically guided percutaneous microwave coagulation therapy for small hepatocellular carcinoma.Cancer,1994,74:817-825.DOI:10.1002/1097-0142(19940801)74:3<817::AID-CNCR2820740306>3.0.CO;2-8
11中国抗癌协会肝癌专业委员会,中国抗癌协会临床肿瘤学协作专业委员会.中华医学会肝病学分会肝癌学组.肝癌局部消融治疗规范的专家共识.中华肝脏病杂志,2011,19:257-259.DOI:10.3760/cma.j.issn.1007-3418.2011.04.007.
12Nishikawa H,Kimura T,Kita R,et al.Radiofrequency ablation for hepatocellular carcinoma.Int J Hyperthermia,2013,29:558-568.DOI:10.3109/02656736.2013.821528.
13Waitz R,Solomon SB,Petre EN,et al.Potent induction of tumor immunity by combining tumor cryoablation with anti CTLA-4 therapy.Cancer Res,2012,72:430-439.DOI:10.1158/0008-5472.CAN-11-1782.
14Zerbini A,Pilli M,Penna A,et al.Radiofrequency thermal ablation of hepatocellular carcinoma liver nodules can activate and enhance tumor-specific T-cell responses. Cancer Res,2006,66:1139-1146. DOI:10.1158/0008-5472.CAN-05-2244.
15Haen SP,Pereira PL,Salih HR,et al.More than just tumor destruction:immunomodulation by thermal ablation of cancer.Clin Dev Immunol,2011,2011:160250. DOI:10.1155/2011/160250.
16Van Leeuwen PA,Boermeester MA,Houdijk AP,et al.Pretreatment with enteral cholestyramine prevents suppression of the cellular immune system after partial hepatectomy.Ann Surg,1995,221:282-290.
17Chen Z,Shen S,Peng B,et al.Intratumoural GM-CSF microspheres and CTLA-4 blockade enhance the antitumour immunity induced by thermal ablation in a subcutaneous murine hepatoma model.Int J Hyperthermia,2009,25:374-382.DOI:10.1080/02656730902976807.
18Pan Q,Li Q.New prospects for hepatocellular carcinoma therapy:microwave ablation working together with cellular immunotherapy.Cancer Biol Ther,2011,11:642-643.DOI:10.4161/cbt.11.7.14970.
19Petrowsky H,Busuttil RW.Resection or ablation of small hepatocellular carcinoma:what is the better treatment.J Hepatol,2008,49:502-504.DOI:10.1016/j.jhep.2008.07.018.
20Peng ZW,Zhang YJ,Chen MS,et al.Radiofrequency ablation with or without transcatheter arterial chemoembolization in the treatment of hepatocellular carcinoma:a prospective randomized trial.J Clin Oncol,2013,31:426-432.DOI:10.1200/JCO.2012.42.9936.
21Nakakuma K,Tashiro S,Hiraoka T,et al.Hepatocellular carcinoma and metastatic cancer detected by iodized oil. Radiology,1985,154:15-17.DOI:10.1148/radiology.154.1.2981111
Comparison between transcatheter arterial chemoembolization combined with microwave ablation vs. surgical resection for small hepatocellular carcinoma
TanGuan,ShenShiqiang,QinFeng,HuangChunjiang.
DepartmentofHepatobiliarySurgery,RenminHospital,WuhanUniversity,Wuhan430060,China
ShenShiqiang,Email:swsw2218@hotmail.com
Objective To compare transcatheter arterial chemoembolization (TACE) combined with microwave ablation (MWA) vs. surgical resection for small hepatocellular carcinoma.Methods The clinical data of 65 patients with small hepatocellular carcinoma treated in our hospital between January 2008 and January 2013 were retrospectively analyzed, 30 patients accepted TACE combined with MWA, and 35 patients were subjected to surgical resection. The complication rate, 1-, 2- and 3-year survival rate and recurrence rate were compared between the two groups after treatment.Results The total complication rate in TACE combined with MWA group (10.0%) was significantly lower than in the surgery group (31.4%) (χ2=4.389,P=0.036). 1-, 2-, and 3-year recurrence rate was 6.7%, 13.3% and 23.3% in TACE combined with MWA group, and 11.4%, 17.1% and 31.4% in the surgery group (χ2=0.465,P=0.495). The 1-, 2- and 3-year survival rate in TACE combined with MWA group was 93.3%, 80.0% and 60.0%, and that was 91.4%, 77.1%, and 57.1% in the surgery group (χ2=0.078,P=0.78).Conclusions TACE combined with MWA for small hepatocellular carcinoma is effective, has lower complication rate than surgical resection, and similar long-term curative effects with the surgical resection. TACE combined with MWA can be considered as the preferred treatment for small hepatocellular carcinoma.
Small hepatocellular carcinoma; Transcatheter arterial chemoembolization; Microwave ablation; Surgical resection
430060 武汉,武汉大学人民医院肝胆外科
沈世强,Email:swsw2218@hotmail.corn
R735.7
A
10.3969/j.issn.1003-5591.2016.02.007
2015-08-17)
