入肝血流联合肝下下腔静脉阻断在腹腔镜肝切除术中的应用
2016-07-05张万广张必翔王健张志伟朱鹏李常海董汉华陈孝平
张万广 张必翔 王健 张志伟 朱鹏 李常海 董汉华 陈孝平
·论 著·(肝脏疾病微创治疗专题)
入肝血流联合肝下下腔静脉阻断在腹腔镜肝切除术中的应用
张万广 张必翔 王健 张志伟 朱鹏 李常海 董汉华 陈孝平
目的 评价入肝血流联合肝下下腔静脉阻断在腹腔镜肝切除中的安全性及疗效。方法 回顾性分析2015年1月至2015年12月由同一医疗组开展的腹腔镜下肝切除51例,其中入肝血流联合肝下下腔静脉阻断(联合阻断组)32例,入肝血流阻断(Pringle组)19例。记录术中阻断时间、出血量、血流动力学改变、术后肝功能、肾功能变化,及并发症的发生率。结果 联合阻断组入肝血流平均阻断时间17 min,肝下下腔静脉阻断时间12 min。Pringle组平均阻断时间23 min。联合阻断组术中出血量平均(370.1±107.9) ml,1例病人输血,显著低于Pringle组(560.3±191.3) ml,术中输血3例。联合阻断组无手术中转开腹,Pringle组中转开腹1例。阻断肝下下腔静脉,病人平均动脉压由阻断前的(92.3±4.7) mmHg下降至(71.3±4.6) mmHg,心率则由阻断前的(73.9±6.9) 次/min增快至(93.5±10.7) 次/min。松开阻断带后,在无明显出血情况下,平均动脉压和心率可自行恢复至阻断前水平。两组肝功能和肾功能恢复无明显差异,总体并发症无明显差异。结论 腹腔镜下入肝血流联合肝下下腔静脉阻断安全有效,并能减少术中出血量及中转率。
肝下下腔静脉; 肝切除; 腹腔镜
近年,随着腹腔镜肝切除的快速发展,腹腔镜肝切除切除范围已从Louisville宣言推荐的肿瘤大小不超过5 cm,发展到无肿瘤大小的限制,并且肝切除的范围,也从局部小范围切除发展到大范围肝切除[1-3]。即便如此,腹腔镜肝切除过程中,肝实质断面出血仍是限制其进一步推广的关键问题。尽管目前常用的控制出血技术如肝门阻断技术、低中心静脉压、术中使用各种止血器械等,但仍达不到理想的手术清晰视野[4-5]。我们中心在肝切除技术发展过程中,对复杂的肝切除,常常使用入肝血流联合肝下下腔静脉阻断,已被证实能够减少术中断肝过程中的出血[6-8]。此项技术能否应用于腹腔镜下肝切除还未见报道。本文拟对其在腹腔镜肝切除术中的有效性及安全性做初步的临床研究。
资料与方法
一、临床资料
选择从2015年1月至2015年12月在华中科技大学同济医学院附属同济医院肝脏外科中心接受腹腔镜肝切除51例病人,根据术中阻断血流的方法不同,分为两组。一组为入肝血流联合肝下下腔静脉阻断组(联合阻断组,n=32例),另一组为入肝血流阻断组(Pringle组,n=19例)。术前所有病人心肺功能等均良好。两组病人均由同一医疗组进行手术。Pringle组病人平均年龄(49.7±12.5)岁,联合阻断组平均年龄为(48.4±9.8)岁。肝功能Child-Pugh分级A级48例,B级3例。所有病例经病理诊断为肝细胞癌。
二、手术方法
病人取仰卧位,根据肿瘤的位置,采用向右或左倾斜15°~30°,CO2气腹维持在12~14 mmHg。通常采用5孔法,包括10 mm观测孔和可以用于术中超声或血管闭合的12 mm戳卡孔。Pringle组,仅行入肝血流阻断。联合阻断组,术中需要在阻断入肝血流期间,控制出血仍不理想时,予以阻断肝下下腔静脉。技术要领:第一肝门预置阻断带。切开肝下下腔静脉两侧的后腹膜,用长弯血管钳从右肾静脉水平上方的下腔静脉后方贯穿予以预置阻断带,见图1。入肝血流和肝下下腔静脉阻断带均从腹壁戳孔引出,在肝实质离断过程中出血时可以收紧阻断带予以血流阻断。常规术中超声明确肿瘤的位置和周围血管的关系。肝实质离断采用超声刀(harmonic scalpel,Ethicon Endo-Surgery)。小的出血可用双极电凝钳止血,断面遇到大的管道均以Hem-o-lok (Weck Surgical Instruments)或钛夹闭合(Ethicon Endo-Surgery)。较粗大的左右肝蒂或肝静脉采用线状血管闭合器 (Echelon 60 ENDOPATH Stapler, Ethicon Endo-Surgery)。最后组织标本置于标本带中,从脐部或下腹部取出。
三、观察指标
手术过程中详细记录手术总时间、阻断入肝血流和肝下下腔静脉的时间、出血量、输血率。记录从诱导麻醉开始到苏醒过程中收缩压、舒张压及心率的变化。监测术后第1、3、5、7天肝功能和肾功能。记录手术并发症和死亡率。
四、统计学方法
所有数据采用SPSS(19.0版)或Graphpad Prism 5软件进行分析,计量资料以均数±标准差表示,采用独立样本t检验或非参数检验;计数数以例(n)表示,采用χ2检验或Fisher’s 检验;P<0.05为差异有统计学意义;数值资料变化趋势图用Graphpad Prism 5软件制作。
结 果
一、两组病例临床特征
2015年1月至12月期间,同一手术组共完成腹腔镜肝细胞癌肝切除51例,其中Pringle组19例,联合阻断组32例,两组病例在病人性别、年龄、体质量指数(BMI)、肿瘤大小、位置、肝功能、肝功能Child-Pugh分级、术前行经导管肝动脉化疗栓塞术(TACE)治疗等方面差异无统计学意义。见表1。

表1 51例腹腔镜肝切除病人临床病例资料
二、术中阻断肝门时间、出血量和手术方式
两组病例总体手术时间间差异无统计学意义。联合阻断组肝下下腔静脉预置阻断带平均耗时21 min。Pringle组入肝血流平均阻断时间为23 min;联合阻断组,入肝血流阻断时间为17 min,肝下下腔静脉阻断时间为12 min。两组病例在手术方式无明显差异,但联合阻断组术中出血量显著低于Pringle组。联合阻断组1例输血,Pringle组术中输血3例。联合阻断组无中转,Pringle组中转1例。见表2。

表2 术中病人资料
三、术中血流动力学变化
与Pringle手法相比,肝下下腔静脉阻断可导致血流动力学改变。阻断肝下下腔静脉后,病人的平均动脉压由(92.3±4.7) mmHg下降至(71.3±4.6) mmHg(P<0.001),心率则由(73.9±6.9) 次/min增快至(93.5±10.7) 次/min(P<0.01)。但松开肝下下腔静脉阻断带后,在无明显出血情况下,两者均在数分钟内平衡至阻断前水平。而Pringle组平均动脉压由入肝血流阻断前的(93.1±5.4) mmHg降为(90.9±4.8) mmHg(P=0.081),心率由(72.6±7.5) 次/min增快为(77.1±8.9) 次/min(P=0.001)。
四、术后肝肾功能恢复和术后并发症
由于术中阻断了病人的肝下下腔静脉,可能对病人的肝肾功能造成影响。我们记录了病人术后1、3、5、7 d的肝肾功能,结果提示肝下下腔静脉阻断对肾功能无影响。对肝功能而言,病人的丙氨酸转氨酶(ALT)、天冬氨酸转氨酶(AST)、总胆红素(TBIL)等虽一过性的升高,并且联合阻断组三者的变化幅度稍大,但两组之间差异无统计学意义,见图2。病人术后3 d常规行彩超检查,发现主要的并发症为腹腔或胸腔积液,均无需特殊处理,自行吸收。两组病例均无胆漏、术后腹腔出血。联合阻断组病人无明显肺栓塞表现,并行彩超检查未见下肢深静脉血栓形成。见表3。
讨 论
腹腔镜手术最大的特点和优势是微创,而腹腔镜肝切除除了微创外,手术时间缩短、术中出血、输血减少以及术后住院时间缩短等都十分有利于病人的治疗[9-10]。腹腔镜肝切除与开腹肝切除对比的Meta分析显示两者手术时间、术中出血及输血以及住院时间差异具有统计学意义,然而,两者之间生存率没有明显差异[11]。并且术后肝衰竭、肝硬化肝功能失代偿或腹水及肺部并发症,腹腔镜肝切除也是明显低于开腹手术。随着近20年来腹腔镜肝脏手术技术的发展,腹腔镜肝切除适应证与开腹肝切除适应证几乎没有区别[12],在对病人肝脏功能、残肝体积等进行全面的术前评估后,腹腔镜肝切除术中出血的控制技巧成为主要的障碍因素。据相关文献报道,中转率大概在2%~15%,中转的原因多为难以控制的出血[13-14]。

图1 A1~A4.入肝血流阻断:用弯血管钳将束带预置于肝蒂,由两端带有2cm软塑料管的16号导管引出体外。B1~B4.肝下下腔阻断:用长弯血管钳从肝下下腔静脉后方,预置10#丝线,同样方法引出体外。

表3 两种手术方式的术后结果及并发症
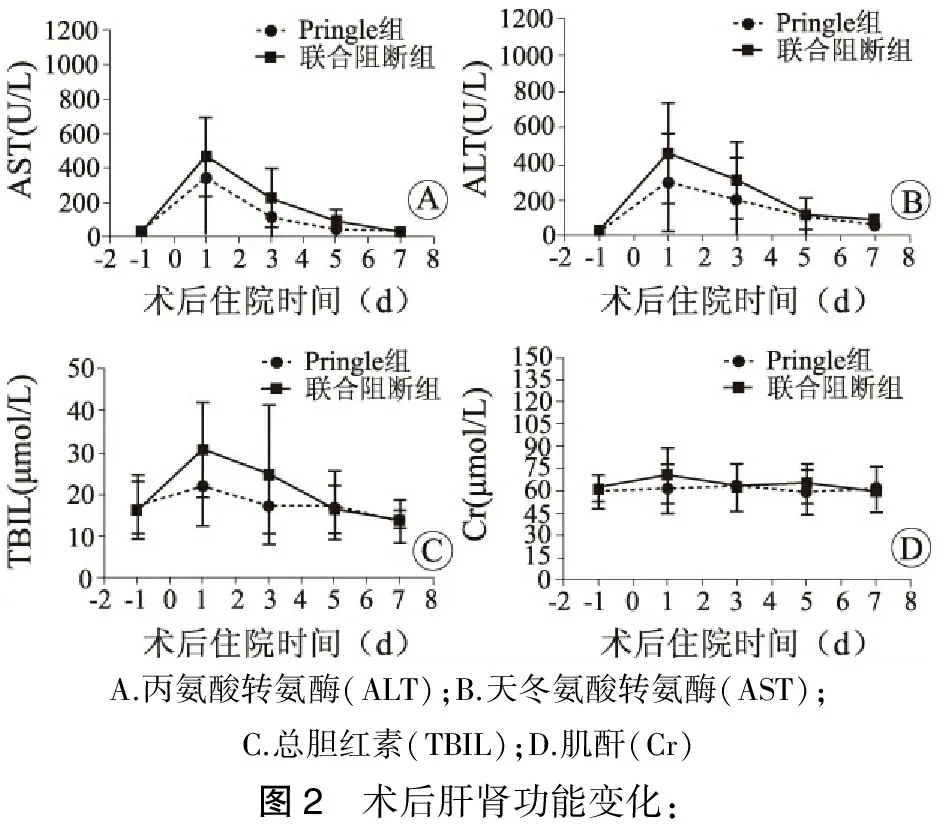
A.丙氨酸转氨酶(ALT);B.天冬氨酸转氨酶(AST);C.总胆红素(TBIL);D.肌酐(Cr)图2 术后肝肾功能变化:
目前常用的术中控制出血技术是低中心静脉压和入肝血流阻断技术。低中心静脉压是麻醉医生通过限制液体的进入和利用血管活性药物使中心静脉压维持在5 cmH2O以下[15-16]。尽管大多数学者认为在此压力下可以减少肝切除过程中的出血量,但过多的限制液体的输入,在肝切除过程中一旦发生大的出血,会使病人的血流动力学更加不稳定[17]。而且我们面临的问题是控制低中心静脉压技术在大多数地市级或基层医院还未普及。入肝血流阻断技术可以减少来自于肝动脉和门静脉的血流,但不能阻止来至于肝静脉的血流,而肝静脉出血是腹腔镜肝切除最困难的问题。在本中心肝切除发展过程中,我们早在1989年就发现,阻断入肝血流和肝下下腔静脉可以减少肝切除的出血量,其主要机制是Pringle手法阻断了入肝血流,肝下下腔静脉阻断可以降低中心静脉压,减少了断面肝静脉的出血,同时利用三尖瓣的抗反流作用,达到全肝血流阻断的作用。2004年Otsubo等[18]发现阻断肝下下腔静脉阻断可以使CVP降低3.7 cmH2O,并且使肝切除出血量从1 177 ml减少至910 ml。2011年Rahbari等[17]研究提示阻断肝下下腔静脉无论从总的出血量还是每平方厘米的肝脏断面出血量均少于低中心静脉压组。我们采用这种技术已完成2 000余例的开放肝切除,未发生严重的并发症。在开放手术中,游离肝下下腔静脉比较容易,我们在右肾静脉水平以上,稍切开下腔静脉两侧的后腹膜,用直角钳可以轻易通过其后方,置以阻断带,平均时间在1 min以内。在腹腔镜下是否可以予以阻断呢?我们的研究结果提示在腹腔镜下可以分离出肝下下腔静脉,予以阻断,平均用时约21 min,虽然比开放手术操作时间延长,但证实在腹腔镜下是切实可行的。
在腹腔镜肝切除过程中,我们常规予以入肝血流阻断,如果断面出血仍控制不理想,则进一步阻断肝下下腔静脉。本组研究表明约80%以上的病例可以有效地减少断面的出血,手术视野清晰,小的出血点可以采用超声刀或双极电凝钳止血,大的管道可以使用钛夹或Hem-o-lok夹闭。入肝血流联合肝下下腔静脉联合阻断平均出血量约370 ml,明显低于仅阻断入肝血流组的560 ml出血量。同时术中输血率及中转率均低于单纯阻断入肝血流组。因此我们认为对于肿瘤紧邻主肝静脉或大的分支,或对腹腔镜而言复杂的肝切除如肝脏Ⅶ段或Ⅷ段切除、肝中叶切除、右半肝切除,应常规预置肝下下腔静脉阻断带以备用。
由于肝下下腔静脉阻断减少了回心血流,对血流动力学造成一定的影响。本组病例中,术中阻断肝下下腔静脉后,病人的平均动脉压下降,心率则增快,但由于阻断时间比较短暂,绝大多数病例不需要麻醉师特殊处理。如果血压降低比较明显,可适当予以血管活性药物,收缩压至少维持在60 mmHg以上。此组病例肝功能90%以上均为Child-Pugh A级,因此在肝功能恢复方面无明显差异。在肾静脉水平以上阻断肝下下腔静脉,术后未发现对肾功能产生影响。
在术后并发症方面,两组病例术后无活动性出血和胆漏的发生。最常见的并发症是局限性腹腔或胸腔积液,经保守治疗好转。肝下下腔静脉组未见肺栓塞和下肢静脉血栓等并发症。
对于肝下下腔静脉阻断,另一个担心的问题是CO2气腹造成的气体栓塞。气体栓塞因其高致死性也一度让外科医生对腹腔镜的应用产生怀疑[19-20]。然而,气体栓塞的风险被明显夸大,其发生率非常低[21]。相关文献指出,气腹的压力在12 mmHg,中心静脉压维持在3~6 cmH2O时,既可以避免空气栓塞的危险,又可以达到减少术中出血的目的[22-23]。我们认为阻断肝下下腔静脉更易达到清晰的手术视野,能够较快地处理断面上的血管,发生空气栓塞的可能性更低。在本组病例中,一些断面可以看见小的肝静脉破口,但在CO2气腹的压力下,同时配合使肝脏断面能够保持一定的张力,血管多是贴靠在一起,不会引发空气栓塞。本组病例未见肺栓塞发生。
本文是腹腔镜下肝切除运用肝下下腔静脉阻断的初步经验。我们认为在腹腔镜下运用肝下下腔静脉阻断时应注意以下几点:①在游离肝下下腔静脉时,预置阻断带时,注意避免损伤肾静脉;②在绕过肝下下腔静脉时,动作应轻柔,避免损伤腰静脉;③术中需要阻断肝下下腔静脉时,应在直视下阻断;④连续肝下下腔静脉阻断15 min是安全的,若断肝未完成,建议松开肝下下腔静脉5 min,再次予以阻断;⑤若术中发现肝下下腔静脉阻断后,病人血压下降至60 mmHg以下,应用血管活性药物仍不能升高血压至60 mmHg以上,尽管这种情况很少发生,但建议放弃肝下下腔静脉阻断;⑥因本研究缺少高龄病人,对于年龄超过65岁的病人,腹腔镜下阻断肝下下腔静脉应慎重。
我们初步的经验认为腹腔镜下肝下下腔静脉阻断是安全有效,将在腹腔镜肝切除术中具有重要的价值,对进一步推广腹腔镜肝切除在我国的普及大有帮助。
1 BuellJF,Cherqui D,Geller DA,et al.The international positionon laparoscopic liver surgery:The Louisville Statement 2008. World Consensus Conference on Laparoscopic Surgery.Ann Surg,2009,250:825-830.DOI:10.1097/SLA.0b013e3181b3b2d8
2 Wakabayashi G,Cherqui D,Geller DA,et al. Recommendations for laparoscopic liver resection: a report from the second international consensus conference held in Morioka. Ann Surg,2015,261:619-629.DOI:10.1097/SLA.0000000000001184
3 National Hepatic Surgery Group Society of Surgery,Chinese Medical Association Expert consensus on laparoscopic hepatectomy (2013 version). J Huazhong Univ Sci Technolog Med Sci,2013,33:791-797. DOI:10.1007/s11596-013-1200-1
4 Zhang XL,Wang WJ,Wang WJ,et al. Effectiveness and safety of controlled venous pressure in liver surgery: a systematic review and network Meta-Analysis.Biomed Res Int,2015,290234:1-10. DOI: 10.1155/2015/290234
5 Kawaguchi Y,Nomi T,Fuks D,et al.Hemorrhage control for laparoscopic hepatectomy: technical details and predictive factors for intraoperative blood loss.Surg Endosc,2015,30:1-9.DOI:10.1007/s00464-015-4520-3
6 陈孝平,吴在德,覃修福,等.肝段切除术120例.中华外科杂志,1990,28:599-601.
7 Chen XP,Qiu FZ,Lau WY,et al.Mesohepatectomy for hepatocellular carcinoma a study of 256 patients.Int J Colorectal Dis,2008,23:543-546.DOI:10.1007/s00384-007-0411-y
8 Zhu P,Lau WY,Chen YF,et al. Randomized clinical trial comparing infrahepatic inferior vena cava clamping with low central venous pressure in complex liver resections involving the Pringle manoeuvre. Br J Surg,2012,99:781-788.DOI:10.1002/bjs.8714
9 Koffron AJ,Auffenberg G,Kung R,et al.Evaluation of 300 minimally invasive liver resections at a single institution:less is more.Ann Surg,246:385-392.DOI:10.1097/SLA.0b013e318146996c
10Buell JF,Thomas MT,Rudich S,et al.Experience with more than 500 minimally invasive hepatic procedures.Ann Surg,248: 475-486.DOI:10.1097/SLA.0b013e318185e647
11Mirnezami R,Mirnezami AH,Chandrakumaran K,et al.Short- and long-term outcomes after laparoscopic and open hepatic resection: systematic review and meta-analysis.HPB (Oxford),2011,13:295-308. DOI: 10.1111/j.1477-2574.2011.00295.x
12Vigan L,Tayar C,Laurent A,et al.Laparoscopic liver resection:a systematic review.J Hepatobiliary Pancreat Surg,2009,16:410-421.DOI: 10.1007/s00534-009-0120-8
13Nguyen KT,Gamblin TC,Geller DA.World review of laparoscopic liver resection-2,804 patients.Ann Surg,2009,250:831-841.DOI:10.1097/SLA.0b013e3181b0c4df
14Kaneko H,Otsuka Y,Tsuchiya M,et al.Application of device for safe laparoscopic hepatectomy.HPB (Oxford),2008,10:219-224.DOI:10.1080/13651820802166831
15Jones RM,Moulton CE,Hardy KJ,et al.Central venous pressure and its effect on blood loss during liver resection.Br J Surg,1998,85:1058-1060. DOI: 10.1046/j.1365-2168.1998.00795.x
16Hughes MJ,Ventham NT,Harrison EM,et al. Central venous pressureandliverresection:a systematic review and meta-analysis. HPB (Oxford),2015,17:863-871. DOI:10.1111/hpb.12462
17Rahbari NN,Koch M,Zimmermann JB,et al. Infrahepatic inferior vena cava clamping for reduction of central venous pressure and blood loss during hepatic resection: a randomized controlled trial. Ann Surg,2011,253:1102-1110.DOI: 10.1097/SLA.0b013e318214bee5
18Otsubo T,Takasaki K,Yamamoto M,et al.Bleeding during hepatectomy can be reduced by clamping the inferior vena cava below the liver. Surgery,2004,135:67-73.DOI:10.1016/S0039-6060(03)00343-X
19Fors D,Eiriksson K,Arvidsson D,et al.Gas embolism during laparoscopic liver resection in a pig model:frequency and severity.Br J Anaesth,2010,105:282-288.DOI:10.1093/bja/aeq159
20Schmandra TC,Mierdl S,Hollander D,et al.Risk of gas embolism in hand-assisted versus total laparoscopic hepatic resection.Surg Technol Int,2004,12:137-143.
21Gagner M.Small incision,big surgeon:Laparoscopic liver resection for tumors without a doubt:Comment on "Laparoscopic Liver Resection for Malignant and Benign Lesions:Ten-Year Norwegian Single-Center Experience".Arch Surg,2010,145:40-41.
22Gagner M,Rogula T,Selzer D.Laparoscopic liver resection: benefits and controversies.Surg Clin North Am,2004,84:451-462.DOI:10.1016/j.suc.2003.11.00223Abu Hilal M,Underwood T,Taylor MG,et al.Bleeding and hemostasis in laparoscopic liver surgery.Surg Endosc,2010,24:572-577.DOI:10.1007/s00464-009-0597-x
Infrahepatic inferior vena cava clamping with pringle maneuvers for laparoscopic hepatoectomy for hepatocellular carcinomas
ZhangWanguang,ZhangBixiang,WangJian,ZhangZhiwei,ZhuPeng,LiChanghai,DongHanhua,ChenXiaoping.
CenterofHepatobiliarySurgery,TongjiHospital,TongjiMedicalCollege,HuazhongUniversityofScienceandTechnology,Wuhan430030,China
ChenXiaoping,Email:chenxp@medmail.com.cn
Objective To retrospectively evaluate the safety and efficacy of hemorrhage control with infrahepatic inferior vena cava (IVC) clamping during laparoscopic hepatoectomy.Methods From January 2015 to December 2015, a total of 51 patients undergoing laparoscopic hepatectomy were enrolled and allocated to infrahepatic IVC clamping group (n=32) and Pringle group (n=19). Baseline data were similar. All procedures were performed by the same surgeon. Operative time, clamping time, blood loss, RBC transfusion, perioperative morbidity, and mortality were evaluated. Intraoperative haemodynamic parameters were recorded. Serum total bilirubin, aspartate aminotransferase (AST), alanine aminotransferase (ALT), and creatinine (Cr) was measured intraoperatively. Postoperative morbidity and mortality were assessed.Results Mean blood loss in IVC clamping group was 370.1±107.9 mL, 1 patient
blood transfusions and there was no conversion to open surgery. No patients had life-threatening complications. In Pringle group, the mean blood loss was 560.3±191.3 mL. Three patients received blood transfusions. One had conversion to open surgery. Mean arterial pressure (MAP) was decreased from 92.3±4.7 mmHg to 71.3±4.6 mmHg after clamping the IVC. The heart rate (HR) was increased from 73.9±6.9/min to 93.5±10.7/min. MAP and HR restored to the normal levels once the IVC was released. There was no significant difference in the recovery of liver and renal function. The overall complications were similar between those two groups.Conclusions Infrahepatic IVC clamping significantly decreased blood loss. The infrahepatic IVC clamping technique is feasible and useful for controlling intraoperative hemorrhage from the hepatic veins during laparoscopic hepatoectomy.
Infrahepatic inferior vena cava; Hepatoectomy; Laparoscope
430030 武汉, 华中科技大学同济医学院附属同济医院肝脏外科中心
陈孝平,Email:chenxp@medmail.com.cn
R735.7
A
10.3969/j.issn.1003-5591.2016.02.002
2016-03-20)
