抗A型流感病毒聚合酶碱性蛋白1多克隆抗体的制备和鉴定
2016-07-04秦玉洁张廷虹叶昕
秦玉洁,张廷虹,叶昕
中国科学院微生物研究所,北京 100101
抗A型流感病毒聚合酶碱性蛋白1多克隆抗体的制备和鉴定
秦玉洁,张廷虹,叶昕
中国科学院微生物研究所,北京 100101
秦玉洁, 张廷虹, 叶昕. 抗A型流感病毒聚合酶碱性蛋白1多克隆抗体的制备和鉴定. 生物工程学报, 2016, 32(1): 105–113.
Qin YJ, Zhang TH, Ye X. Preparation and detection of anti-influenza A virus polymerase basic protein 1 polyclonal antibody. Chin J Biotech, 2016, 32(1): 105–113.
摘 要:流感病毒属于正黏病毒科,为有包膜包裹的单股负链RNA病毒。它的8个基因片段编码至少16种病毒蛋白,其中3个蛋白组成流感病毒的聚合酶复合体。流感病毒聚合酶碱性蛋白1 (PB1) 是该复合体的组分之一,在病毒的转录、复制及重配中发挥重要的作用。为研究其功能,构建His-PB1 (aa 550–755) 融合蛋白原核表达质粒,IPTG诱导融合蛋白表达,通过镍柱亲和将其纯化,然后作为抗原免疫家兔。对抗血清进行间接ELISA检测,表明抗体效价可达1∶100 000。兔源PB1蛋白抗血清经亲和纯化后,用于免疫印迹检测流感病毒WSN毒株PB1蛋白以及外源转染的FLAG-PB1蛋白,结果表明该PB1抗体具有良好的特异性,同时也能特异性识别其他亚型的A型流感病毒的PB1蛋白,为进一步研究流感病毒PB1蛋白的功能奠定了基础。
关键词:流感病毒,PB1,多克隆抗体,亲和纯化
Received: March 7, 2015; Accepted: May 4, 2015
Supported by: National Basic Research and Development Program of China (973 Program) (No. 2011CB504705), Key Projects in the National Science and Technology Pillar Program (No. 2013ZX10004611).
国家重点基础研究发展计划 (973计划) (No. 2011CB504705),国家科技重大专项 (No. 2013ZX10004611) 资助。
流感病毒属于正黏病毒科,为有包膜包裹的单股负链RNA病毒[1]。流感病毒8个基因片段编码16种蛋白[2-3]。每个基因片段都被核蛋白(NP) 以及RNA依赖的RNA聚合酶包裹,形成病毒核糖核蛋白复合体[4]。其中,RNA依赖的RNA聚合酶复合体由聚合酶碱性蛋白1 (PB1)、聚合酶碱性蛋白2 (PB2)、聚合酶酸性蛋白 (PA) 3种组分构成。病毒感染宿主细胞之后,聚合酶复合体入核,完成病毒的转录及复制。PB1在流感病毒聚合酶复合体中作为骨架起支撑作用且具有聚合酶活性,在RNA链延伸过程中起催化作用[4-7]。此外PB1还含有病毒RNA (vRNA) 及cRNA的结合域[8-9],与病毒的转录及复制密切相关。在流感病毒的重配中,PB1蛋白及病毒表面糖蛋白经常发生重排,研究人员认为这些重排能通过提高流感病毒的适应性使其在自然选择中占据优势[10],而且已经证明PB1蛋白与流感病毒的种间传递及适应有关[10]。PB1还与多种宿主因子如CES1、CHAF1A、DDX54、EEF1A1等存在相互作用[4]。通过序列重排及突变分析表明PB1的活性位点位于其中部区域S-D-D基序[11]。由此可见,流感病毒的PB1蛋白在病毒的发生发展中发挥着重要的作用,目前虽然有一些商品化的PB1的抗体,但是其特异性、灵敏度并不十分好。这为PB1蛋白的研究工作造成了不便。为了进一步研究流感病毒PB1蛋白与病毒组分及宿主细胞因子的相互作用,通过对PB1蛋白进行抗原表位分析以及同源比对,首次选取了流感病毒PB1蛋白550–755位氨基酸作为免疫原免疫家兔。同源比对结果表明,该段区域在不同亚型的A型流感病毒PB1蛋白高度保守,例如:与A/Puerto Rico/8/1934 (H1N1) 亚型有98%的同源性,与A/Philippines/2/ 1982 (H3N2)、A/chicken/Vietnam/949B/2004 (H5N1)、A/Anhui/1-DEWH 730/2013 (H7N9) 的同源性分别为84%、84%和83%。并得到了兔源的PB1蛋白多克隆抗体。利用抗原抗体的亲和纯化得到了效价及特异性都较好的抗PB1蛋白的多克隆抗体,为进一步研究该蛋白的功能特性奠定了基础。
1 材料与方法
1.1材料
1.1.1材料
引物由博尚公司、华大基因合成;pET-30a原核表达载体及pHH21-PB1重组质粒均由本实验室保存,大肠杆菌Escherichia coli Top 10、BL21感受态细胞由本实验室制备。WSN病毒由本实验室制备,H3N2以及H9N2亚型流感病毒由中国科学院微生物研究所严景华研究员惠赠。
1.1.2试剂
rTaq DNA聚合酶,10×PCR缓冲液,EcoRⅠ/ Hind Ⅲ,1 mol/L 缓冲液,T4 DNA 连接酶,T4 DNA 连接酶缓冲液均购自宝生物工程 (大连) 有限公司;胶回收试剂盒和镍柱购自Qiagen公司;质粒提取试剂盒、BCA protein Aassy kit、显色用A/B液购自Vigorous公司;IPTG购自Merck公司。
1.1.3仪器
PCR仪为Bio-Rad产品;摇床购自上海博彩生物科技有限公司;37 ℃温箱购自上海一恒科技有限公司;离心机购自Eppendorf公司;超声破碎仪JY92-2D购自宁波新芝公司;核酸电泳仪购自北京君益东方电泳设备有限公司;蛋白电泳仪及凝胶成像仪购自上海天能公司;摄影暗匣购自广东粤华医疗器械厂有限公司。
1.2方法
1.2.1pET-30a-PB1 (aa 550-755) 原核表达质粒的构建和鉴定
通过Lasergene软件预测PB1较为高效的抗原表位:分别采用protean中的Chou-Fasman方案和Garnier法对PB1蛋白的二级结构进行预测;通过Hopp-woods分析PB1蛋白的亲疏水性;通过Emini分析PB1蛋白的溶剂可及性;通过Karplus-Schulz方法分析PB1蛋白的可塑性;通过Jameson-Wolf预测PB1蛋白潜在的抗原表位,最终选取PB1蛋白的550–755aa段作为抗原区段[12]。根据PB1蛋白的碱基序列及pET-30a载体多克隆位点序列设计扩增引物,上游引物:5′-CGGAATTCATGCTGTTCATCAAAGATTA C-3′,下游引物:5′-CCCAAGCTTCTACCGT CTGAGCTCTTCAAT-3′。引物两端分别引入了EcoRⅠ、Hind Ⅲ酶切位点,扩增片段为618 bp。PCR体系:rTaq DNA 聚合酶0.25 μL;10×PCR 缓冲液5 μL;dNTPs 4 μL;pHH21-PB1质粒 0.25 μL;上游引物 1 μL;下游引物 1 μL; H2O 38.5 μL。PCR的条件为:95 ℃ 5 min;94 ℃30 s,50 ℃ 30 s,72 ℃ 40 s;72 ℃ 10 min ,共设30个循环。PCR 产物全部进行TAE电泳后用胶回收试剂盒进行回收。PCR 产物纯化按说明书进行。将其经 EcoRⅠ和 Hind Ⅲ双酶切后,克隆于 pET-30a 中,并将连接产物转化E. coli Top 10 感受态细胞。挑取转化子提质粒分别进行酶切及PCR验证。
1.2.2His-PB1 (aa 550–755) 融合蛋白的原核表达及纯化
将测序正确的重组质粒转化E. coli BL21感受态细胞,待菌液OD600值至0.4−0.6时,经终浓度0.8 mmol/L的异丙基-β-D-硫代半乳糖苷(IPTG) 诱导表达,采用SDS-PAGE 进行蛋白表达分析。重组蛋白在8 mol/L尿素存在的变性条件下镍柱亲和纯化蛋白。BCA试剂盒测定蛋白浓度。
1.2.3His-PB1 (aa 550–755) 融合蛋白多克隆抗体的制备及纯化
将纯化后的His-PB1 (aa 550−755) 融合蛋白与等体积的弗氏完全佐剂混合乳化并对成年雄性家兔颈背部皮下进行多点注射,每次注射蛋白用量为0.5 mg;每隔两周免疫1次,免疫3次后从家兔耳源静脉采血,间接ELISA法检测抗血清效价;最终收集免疫后的家兔血清加入0.01%的叠氮化钠于–20 ℃保存。将得到的抗血清进行亲和纯化。
将PB1融合蛋白抗原蛋白质电泳后转PVDF膜 (150 mA,40 min),5%脱脂奶粉封闭2 h,丽春红染液染色,TBST脱色后将膜上显示目的蛋白的条带剪碎加至15 mL离心管中,加入9 mL PBS、900 μL抗血清及100 μL 1 mol/L Tris (pH 9.0),4 ℃过夜。TBST洗脱 (10 min×3 次)。向离心管中加入200 μL10 mmol/L的甘氨酸 (pH 2.7),室温孵育1 h,将溶液吸出转到另一个柱子中,加入8 μL1.5 mol/L Tris (pH 8.8)调节pH,稳定抗体。
1.2.4ELISA检测抗体效价
96孔板每孔加入100 μL蛋白稀释液。免疫家兔后的抗血清梯度稀释后按每孔100 μL的量加至蛋白稀释液。封板,4 ℃冰箱静置过夜,PBST (含有0.5% Tween的PBS) 洗3遍,每孔加入100 μL 2.5%脱脂奶粉静置封闭1 h,PBST 洗3遍,每孔加入100 μL抗兔二抗,室温静置1 h,PBST洗3遍,每孔加入100 μL显色液,37 ℃静置30 min,每孔加入50 μL H2SO4终止反应,测定波长450 nm处OD值。
1.2.5Western blotting检测PB1抗体灵敏度及特异性
293T细胞感染MOI=0.5的流感病毒或者转染FLAG-PB1真核表达质粒,细胞裂解液处理之后进行蛋白质电泳,结束后转膜 (湿法转膜) 200 mA恒流转50 min,5%的脱脂奶粉封闭1 h,将抗体稀释后与膜室温共孵育2 h,TBST洗膜10 min×3次,抗兔的二抗室温孵育膜1 h,弃二抗,TBST洗膜10 min×3次,显色。
2 结果
2.1PB1蛋白抗原表位的生物信息学分析
通过Protean软件预测寻找PB1蛋白潜在的抗原表位,最终选择了550–755这段氨基酸序列,PB1的基因序列来源于NCBI (GI:194352384)。如图1所示,该序列表达蛋白二级结构多是β转角和无规则卷曲,且氨基酸多为亲水性氨基酸,可及性与可塑性都较高,这类结构多处于蛋白表面,利于与抗体的嵌合[12-13],同源比对结果也表明该段序列高度保守。
2.2pET-30a-PB1 (aa 550–755) 重组质粒的构建及鉴定
以pHH21-PB1质粒为模板对PB1基因1 648−2 265段进行PCR扩增。PCR扩增产物约为 618 bp,将其克隆于pET-30a表达载体中,测序结果显示扩增片段与目的基因序列完全一致。

图1 PB1蛋白抗原表位的选取Fig. 1 Selection of the antigenic epitopes of PB1. Chou-Fasman and Garnier were adopted to predict the second structure of PB1 protein. Hopp-woods were adopted to analyse the hydrophilicity of PB1 protein. Emini was adopted to analyse the solvent accessibility of PB1 protein. Karplus-Schulz was adopted to analyse the flexible region of PB1 protein. Jameson-Wolf was adopted to predict the potential antigenic epitopes of PB1 protein.
2.3重组蛋白的表达及纯化
重组菌经IPTG诱导表达融合蛋白,分子量大小预测为24 kDa。经SDS-PAGE电泳分析,显示在24 kDa处出现特异性的目的条带,与预期相符。SDS-PAGE检测发现,IPTG诱导后5−8 h均可见明显大量的表达产物。同时超声结果显示,重组蛋白主要存在于超声沉淀中,表明目的蛋白以包涵体的形式表达。将诱导8 h后的菌液离心,沉淀超声后收取蛋白并进行纯化,SDS-PAGE电泳结果表明蛋白纯化结果较好,如图2所示。同时将纯化后的His-PB1 (aa 550−755) 用His标签抗体进行Western blotting鉴定,结果表明(图3) 抗His的MAb与带有His标签的融合重组蛋白特异性结合,也检测到了该蛋白的表达。
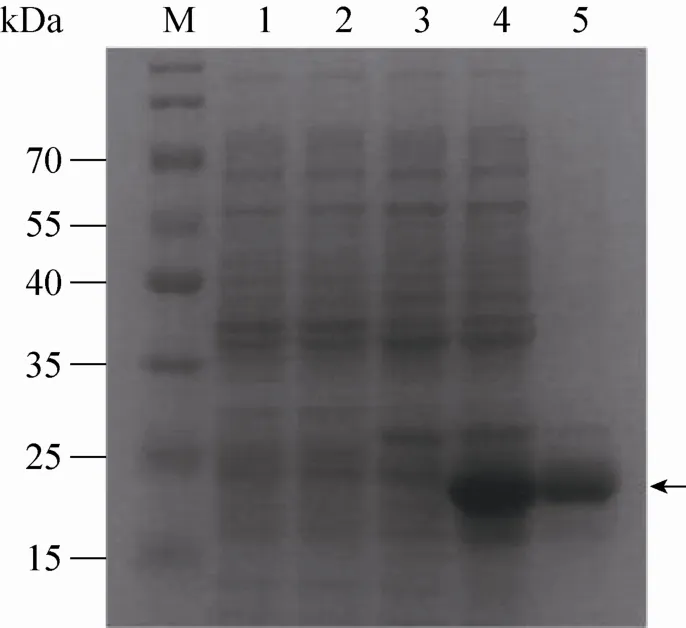
图2 His-PB1融合蛋白的纯化Fig. 2 Purification of the His-PB1 fusion protein. E. coli BL21 bacteria were transformed with pET-30a (lane 1, 2) or pET-30a-PB1(lane 3, 4) and harvested at 8 h after IPTG induction (lane 2, 4). Lane 5 indicates the purified His-PB1 protein. The expression of protein was analysed by SDS-PAGE and stained by CBB. Arrow shows the expression of His-PB1 fusion protein. M: protein marker.

图3 His-PB1融合蛋白的Western blotting鉴定Fig. 3 Identification of the His-PB1 fusion protein by Western blotting. E. coli BL21 bacteria were transformed with pET-30a (lane 1) or pET-30a-PB1 (lane 2) and harvested at 8 h after IPTG induction. Lane 3 indicates the purified His-PB1 protein. The expression of protein was analysed by Western blotting and immunoblotted with anti-His tag antibody.
2.4ELISA检测抗体效价
纯化后蛋白经BCA试剂盒测得浓度为0.58 g/L。将所得抗原免疫家兔,取免疫前血清,二次免疫后血清进行ELISA实验检测抗体效价。ELISA结果表明所得兔源PB1多克隆抗体效价至少为1∶100 000 (图4)。

图4 ELISA检测兔源PB1多克隆抗体效价Fig. 4 Detection of the polyclonal antibody titer of PB1 by indirect ELISA. Serum from rabbit immunized with PB1 fusion protein was added to the PB1 protein in dilution of 1:1 000, 1:10 000, 1:100 000 and 1:1 000 000. Serum from rabbit before immunization was added as negative control. The OD450was then detected.
2.5抗PB1重组蛋白多克隆抗体特异性鉴定及效价分析
Western blotting鉴定纯化的抗PB1多克隆抗体与FLAG-PB1及病毒PB1蛋白结合的特异性,SDS-PAGE检测结果如图5A所示。结果表明纯化后的抗体与过表达的FLAG-PB1以及流感病毒WSN毒株的PB1蛋白均能发生特异性反应,且条带单一,表明特异性较好。同时该PB1抗体也可以与其他亚型如H3N2、H9N2流感病毒的PB1蛋白发生特异性反应,结果如图5B所示。将制备的PB1多克隆抗体与购自Santa 的PB1抗体进行比较,结果显示PB1多克隆抗体的灵敏度显著高于商业化PB1抗体 (Santa I0303) (图6)。
3 讨论
流感病毒PB1蛋白是流感病毒聚合酶复合体的组分之一,在流感病毒的转录、复制等过程中发挥非常重要的作用。为更好地研究PB1蛋白的功能及其与宿主细胞因子的相互作用,本实验制备了灵敏度及特异性都较好的抗PB1多克隆抗体。我们首次选取了PB1蛋白550–755段氨基酸序列作为抗原免疫家兔,该段亲水性、可塑性、可及性都较好,是较为理想的抗原表位。同源比对结果表明该段蛋白区域在不同亚型A型流感病毒毒株中高度保守。免疫家兔获得了高效价的兔源的PB1蛋白多克隆抗体。获得的多克隆抗血清经膜亲和纯化后实验检测表明效价及特异性都较好,其灵敏度显著高于购买的PB1抗体 (Santa I0303),且能够与不同亚型的A型流感病毒PB1蛋白特异性结合,为人们研究流感病毒聚合酶或制备PB1抗体提供了思路。
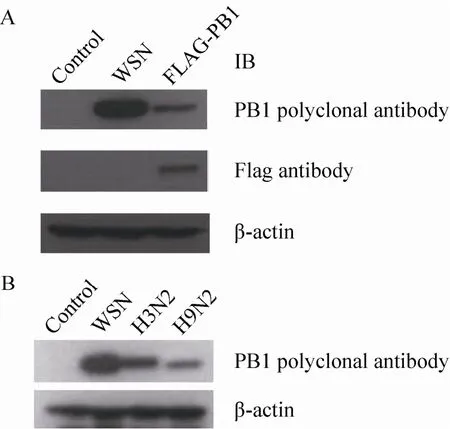
图5 Western blotting检测PB1多克隆抗体的特异性Fig. 5 Detection of the specificity of the PB1 polyclonal antibody. (A) 293T cells were infected with WSN influenza virus at MOI of 0.5 or transfected with FLAG-PB1 expressing plasmid and harvested 14 h after infection or 24 h after transfection. Total cell extracts were prepared for immunoblotting with indicated antibodies. 293T cells without any treatment were used as negative control. (B) 293T cells were infected separately with WSN, H3N2, H9N2 influenza virus at MOI of 0.5 and harvested 14 h after infection. Total cell extracts were prepared for immunoblotting with indicated antibodies. 293T cells without any treatment were used as negative control.
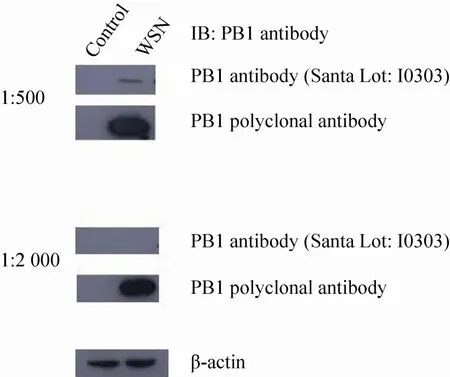
图6 PB1多克隆抗体与商业化PB1抗体灵敏度及特异性比较Fig. 6 Comparison of the specificity and sensitivity between anti-PB1 polyclonal antibody and commercial PB1 antibody. 293T cells were infected with WSN influenza virus at MOI of 0.5 and harvested 14 h after infection. Total cell extracts were prepared for immunoblotting with indicated antibodies. 293T cells without any treatment were used as negative control.
本实验原核表达的抗原蛋白以包涵体的形式存在于原核表达菌株中。一般而言,包涵体的形成主要有两方面的因素:一方面是因为蛋白表达效率太高,使得表达的蛋白无法正常折叠而发生聚集,另一方面可能是因为所含有的半胱氨酸残基形成了链间的二硫键,影响了蛋白质的正确折叠[14-15]。通常情况下会通过采用利用分子伴侣共表达、降低IPTG诱导浓度或者降低蛋白表达温度等手段得到可溶性表达的蛋白[16-17]。实验中虽然采用不同IPTG诱导浓度,不同的诱导温度 (4 ℃、16 ℃、20 ℃、37 ℃),蛋白仍以包涵体的形式表达。故选择在变性条件下镍柱亲和纯化包涵体蛋白,达到了较好的纯化效果。
本文中作为抗原免疫家兔的蛋白为变性后的蛋白,未经复性处理。变性蛋白作为抗原免疫家兔时,抗原中含有8 mol/L的尿素,可能使家兔产生一定的免疫反应。同时由于变性蛋白做抗原获得的抗体识别的是蛋白的线性表位,故而抗体可以用于Western blotting实验,但是只有当该段抗原同时位于处于天然状态下的蛋白表面时,该抗体才可以识别对应的天然蛋白,即可用于免疫共沉淀、免疫荧光等实验。免疫荧光实验证明该段抗体不能应用于该类实验,可能正是因为PB1蛋白的550−775段的氨基酸位于天然构象的PB1蛋白的内部,故以其为抗原制备的抗体不能够识别天然状态下的PB1蛋白,但是可以用于Western blotting实验。实验也证明该抗体在Western blotting实验中的灵敏度及特异性都较好。
免疫家兔得到的抗血清成分比较复杂,使用时会产生较多的非特异性信号,需要纯化才可用于实验。实验室一般采用的抗体纯化方法有分级沉淀、柱纯化以及膜纯化等[14]。在柱纯化中,抗原与微珠以氢键、疏水堆积等作用力相结合,而抗原与抗体特异性结合的作用力也是如此,因此抗体洗脱步骤格外重要,洗脱条件太剧烈会导致抗原一同被洗脱下来,太温和洗脱下的抗体量将大大减少[18],因此抗体的纯化质量不能够保证。本实验采用的膜纯化方法是利用抗原抗体的特异性结合特性,进而通过低pH的甘氨酸洗脱,虽然得到的抗体的量相对柱纯化较少,但是纯度更好,且操作简单易行[19]。经ELISA及Western blotting实验检测,纯化得到的抗体的效价达到100 000且特异性较好,为进一步研究流感病毒PB1蛋白与病毒各组分以及宿主细胞因子的相互作用奠定了基础。
REFERENCES
[1] Samji T. Understanding the viral life cycle. Yale J Biol Med, 2009, 82(4): 153–159.
[2] Wu Y, Wu Y, Tefsen B, et al. Bat-derived influenza-like viruses H17N10 and H18N11. Trends Microbiol, 2014, 22(4): 183–191.
[3] Muramoto Y, Noda T, Kawakami E, et al. Identification of novel influenza A virus proteins translated from PA mRNA. J Virol, 2012, 87(5): 2455–2462.
[4] Tafforeau L, Chantier T, Pradezynski F, et al. Generation and comprehensive analysis of an influenza virus polymerase cellular interaction network. J Virol, 2011, 85(24): 13010–13018.
[5] Poch O, Sauvaget I, Delarue M, et al. Identification of four conserved motifs among the RNA-dependent polymerase encoding elements. EMBO J, 1989, 8(12): 3867–3874.
[6] Asano Y, Ishihama A. Identification of two nucleotide-binding domains on the PB1 subunit of influenza virus RNA polymerase. J Biochem, 1997, 122(3): 627–634.
[7] González S, Zürcher T, Ortín J. Identification of two separate domains in the influenza virus PB1 protein involved in the interaction with the PB2 and PA subunits a model for the viral RNA polymerase structure. Nucleic Acids Res, 1996, 24(22): 4456–4463.
[8] González S, Ortín J. Distinct regions of influenza virus PB1 polymerase subunit recognize vRNA and cRNA templates. EMBO J, 1999, 18(13): 3767–3775.
[9] Jung TE, Brownlee GG. A new promoter-binding site in the PB1 subunit of the influenza A virus polymerase. J Gen Virol, 2006, 87(3): 679–688.
[10] Gíria M, de Andrade HR. Genetic evolution of PB1 in the zoonotic transmission of influenza A (H1) virus. Infect Genet Evol, 2014, 27: 234–243.
[11] Biswas SK, Nayak DP. Mutational analysis of the conserved motifs of influenza A virus polymerase basic protein 1. J Virol, 1994, 68(3): 1819–1826.
[12] Yang QH, Wang XW, Jin Y, et al. Prediction of the B cell epitope for MUC1 antigen. Med Militaris Tertiae, 2005, 27(5): 406–409 (in Chinese).杨清浩, 王祥卫, 金燕, 等. MUC1抗原的B细胞表位预测. 第三军医大学学报, 2005, 27(5): 406–409.
[13] Apostolopoulos V, Yu M, Corper AL, et al. Crystal structure of a non-canonical low-affinity peptide complexed with MHC class I: a new approach for vaccine design. J Mol Biol, 2002, 318(5): 1293–1305.
[14] Wang Z, Dai R, Zhang JW, et al. Induced expression of Arabidopsis thaliana WUSCHEL in Escherichia coli, affinity protein purification and polyclonal antibody preparation. Chin J Biotech, 2009, 25(9): 1409–1416 (in Chinese).王增, 代茹, 张江巍, 等. 拟南芥WUSCHEL蛋白的原核表达、亲和纯化和多克隆抗体制备. 生物工程学报, 2009, 25(9): 1409–1416.
[15] Wang Z, Ma HQ, Zhang W, et al. The progress of inclusion body isolation and chromatographic refolding, purification methods. China Biotechnol, 2009, 29(7): 102–107 (in Chinese).王增, 马会勤, 张文, 等. 包涵体蛋白的分离和色谱法体外复性纯化研究进展. 中国生物工程杂志, 2009, 29(7): 102–107.
[16] Swietnicki W. Folding aggregated proteins into functionally active forms. Curr Opin Biotechnol, 2006, 17(4): 367–372.
[17] Lin GZ, Lian YJ, Ryu JH, et al. Expression and purification of His-tagged flavonol synthase of Camellia sinensis from Escherichia coli. Protein Expr Purif, 2007, 55(2): 287–292.
[18] Shu W, Li FH, Deng M, et al. Preparation, purification the antibody and immunofluorescence analyse of ANKRD17. Lett Biotechnol, 2007, 18(5): 771–773 (in Chinese).舒伟, 李发慧, 邓敏, 等. ANKRD17蛋白抗体的制备、纯化及检测. 生物技术通讯, 2007, 18(5): 771–773.
[19] Cai R, Ye X. Preparation, purification and identification of the polyclonal antibody of PHD finger protein 8. Chin J Biotech, 2010, 26(3): 393–397 (in Chinese).蔡荣, 叶昕. PHD finger protein 8蛋白多克隆抗体的制备、纯化与检测. 生物工程学报, 2010, 26(3): 393–397.
(本文责编 陈宏宇)
Preparation and detection of anti-influenza A virus polymerase basic protein 1 polyclonal antibody
Yujie Qin, Tinghong Zhang, and Xin Ye
Institute of Microbiology, Chinese Academy of Sciences, Beijing 100101, China
Abstract:Influenza A virus is an enveloped virus that belongs to the Orthomyxoviridae family. It has 8 negative RNA segments that encode 16 viral proteins. The viral polymerase consists of 3 proteins (PB1, PB2 and PA) which plays an important role in the transcription and replication of the influenza A virus. Polymerase basic protein 1 (PB1) is a critical member of viral polymerase complex. In order to further study the function of PB1, we need to prepare the PB1 antibody with good quality. Therefore, we amplified PB1 conserved region (nt1648–2265) by PCR and cloned it into pET-30a vector, and transformed into Escherichia coli BL21. The expression of His tagged PB1 protein was induced by IPTG, and His-PB1 proteins were purified by Ni-NTA resin. For preparation of PB1 protein antiserum, rabbits were immunized with His-PB1 fusion protein 3 times. Then the titer of PB1 polyclonal antibody was measured by indirect ELISA. The antibody was purified by membrane affinity purification and subjected to immunoblotting analysis. Data showed that PB1 antibody can recognize PB1 protein from WSN virus infected or pCMV FLAG-PB1 transfected cells. Meanwhile, PB1 antibody can also recognize specifically other subtype strains of influenza A virus such as H9N2 and H3N2. PB1 polyclonal antibody we generated will be a useful tool to study the biological function of PB1.
Keywords:influenza A virus, PB1, polyclonal antibody, affinity purification
DOI:10.13345/j.cjb.150103
Corresponding author:Xin Ye. Tel: +86-10-64807508; E-mail: yex@im.ac.cn
