二氢杨梅素-铜配合物抗氧化活性的研究
2016-07-04郭清泉
袁 娟,郭清泉,徐 勇
(1. 广东省食品工业研究所,广东 广州 510308;2. 广东工业大学 轻工化工学院,广东 广州 510006)
二氢杨梅素-铜配合物抗氧化活性的研究
袁娟1,郭清泉2,徐勇1
(1. 广东省食品工业研究所,广东 广州 510308;2. 广东工业大学 轻工化工学院,广东 广州 510006)
摘要:首先合成氢杨梅素-铜(DMY-Cu(Ⅱ))配合物,通过紫外光谱、红外光谱、热重-热差分析(TG-DTA) 及元素分析对DMY-Cu(Ⅱ)金属配合物的结构进行表征.结果表明,DMY易与Cu2+形成配合物,其组成为[C15H10O8Cu]·H2O.进一步地研究了DMY-Cu(Ⅱ)金属配合物对超氧阴离子自由基·)、羟基自由基(OH·)及DPPH 自由基(DPPH·)的清除作用,结果发现DMY-Cu(Ⅱ)配合物对·和DPPH·具有显著的清除效果,且清除效果比单独配体DMY更强.
关键词:DMY-Cu(Ⅱ)配合物; 羟基自由基; 超氧阴离子自由基; DPPH自由基
二氢杨梅素(Dihydromyricetin,DMY) 是天然多酚羟基双氢黄酮醇类化合物,为藤茶中的主要活性成分,在藤茶幼嫩的茎叶中含量很高,达38%以上[1].DMY在抗菌、抗氧化、降血糖、降血脂、增强免疫、保肝、抗癌等方面具有显著的生理活性,其生理毒性较小.其中,在抗氧化方面DMY可抑制自由基对人体各组织器官的损害,且随着DMY纯度(60%~90%) 的增加,其抗氧化活性明显增强[2-5].
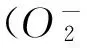
1实验部分
1.1仪器及试剂
VERTEX70型FTIR傅立叶红外光谱仪(德国Bruker公司);FluoroMax-4VPF-100型荧光分光光度计(法国HORIBAJobinYvon公司);STA-409PC集合热分析仪(德国耐驰仪器制造有限公司)(升温速率为15 ℃/min,空气气氛,从室温升至800 ℃);VarioEL元素分析仪(德国Elementar公司);DF-101S型定时恒温磁力搅拌器(予华有限公司).
DMY(99%) 自制;1,1-二苯基苦基苯肼(DPPH) (美国Sigma公司);邻苯三酚、醋酸铜、双氧水等均为分析纯试剂.
1.2实验方法
1.2.1二氢杨梅素-铜配合物的制备
称取0.920g(4.0mmol)DMY,置于160mL无水乙醇中,加热、搅拌至完全溶解后,加入适量的无水醋酸钠调节pH值至7.0~8.0,继续搅拌1h,而后加入0.798g(4.0mmol) (CH3COO)2Cu·2H2O,在70 ℃下搅拌回流8h.然后待静置析出红褐色沉淀物后减压抽滤,将抽滤得到的沉淀物依次用无水乙醇和水反复洗涤.最后干燥,得到的红褐色粉状固体即为DMY-Cu(Ⅱ)金属配合物.
据文献[12-13]取5mL50mmol/LTris-HCl缓冲液(pH为8.2),加入无水乙醇和去离子水各1mL,混和均匀后在25℃的水浴中保温20min.然后加入0.5mL浓度为3mmol/L的邻苯三酚(用10mmol/LHCl配制),空白组为10mmol/L的HCl溶液,迅速摇匀之后在波长320nm下每隔30s测定其吸光度,计算线性范围内1min吸光值的增加值A1即邻苯三酚的自氧化速率.另外取5mL50mmol/L的Tris-HCl缓冲液(pH为 8.2),在加入邻苯三酚前先加入1mL的DMY-Cu(Ⅱ)金属配合物溶液(无水乙醇溶解),同样方法操作,计算线性范围内每lmin吸光度的增加值Ax即为加样品后邻苯三酚的自氧化速率.每个样品平行操作3 次,求其平均值.清除率=[(A1-Ax)/A1]×100%.
1.2.3羟自由基OH·清除率的测定
根据Fenton方法[14],H2O2与亚铁离子可反应生成OH·,OH·存活时间较短但具有很高的活性.OH·用水杨酸显色能形成红色物质,该物质在波长510nm处能被较强地吸收.由于其呈色与OH·量成正比,若在该体系中加入具有清除OH·功能的化合物,则会使有色物质的浓度大为降低.本实验采用Fenton方法研究DMY-Cu(Ⅱ)金属配合物清除OH·的能力.取3.00mL2mmol/LFeSO4溶液,3.00mL6mmol/L水杨酸-乙醇溶液,3mL样品液(DMY-Cu(Ⅱ)金属配合物溶液)以及0.3mL0.3%H2O2溶液,混匀后在37℃的恒温水下反应40min,在510nm处测定其吸光度值Ax.另外以0.3mL的蒸馏水代替0.3mL0.3%H2O2溶液,同样方法操作,在510nm处测定其吸光度值A1.用3mL的蒸馏水代替3mL样品液, 同样方法操作, 测定吸光度值为A0.每个样品平行操作3 次,求其平均值.清除率=[1-(Ax-A1) /A0]×100%.
1.2.4DPPH·清除能力测定
据文献[15-16]取2mLDMY-Cu(Ⅱ)金属配合物(无水乙醇溶解),向其中加入2mL0.01mmol/LDPPH无水乙醇溶液,在室温条件下避光反应30min后,在波长 517nm处测量其吸光度Ax,用等体积的无水乙醇代替DPPH无水乙醇溶液作为空白组,在波长 517nm处测定其吸光度为 A1,直接用DPPH无水乙醇溶液作为对照组,测定其吸光度为A0.每个样品平行操作3次,求其平均值.清除率=[1-( Ax-A1) /A0]×100%.
2结果与讨论
2.1DMY-Cu(Ⅱ)金属配合物的结构表征
DMY及DMY-Cu(Ⅱ)金属配合物的紫外光谱如图1所示,图1中DMY分别在200~230nm和280~310nm处有吸收峰.当DMY与Cu2+螯合后DMY的吸收峰发生明显的红移,其红移现象可能是由于DMY与Cu2+形成配合物后,DMY配体上-OH的氢电离导致苯环与氧原子的共轭作用加强,使共轭体系电子的离域性增大,跃迁的能量降低,则吸收峰的位置自然向低波数方向移动.由图1表明DMY与Cu2+发生了螯合作用.
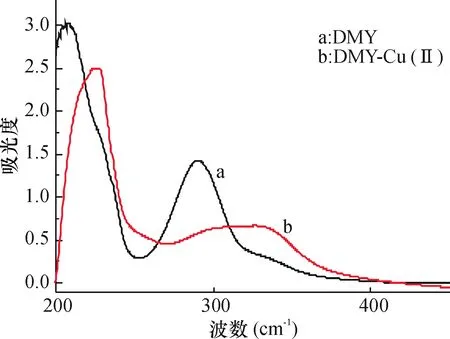
图1 DMY-Cu(Ⅱ)金属配合物及DMY的紫外光谱图
采用KBr压片法测定DMY-Cu(Ⅱ)金属配合物与DMY的红外吸收光谱(见图2),用元素分析仪分析配合物中C、O、H和Cu元素的含量,其实验数据见表1.
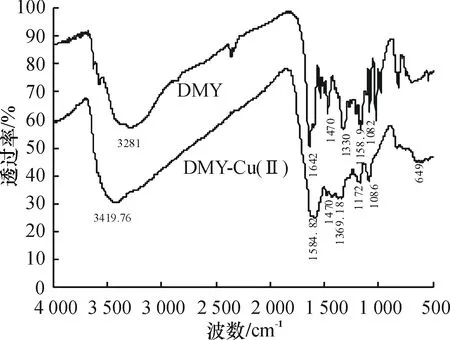
图2 DMY及DMY-Cu(Ⅱ)金属配合物的红外光谱图
对比DMY与DMY-Cu(Ⅱ)金属配合物红外光谱可知,DMY-Cu(Ⅱ)金属配合物在1 450~1 600cm-1处苯环骨架的吸收峰基本上无变化.同时C-O-C振动频率也基本上无变化,这说明DMY与Cu2+发生螯合后其苯环结构依然存在.在3 419.76cm-1出现-OH特征吸收峰,则说明DMY与Cu2+发生螯合后其-OH还存在.与DMY的红外光谱相比,DMY的CO吸收峰在1 642cm-1,当与Cu2+作用时其吸收峰红移到1 584.82cm-1,此外配合物在649cm-1出现新的吸收峰,说明DMY与Cu2+发生了螯合作用并形成以Cu-O键结合的DMY-Cu(Ⅱ)金属配合物.元素分析测得配合物中C、H、O和Cu元素的含量与理论计算的结果也相当.

表1 DMY-Cu(Ⅱ)配合物的元素分析数据
DMY-Cu(Ⅱ)金属配合物的热重分析结果如图3所示.图3中明显看出DMY-Cu(Ⅱ)金属配合物在100℃以下失重,其失重率约为4.23%,与失去1个水分子的量相当(理论计算失重率为4.50%),则说明此阶段失重的水为配合物分子外的结晶水.在120~420 ℃的失重为配体的燃烧分解,当温度升至460℃后配合物基本上没有失重,最后的残余物为氧化铜19.48%(理论计算值为20.00%).从整个热分解过程来看,DMY-Cu(Ⅱ)金属配合物热重的实验值与理论计算值基本相吻合.另据红外光谱的结果、元素分析及热重分析可以推断DMY易与Cu2+发生配合作用,其金属配合物的组成为[C15Hl0O8Cu]·H2O.
2.2DMY-Cu(Ⅱ)配合物对自由基的清除作用
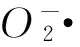
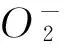
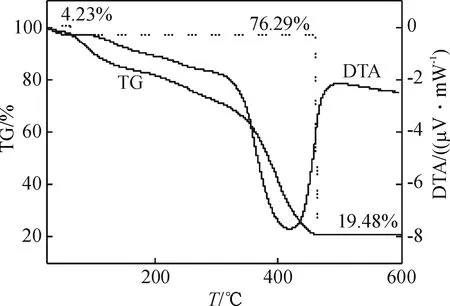
图3 DMY-Cu(II) 配合物的TG-DTA 分析
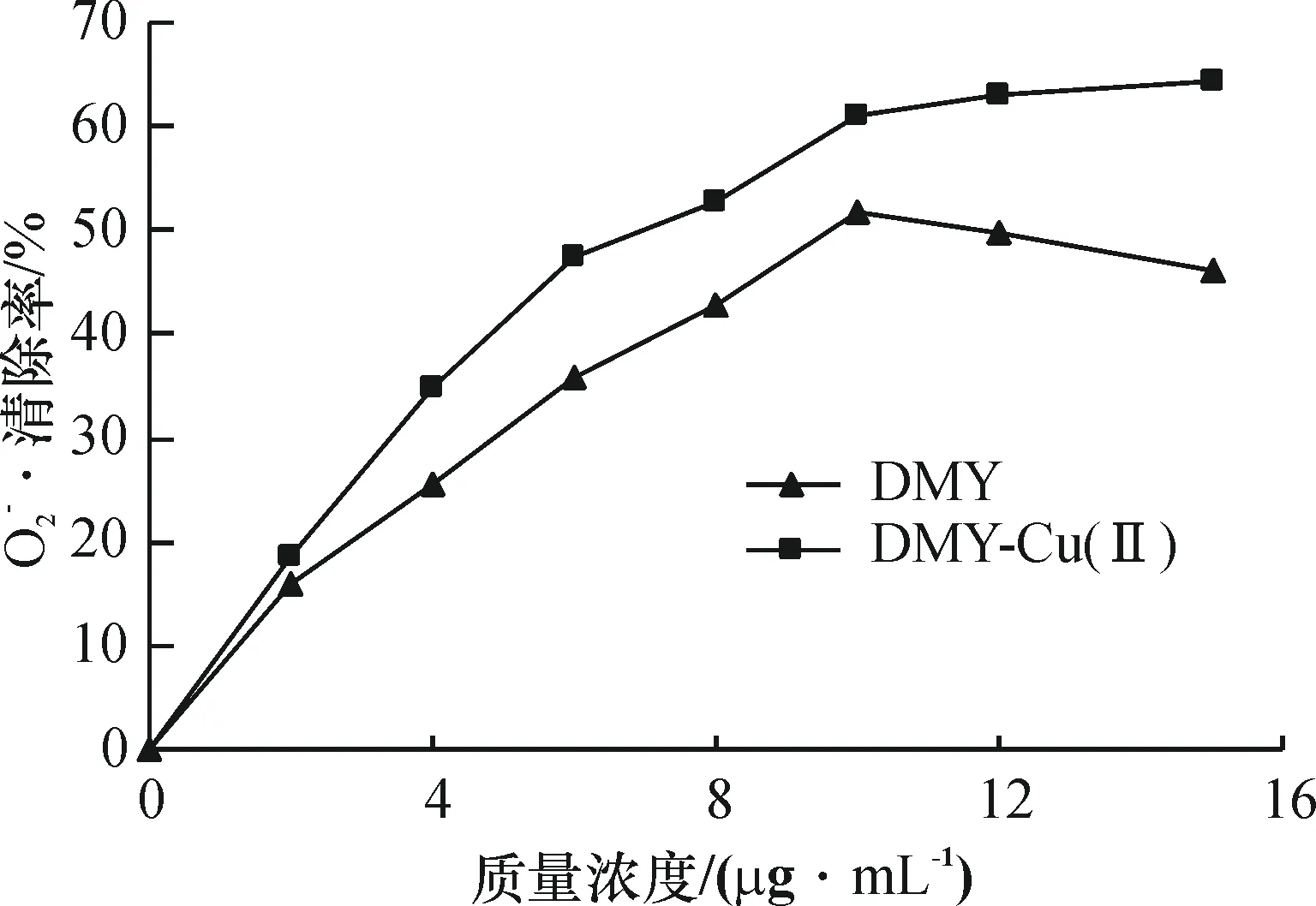
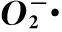
2.2.2DMY及DMY-Cu(Ⅱ)配合物对OH·的清除DMY和DMY-Cu(Ⅱ)金属配合物对OH·清除测试结果如图5所示,其清除效果均随浓度的增大而增大.在低浓度的情况下二者对OH·清除作用基本相近,无大差异.然而在质量浓度大于60μg/mL后DMY-Cu(Ⅱ)配合物对OH·清除效果明显优于DMY,说明Cu2+与有机活性配体DMY协同作用可提高DMY抗OH·活性的能力.
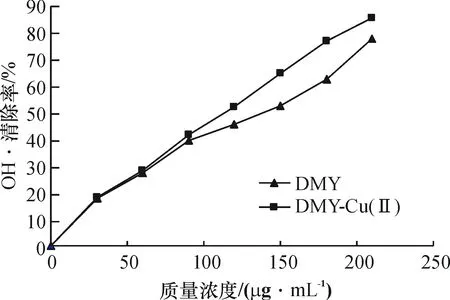
图5DMY及DMY-Cu(Ⅱ)配合物对OH·自由基的清除作用
Fig.5ScavengingeffectofDMYandDMY-Cu(Ⅱ)complexonOH·
2.2.3DMY及DMY-Cu(Ⅱ)配合物对DPPH·的清除从图6可知,DMY和DMY-Cu(Ⅱ)金属配合物对DPPH·均具有很好的清除作用,而且清除效果均随浓度的增大而增大.当DMY质量浓度大于30μg/mL时,其清除率达到80%以上后,再随着DMY浓度的增加,其清除率变化很小.而DMY-Cu(Ⅱ)配合物对DPPH·的清除率随其浓度的增加呈线性增大,且相同浓度下DMY-Cu(Ⅱ)配合物对DPPH·的清除效果明显优于DMY,则说明Cu2+与有机活性配体DMY协同作用可提高DMY抗DPPH·活性的能力.
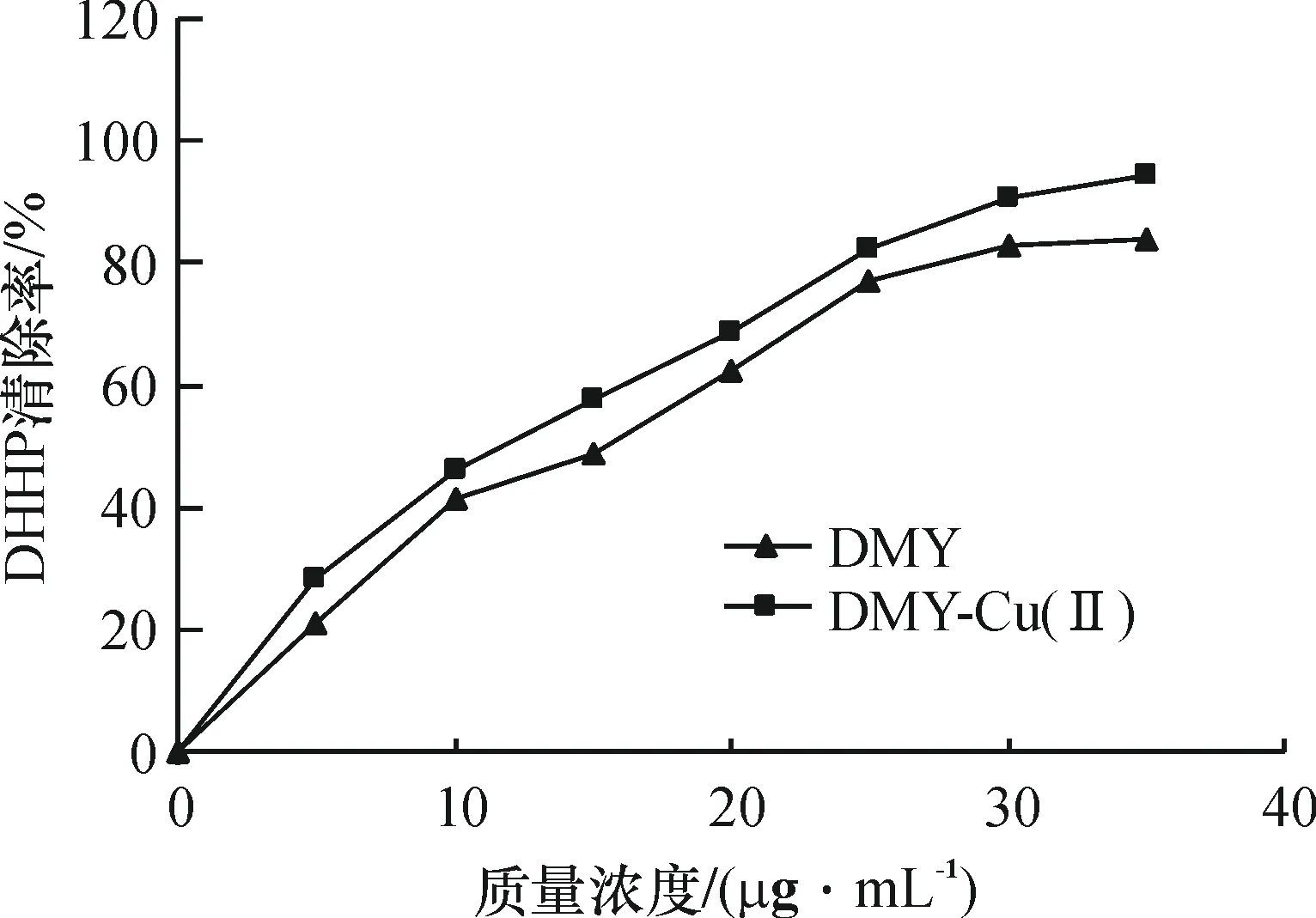
图6DMY及DMY-Cu(Ⅱ)配合物对DPPH·的清除作用
Fig.6ScavengingeffectofDMYandDMY-Cu(Ⅱ)complexonDPPH·
3结论
参考文献:
[1] 王丹,郁建平,刘灏. 藤茶二氢杨梅素抗氧化活性研究[J]. 山 地 农 业 生 物 学 报, 2013, 32(3):243-246.
WANGD,YUJP,LIUH.TheinVitroandvivoantioxidantactivityofDihydromyricetinisolatedfromAmpelopsisgrossedentata[J].JournalofMountainAgricultureandBiology, 2013, 32(3):243-246.
[2] 袁娟,郭清泉,曾金华,等. 二氢杨梅素-锌配合物的合成及其与DNA相互作用研究[J]. 分析测试学报, 2012, 31(8):982-986.
YUANJ,GUOQQ,ZENGJH,etal.StudyonsynthesisofDihydromyricetin-ZinccomplexanditsinteractionwithDNA[J].JournalofInstrumentalAnalysis, 2012, 31(8):982-986.
[3]XUY,WANGF,WANGL,etal.SensitivevoltammetricsensorofdihydromyricetinbasedonNafion/SWNT-modifiedglassycarbonelectrode[J].JSolidStateElectrochem, 2012, 16: 1473-1480.
[4] 董倩倩, 陈立峰. 二氢杨梅素药理研究进展[J]. 中南药学, 2005, 5(3): 295-298.
DONGQQ,CHENLF.AdvancesonpharmacologicalresearchofDihydromyricetin[J].CentralSouthPharmacy, 2005, 5(3):295-298.
[5]SHENY,LINDEMEYERAK,GonzalezC,Shao,etal.Dihydromyricetinasanovelanti-alcoholintoxicationmedication[J].JNeuroSci, 2012, 32(1): 390-401.
[6]PANDELOVAM,LOPEZWL,MichalkeB,etal.Ca,Cd,Cu,Fe,Hg,Mn,Ni,Pb,Se,andZncontentsinbabyfoodsfromtheEUmarket:Comparisonofassessedinfantintakeswiththepresentsafetylimitsformineralsandtraceelements[J].JFoodCompAnal, 2012, 27(2): 120-127.
[7]HäNSCHR,MENDELRR.Physiologicalfunctionsofmineralmicronutrients(Cu,Zn,Mn,Fe,Ni,Mo,B,Cl)[J].CurrOpinPlantBiol, 2009, 12(3):259-266.
[8] 李翠萍, 曹输稳, 余燕影. 二氢杨梅素研究进展[J]. 化学试剂, 2010, 32(7): 608-612.
LICP,CAOSE,YUYY.Advanceinresearchondihydromyricetin[J].ChemicalReagents, 32(7): 608-612.
[9]WUC,ZHENGXP,CHENLL.StudyonantioxidantactivityofDihydromyricetin-Zinc(II)complex[J].AdvMaterRes, 2011,(183-185):863-867.
[10]SATHYADEVIP,KRISHNAMOORTHYP,BUTORACRR,etal.EffectofsubstitutionandplanarityoftheligandonDNA/BSAinteraction,freeradicalscavengingandcytotoxicityofdiamagneticNi(II)complexes:Asystematicinvestigation[J].DaltonTrans, 2011, 40:9690-9696.
[11] 李海霞. 二氢杨梅素-镍配合物的制备及其羟自由基的清除作用[J]. 中 国 酿 造, 2013, 32(5):70-72.
LIHX.SynthesisanditsOH·freeradicalscavengecapacityofdihydromyricetin-Nicomplexes[J].ChinaBrewing, 2013, 32(5): 70-72.
[12] 黄池宝,罗宗铭,宾丽英. 黄酮类化合物抗氧化性与其结构关系的研究[J]. 广东工业大学学报, 2000, 17(2): 71-75.
HUAGNCB,LUOZM,BINLY.StudyontherelationbetweenstructureandantioxygenicactivityofFlavonoid[J].JournalofGuangdongUniversityofTechnology, 2000, 17(2): 71-75.
[13]SHUKLAS,MEHTAA,MEHTAP,etal.AntioxidantabilityandtotalphenoliccontentofaqueousleafextractofSteviarebaudiana[J].BertExpToxicolPathol, 2012, 64(7-8): 807-811.
[14] 颜军,苟小军,邹全付, 等. 分光光度法测定Fenton反应产生的羟基自由基[J]. 成都大学学报(自然科学版), 2009, 28(2):91-92.
YANJ,GOUXJ,ZOUQF,etal.DeterminationofhydroxylradicalgeneratingfromFentonreactionbyspectrophotometry[J].JournalofChengduUniversity(NaturalScienceEdition), 2009, 28(2):91-92.
[15] 翟广玉, 颜子童, 渠文涛, 等. 槲皮素锡的合成及其生物活性研究[J]. 信阳师范学院学报(自然科学版), 2013, 26(1):111-114.
ZHAIGY,YANZT,QUWT,etal.SynthesisandbiologicalactivitiesofQuercetin-Sn[J].JournalofXinyangNormalUniversity(NaturalScienceEdition), 2013, 26(1):111-114.
[16]Gülçina,ElmastaξM,Aboul-EneinHY.Antioxidantactivityofcloveoil—apowerfulantioxidantsource[J].ArabJChem, 2012, 5(4): 489-499.
Study on Antioxidant Activities of the Complex of DMY-Cu(Ⅱ)
Yuan Juan1, Guo Qing-quan2, Xu Yong1
(1.GuangdongFoodIndustryResearchInstitute,Guangzhou510308,China;2.SchoolofChemicalEngineeringandLightIndustry,GuangdongUniversityofTechnology,Guangzhou510006,China)
Abstract:This paper characterizes the structure of metal complex DMY-Cu(Ⅱ)after its preparation through UV spectroscopy, IR spectroscopy, elemental analysis and thermogravimetry-differential thermal analysis (TG-DTA). The results indicate that DMY and Cu2+ion are easy to form complexes whose composition is [C15H10O8Cu]·H2O. It further studies the scavenging capacity of DMY-Cu(Ⅱ)on superoxide anion radical · ), hydroxyl radical (OH·) and DPPH radical(DPPH·). The finding of the investigation is that the complex DMY-Cu(Ⅱ) has a great cleaning effect on · and DPPH·, which outweighs the DMY ligand.
Key words:complex of DMY-Cu (Ⅱ); hydroxyl radical; superoxide anion radical; DPPH radical
收稿日期:2015-03-16
基金项目:广东省部产学研合作项目(2012B091100187); 广东省科技计划项目(2013B090900007)
作者简介:袁娟(1987-),女,助理工程师,主要研究方向为天然产物化学.
doi:10.3969/j.issn.1007-7162.2016.02.016
中图分类号:TS 202.3
文献标志码:A
文章编号:1007-7162(2016)02-0081-04
