产恩拉霉素链霉菌的诱变及其发酵条件的优化
2016-07-03丁志雯胡永红杨文革顾鹏飞王春晓
丁志雯,胡永红,杨文革,吴 刚,顾鹏飞,王春晓
(南京工业大学生物与制药工程学院,江苏南京211816)
产恩拉霉素链霉菌的诱变及其发酵条件的优化
丁志雯,胡永红*,杨文革,吴 刚,顾鹏飞,王春晓
(南京工业大学生物与制药工程学院,江苏南京211816)
为满足恩拉霉素工业化生产对高产菌株的需求,采用N+注入技术和单因素及正交试验方法对产恩拉霉素链霉菌(Streptomyces sp.)NJWGY3665进行诱变,并对目的菌株的最佳发酵条件进行优化。结果表明:随N+注入剂量的增加,菌株的存活率呈典型的马鞍型剂量-效应曲线。在最佳注射剂量120× 1013ions/cm2条件下筛选到1株具有遗传稳定性的高产链霉菌突变菌株LD1;该菌株发酵最适培养基条件为蔗糖50g/L,酵母粉20g/L,NaCl 1.5g/L,FeSO40.5g/L;最佳发酵条件为转速190r/min,温度28℃,pH 7,接种量8%。在此条件下,发酵液恩拉霉素浓度达11 860μg/mL。
链霉菌;N+诱变;恩拉霉素;发酵条件优化
恩拉霉素(Enramycin)又名恩来霉素、安来霉素、持久霉素,商品名为恩拉鼎,是广谱、高效、安全的多肽类抗生素。作为饲料添加剂,恩拉霉素具有稳定性好、杀菌作用强、无交叉耐药性和不会引起动物性食品药物残留等优点[1-6]。
20世纪60年代恩拉霉素在日本首次发现后,人们对其理化性质、抗菌活性、分析检测和药理等已进行了研究,同时,人们还就恩拉霉素产生菌以及不同C、N源对其产生菌的影响进行探索[7-9]。Eiji等[10]研究恩拉霉素产生菌的菌种形态和发酵条件时发现,从土壤中分离的菌株能形成多刺的螺形孢子丝、灰色的气生菌丝。国内外有关恩拉霉素菌种改良的报道极少,Ikuo等[11]对产持久霉素链霉菌Ⅰ(Streptomyces fungicidicus No.B5477)进行诱变发现,其发酵液恩拉霉素的浓度为4 530μg/mL,远达不到工业化生产的要求。我国对恩拉霉素的研究起步较晚,且多集中在药理学及其应用方面。笔者前期研究链霉菌(Streptomyces sp.)NJWGY3665发酵法产恩拉霉素的结果表明,其发酵液中恩拉霉素浓度仅6 360μg/mL,虽比Ikuo等[11]的产量高,但仍达不到生产要求。为此,笔者利用N+注入技术和单因素及正交试验方法对Streptomyces sp.NJWGY3665菌株进行N+诱变,探索诱变后菌株的适宜培养基并对其发酵条件进行优化,以期寻找到高产恩拉霉素菌株满足其工业化生产要求。
1 试验材料与方法
1.1 供试材料
1.1.1 菌株Streptomyces sp.NJWGY3665(自主筛选)。
1.1.2 培养基 参照文献[12-14]的方法配制相关培养基。1)高氏合成一号。淀粉20g/L,KNO31g/L,K2HPO40.5g/L,MgSO4·7H2O 0.5g/L,NaCl 0.5g/L,FeSO4·7H2O0.01g/L,琼脂20g/L,pH 7.4。2)肉汤培养基。牛肉膏5g/L,蛋白胨10g/L,NaCl 5g/L,pH 7.2~7.3。3)种子液培养基。葡萄糖10g/L,玉米浆10g/L,CaCO310g/L,酵母粉5g/L,NaCl 1g/L,pH 7.0。4)发酵培养基。淀粉20g/L,玉米浆10g/L,酵母膏5g/L,CaCO310g/L,NH4Cl 5g/L,KH2PO42g/L,NH4SO43g/L,pH 7.0。5)斜面培养基。葡萄糖5g/L,牛肉膏5g/L,蛋白胨5g/L,K2HPO420g/L,NaCl 3g/L,K2HPO41g/L,琼脂15g/L,pH 7.0。1.1.3仪器设备LZD900多功能N+离子注入机,西南核物理研究所研制;DIONEX P680高效液相色谱仪,戴安公司;PYX-DHS电热恒温培养箱,上海跃进医疗器械厂;HYG-II a恒温调速摇瓶柜,上海欣蕊自动化设备有限公司;HVE-50灭菌锅,华粤行仪器有限公司;Universal 320R离心机,Hettich。
1.2 N+注入诱变筛选恩拉霉素高产菌株
1.2.1 样品前处理 将链霉菌(Streptomyces sp.)NJWGY3665于液体培养基中培养至对数期,取0.1mL菌液均匀涂布于无菌空白培养皿中,以在显微镜下观察无相互重叠的细胞为宜,用无菌风吹干后立即进行N+注入。
1.2.2 不同能量N+注入对菌株存活率的影响选取同一出发菌株,分别用能量5~15keV的N+注入诱变,靶室真空度为10-3Pa,以5s脉冲式注入,间隔15s,注入3次。将经过N+注入的培养皿取出,用无菌水洗脱,适当稀释后涂布于高氏一号平板上,置28℃下培养出单菌落,统计不同剂量处理菌落的存活数(计数单菌落数目)。以能量0keV处理菌落存活数为对照(CK),计算各注入剂量的菌落存活率,绘制存活率曲线。
1.2.3 不同能量N+和不同剂量N+注入对菌株突变率的影响
1)不同能量N+注入对菌株突变率的影响。选取经相同能量N+注入处理后得到的单菌落接种斜面,培养后分别进行摇瓶发酵试验,测定恩拉霉素含量。根据3次重复的平均结果统计菌种的突变率。突变率的计算:对受辐射后的单菌落分别进行发酵试验,以出发菌株作为对照,考察单位体积发酵液中恩拉霉素的含量。其中,产量比出发菌株低5%的视为负突变株,大于5%的为正突变株,产量变化在±5%的视为无意义突变株或试验误差。负突变率是指负突变株占全部被考察菌株的比率,正突变率是指正突变菌株占全部被考察菌株的比率,总突变率是指正、负突变率之和。
2)不同剂量N+注入对菌株突变率的影响。采用能量为10keV的N+,以(30~180)×1013ions/cm2为处理剂量对菌株进行诱变筛选,根据3次重复的平均结果计算突变率。
1.2.4 高产菌株的筛选 将挑选出的单菌落重新活化,用管碟法测其产生恩拉霉素能力。将菌液在最佳注入剂量120×1013ions/cm2下进行N+注入诱变处理,适当稀释后涂布于平板上,挑取单菌落进行抑菌圈试验,并进行摇瓶培养,应用高效液相色谱(HPLC)进行检测。
1.2.5 高产菌株的遗传稳定性测试 将菌液在最佳注入剂量120×1013ions/cm2下进行N+注入诱变处理,适当稀释后涂布于平板上,挑取单菌落进行抑菌圈试验,并进行摇瓶培养,应用高效液相色谱(HPLC)进行检测。
1.3 突变菌株LD1发酵培养基和发酵条件的优化
1.3.1 培养基
1)碳源的筛选。试验设6个处理,即分别添加碳源浓度为3%的甘露醇、甘油、麦芽糖、海藻糖和葡萄糖作为碳源替代发酵培养基中的淀粉,以发酵培养基作对照(CK)。发酵6d后测定各处理菌株的生长及恩拉霉素的含量。
2)氮源的筛选。试验设6个处理,即在发酵培养基中添加优化的碳源,然后分别添加氮源浓度为3%的蛋白胨、乙酸胺、多价胨、硫酸铵和酵母粉作为氮源代替发酵培养基中的酵母膏,以发酵培养基作对照(CK)。发酵6d后测定各处理菌株生长及恩拉霉素的含量。
3)无机盐的确定。试验设5个处理,即在培养基中分别添加浓度为0.3%的NaCl,KCl,MgSO4,CuSO4和FeSO4,发酵6d后测定各处理菌株的生长及恩拉霉素的含量。
4)正交试验设计优化发酵培养基。根据单因素试验结果选择C源、N源和无机盐等因素,设计L9(43)正交试验对培养基配比进行优化。
1.3.2 突变菌株LD1发酵条件的优化
1)最适起始pH的筛选。试验设5个处理,即在摇瓶装液量100mL/500mL、接种量10%、温度28℃及摇床转速220r/min条件下,分别测定培养基起始pH为5、6、7、8和9时,培养6d后突变菌株的生长情况及恩拉霉素的含量。
2)最适培养温度筛选。试验设5个处理,即在摇瓶装液量100mL/500mL、接种量10%、pH7及摇床转速220r/min条件下,分别测定培养温度为25℃、28℃、30℃、32℃和37℃时,培养6d后突变菌株的生长情况及恩拉霉素的含量。
3)最适转速筛选。试验设5个处理,即在摇瓶装液量100mL/500mL、接种量10%、pH 7及温度28℃条件下,分别测定转速为150r/min、180r/min、200r/min、220r/min及250r/min时,培养6d后突变菌株的生长情况及恩拉霉素的含量。
4)最适接种量筛选。试验设7个处理,即在摇瓶装液量50mL/500mL、温度28℃、pH 7及摇床转速170r/min条件下,分别测定接种量为2%、3%、4%、5%、6%、7%和8%时,培养6d后突变菌株的生长情况及恩拉霉素的含量。
5)正交设计优化发酵条件。根据单因素试验结果选择转速(A)、温度(B)、pH(C)和接种量(D)等4个因素,设计L9(43)正交试验对突变菌株LD1的发酵条件进行优化。
1.4 数据统计与分析
利用Excel进行数据统计,采用Origin 8.0对相关数据进行绘图;利用Design Expert 6.0软件进行Plackett-Burman(PB)正交试验设计。
2 结果与分析
2.1 N+注入链霉菌(Streptomyces sp.)NJWGY3665的存活率
从图1可知,在N+注入剂量<40×1013ions/cm2时,随N+注入剂量的增加,菌株存活率迅速降低,当剂量达40×1013ions/cm2时,存活率有短暂的回升,后又逐渐下降,整个过程呈马鞍型变化曲线;注入剂量超过150×1013ions/cm2后存活率趋于零。原因可能是离子注入细胞的射程较短,低剂量时离子只对细胞表面进行损伤和刻蚀,能量沉积所产生的大量自由基导致DNA和生物膜等其他生物大分子损伤,从而造成存活率下降;随着剂量继续增加,大量连续注入电荷的堆积产生很强的库仑斥力,该斥力对被注入的细胞形成保护屏障,阻碍后续注入离子对细胞的损伤,而且大量堆积的电荷形成一个弱电场,该电场的刺激效应可以激活菌内的各种修复机制和修复酶,诱导Mn-SOD(锰超氧化物歧化酶)和CAT(过氧化氢酶)的酶活性升高,从而使得菌株存活率有所回升;当剂量上升到一定程度时,聚集于细胞表面的电荷产生库仑爆炸,细胞失去电荷屏蔽而使存活率再次下降。综上所述,在注入能量相同条件下,辐射剂量为120×1013ions/cm2时,菌株的成活率最高。
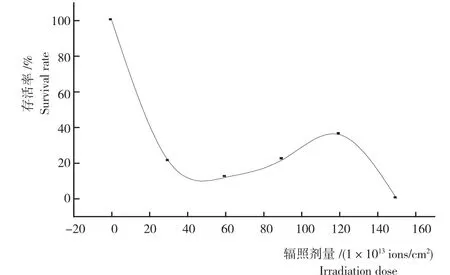
图1 N+注入链霉菌(Streptomyces sp.)NJWGY3665的存活率Fig.1 Survival rate of strain Streptomyces sp.NJWGY3665with N+injection
2.2 N+注入链霉菌(Streptomyces sp.)NJWGY3665的突变率
从图2可知:1)不同能量N+注入。N+注入能量5~15keV时,菌株Streptomyces sp.NJWGY3665的突变率呈先升高再降低的趋势,在注入能量5keV时突变率最高,达90%。其中,N+注入能量为15keV时引起菌株Streptomyces sp.NJWGY3665的正突变率明显小于5keV和10keV,可能是由于注入能量太高使DNA损伤过于严重所致。因此,确定N+的最佳注入能量为10keV。2)不同剂量N+注入。随着N+注入剂量的增加菌株Streptomyces sp.NJWGY3665的正突变率呈先增大后减小的趋势。其中,注入剂量为120×1013ions/cm2时突变率最高,达93%,且此时其正突变率高于负突变率。表明,以该注量进行N+注入可获得较多的正突变菌株,有助于筛选工作的进行。因此,120×1013ions/cm2为最佳注入剂量。

图2 不同能量和剂量N+注入链霉菌Streptomycessp.NJWGY3665的突变率Fig.2 Mutation rate of strain Streptomyces sp.NJWGY 3665with different energy and injection dose of N+
2.3 突变菌株LD1的遗传稳定性
采用N+注入技术得到1株高产突变菌株,命名为链霉菌LD1。从表1可知,对突变菌株LD1进行连续传代培养,其1~4代恩拉霉素的产量均超过7 800μg/mL,4代后仍保持较高的发酵能力,各代恩拉霉素的产量均较原始菌株高,表明其具有良好的遗传稳定性。

表1 链霉菌(Streptomyces sp.)NJWGY3665与突变菌株LD1传代培养的恩拉霉素生成量Table 1 Yield of enduracidin fromStreptomyces sp.NJWGY3665and mutant strain LD1μg/mL
2.4 不同培养基对突变菌株LD1产恩拉霉素的影响
从图3可知:1)碳源。各处理突变菌株LD1恩拉霉素的产量依次为葡萄糖>淀粉>甘露醇>麦芽糖>甘油>海藻糖,其中,添加葡萄糖的最高,为8 208μg/mL,表明,葡萄糖是菌体生长良好的碳源和能源。因此,采用葡萄糖作为初始碳源,而从产素和经济角度考虑可将淀粉作为后期碳源。2)氮源。各处理突变菌株LD1恩拉霉素的产量依次为酵母粉>酵母膏>蛋白胨>多价胨>乙酸胺>硫酸铵,其中,添加酵母粉的最高,为8 322μg/mL,是最有利于恩拉霉素生产的氮源,且有机氮源的效果明显好于无机氮源。因此,选择酵母粉作为恩拉霉素发酵中的氮源。3)无机盐。各处理突变菌株LD1恩拉霉素的产量依次为FeSO4>NaCl>KCl>MgSO4>CuSO4,其中,NaCl和FeSO4提高恩拉霉素效价的效果最明显,其恩拉霉素产量分别为9 349.3μg/mL和9 170μg/mL。4)正交试验。从表2可知,根据以上试验结果选择碳源、氮源及无机盐分别为葡萄糖、酵母粉、NaCl及FeSO4,其用量分别为葡萄糖3%、5%和8%,酵母粉2%、3%和4%, NaCl 0.15%、0.30%和0.60%,FeSO40.02%、0.05%和0.10%。正交试验结果(表3)表明,B因素的极差最大(R=4 563.70),即酵母粉的含量对试验效果影响作用较大。因此,碳、氮和无机盐的最佳配方比例为A2B1C2D2,即蔗糖50g/L+酵母粉20g/L+NaCl 1.5g/L+FeSO40.5g/L。
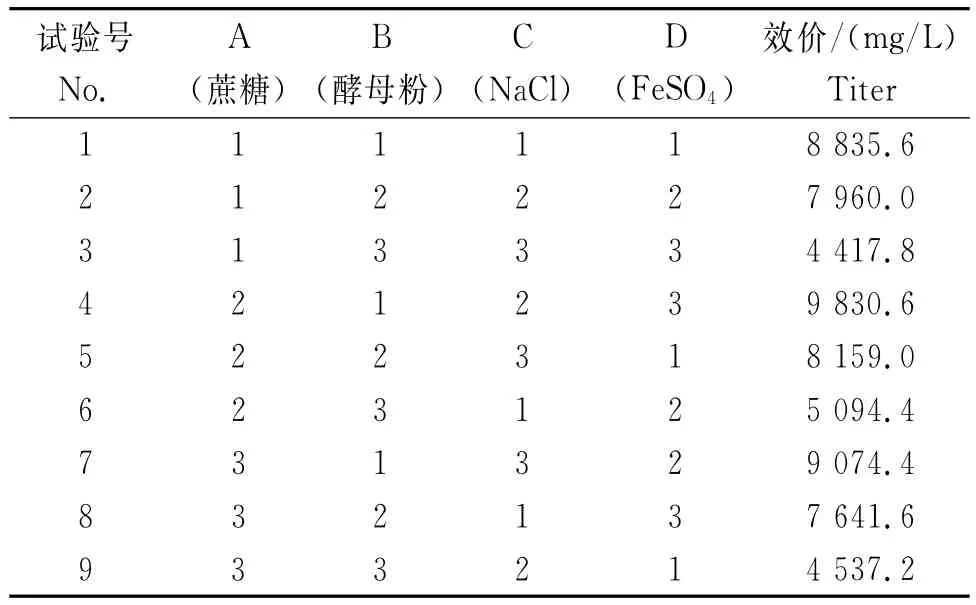
表2 突变菌株LD1发酵培养基正交试验各处理恩拉霉素的生成量Table 2 Enduracidin yield of mutant strain LD1in the orthogonal test of fermentation medium
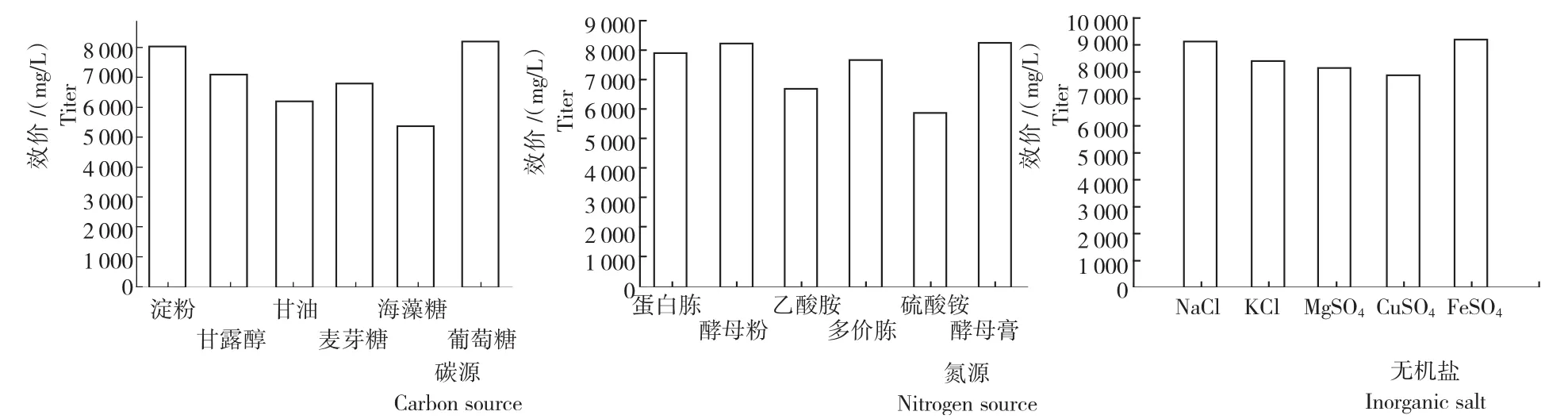
图3 不同碳源、氮源和无机盐处理突变菌株LD1的恩拉霉素生成量Fig.3 Enduracidin yield of mutant strain LD1with different carbon source,nitrogen source and inorganic salt

表3 突变菌株LD1发酵培养基正交试验各因素恩拉霉素生成量的均值与极差Table 3 Mean value and range of enduracidin yield of mutant strain LD1in the orthogonal test of fermentation medium
2.5 突变菌株LD1发酵条件的优化
从图4可知,不同摇瓶发酵条件下突变菌株LD1产恩拉霉素的量存在差异。1)培养基的初始pH。随培养基初始pH的升高,发酵液中恩拉霉素含量呈先升高再降低的趋势。其中,以初始pH7为宜,此时发酵液中恩拉霉素含量最高,为9 060μg/mL。偏酸或偏碱对菌体发酵产恩拉霉素均不利。2)温度。随培养温度升高,发酵液中恩拉霉素含量呈先升高再降低的趋势。其中,培养温度为28℃时,菌株发酵产恩拉霉素的量最高,为9 242μg/mL。3)转速。随转速加快,发酵液中恩拉霉素含量呈先升高再降低的趋势。其中,转速为170r/min时,发酵液中恩拉霉素含量最高,为9 642μg/mL。4)接种量。随接种量加大,发酵液中恩拉霉素含量呈先缓慢升高再降低的趋势。其中,接种量达6%时恩拉霉素的效价最高,为9 396μg/mL;之后继续增加接种量效价随之缓慢下降。5)正交试验。从表4可知,根据以上试验结果选择初始pH 6、7和8,温度26℃、28℃和30℃,转速150r/min、170r/min和190r/min,接种量4%、6%和8%进行发酵条件优化。正交试验结果(表5)表明,B因素的极差最大(R=3 491.95),即温度对试验效果影响作用较大。因此,最佳发酵条件为A3B2C2D3,即转速190r/min、温度28℃、pH 7及接种量8%。
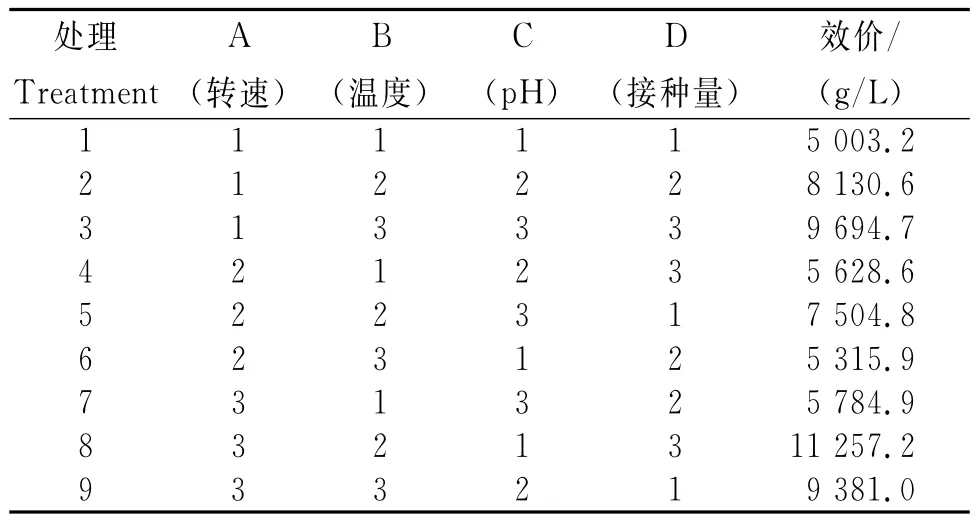
表4 突变菌株LD1发酵条件正交试验各处理恩拉霉素的生成量Table 4 Enduracidin yield of mutant strain LD1in the orthogonal test of fermentation conditions
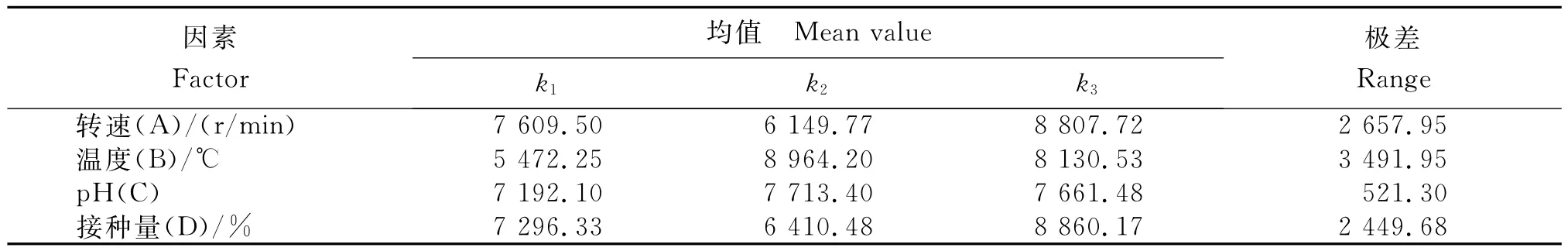
表5 突变菌株LD1发酵条件正交试验各因素恩拉霉素生成量的均值与极差Table 5 Mean value and range of enduracidin yield of mutant strain LD1in the orthogonal test of fermentation conditions
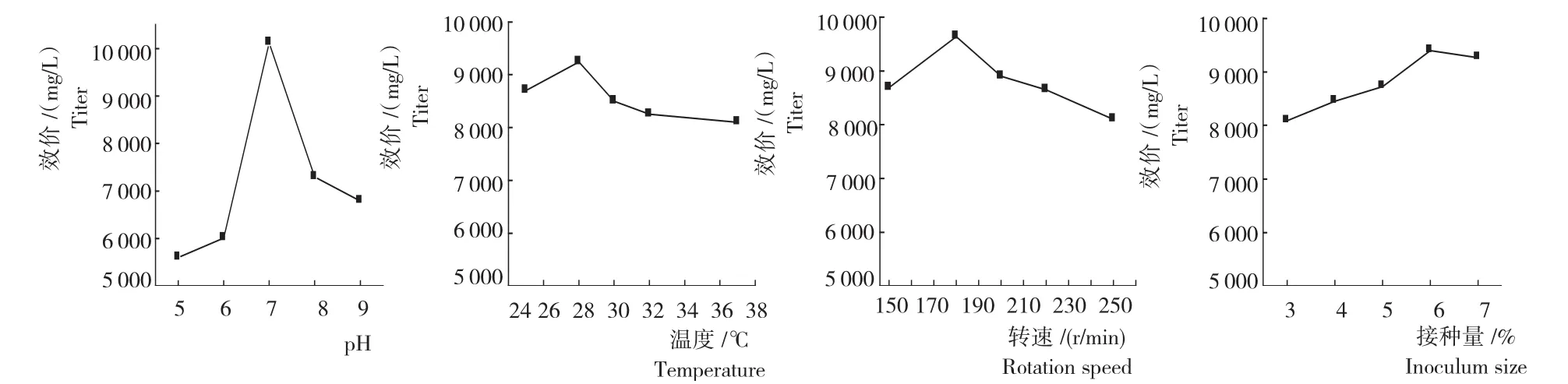
图4 不同最适起始pH、培养温度、转速和接种量处理恩拉霉素的生成量Fig.4 Enduracidin yield of LD1with different optimal initial pH,temperature,rotation speed and inoculum size
3 结论与讨论
利用N+注入技术对产恩拉霉素链霉菌(Streptomyces sp.)NJWGY3665进行诱变,经不同剂量的N+注入后,菌株的存活率呈典型的马鞍型剂量-效应曲线。在最佳注射剂量120×1013ions/cm2下筛选到1株具有良好遗传稳定性的高产突变菌株LD1,其恩拉霉素产量为7 800μg/mL。表明,离子注入技术能够应用于恩拉霉素高产菌株的诱变选育。此项技术对微生物菌种选育而言具有较高的突变率和较宽的突变谱,诱变效果好。
单因素及正交试验的结果表明,链霉菌(Streptomyces sp.)NJWGY3665突变菌株LD1的最适发酵培养基为蔗糖50g/L+酵母粉20g/L+NaCl 1.5g/L+FeSO40.5g/L;最佳发酵条件为转速190r/min+温度28℃+pH 7+接种量8%。在上述最适培养基和最佳发酵条件下,发酵液中恩拉霉素浓度达11 860μg/mL,符合工业化生产要求。
本试验是摇瓶发酵的结果,今后还将进行5L 及50L发酵罐的放大生产研究,优化恩拉霉素分离纯化工艺,提高恩拉霉素纯度,实现恩拉霉素产业化生产,助推我国绿色农用生物制品的规模化发展。
[1]陈旭峰.恩拉霉素的发酵生产[J].广东化工,2012,39 (24):182-184.
[2]唐慧慧,杨淑慎.恩拉霉素高产菌株的筛选[J].广州化工,2014,42(22):102-105.
[3]陈 敏,金 萍,方 中.恩拉霉素微生物检定法的研究[J].中国畜牧兽医,2012,39(1):56-60.
[4]Asai M,Muroi M,Sugita N,et al.Enduracidin,a new antibiotic.Ⅱ.Isolation and characterization[J].The Journal of Antibiotics,1968,2:138-146.
[5]Bu S J.Peptides feed additive-Enduracidin[J].Chinese journal of veterinary medicine,2003,36:48-50.
[6]Hatano K,Nogami I,Higashide E,et al.Biosynthesis of enduracidin:origin of enduracididine and other amino acids[J].Agricultural and Biological Chemistry,1984,48:1503-1508.
[7]胡烈其.在畜牧生产中安全使用抗生素[J].上海畜牧兽医通讯,2011(3):63.
[8]姜洪起,李 鹏.饲用抗生素替代品的研究进展[J].饲料研究,2011(2):25-27.
[9]刘 艳,林 洋,张 翔,等.抗生素替代品的研发概况[J].黑龙江畜牧兽医,2010(22):32-33.
[10]Eiji H,Kazunori H,Motoo S.Enduracidin,A new antibioticⅠStreptomyces fungicidicus NO.B5477,An enduracidin producing organism[J].The journal of antibiotics,1968(2):126-137.
[11]Ikuo N,Hideo S,Shigeo M,et al.Production of enduracidin and microorganisms therefore[P].US,4465771,1984-08-14.
[12]周岷江,严玉宝,胡 娟,等.恩拉霉素的研究进展[J].中国兽药杂志,2007,41(12):42-44.
[13]黄 峰,杜国强,赵延俊.饲料中添加安来霉素对异育银鲫生长性能的影响[J].饲料研究,2004(3):4-6.
[14]汪 莉,李 军.牛至油与安来霉素对仔猪生产性能的影响[J].畜禽业:南方养猪,2006(5):14-15.
(责任编辑:王 海)
Inducing of Streptomyces Strain Producing Enduracidin and Optimization of Fermentation Conditions
DING Zhiwen,HU Yonghong*,YANG Wenge,WU Gang,GU Pengfei,WANG Chunxiao
(College of Biotechnology and Pharmaceutical Engineering,Nanjing University of Technology,Nanjing,Jiangsu211816,China)
In order to meet the demand of industrialized production for high-yield strains producing enduracidin,the N+implantation technique was used for inducing the strain producing enduracidin Streptomycessp.NJWGY3665and the best fermentation condition of the high-yield strains was optimized through single factor and orthogonal experimental design.Results:With different doses of N+injected,the survival rate of the strain showed a typical saddle dose-response curve.Under the preferred dose 120×1013ions/cm2,a high yield and good genetic stability strain LD1was screened;The best medium of Streptomyces sp.NJWGY3665were as follows:sucrose 50g/L,yeast powder 20g/L,NaCL 1.5g/L,FeSO40.5g/L and the optimum fermentation conditions were:speed 190r/min,temperature 28℃,pH 7,inoculum 8%,In these conditions,the enduracidin concentration reached 11 860μg/mL in the fermented liquid
Streptomyces;N+inducing;enduracidin;optimization of fermentation conditions
S154.39;Q935
A
1001-3601(2016)07-0302-0072-05
2015-12-29;2016-05-26修回
江苏省农业科技自主创新资金项目“一种新型高效动物专用多肽类生长调节剂恩拉霉素的发酵关键技术研究与产业化开发”
[CX(12)3063]
丁志雯(1992-),女,在读硕士,研究方向:微生物发酵。E-mail:18260037906@163.com
*通讯作者:胡永红(1968-),女,教授,博士,从事绿色农用生物制品研究。E-mail:yonghonghu11@126.com
