基于反向对接法的黄连碱抗炎机制分子模拟研究
2016-07-02徐佑东张艳孟宪丽曾勇王平
徐佑东,张艳,孟宪丽,曾勇,王平
基于反向对接法的黄连碱抗炎机制分子模拟研究
徐佑东,张艳,孟宪丽,曾勇,王平
[摘要]目的:基于分子反向对接技术,以黄连碱为研究对象,对TLR4/NF-κB、p38、JAK2/STAT3 3条通路上的蛋白进行反向筛选,以筛选出黄连碱的炎症靶标蛋白。方法:获取Toll样受体4/核因子(TLR4/NF-κB)、p38 促分裂原活化蛋白激酶(P38 MAPK) 和Janus激酶-信号转导转录激活因子(JAK2/STAT3)3条炎症通路上的30个蛋白的晶体学结构以及黄连碱的化学结构;利用AutoDockTools对所有蛋白的晶体学结构进行标准化处理;AutoGrid对蛋白的活性位点进行格子计算;利用AutoDock对黄连碱进行反向对接模拟实验;根据对接结果自由能高低进行排序,筛选出亲和力高的靶蛋白;对筛选得到的靶蛋白进行作用力分析并作图。结果:反向筛选得到4个与黄连碱具有高亲和性的靶蛋白,4个靶蛋白分别为PI3Kδ、PI3Kγ、IKKβ、PI3Kα。结论:黄连碱对PI3Kδ、PI3Kγ、IKKβ、PI3Kα靶蛋白具有竞争抑制的活性,提示黄连碱可以通过抑制该4个靶蛋白进而阻碍炎症信号传递,影响下游蛋白的表达,发挥抗炎作用。
[关键词]黄连碱;分子对接;JAK2/STAT3通路;TLR4/NF-κB通路;炎症;AutoDock
[作者单位]成 都中医药大学药学院 中药材标准化教育部重点实验室 中药资源系统研究与开发利用省部共建国家重点实验室培育基地,四川 成都 611137
Tel:18782946825 Email:xydarticle@hotmail.com
Tel:13551082520 Email:viviansector@aliyun.com
黄连碱是毛茛科植物黄连(Coptis chinensis Franch)中的有效成分,其属于原小檗碱型生物碱季铵盐,并具有良好的抗内毒素和抗炎作用[1,2]。研究显示黄连碱能通过TLR4/NF-κB信号通路抑制LPS诱导的iNOS mRNA的表达水平升高,下调IL-1β、IL-6、IL-8表达量[3~4]。虽然,众多实验表明黄连碱具有抗炎作用,但是目前的研究仅停留在动物以及细胞阶段,通过检测炎症因子或某些蛋白表达量的高低来评价黄连碱的抗炎效果。而黄连碱在TLR4/NF-κB通路上特异性结合的靶蛋白,并通过抑制靶蛋白,阻断炎症信号传导的机制性研究却鲜有报道,这也导致黄连碱直接以及间接作用的靶蛋白不够明确。因此,有必要在分子水平上对黄连碱进行深入的探究。
在炎症应答过程,TLR4/NF-κB信号通路涉及到多条信号通路的共同参与完成,并能通过通路间的协同作用,增强炎症的应答。其中,TLR4/ NF-κB信号通路、JAK激酶2/信号转导和转录激活因子3(Janus kinase 2/ signal transducer and activatorof transcription 3, JAK2/STAT3)以及P38丝裂原激活蛋白激酶(P38 mitogen-activated protein kinases,p38 MAKP)在炎症应答过程中彼此间联系紧密。实验显示,NF-κB的活化将诱导一氧化氮合成酶(inducible nitric oxide synthase, iNOS)、环氧酶2 (cyclooxygenase-2, COX-2)、金属基质螯合蛋白酶(matrix metallopeptidase 9, MMP-9)的表达[5-8]。在LPS刺激下,P38蛋白被激活并迁移进入细胞核调控NF-κB的表达,使NF-κB介导的下游蛋白表达增加[9]。另外,JAK2/STAT3信号通路也能通过PI3K/ PDK1/Akt 通路来调控NF-κB的表达,同样TLR4/ NF-κB信号通路也可以利用PI3K/Akt/mTOR通路与STAT3协同作用,促进IL-6、IL-10、IL-11、IL-18、IL-21、IL-23、IL-27等炎症因子活化[10,11]。因此,完整的黄连碱的抗炎实验需要进行多个蛋白的活性抑制实验,从而获得详尽蛋白活性抑制信息。
目前,蛋白晶体学解析、蛋白荧光猝灭以及分子反向对接技术是验证配体与靶蛋白相互作用的最有效的方法[12-14]。蛋白晶体学解析对蛋白纯化要求极高而且成本昂贵,因此只能对单个明确的靶蛋白展开研究。荧光淬灭实验,虽然对蛋白要求较低,但是若进行多靶标蛋白的验证,将会导致实验周期过长,实验量增大,从而导致实验成本过于高昂。反向对接技术是目前较为准确的靶蛋白筛选手段,该技术以分子对接技术作为基础,对单个或者多个配体进行蛋白批量的对接筛选,再根据对接能量高低排序并分析,找出潜在的靶标蛋白[15],反向对接技术[16,17]可以减少实验所需靶标蛋白数量提高实验效率,同时也能在保证可信度的基础上降低实验成本。基于分子模拟技术及黄连碱抗炎机理的研究现状,本文利用反向对接技术,对炎症通路相关的30蛋白进行反向对接,以筛选出黄连碱的高亲和性靶蛋白,并对黄连碱与靶蛋白进行受力分析,以期为黄连碱抗炎机制以及抗炎新药的研制提供依据。
1 材料与方法
本实验以TLR4/NF-κB、p38、JAK2/STAT3炎症通路上30个蛋白为研究对象(相关蛋白详见表1),所有蛋白的晶体结构均从RCSB Protein Data bank (PDB)上PDB格式获取。晶体结构中的所有杂原子、结晶水以及本身结构解析时所携带的配体全部去除,并添加极性氢,计算高斯电荷。以上所有优化过程均在AutoDock Tools-1.5.6rc3软件上完成。
黄连碱的化学结构从PubChem上获取,文件保存为3D SDF格式。配体结构通过Swiss-PDB Viewer V.4.02中的GRO-MOS96模块进行MM-2能量优化。
将上述处理的蛋白受体作为黄连碱(配体)反向筛选的酶靶。在实验过程中,配体允许自由旋转。AutoGrid模块利用对应配体原子(C, N和O)的探针原子在靶点蛋白的活性区域进行探测并生成势能图。AutoDock选择拉马克遗传算法(Lamarckian Genetic-Algorithm, GA)来模拟计算配体与靶点蛋白活性位点间的亲和力。对接过程选用半柔性对接,运行次数为100次,最大能量评价为5000000,种群数量为150,其余参数采用默认值。
最后,选用PyMOL1.5.0.4 (python molecule,PyMOL) 与 LigPlot+进行实验结果分析。
2 结果
2.1 对接方法的检验
为了检验对接方法的可靠性,选取4个晶体结构(PDB ID:2B7A,3HR4,3UVQ,4EZJ)进行重复对接实验。对接结果显示,重复对接实验的RMSD值均小于2.0Å,说明重复对接实验是成功的,对接方案是可信的。
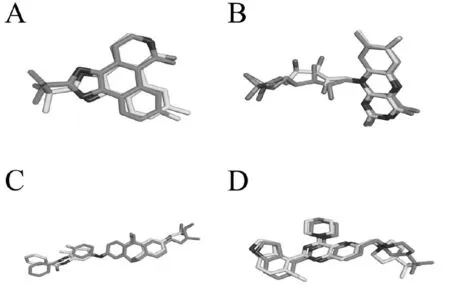
图1 重复对接结果,蓝色的配体为晶体结构上的原配体,黄色配体为重复对接构象,两个构象叠合对比显示。A,2B7A;B,3HR4;C,3UVQ;4,4EZJ
2.2 黄连碱反向对接结果黄连碱与3条炎症通路靶标蛋白的对接结果显示,黄连碱对蛋白激酶具有更高的亲和力,尤其是对PI3Kδ、PI3Kγ、IKKβ、PI3Kα(PDB ID:4EZJ、4ANV、4KIK、4JPS)的ATP催化位点的结合能力最强,对接自由能分别为:-9.93、-9.54、-9.44、-9.14 kcal/mol,抑制常数分别为52.22、101.07、120.47、198.91 nM.L-1。另外,黄连碱与Akt1、Akt2、p38、COX-2、iNOS、PI3Kβ、JAK2、TLR4、TAK1也有较高的亲和性,结合自由能在:-8.00到 -9.00 kcal/ mol之间。
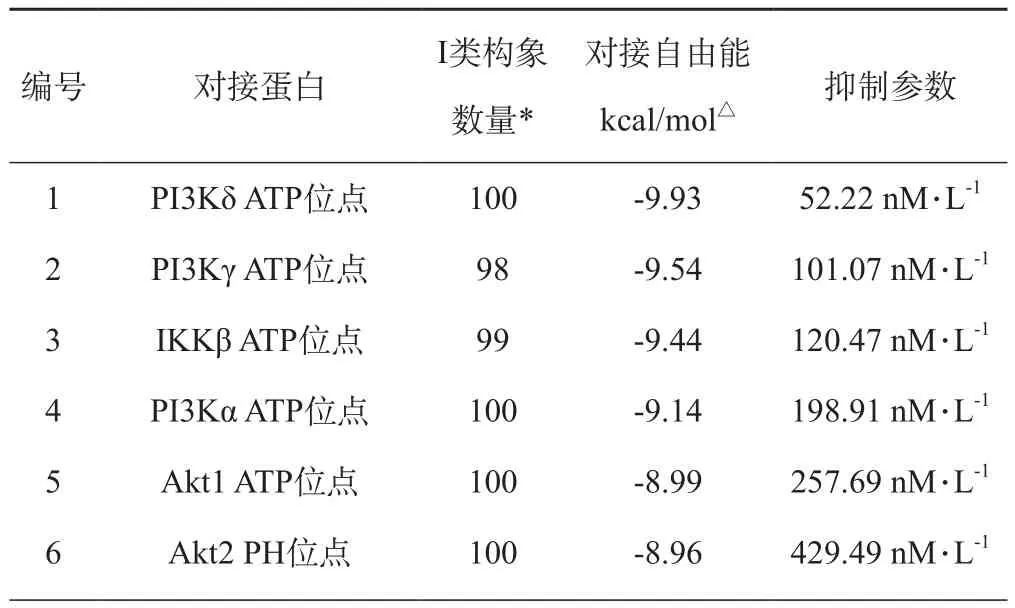
表1 黄连碱与炎症靶标蛋白对接数据

7 Akt2 ATP位点 100 -8.68 431.16 nM.L-18 P38 脂质结合位点 100 -8.62 477.21 nM.L-19 COX-2 84 -8.43 660.2 nM.L-110 iNOS 还原区域 99 -8.41 682.32 nM.L-111 PI3Kβ ATP位点 100 -8.37 782.71 nM.L-112 iNOS 氧化区域 100 -8.27 870.32 nM.L-113 JAK2 100 -8.25 891.43nM.L-114 TLR4 100 -8.25 899.4 nM.L-115 TAK1 ATP位点 100 -8.01 1.35 μM.L-116 IRAK4 ATP位点 19 -7.87 1.7 μM.L-117 MyD88 37 -7.71 2.24 μM.L-118 TAB1 100 -7.66 2.43 μM.L-119 MMP-9催化位点 100 -7.55 2.9 μM.L-120 Akt1 PH位点 75 -7.45 3.44 μM.L-121 P38 ATP位点 51 -7.35 4.07μM.L-122 TRADD 10 -7.34 4.14 μM.L-123 TIRAP 85 -7.26 4.77 μM.L-124 TRAF2 7 -7.13 5.93 μM.L-125 IRAK4底物结合位点 15 -6.95 8.04 μM.L-126 TRAF6 98 -6.87 9.25 μM.L-127 IKKγ 100 -6.80 10.31 μM.L-128 Akt3 PH位点 49 -6.67 12.96 μM.L-129 SHP2催化位点 100 -6.63 13.74 μM.L-130 MMP-9 底物结合位点 100 -6.55 15.75μM.L-131 TNFR1 100 -6.36 21.89 μM.L-132 NF-κB 37 -6.73 11.69 μM.L-133 Gp130 15 -6.17 30.22 μM.L-134 IKKβ 85 -5.95 43.17 μM.L-135 STAT3 28 -5.91 46.96 μM.L-1
2.3 黄连碱与高亲和性键靶标蛋白作用模式
如图2,3所示,黄连碱的所含氧原子为氢键作用的位点,这些氢键为黄连碱与ATP位点间的稳定结合起做出巨大贡献。由于黄连碱的高度共轭结构,其与PI3Kδ、PI3Kγ、PI3Kα的残基Lys833、Lys802形成π-cation相互作用,与IKKβ的Tyr96之间产生π-π堆积效应。黄连碱与PI3Kδ、PI3Kγ、IKKβ、PI3Kα 的ATP位点稳定结合的另一个作用力——疏水作用,为黄连碱与靶蛋白对接的主要作用力。如图3所示,黄连碱与4个靶蛋白ATP位点的残基形成疏水作用,并且与活性区域形成构型互补,从而牢牢的结合在活性位点上。
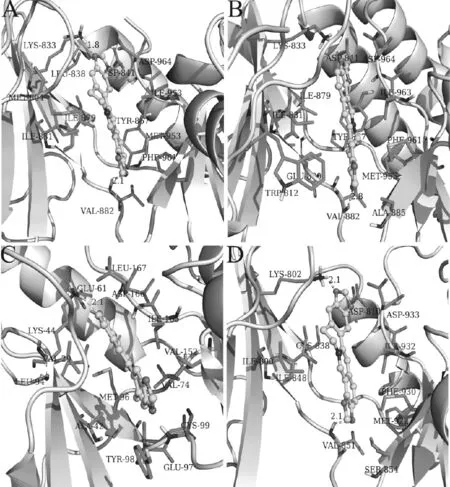
图2 黄连碱与PI3Kδ、PI3Kγ、IKKβ、PI3Kα的对接模式图。
A为黄连碱与PI3Kδ ATP位点的作用模式;B为黄连碱与PI3Kγ ATP位点的作用模式;C为黄连碱与IKKβATP位点作用模式;D为黄连碱与PI3Kα的作用模式在3D示意图中,靶蛋白以二级结构显示,黄连碱以球棍模型显示,残基以棍棒模型显示。

图3 黄连碱与PI3Kδ、PI3Kγ、IKKβ、PI3Kα的受力分析图。
A为黄连碱与PI3Kδ的受力分析;B为黄连碱与PI3Kγ的受力分析;C为黄连碱与IKKβ的受力分析;D为黄连碱与PI3Kα的受力分析。在平面示意图中,辐射状弧形代表疏水作用的残基,虚线代表氢键,球棍模型为黄连碱
3 讨论
分子反向对接技术是基于分子对接的逆运用,其以配体作为研究对象,蛋白作为靶标进行靶蛋白的筛选。本实验选择TLR4/NF-κB、p38、JAK2/ STAT3 3条通路上的30个蛋白进行反向对接。结果显示,黄连碱对PI3Kδ、PI3Kγ、IKKβ、PI3Kα靶蛋白具有高亲性。
I型PI3K激酶作为NF-κB通路与JAK2/STAT3通路的“交汇”,磷酸化的I型PI3K可以通过PDK1/Akt通路激活NF-κB并促进iNOS的表达,也可以通过Akt/ mTOR通路促进STAT3的转录表达。 Wu X等[18]研究发现,I型PI3K的抑制能够显著减少LPS所引起的氧化自由基的产生,并且极大程度上抑制的NF-κB的活化,减少iNOS、MMP-9、COX-2、IL-6、IL-1β表达,从而缓解炎症。JAK2/STAT3通路可介导多种细胞因子的转导,JAK2的磷酸化可激活STAT3进入细胞核并介导多种炎症因子生成,I型PI3K的活化能够促进这一炎症应答过程,增加iNOS、TNF-α、IL-6、IL-1β[19,20]。另外,在LPS/TLR4、PI3K/Akt、p38信号通路上,NF-κB作为多条信号通路的汇聚点,是生成iNOS、COX-2/MMP-9等炎症因子的关键的靶蛋白。IKKβ作为NF-κB的抑制蛋白,掩盖了NF-κB的活化区域,有效的阻止NF-κB的转录入核,但IKKβ却可以在ATP的磷酸化作用下活化并暴露NF-κB的活化区域,导致NF-κB的激活[21]。因此,IKKβ的抑制将能有效的中断炎症应答过程。
对接结果表明黄连碱与PI3Kδ、PI3Kγ、IKKβ、PI3Kα的ATP活性位点间存在高亲和性,说明黄连碱对4个蛋白有竞争抑制的活性,这一竞争抑制的继发效果表现为阻碍TLR4/NF-κB信号通路,降低NF-κB的活化等作用。并且已有的实验显示,黄连碱能够下调下游的炎症因子及核转录蛋白的表达量[22,23]。这些实验结果也从侧面证实黄连碱通过抑制I型PI3K以及IKKβ的磷酸化而发挥抗炎作用。
能量分析显示,黄连碱倾向于亲和蛋白激酶,如Akt1、Akt2、p38、PI3Kβ、TAK1等。这可能与人类激酶的ATP区域(激酶区域)都有着序列和结构的高度保守性有关[24]。在ATP与激酶的结合过程中,高度共轭腺嘌呤负责与激酶区域牢固地结合,而黄连碱母核的高度共轭的特性与腺嘌呤相似,所以黄连碱可以像ATP的腺嘌呤环一样的结合到激酶区域,并且ATP区域狭窄的构象特点也使得黄连碱可以有效地形成构型互补,从而与蛋白激酶结合阻碍炎症应答,发挥抗炎作用。
从对接受力分析,黄连碱的高度共轭结构易与残基之间形成π-π堆积以及cation-a相互作用,并且黄连碱的环氧原子是与残基形成氢键作用的位点,这些特征性结构在黄连碱的稳定结合过程中发挥着重要作用。这些结构特征提示在设计PI3Kδ、PI3Kγ、IKKβ、PI3Kα等激酶的抑制剂时,高度共轭以及环氧结构可以提高化合物的亲和性同时减少旋转键带来的空间结构的阻碍,同时氮原子的整合可以降低氧原子带来的原子间的排斥力同时还可挺高化合物的成药性。
综上所述,炎症通路靶位反向对接实验表明黄连碱抗炎的直接作用靶蛋白为胞内PI3Kδ、PI3Kγ、IKKβ、PI3Kα的高度保守ATP位点。这一结果为进一步明确小檗碱型生物碱的抗炎机制提供了新的研究侧重点,也为相应新型先导化合物合成提供了初步的构效关系指征。
[参考文献]
[1]Yi-Ching Lo, Pei-Ling Tsai,Yaw-Bin Huang, et al. San-Huang-Xie-Xin-Tang reduces lipopolysaccharides-induced hypotension and inflammatory mediators [J]. Journal of Ethnopharmacology, 2005, 96(1-2): 99.
[2]LoYC, Lin YL,Yu KL, et al. San-Huang-Xie-Xin-Tang attenuates inflammatory responses in lipopolysaccharideexposed rat lungs[J].Journal of Ethnopharmacology,2005,101(1-3):68.
[3]Zou ZY, Hu YR, Ma H, et al. Coptisine attenuates obesity-related inflammation through LPS/TLR-4-mediated signaling pathway in Syrian golden hamsters[J]. Fitoterapia,2015,105(3):139.
[4]Wu JS, Liu Y, Shi R, et al. Effects of combinations of Xiexin decoction constituents on diabetic nephropathy in rats[J].J Ethnopharmacol,2014,157(6):126.
[5]Kanarek N, London N, Schueler-Furman O, et al. Ubiquitination and degradation of the inhibitors of NF-kappaB[J].Cold Spring Harb Perspect Biol,2010,2(2):a000166. [6]Perkins ND. The diverse and complex roles of NF-κB subunits in cancer[J].Nat. Rev. Cancer,2012,12(2):121.
[7]Razani B, Reichardt AD,Cheng G. Non-canonical NFKb signaling activation and regulation: principles and perspectives[J].Immunol. Rev,2011,244(1):44.
[8]Fitzgerald DC, Meade KG, McEvoy AN, et al. Tumour necrosis factor-alpha (TNF-alpha) increases nuclear factorkappaB (NFkappaB) activity in and interleukin-8 (IL-8)release from bovine mammary epithelial cells[J].Vet Immunol Immunopathol,2007,116 (1-2):59.
[9]Chandel NS, Trzyna WC, McClintock DS, et al. Role of oxidants in NF-kappa B activation and TNF-alpha gene transcription induced by hypoxia and endotoxin [J].J Immunol,2000,165(2):1013.
[10]Huey R, Morris G M, Olson A J, et al. A Semiempirical Free Energy Force Field with Charge-Based Desolvation[J]. Computational Chemistry,2007,28(6): 1145.
[11]Hou XL, Tong Q, Wang WQ, et al. Suppression of Inflammatory Responses by Dihydromyricetin, a Flavonoid from Ampelopsis grossedentata, via Inhibiting the Activation of NF-κB and MAPK Signaling Pathways[J].J Nat Prod,2015,78 (7):1689.
[12]Jiang L, Zhang X, Chen X, et al. Virtual Screening and Molecular Dynamics Study of Potential Negative Allosteric Modulators of mGluR1 from Chinese Herbs [J]. Molecules,2015,20(7):12769.
[13]Lucet IS, Fantino E, Styles M, et al. The structural basis of Janus kinase 2 inhibition by a potent and specific pan-Janus kinase inhibitor[J].Blood,2006, 107(1):176.
[14]Söderhielm PC, Andersen J, Munro L, et al. Substrate and Inhibitor-Specific Conformational Changes in the Human Serotonin Transporter Revealed by Voltage-Clamp Fluorometry[J].Mol Pharmacol,2015,88(4):676.
[15]harkar PS, Warrier S, Gaud RS. Reverse docking: a powerful tool for drug repositioning and drug rescue[J].Future Med Chem,2014,6(3):333.
[16]Li HL, Gao ZT, Kang L, et al. TarFisDock: a web server for identifying drug targets with docking approach[J].Nucleic Acids Res,2006,34(4):219.
[17]Chen YZ, Zhi DG. Ligand-protein inverse docking and its potential use in the computer search of protein targets of a small molecule[J].Proteins: Struct Funct Genet,2001,43(2):217.
[18]Wu X, Song M, Rakariyatham K, et al. Inhibitory Effects of 4'-Demethylnobiletin, a Metabolite of Nobiletin,on 12-O-Tetradecanoylphorbol-13-acetate (TPA)-Induced Inflammation in Mouse Ears[J].J Agric Food Chem,2015,63(51):10921.
[19]Yu Y, Li M, Su N, et al. Honokiol protects against renal ischemia/reperfusion injury via the suppression of oxidative stress, iNOS, inflammation and STAT3 in rats[J]. Mol Med Rep,2015,52(23):1028.
[20]Tong F, Zhang J, Liu L, et al. Corilagin Attenuates Radiation-Induced Brain Injury in Mice[J].Mol Neurobiol,2015,23(5):890.
[21]Liu S, Misquitta YR, Olland A, et al. Crystal structure of a human IκB kinase β asymmetric dimer[J].J Biol Chem,2013,288(31):22758.
[22]Han XH, Zhong J, Guo JY, et al. Relationships between pharmacokinetics and efficacy of Xie-xin decoction in rats with experimental ulcerative colitis[J].J Ethnopharmacol,2013,148(1):182.
[23]Seo CS, Kim OS, Kim JH, et al. Simultaneous quantification and antiatherosclerosis effect of the traditional Korean medicine, Hwangryunhaedoktang[J].BMC Complement Altern Med,2015,15(41):108.
[24]Meng Z, Yan Y, Tang Z, et al. Anti-hyperuricemic and nephroprotective effects of rhein in hyperuricemic mice[J]. Planta Med,2015,81(4):279.
(责任编辑:陈思敏)
Study on anti-inflammatory mechanism of coptisine based on reverse docking method
XU You-dong, ZHANG Yan,MENG Xian-li, ZENG Yong, WANG Ping // (School of Pharmacy, Chengdu University of Traditional Chinese Medicine; Key Laboratory of Standardization for Chinese Herbal Medicine, Ministry of Education; National Key Laboratory Breeding Base of Systematic Research, Development and Utilization of Chinese Medicine Resources, Chengdu 611137, Sichuan)
[Abstract]Objective: To investigate the mechanism of anti-inflammation of coptisine via the approach of reverse docking,which was utilized to dock coptisine with proteins in the signal pathways of TLR4/NF-κB, P38 and JAK2/STAT3. Method: 30 proteins of TLR4/NF-κB, P38 and JAK2/STAT3 were obtained from PDB website. The structure of coptisine was obtained from PubChem website. The 30 proteins were processed with standardization disposal of AutoDock tools. Then AutoGrid was utilized to calculate the grids of active sites. The docking results were ranked according to docking energy, for the purpose of selecting the proteins with high affinity for coptisine. The action force of the target protein were analyzed and plotted. Result: 4 target proteins including PI3Kδ, PI3Kγ, IKKβ and PI3Kα were found to interact with coptisine with high affinity. Conclusion: Anti-inflammation of coptisine relates to its function of competitive inhibition of the 4 target proteins, which suggests that the behavior of coptisine results in the obstruction to signal pathways. Finally the purpose of treatment for inflammation has been achieved by this method.
[Key words]Coptisine; molecular docking; pathway of JAK2/STAT3; pathway of NF-κB; inflammation; autoDock
[中图分类号]R 285.5
[文献标识码]A
[文章编号]1674-926X(2016)02-018-05
[基金项目]国 家自然基金资助项目(81274111)
[作者简介]徐 佑东,硕士在读,主要从事中药药理学研究
[通讯作者]王 平,副教授,硕士生导师,主要研究方向为药代动力学研究
[收稿日期]2016-01-20
