经腹腔机器人辅助腹腔镜巨大肾癌根治术的临床研究
2016-07-01王强史立新王保军马鑫李宏召高江平董隽张旭
王强 史立新 王保军 马鑫 李宏召 高江平 董隽 张旭
1中国人民解放军总医院泌尿外科 100853 北京
2中国人民解放军第309医院全军器官移植研究所泌尿外科
论著
经腹腔机器人辅助腹腔镜巨大肾癌根治术的临床研究
王强1,2史立新1王保军1马鑫1李宏召1高江平1董隽1张旭1
1中国人民解放军总医院泌尿外科 100853 北京
2中国人民解放军第309医院全军器官移植研究所泌尿外科
[摘要]目的:总结单中心经腹机器人辅助腹腔镜下行巨大肾癌(肿瘤直径≥ 7 cm)根治术的手术经验,探讨该技术的疗效及安全性。方法:回顾分析2008年10月~2015年4月应用达芬奇机器人辅助腹腔镜完成巨大肾癌根治性切除术29例的临床资料,总结巨大肾癌临床特点、手术经验、手术时间、术中并发症、术中出血量、术后住院时间等。结果:2008年10月~2015年4月共有101例行肾癌根治性切除,其中29例为巨大肾癌(占根治性肾切除的28.71%)。其临床特点为:男20例,女9例,平均(54.9±11.9)岁;左侧14例,右侧15例;肿瘤最大直径16 cm,平均(9.56±2.36)cm;11例(39.29%)合并癌栓形成。29例均经腹腔途径完成,无中转开放;合并癌栓11例病例术前均行介入肾动脉栓塞;手术时间(164.4±40.0)min;术中出血量50~1 200 ml。术后胃肠功能平均恢复(2.65±0.71)d;引流管拔除平均时间(3.17±1.36)d;术后平均住院(6.8±2.5)d。本组术中无十二指肠、肝脏、结肠及大血管损伤,术后无腹腔感染及术后肠梗阻。术后病理分期,T2N0~1M0~1期9例,T3N0~1M0~1期14例,T4N0~1M0~1期6例。随访1~24个月,肾床肿瘤复发或远处转移8例(27.6%)。结论:根据初期的手术操作经验和随访结果,经腹机器人辅助腹腔镜下行巨大肾癌根治术是安全和可行的,长期和前瞻性的对照研究将有助于对这一技术的评估。
[关键词]肾巨大肿瘤;肾癌根治术;机器人辅助腹腔镜
巨大肾癌是肿瘤体积≥7 cm的肾脏恶性肿瘤,具有丰富的滋养血管,淋巴结转移和浸润概率高,常合并癌栓形成,属于肾癌手术中的高难病例,同时术中出血、副损伤、癌栓脱落等并发症相对较高。随着腹腔镜,特别是机器人手术技术的发展和成熟,使该类手术安全性和有效性明显提高[1,2]。为探讨目前巨大肾肿瘤行机器人辅助腹腔镜手术的可行性,我们收集2008年10月~2015年4月行机器人辅助腹腔镜巨大肾癌根治性切除术的29例患者的临床数据进行回顾性分析,现报告如下。
1资料与方法
1.1临床资料
2008年10月~2015年4月中国人民解放军总医院共完成肾癌相关手术1 174例,其中101例(8.60%)行肾癌根治性切除,余均行保留肾单位手术。行肾癌根治性切除的病例中巨大肾癌29例(占根治性肾切除的28.71%)。伴有远处转移或局部浸润无法手术的巨大肾癌不纳入研究。29例均采用达芬奇机器人辅助腹腔镜完成根治性切除,伴下腔静脉癌栓者行下腔静脉癌栓取出术。29例巨大肾肿瘤患者中男20例,女9例,平均年龄(54.9±11.9)岁。左侧14例,右侧15例;肿瘤最大直径16 cm,平均(9.56±2.36)cm;11例(39.29%)合并癌栓形成(7例Ⅰ级,4例Ⅱ级),非巨大肿瘤(<7 cm)癌栓发生仅3例(4.17%)[1]。临床表现:2例无任何临床症状,27例表现为无痛性肉眼血尿、腰痛。29例均行彩色多普勒和CT三维重建检查,11例伴癌栓患者同时行MRI检查(图1)。3例右侧和1例左侧肾癌患者术前发现下腔静脉旁和腹主动脉旁、近肾门处淋巴结肿大。29例术前均未发现远处转移。术前3例行1个月新辅助靶向药物治疗,口服苹果酸舒尼替尼胶囊(50 mg,1次/d)。
1.2手术方法
对于合并癌栓的巨大肾肿瘤常规于术前1~2 h行患侧肾动脉栓塞术[1]。手术均在全麻下进行。
1.2.1右侧病变左侧60°斜卧位,升高腰桥。气腹针制备气腹,并维持气腹压力在1.862 kPa(14 mm Hg)。于脐右上方约2 cm处标记为镜头孔,切开1.5 cm皮肤,置入12 mm一次性套管,经此套管置入达芬奇机器人手术镜头。距镜头孔约8 cm,于右侧肋缘下锁骨中线偏内侧,标记为第1机械臂孔;在右下腹距镜头孔8 cm,与第1机械臂孔成120°夹角处标记为第2机械臂孔;第2机械臂孔内下方6 cm,与第1机械臂孔成近180°夹角处,标记为第3机械臂孔;在上述3处标记孔切开8 mm皮肤,内镜直视下置入8 mm机器人专用套管,并经该套管置入和链接达芬奇SI系统第1、2、3机械臂。于腹正中线上的剑突下、第1机械臂孔与镜头孔之间,镜头孔与第3机械臂孔之间分别置入1个12 mm一次性套管(共3个),用于撑开肝脏以及置入吸引器、结扎夹、直线切割器等辅助器械。第1臂连接单级剪,第2臂连接双极钳,第3臂连接无创钳。切开肝结肠韧带、肝肾韧带和肝镰状韧带,向头侧牵开肝脏,充分暴露右侧肾肾动脉区,切开侧腹膜,进入右侧后腹腔。向内推开结肠和十二指肠,显露并游离肾动脉和肾静脉,用Hem-o-lok结扎肾血管,完成将肾周脂肪囊,位于肾上级肿瘤一并经右侧肾上腺切除。同时行下腔静脉淋巴结清扫。如合并癌栓同时行机器人辅助腹腔镜下下腔静脉癌栓取出术,方法见文献[1]。将切除下的标本一并置入标本袋,经延长的皮肤切口取出。检查无活动出血,逐层缝合各切口。
1.2.2左侧病变患者体位、套管放置等均与右侧病例相同。先按右侧病例的方法分离左肾静脉及左肾静脉分支,右肾动脉,根治性切除左肾,同时行左侧腹主动脉旁淋巴结清扫。如伴有左侧下腔静脉癌栓按文献方法进行[1]。
2结果
本组29例手术均顺利完成,无机器人故障或其他原因导致中转开放。手术时间(164.4±40.0)min;术中出血量50~1 200 ml。胃肠功能恢复(2.65±0.71)d;引流管拔除(3.17±1.36)d;术后住院(6.8±2.5)d。平均住院时间(12.4±6.0)d。本组术中无十二指肠、肝脏、结肠及大血管损伤,术后无腹腔感染及术后肠梗阻。术后病理分期,T2N0~1M0~1期9例,T3N0~1M0~1期14例,T4N0~1M0~1期6例;术后病理24例为透明细胞癌,1例为乳头状肾细胞癌2例为嫌色细胞肾细胞癌,2例为肉瘤样肾细胞癌。术后15例辅以靶向药物治疗:口服苹果酸舒尼替尼胶囊(50 mg,1次/d),服药4周停药2周方案,3个月后剂量减半。随访1~24个月,肾床肿瘤复发或远处转移8例(27.6%)。
3讨论
肾癌占成人恶性肿瘤的2%~3%,占成人肾脏恶性肿瘤的80%~90%。2013年美国新增肾癌病例65 150例,肾癌相关性死亡病例13 680例[3]。我国肾癌发病率也呈逐年上升趋势,在2008年已经成为我国男性恶性肿瘤发病率第10位的肿瘤,成为威胁健康的主要肿瘤之一[4]。随着就医意识和定期体检加强,越来越多新发的肾肿瘤处于早期,可选择保留肾单位手术,并在临床中明显受益[5]。巨大肾癌在临床中相对较为少见,但严重影响肾癌患者中远期生存,5年生存率为30%~85%[6~11]。根治性切除是治疗巨大肾癌的标准术式,但术中出血、副损伤、癌栓脱落等并发症相对较高,多采用经腹腔开放肾癌根治术[12]。
机器人辅助腹腔镜技术具有三维视野、放大的手术区域、灵巧的机械手、相对少的出血量、手震颤的过滤及减少外科医生疲劳等优点,与普通腹腔镜比较增加了该类手术精确性,暴露、止血、缝合等效率更高,使该类手术安全性和有效性大大提高,将手术适应证不断拓展,并取得与开放手术相似的预后结果[1,2,13]。本研究应用达芬奇机器人辅助腹腔镜完成巨大肾癌根治性切除术29例,其中11例合并癌栓,不仅完成临床巨大肾肿瘤完整切除和淋巴结清扫,更将癌栓完整取出,临床效果满意,无中转开放。
总结机器人辅助腹腔镜下巨大肾癌根治性肾切除术的体会如下:①术前准备要充分,一方面针对局部高危肾癌患者术前辅助性靶向治疗,提供良好的肿瘤预后结果;另一方面由于肿瘤体积巨大,为提高手术切除的安全性,常规在术前1~2 h行患侧肾动脉栓塞术,有效减少术中出血风险和围手术期并发症,尤其提高局部进展的肾癌手术切除的安全性[1,14,15]。②充分利用机器人的四臂优势,向上牵拉肾脏,充分暴露肾门血管,有助于肾门血管的解剖游离,可更精准的结扎肾蒂血管;充分利用机器人专用手术器械良好的活动度,对常规腹腔镜器械难以处理的部位,可更精准、轻松的进行游离和缝合操作。③对于合并下腔静脉癌栓处理关键步骤是先结扎并离断肾动脉,有助于术中用沙丁钳将瘤栓推回患肾静脉,对于Ⅰ级或Ⅱ级下腔静脉瘤栓,多数不需要阻断下腔静脉即可完成。另外,先结扎并离断肾动脉后,游离下腔静脉时创面渗出少,视野清楚,有助于下腔静脉的显露[1]。
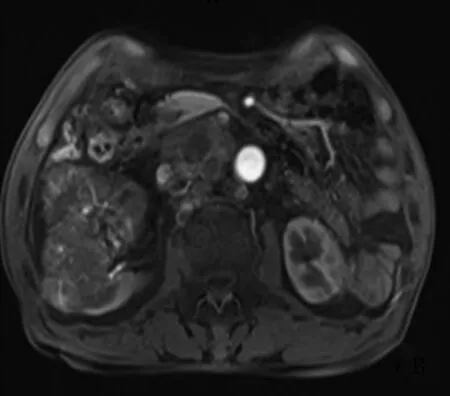
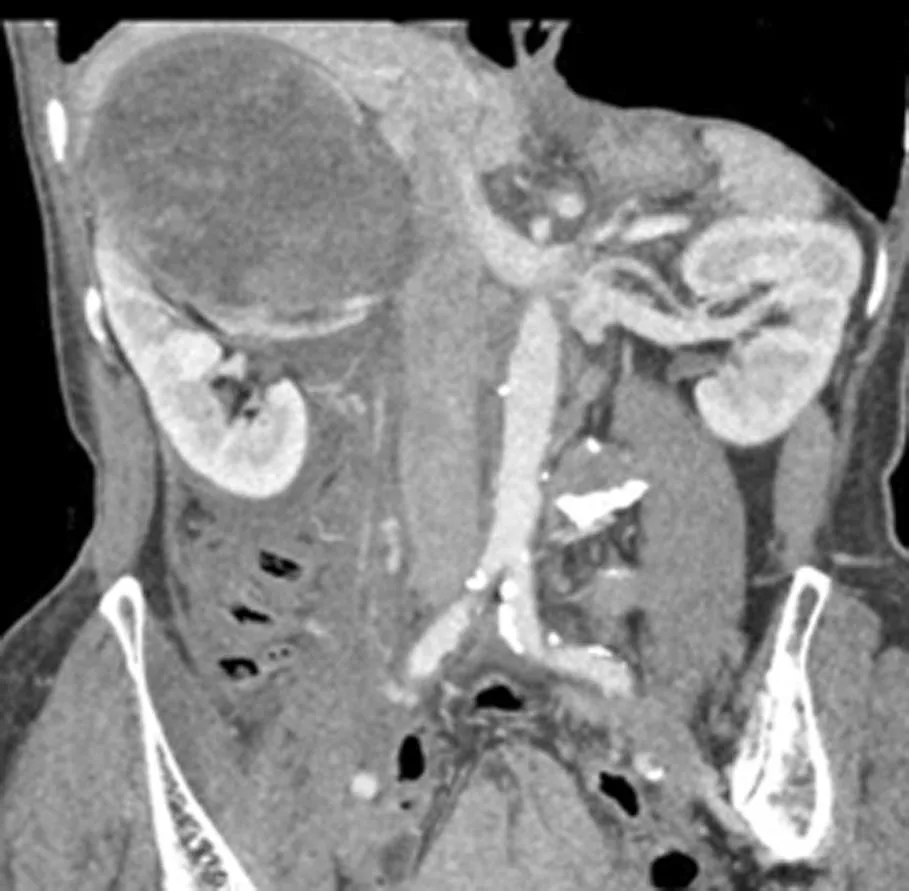
上图:肾脏增强MR显示右侧肾脏下极可见一团块状混杂稍长T2、混杂长T1、抑脂像稍低信号影,大小为10.1 cm×8.6 cm;肾门、腹主动脉旁多发肿大,淋巴结,部分融合,邻近的下腔静脉、右肾静脉受侵。下图:肾脏增强CT显示右肾中上极大小为10 cm×11 cm巨大肿块影,边缘尚清晰,包膜完整,增强明显不均匀强化。
图1合并癌栓影像学资料
综上,巨大肾癌是肾癌根治性切除的主要指征;巨大肾癌发生腔静脉癌栓概率高,达37.9%,是非巨大肾癌发生率的9倍;巨大肿瘤预后较差,局部复发或远处转移率高。经腹机器人辅助腹腔镜手术视野显露良好,操作灵活、精细,解剖清晰,出血少,创伤小恢复快。本研究显示机器人辅助腹腔镜下肾癌根治性切除术安全、有效,优势明显,是巨大肾癌根治性切除术的发展方向,一定程度上拓宽了肾癌腹腔镜手术的适应证。但处理此类患者需要术者不仅具有丰富的手术经验和娴熟的腔镜技术,同时也要具备良好的心理素质,整体学习曲线较长。由于本研究临床病例资料有限,尚需在临床中进一步积累和总结经验。
[参考文献]
[1]张旭,王保军,马鑫,等.机器人辅助腹腔镜下根治性肾切除联合下腔静脉瘤栓取出术的临床研究.中华泌尿外科杂志,2015,36(5):321-324.
[2]Nayak JG,Patel P,Bjazevic J,et al.Clinical outcomes following laparoscopic management of pT3 renal masses:A large,multi-institutional cohort.Can Urol Assoc J,2015,9(11-12):397-402.
[3]Ljungberg B,Bensalah K,Canfield S,et al.EAU guidelines on renal cell carcinoma:2014 update.Eur Urol,2015,67(5):913-924.
[4]张旭,李宏召,马鑫,等.泌尿外科腹腔镜与机器人手术学.北京:人民卫生出版社,2015:184-185.
[5]Kim SP,Murad MH,Thompson RH,et al.Comparative effectiveness for survival and renal function of partial and radical nephrectomy for localized renal tumors:a systematic review and meta-analysis.J Urol,2012,188(1):51-57.
[6]Levy DA,Slaton JW,Swanson DA,et al.Stage specific guidelines for surveillance after radical nephrectomy for local renal cell carcinoma.J Urol,1998,159(4):1163-1167.
[7]Hafez KS,Novick AC,Campbell SC.Patterns of tumor recurrence and guidelines for followup after nephron sparing surgery for sporadic renal cell carcinoma.J Urol,1997,157(6):2067-2070.
[8]Ljungberg B,Alamdari FI,Rasmuson T,et al.Follow-up guidelines for nonmetastatic renal cell carcinoma based on the occurrence of metastases after radical nephrectomy.BJU Int,1999,84(4):405-411.
[9]Fergany AF,Hafez KS,Novick AC.Long-term results of nephron sparing surgery for localized renal cell carcinoma:10-year followup.J Urol,2000,163(2):442-445.
[10]Gofrit ON,Shapiro A,Kovalski N,et al.Renal cell carcinoma:Evaluation of the 1997 TNM system and recommendations for follow-up after surgery.Eur Urol,2001,39(6):669-674.
[11]Stephenson AJ,Chetner MP,Rourke K,et al.Guidelines for the surveillance of localized renal cell carcinoma based on patterns of relapse after nephrectomy.J Urol,2004,172(1):58-62.
[12]应向荣,沈冲.后腹腔镜技术联合肋缘下切口处理巨大肾肿瘤伴肾静脉癌栓的可行性及安全性研究.临床泌尿外科杂志,2015,30(1):18-23.
[13]张旭,高江平,符伟军,等.机器人辅助腹腔镜在泌尿外科手术中的临床应用(附500例报告).微创泌尿外科杂志,2014,3(1):4-7.
[14]Zargar H,Addison B,McCall J,et al.Renal artery embolization prior to nephrectomy for locally advanced renal cell carcinoma.ANZ J Surg,2014,84(7-8):564-567.
[15]Schwartz MJ,Smith EB,Trost DW,et al.Renal artery embolization:clinical indications and experience from over 100 cases.BJU Int,2007,99(4):881-886.
Clinical analysis of intraperitoneal robot-assisted laparoscopic radical nephrectomy for renal large tumor
Wang Qiang1,2Shi Lixin1Wang Baojun1Ma Xin1Li Hongzhao1Gao Jiangping1Dong Jun1Zhang Xu1
(1Department of Urology,Chinese PLA General Hospital,Beijing 100853,China;2Department of Urology,Organ Transplant Institute of 309th Hospital of PLA)
AbstractObjective:To summarize the experience of transperitoneal approach robotic-assisted laparoscopic surgery in renal large tumor and to discuss the technical safety and surgical outcomes in single center.Methods:We retrospectively analyzed the clinic data of 29 patients with renal large tumor undergoing transperitoneal approach robotic-assisted laparoscopic surgery in our center,and summarized the clinical characteristics and operative outcomes.Results:101 cases underwent robotic-assisted laparoscopic radical nephrectomy during 2008 October to 2015 April.Among all these cases,29 were diagnosed as renal large tumor(28.7% of the cases given radical nephrectomy),including 20 males and 9 females with the mean age of(54.9±11.9)years old;.Fourteen tumors were located in the left kidney,and 15 in the right kidney.The maximum diameter was 16 cm and average diameter was(9.56±2.36)cm.Eleven cases(39.29%)were complicated with tumor thrombosis.Twenty cases were accomplished by transperitoneal approach and all procedures were technically successful without open conversion.All the 11 cases combined with tumor thrombus were treated with renal artery embolization.Average operative time was(164.4±40.0)min and average blood loss was 50-1 200 mL.The gastrointestinal function recovered in(2.65±0.71)days,and drains were removed in(3.17±1.36)days.The length of hospital stay after operation was(6.8±2.5)days.No abdominal visceral or great vessel injury happened during the surgery,and no intra-abdominal infection or ileus occurred after surgery in all the cases.Tumor stage was pathologically classified as:9 cases of T2N0-1M0-1,14 cases of T3N0-1M0-1and 6 cases of T4N0-1M0-1.During follow-up period of 1-24 months,metastasis and recurrence were found in 8 cases(27.6%).Conclusions:With initial surgery experience and short-term follow-up,transperitoneal approach robotic-assisted laparoscopic surgery is safe and feasible for renal large tumor.Extensive surgical experiences,long-term and more randomized trials will be required to better assess the appropriateness and potential of this technique.
Key wordsRenal large tumor; Radical nephrectomy; Robotic-assisted laparoscopic surgery
通信作者:张旭,xzhang@foxmail.com
收稿日期:2015-12-12
基金项目:国家高技术研究发展计划(863计划)(2014AA020607)
[中图分类号]R737.11
[文献标识码]A
[文章编号]2095-5146(2016)02-069-04
Corresponding author:Zhang Xu,xzhang@foxmail.com
