短发夹RNA干扰CXCR4表达对卵巢癌SKOV3细胞凋亡及侵袭能力的影响*
2016-06-30杨英捷
赖 靖, 訾 聃, 杨英捷
(1.贵州医科大学, 贵州 贵阳 550004; 2.贵州医科大学附院, 贵州 贵阳 550004; 3.贵州省肿瘤医院, 贵州 贵阳 550004)
短发夹RNA干扰CXCR4表达对卵巢癌SKOV3细胞凋亡及侵袭能力的影响*
赖靖1, 訾聃2**, 杨英捷3
(1.贵州医科大学, 贵州 贵阳550004; 2.贵州医科大学附院, 贵州 贵阳550004; 3.贵州省肿瘤医院, 贵州 贵阳550004)
[摘要]目的: 探讨短发夹RNA(shRNA)干扰趋化因子受体4(CXCR4)表达对卵巢癌细胞株SKOV3侵袭能力及细胞凋亡的影响。方法: 将带有绿色荧光蛋白的慢病毒载体转染卵巢癌细胞株SKOV3,设计特异shRNA将其连入慢病毒载体;测序及荧光显微镜下观察绿色荧光验证慢病毒载体构建并转染,利用RT-qPCR检测转染后细胞株中CXCR4的mRNA表达,Western blot检测转染后细胞株中CXCR4、促凋亡蛋白Bax、B细胞白血病-2基因(Bcl-2)、Bcl-xl及半胱氨酸天冬氨酸蛋白酶-3(Caspase-3)的蛋白表达;Annexin V/PE双染色流式细胞术检测SKOV3细胞凋亡率,Transwell小室检测转染后卵巢癌细胞株SKOV3的侵袭力。结果: 测序结果及微下见绿色荧光蛋白表达,证实成功构建慢病毒载体并转染卵巢癌细胞株SKOV3,成功将特异shCXCR4连入载体;shCXCR4组mRNA及蛋白表达水平明显低于NC组(P<0.05);干扰细胞中CXCR4的表达能提高SKOV3细胞中Bax及Cleaved caspase-3蛋白的表达量,降低Bcl-xl与Bcl-2的蛋白表达,干扰后,SKOV3细胞凋亡率,shCXCR4组细胞凋亡率较CON组和NC组明显增高(P<0.05);穿膜的细胞数明显减少,抑制率为58.94%,差异有统计学意义(P<0.01)。结论: 慢病毒干扰载体pLVshCXCR4-EGFP(2A)-Puro转染卵巢癌细胞株SKOV3,可以下调细胞株中CXCR4的表达,并能促进卵巢癌细胞的凋亡,并能有效地降低卵巢癌细胞的侵袭能力。
[关键词]卵巢肿瘤; 趋化因子受体4; RNA干扰; 细胞凋亡; 侵袭能力[中图分类号] R711.75; R737.33
[文献标识码]A
[文章编号]1000-2707(2016)06-0653-07
卵巢癌是妇科发病率较高的恶性肿瘤之一,居妇科肿瘤病死率的首位,一直威胁着妇女的生命健康[1]。由于卵巢位居盆腔深部使得卵巢癌初期症状不明显,且缺乏早期诊断依据,易造成浸润转移,这也是卵巢癌病死率较高的首要原因。 趋化因子(Chemokine)是一类具备趋化活性的细胞因子,能被肿瘤细胞所分泌,增进肿瘤细胞的侵袭和转移[2-5]。趋化因子12(chemokine ligand 12,CXCL12),也称基质细胞衍生因子(stromal cell derived factor-1,SDF-1)与趋化因子受体4(chemokine CXC motif receptor 4,CXCR4)构成CXCR4/SDF-1生物轴,介导细胞内信号的转导。有研究证实,CXCR4在卵巢癌细胞中高表达[6],并且在卵巢癌的浸润中有着重要的作用。RNA干扰(RNA interference ,RNAi)是目前分子生物领域兴起的一项干扰技术,能够特异的降解相应基因的mRNA,使细胞的目的基因缺失或使其表达量下调[7];Bcl-2(B-cell-leukemia/Lymphoma-2)与Bax(Bcl-2 Associated X Protein)基因是目前已知的在凋亡过程中功能相互对立的一组调控基因[8-9],而半胱氨酸天冬氨酸蛋白酶-3(caspase-3)是凋亡过程中最关键的凋亡执行蛋白酶,因此,3者的关系已成为进来研究细胞凋亡的热点。本研究期望能够通过RNAi技术下调CXCR4的表达,探讨短发夹RNA(short hairpin RNA,shRNA)干扰CXCR4的表达对卵巢癌细胞株SKOV3侵袭能力以及细胞凋亡的影响,以期为卵巢癌的治疗找到一个新的靶点。
1材料和方法
1.1细胞株与慢病毒载体
人卵巢癌细胞株SKOV3购于北京北纳生物科技有限公司;慢病毒载体pLVshRNA-EGFP(2A)Puro,含U6启动子及绿色荧光蛋白基因,购自北京英盛茂业生物有限公司。
1.2主要试剂
RPMI-1640 购自Gibco公司,胰酶购自Hyclone公司,胎牛血清购自杭州四季青生物工程材料有限公司,PBS、青霉素/链霉素购自北京鼎盛茂业生物有限公司,限制性内切酶EcoRⅠ、BamHⅠ、T4 DNA Ligase、琼脂糖凝胶DNA回收试剂盒、蛋白裂解液、SDS-PAGE凝胶制备试剂盒、一步法WB(HRP)快速二抗试剂盒(鼠)购自北京康为世纪生物有限公司,Polyfect-v转染试剂购自北京英盛茂业生物有限公司,去内毒素质粒抽提试剂盒购自美国OMEGA公司,封闭蛋白干粉购自博士德公司,TRIZOL 试剂购自Invitrogen公司,SYBR Green qPCR Mix购自TOYOBO公司,Bax鼠抗人多克隆抗体、Bcl-2鼠抗人多克隆抗体、Bcl-xl鼠抗人多克隆抗体、cleaved caspase-3兔抗人多克隆抗体购于美国cell signaling Technology公司,含有基质胶的Transwell小室购自美国Corning公司,引物合成及基因测序由北京鼎盛茂业生物有限公司完成。
1.3实验分组
实验分为3组:CON组(空白组)转染pLV shRNA-EGFP(2A)Puro的卵巢癌细胞株SKOV3,NC组(阴性组)转染无义序列的pLVshCXCR4-EGFP(2A)Puro的卵巢癌细胞株SKOV3和shCXCR4组 (实验组)转染pLVshCXCR4-EGFP(2A)Puro卵巢癌细胞株SKOV3。
1.4实验方法
1.4.1CXCR4特异性干扰序列Genebank检测CXCR4(序列号NM_003467)基因序列,The RNAi Consortium网站设计干扰序列4条(其中1条为阴性序列,3条为特异性干扰序列,)经美国国立生物技术信息中心数据库进行序列检索,检测基因序列无同源性后交由北京鼎盛茂业生物有限公司合成(表1)。
1.4.2构建pLVshCXCR4-EGFP(2A)Puro载体、病毒的包装及滴度测定将合成的CXCR4干扰序列互补双链退火,慢病毒载体pLVshRNA-EGFP(2A)Puro进行BamHⅠ、EcoRⅠ双酶切,将退火的双链连入酶切的载体,转化DH5α感受态细菌,挑取克隆送测序。测序无误后进行病毒包装及滴度的测定。
1.4.3细胞培养卵巢癌细胞株SKOV3于RPMI-1640培养基中常规培养,细胞呈贴壁生长,2~3 d换液传代,取对数生长期细胞用于实验。
1.4.4CXCR4 mRNA表达取对数生长期的SKOV3细胞,细胞密度为1×1010/L进行转染。病毒滴度为1×109TU/L,按MOI=病毒滴度×需加入的体积/细胞浓度,在3组细胞中分别加入50 μL病毒液,常规培养6 h后再次加入培养基。转染前先计数细胞数,转染24 h后,利用荧光显微镜观察细胞内GFP表达,GFP阳性细胞表达绿色荧光,计数GFP阳性细胞,选取转染效率高的一组CXCR4阳性序列进行下一步实验。转染24 h后以TRIZOL法提取总RNA进行逆转录,并进行定量PCR反应。待测基因引物序列CXCR4 F为GGTCTATGTTGGCGTCTGGAT,R为TGAGGATGACTGTGGTCTTGAG β-actin F为CATTGCCGACAGGATGCAG,R为CTCGTCATACTCCTGCTTGCTG。1.4.5CXCR4、Bax、BCL-xl、Bcl-2及cleaved caspase-3蛋白表达将转染后的3组细胞常规培养24 h后收集细胞,BCA试剂盒对细胞裂解进行蛋白定量,并测定总蛋白浓度,以30 μL/泳道上样,按常规方法进行Western blot检测。
1.4.6SiRNA对SKOV3细胞凋亡的影响消化收集各组细胞,细胞浓度约为1×107个/L,用PBS重悬细胞,吹打均匀后加入AnnexinV溶液混匀,室温避光孵育10~15 min,离心,PBS洗涤细胞,重悬细胞,加入PE染色细胞,4 ℃下避光孵育20 min,流式细胞仪分析凋亡率。
1.4.7Transwell小室检测细胞侵袭能力将Transwell小室放入培养板中,在上室加入300 μL预温的无血清培养基,室温下静置15~30 min,使基质胶再水化,20 min后吸去培养液。病毒转染细胞后常规培养24 h,撤去培养基中的血清使细胞饥饿12 h,调整细胞密度至 1×108个/L,不超过5×108个/L,上室加入细胞悬液,下室加入含有趋化因子及血清的培养基,常规培养24 h后,弃去培养液,PBS清洗滤膜表面,固定细胞,倒置Transwell小室,自然风干后细胞染色计数。
1.5统计学方法
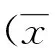
2结果
2.1pLVshCXCR4-EGFP(2A)puro载体测序
将插入干扰序列的载体送测序,测序结果与设计的靶序列完全相符(图1),表明靶向沉默基因shCXCR4表达载体构建成功。
2.2pLVshCXCR4-EGFP(2A)puro转染SKOV3
载体pLVshCXCR4-EGFP(2A)puro携带绿色荧光表达基因,在荧光显微镜下观察到绿色荧光表达。选取转染效率较高的shCXCR4-3组(图2)及NC组进行下一步实验。
2.3特异性CXCR4shRNA对SKOV3细胞CXCR4mRNA表达的抑制作用
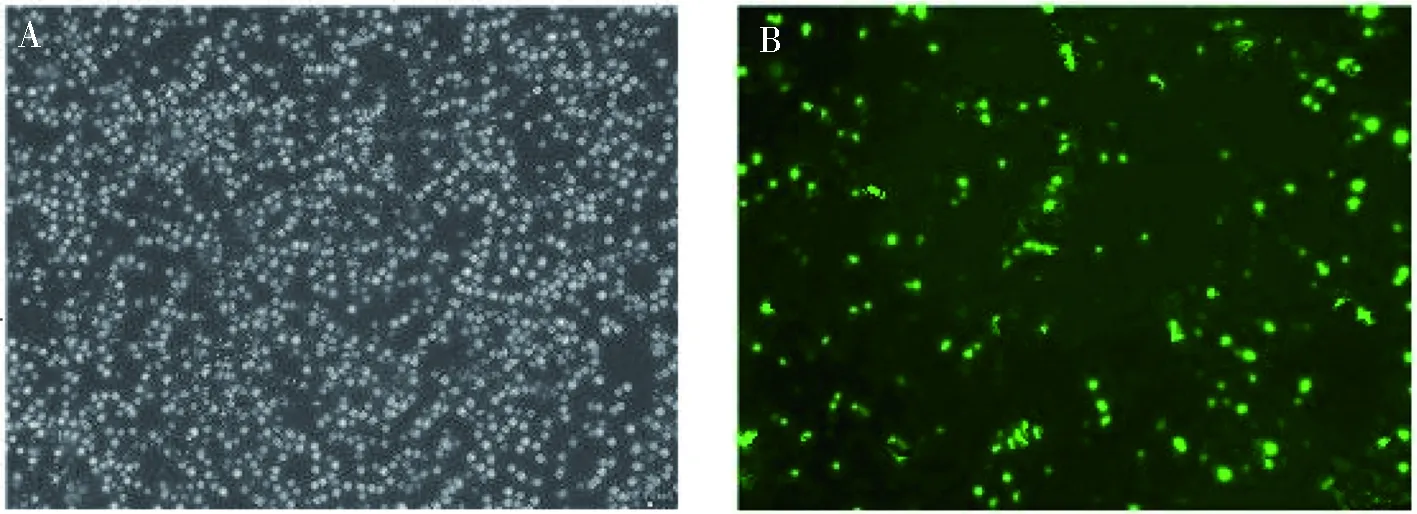
RT-qPCR和2-ΔΔCT法分析SKOV3中CXCR4的mRNA相对表达量,shCXCR4组较NC组的mRNA的表达量降低,差异有统计学意义(P=0.02);NC组与CON组比较,差异无统计学意义(图3)。
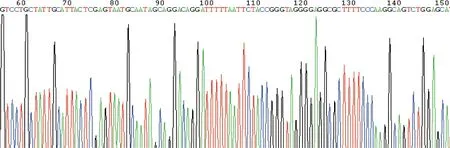
图1 构建的shCXCR4 表达载体测序结果Fig.1 Expression medium sequencing of constructed shCXCR4
注:A为转染前倒置显微镜下SKOV3细胞,B为转染24 h后荧光显微镜下SKOV3细胞图2 慢病毒干扰载体转染SKOV3细胞 (10×)Fig.2 Transfection of SKOV3cells with lentivirus vector
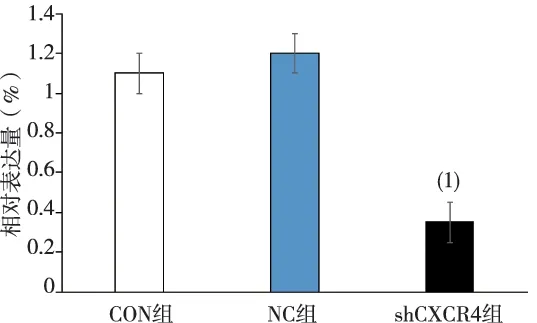
(1)与NC组相比,P<0.05图3 CXCR4 shRNA对卵巢癌SKOV3细胞CXCR4 mRNA 表达的影响Fig.3 Influence of CXCR4 shRNA on expression of ovarian cancer SKOV3 cell CXCR4 mRNA
2.4特异性CXCR4shRNA对SKOV3细胞CXCR4、Bax、Bcl-xl、Bcl-2及cleaved caspase-3蛋白表达的影响
与NC组比较,shCXCR4组CXCR4蛋白表达水平明显降低,差异有统计学意义(P<0.05);CON组与NC组比较,差异无统计学意义(P>0.05),见图4;与NC组比较,Bax、cleaved caspase-3蛋白表达升高,而Bcl-2、Bcl-xl蛋白表达水平降低,差异有统计学意义(P<0.05),见图5。
2.5下调CXCR4对SKOV3细胞凋亡的影响
通过AnnexinV和PE双重标记后上流式检测结果显示,shCXCR4组转染后凋亡率(13.53±2.69)%较CON组(4.97±1.71)%和NC组(4.63±1.10)%明显增多,差异有统计学意义(P<0.05),而CON组及NC组的细胞凋亡率分布无统计学意义(P>0.05),见图6。
2.6干扰CXCR4表达对卵巢癌细胞侵袭能力的影响
Transwell小室检测干扰CXCR4表达后,细胞的穿膜数,shCXCR4组每视野为(22.184±2.185),抑制率为58.94%,抑制率明显高出NC组,差异有统计学意义(P<0.01);NC组(57.133±3.214)抑制率为-5.78%,差异无统计学意义(P>0.05),shCXCR4组SKOV3细胞的穿膜数较NC组明显降低(P<0.05),见图7。
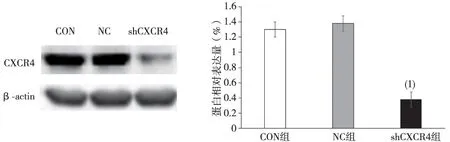
(1) 与NC组比较,P<0.05图4 CXCR4 shRNA对卵巢癌SKOV3细胞CXCR4蛋白表达的影响Fig.4 Influence of CXCR4 shRNA on protein expression of ovarian cancer SKOV3 cell CXCR4 mRNA
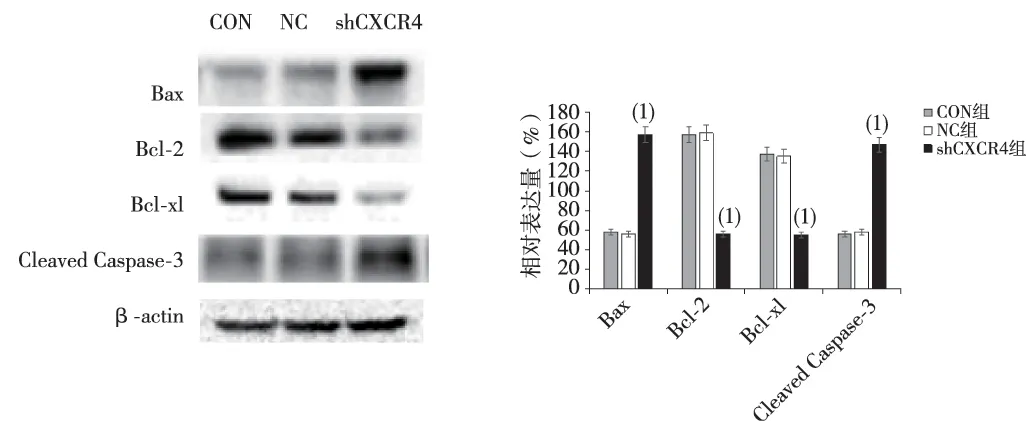
(1)与NC组比较,P<0.05图5 Bax与Bcl-2、Bcl-xl及cleaved caspase-3的蛋白表达水平Fig.5 Downregulated CXCR4, expression of SKOV3 cell strains Bax与Bcl-2, Bcl-xl and cleaved caspase-3
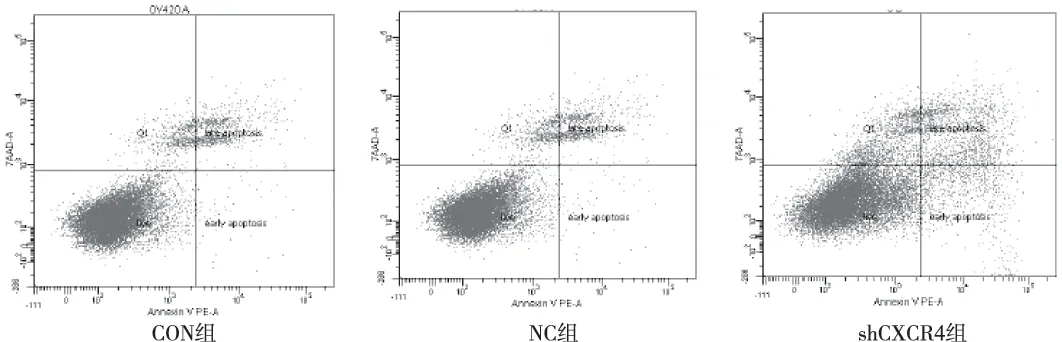
图6 SKOV3细胞凋亡率(AnnexinV和PE双标流式细胞仪)Fig.6 Apoptosis rate of SKOV3
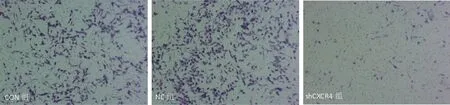
图7 干扰CXCR4表达后SKOV3细胞的穿膜数(Transwell小室)Fig.7 Transwell of interfered expression of CXCR4
3讨论
卵巢癌是女性生殖系统肿瘤,发病率较高,占女性恶性肿瘤的五分之一,因其易发生浸润及远处转移,致死率位居妇科肿瘤的首位,5年存活率低于50%[10]。趋化因子能够增加内皮细胞的聚集,下调免疫监视,调整肿瘤细胞的外形从而使肿瘤细胞躲避免疫监视,增进自身的发展,以此获取远处转移能力[11];CXCR4能产生趋化性,并伴随着细胞重排、肌动蛋白聚合、极化、形成伪足和黏附作用,影响肿瘤的发生和发展[12],CXCR4在多种恶性肿瘤中被检测出,且存在高表达,被证实与肿瘤的浸润转移密切相关[13]。研究发现,正常卵巢组织及卵巢良性肿瘤中较少或无CXCR4表达,而在卵巢上皮性囊腺癌及其转移灶中存在CXCR4的高表达,且在卵巢癌转移灶中表达趋势明显高于原发灶[14];并且与卵巢癌淋巴结的转移存在正相关[15-16]。本研究采用卵巢癌细胞株SKOV3进行实验,证实了在卵巢癌细胞株SKOV3上存在CXCR4的高表达,并且该表达能够被特异性干扰片段下调。这与蒋玉萍等[17]采用CXCR4阻断剂在体外能够阻断其表达相一致,这表明,在卵巢癌细胞上高表达的CXCR4能够被特异性SiRNA及CXCR4拮抗剂下调。
细胞凋亡是由基因控制的细胞自主的有序性死亡,细胞凋亡与胚胎发育、自身免疫耐受、肿瘤发生、病毒感染等生理、病理过程密切相关。细胞凋亡可通过流式细胞仪、DNA凝胶电泳等多种方法检测。在细胞凋亡过程中,Bcl家族成员起着至关重要的作用。其分为2大类,一类是抗凋亡的主要有Bcl-2,Bcl-xl,另一类是促细胞死亡的,主要包括Bax,Bcl-XS等,Bcl-2与Bax是目前研究较深入的凋亡调控基因,Bcl-2是凋亡抑制基因,其活性增高,可抑制细胞凋亡,延长细胞生命[18]。Bax是一种促凋亡基因,抑制细胞增值,因此通过这两种基因表达的检测,能反映出细胞的凋亡[19]。本实验通过流式细胞仪检测细胞凋亡结果显示,在下调CXCR4的表达后,shCXCR4组的细胞凋亡率(13.53±2.69)%明显高于NC组(4.63±1.10)%及CON组(4.97±1.71)%,差异有统计学意义(P<0.05),而在WB检测Bax、Bcl-xl、Bcl-2及cleavedcaspase-3蛋白表达的结果中得出,在shCXCR4组抗凋亡基因Bcl-2及Bcl-xl的蛋白表达较CON组及NC组明显减少,而Bax在shCXCR4的表达则反之;凋亡是一个发生在由caspase家族成员介导的蛋白酶级联反应过程,即caspase在凋亡信号的作用下,启动型caspase先通过结合特异辅因子而激活,发挥水解蛋白的作用,从而激活下游效应型caspase,一旦效应caspase被激活,便大范围的水解细胞内靶物质,从而降解细胞内蛋白,最终使细胞不可逆走向死亡[20],而caspase-3就位于级联反应的下游,执行剪切细胞结构蛋白的作用,直接使细胞发生死亡;在本实验中,下调CXCR4后,cleavedcaspase-3被激活,降解肿瘤细胞内蛋白,促使细胞凋亡的发生。Katkoori[21]的研究显示,在实验中利用CXCR4的拮抗剂下调CXCR4后,能够诱导乳腺癌细胞及直肠癌细胞的凋亡,并能有效地降低其增殖与迁移能力;在Hamdan[22]对尤文氏肉瘤的研究中,利用AMD3100拮抗CXCR4的表达能够引起骨髓细胞的凋亡的同时能够减少肿瘤血管的灌注;我们的结果与其他的研究结果相同,下调CXCR4可诱导细胞的凋亡。
CXCR4在卵巢癌中的作用还与其促进肿瘤细胞的转移和侵袭能力有关[23]。细胞外基质是肿瘤转移的重要屏障,其主要由基底膜和细胞间质组成。CXCR4可以诱导动员细胞内钙离子,活化细胞外信号调节激酶(ERK-1/2),使MMP-9分泌增加,IV型胶原酶纤维被降解,破坏基底膜并诱导新生血管的形成,肿瘤局部的微环境被重新建立,使肿瘤细胞更易获得转移性[24]。本研究在实验中下调了卵巢癌细胞上CXCR4的表达,在此基础上又进行了侵袭能力的检验,shCXCR4组细胞穿膜数 (22.184±2.185),与CON组 (54.018±2.368)及NC组( 57.133±3.214)相比明显减少,差异有统计学意义(P<0.01);由此可得出,肿瘤细胞上CXCR4的表达降低后其侵袭能力较未干扰前有了明显降低,这与之前关于下调CXCR4降低肿瘤细胞侵袭能力的研究结论相符。
卵巢癌是妇科高发的恶性肿瘤之一,治疗后易复发的特点是临床治疗的一个难点。本研究表明,利用特异性shRNA能够对CXCR4进行有效干扰,这或许能成为卵巢癌治疗的一个新的理论依据。
4参考文献
[1] Siegel R, Naishadham D, Jemal A. Cancer statistics[J]. CA: a cancer journal for clinicians, 2012(1):10-29.
[2] Muralidhar GG, Barbolina MV. Chemokine receptors in epithelial ovarian cancer[J]. International Journal of Molecular Sciences, 2013(1):361-376.
[3] Singh AK, Arya RK, Trivedi AK, et al. Chemokine receptor trio: CXCR3, CXCR4 and CXCR7 crosstalk via CXCL11 and CXCL12.[J]. Cytokine & Growth Factor Reviews, 2013(1):41-49.
[4] Döring Y, Pawig L, Weber C, et al. The CXCL12/CXCR4 chemokine ligand/receptor axis in cardiovascular disease[J]. Frontiers in Physiology, 2014(5):212-212.
[5] Coke C, Johnson A, Jones K, et al. Abstract 4989: Cannabinoid receptor 2 and C-X-C chemokine receptor 4 interact to abrogate CXCL12-mediated cellular response[J]. Cancer Research, 2015(1):75.
[6] Hall JM, Korach KS. Endocrine disrupting chemicals promote the growth of ovarian cancer cells via the ER-CXCL12-CXCR4 signaling axis[J]. Molecular Carcinogenesis, 2013(9):715-725.
[7] Prados J, Melguizo C, Roldan H, et al. RNA Interference in the treatment of colon cancer[J]. BioDrugs, 2013(4): 317-327.
[8]Souers AJ, Leverson JD, Boghaert ER, et al. Apotent and selective BCL-2 inhibitor achieves antitumor activity while sparing platelets.[J]. Nature Medicine, 2013(2):202-208.
[9]Tsai CJ, Liu S, Hung CL, et al. BAX-induced apoptosis can be initiated through a conformational selection mechanism.[J]. Structure, 2015(1):139-148.
[10]Ray P, Lewin SA, Mihalko LA, et al. Noninvasive imaging reveals inhibition of ovarian cancer by targeting CXCL12-CXCR4[J]. Neoplasia (New York, NY), 2011(12): 1152.
[11]吴凤, 涂亚庭, 陈思远. 趋化因子及其受体在肿瘤生长中的作用及抗肿瘤治疗的展望[J]. 实用医院临床杂志, 2013(1): 18-21.
[12]马亚南, 王宝红, 许晓群, 等. 趋化因子受体4与肿瘤[J]. 国际肿瘤学杂志, 2014(1): 190-193.
[13]Nikzaban M, Hakhamaneshi MS, Fakhari S, et al. The chemokine receptor CXCR4 is associated with the staging of gastric cancer[J]. Advanced Biomedical Research, 2014(1): 16.
[14]Salomonnson E, Stacer AC, Ehrlich A, et al. Imaging CXCL12-CXCR4 signaling in ovarian cancer therapy[J]. PloS One, 2013(1): e51500.
[15]Tahara T, Arisawa T, Shibata T, et al. Risk prediction of gastric cancer by analysis of aberrant DNA methylation in non-neoplastic gastric epithelium[J]. Digestion, 2007(1): 54-61.
[16]Ling X, Spaeth E, Chen Y, et al. The CXCR4 antagonist AMD3465 regulates oncogenic signaling and invasiveness in vitro and prevents breast cancer growth and metastasis in vivo[J]. PloS one, 2013(3): e58426.
[17]蒋玉萍, 吴小华, 邢邯英, 等. 趋化因子 CXCL12 及其受体 CXCR4 对卵巢上皮性癌细胞增殖, 迁移和侵袭能力的影响[J]. 中华妇产科杂志, 2007(6): 403-407.
[18]Wang H, Zhang Z, Wei X, et al. Small-molecule inhibitor of Bcl-2 (TW-37) suppresses growth and enhances cisplatin-induced apoptosis in ovarian cancer cells[J]. Journal of Ovarian Research, 2015(1):1-8.
[19]Westphal D, Dewson G, Czabotar PE, et al. Molecular biology of bax and bak activation and action[J]. Biochimica et Biophysica Acta (BBA)-Molecular Cell Research, 2011(4): 521-531.
[20]Matthew B, Weir DB, Anthony R, et al. Procaspase-3 regulates fibronectin secretion and influences adhesion, migration and survival independently of catalytic function.[J]. Journal of Cell Science, 2014(10):2217-2226.
[21]Katkoori VR, Basson MD, Bond VC, et al. Nef-Ml, a peptide antagonist of CXCR4, inhibits tumor angiogenesis and epithelial-to-mesenchymal transition in colon and breast cancers[J]. Oncotarget, 2015(29):5821-5825.
[22]Hamdan R, Zhou Z, Kleinerman ES. Blocking SDF-1α/CXCR4 downregulates PDGF-B and inhibits bone marrow-derived pericyte differentiation and tumor vascular expansion in Ewing tumors.[J]. Molecular Cancer Therapeutics, 2014(2):483-491.
[23]张焱, 李巧玉, 袁志诚, 等. 缺氧诱导因子-1α对恶性肿瘤细胞侵袭性生长的影响[J]. 中华实验外科杂志, 2011(2): 258-260.
[24]Krook MA, Nicholls LA, Scannell CA, et al. Stress-induced CXCR4 promotes migration and invasion of ewing sarcoma.[J]. Molecular Cancer Research, 2014(6):601-606.
(2016-03-05收稿,2016-05-21修回)
中文编辑: 刘平; 英文编辑: 赵毅
Influence of Lentivirus-Mediated shRNA-CXCR4 on Ovarian Cancer Cell Apoptosis and Invasion
LAI Jing1, ZI Dan2, YANG Yingjie3
(1.GuizhouMedicalUniversity,Guiyang550004,Guizhou,China; 2.AffiliatedHospitalofGuizhouMedicalUniversity,Guiyang550004,Guizhou,China; 3.GuizhouTumorHospital,Guiyang550004,Guizhou,China)
[Abstract]Objective: To evaluate the influence of CXCR4-targeted short hairpin RNA on invasion ability and apoptosis of ovarian cancer line SKOV3. Methods: CXCR4-shRNA lentivirus with Green fluorescent protein was transfected into ovarian cancer cell line SKOV3. RT-qPCR and western blot were employed to measure the expression of CXCR4 RNA and protein expression of CXCR4, Bax, Bcl-2, Bcl-xl and Caspase-3. Apoptosis rate of SKOV3 cell was detected through Annexin V/PE double staining flow cytometry. Transwell chamber was employed to estimate the invasiveness for SKOV3. Results: Transfected pLVshCXCR4-EGFP (2A)-Puro. 2.CXCR4 RNA expression level and protein in ShCXCR4 group was (0.40±0.13) and (0.45±0.23) ,respectively lower than that in NC group (1.109±0.21, P<0.05). Interference of CXCR4 expression in cells can increase Bax and Cleaved caspase-3 protein expression in SKOV3 cells, reduced the Bcl-xl and the Bcl-2 protein expression. Flow cytometry instrument was adopted to detect cell apoptosis rate, shCXCR4 group was significantly higher than that of NC group and CON group, difference was statistically significant(P<0.05); in invasion test ,cell number of ShCXCR4 group was obviously lower than that in NC group and CON group, inhibition rate of shCXCR4 group was 58.94%, difference was statistically significant(P<0.01). Conclusion: CXCR4 RNA interference mediated with pLVshCXCR4-EGFP (2A)-Puro could effectively downregulate the expression of CXCR4 RNA, and promote the cancer cell apoptosis as well as decrease the invasion ability of cancer cells.
[Key words]ovarian cancer; chemokine receptor 4; RNA interfence; apoptosis; invasion
*[基金项目]贵州省科技厅联合基[黔科合LG(2011)032号]
DOI:10.19367/j.cnki.1000-2707.2016.06.008
**通信作者 E-mail:2816497455@qq.com
网络出版时间:2016-06-16网络出版地址:http://www.cnki.net/kcms/detail/52.5012.R.20160616.1715.044.html
