沉默UVRAG对白血病K562/ADM细胞自噬及耐药性的影响
2016-06-30曹强强殷小成肖正香
曹强强,殷小成,肖 亮,肖正香
(1.南华大学附属第一医院儿科,湖南 衡阳 421001;2.湘潭市中心医院儿科,湖南 湘潭 411100)
沉默UVRAG对白血病K562/ADM细胞自噬及耐药性的影响
曹强强1,殷小成1,肖亮1,肖正香2
(1.南华大学附属第一医院儿科,湖南 衡阳 421001;2.湘潭市中心医院儿科,湖南 湘潭 411100)
[摘要]目的探讨沉默紫外线抵抗相关基因(UVRAG)对人白血病K562/ADM细胞自噬及耐药性的影响。方法Western Blotting检测UVRAG蛋白在K562及K562/ADM细胞中表达差异。特异性干扰UVRAG基因的UVRAG siRNA及Scramble siRNA在LipofectamineTM2000介导下转染K562/ADM细胞,CCK-8法、MDC荧光染色及Western Blotting分别检测UVRAG siRNA转染前后K562/ADM细胞耐药性、自噬水平以及P-糖蛋白(P-gp)表达的变化。结果Western Blotting检测显示K562/ADM细胞中UVRAG蛋白表达明显高于K562细胞(P<0.05);与K562/ADM组及Scramble siRNA转染组相比,UVRAG siRNA转染组UVRAG蛋白表达显著下降(P<0.05),以48 h效果最佳,提示UVRAG siRNA能高效沉默K562/ADM细胞UVRAG;CCK-8法显示与K562/ADM组及Scramble siRNA转染组相比,UVRAGsiRNA组对阿霉素敏感性显著增高,IC50值明显下降(P<0.05);MDC染色荧光显微镜观察到UVRAG siRNA转染后K562/ADM细胞胞浆中自噬泡明显减少;Western Blotting显示K562/ADM细胞中Beclin-1、P-gp表达及P62降解明显高于K562细胞,与K562/ADM细胞及Scramble siRNA转染组相比,UVRAG siRNA转染组Beclin-1、P-gp表达及P62降解显著降低(P均<0.05)。结论UVRAG蛋白在K562/ADM细胞中高表达,与白血病MDR密切相关;UVRAG siRNA下调UVRAG表达可降低K562/ADM细胞耐药性,其机制可能与降低自噬水平及下调P-gp表达有关。
[关键词]紫外线抵抗相关基因;K562/ADM细胞;自噬;耐药性
多药耐药(multiple drug resistance,MDR)是影响白血病治疗效果的重要耐药形式,P-糖蛋白(P-gp)、多药耐药相关蛋白(MRP)等表达可赋予肿瘤细胞耐药表型形成[1]。自噬是真核细胞利用溶酶体降解细胞浆内受损的细胞器和大分子物质的生物学过程,细胞自噬与肿瘤治疗关系密切,参与肿瘤细胞化疗敏感性的调控,已成为肿瘤研究领域的一个热点[2-3]。本课题组前期研究[4]报道外线抵抗相关基因(UV radiation resistance-associated gene, UVRAG)参与自噬通路形成,且UVRAG可抑制Bax线粒体转位而抑制凋亡发生。目前细胞自噬与白血病化疗耐药的研究逐渐增多,但UVRAG是否参与白血病细胞MDR形成及其可能机制研究尚未见报道。本研究拟通过UVRAG siRNA转染人白血病K562/ADM细胞,检测K562/ADM细胞耐药性、自噬相关蛋白及P-gp表达变化,初步探讨UVRAG参与白血病MDR形成的可能机制,为深入研究细胞自噬与白血病MDR关系提供新的实验依据。
1材料与方法
1.1主要材料与试剂胎牛血清购自杭州四季青生物公司;RPMI-1640培养基购自美国Hyclone公司;阿霉素(ADM)购自浙江海正药业股份有限公司;单丹磺酰戊二胺(MDC)购自Sigma公司;LipofectamineTM2000试剂购自Invitrogen公司;siRNA购自吉玛生物公司;UVRAG、Bec1in-1、P-gp、P62抗体购自Abcam公司;β-actin抗体购自北京博奥森生物公司。
1.2实验方法
1.2.1细胞培养K562细胞由实验组成员提供;K562/ADM细胞购自天津血液研究所。K562、K562/ADM细胞生长于含体积分数10%胎牛血清的RPMI-1640培养基中,置于37 ℃、体积分数5% CO2培养箱中培养,取对数生长期细胞用于实验。
1.2.2siRNA转染K562/ADM细胞按照LipofectamineTM2000说明书转染细胞。收集对数生长期K562/ADM细胞,用含胎牛血清的培养基重悬细胞,接种于6孔板中,将稀释的siRNA和Lipofectamin试剂混合,轻柔混匀,室温放置20 min,再加于适量细胞悬浮液中,达到100 pmol siRNA/2 mL细胞培养基,6孔板置于37 ℃、5% CO2培养箱中培养24 h、48 h后,收集细胞进行其他检测步骤。
1.2.3实验分组实验设为K562细胞组、K562/ADM细胞组、UVRAG siRNA转染K562/ADM细胞24 h组(si-UVRAG-K562/ADM,24 h组)、UVRAGsiRNA转染K562/ADM细胞48 h组(si-UVRAG-K562/ADM,48 h组)、Scramble siRNA转染K562/ADM细胞阴性对照组(NC-K562/ADM组)。
1.2.4Western Blotting检测各组细胞UVRAG、P-gp、Beclin-1、P62蛋白表达收集各组细胞,800 r·min-1离心5 min,弃上清,每管加入含PMSF细胞裂解液置于摇床上冰中裂解30 min,于4 ℃、12 000 r·min-1离心5 min,取上清;BCA蛋白定量法进行定量;蛋白质变性;SDS聚丙烯酸胺凝胶电泳、转膜、封闭,抗体孵育、显影、灰度值分析。
1.2.5CCK-8法检测K562、K562/ADM细胞药物敏感性根据CCK-8试剂盒说明书,收集各组细胞,调整细胞数后接种于96孔培养板中,设置空白组、对照组及实验组,实验组每孔加入100 μL细胞悬液及10 μL含不同浓度ADM培养基,设置3个复孔,置于37 ℃、体积分数5% CO2细胞培养箱内放置48 h后,每孔加入10 μL CCK-8试剂后继续孵育3 h,酶标仪测定450 nm处各组OD值。计算细胞存活率,细胞存活率=(实验组OD值-空白组OD值)/(对照组OD值-空白组OD值)×100%,GraphPad Prism 5计算各组细胞IC50值。
1.2.6MDC染色荧光显微镜观察自噬泡收集UVRAGsiRNA转染后si-UVRAG-K562/ADM细胞及K562、K562/ADM细胞,PBS液洗涤后加入1 mL 0.05 mmol·L-1的MDC染液,37 ℃、体积分数5% CO2培养箱孵育15 min后,再用PBS洗涤1次,800 r·min-1离心5 min,以少量PBS液重悬细胞后涂于载玻片上,盖片封片后在荧光显微镜下加356 nm发射滤片和545 nm断滤片进行观察和摄片[5]。

2结果
2.1UVRAG蛋白在K562细胞及耐药株K562/ADM中表达情况K562/ADM细胞是一种人慢性髓原白血病阿霉素耐药细胞株,Western Blotting显示,与K562细胞UVRAG蛋白相对表达量(0.61±0.05)相比,K562/ADM细胞中UVRAG蛋白相对表达量(1.15±0.06)显著增加,差异有统计学意义(P<0.05)。提示UVRAG高表达可能参与K562/ADM细胞MDR形成。见图1。

图1 Western Blotting检测UVRAG蛋白表达情况
2.2siRNA转染K562/ADM细胞对UVRAG蛋白表达的影响siRNA转染至K562/ADM细胞24 h、48 h后,Western Blotting显示,K562/ADM组UVRAG蛋白相对表达量为1.17±0.06,NC-K562/ADM组为1.21±0.03,两者表达差异无统计意义(P>0.05),与K562/ADM组及NC-K562/ADM组比较,UVRAGsiRNA转染K562/ADM细胞24 h, UVRAG蛋白相对表达量为0.59±0.03,48 h为0.44±0.02,均显著降低,且以48 h效果最佳,差异均有统计学意义(P均<0.05)。见图2。
2.3抑制UVRAG表达对K562/ADM细胞药敏性的影响CCK-8法检测显示ADM可以导致K562及K562/ADM细胞存活率下降,K562组[IC50值为(0.05±0.00)μg·mL-1]对ADM药敏性显著高于K562/ADM组[IC50值为(4.67±0.25) μg·mL-1],差异有统计学意义(P<0.05);K562/ADM组和NC-K562/ADM组[IC50值为(4.61±0.30) μg·mL-1]对ADM药敏性相似;与K562/ADM及NC-K562/ADM组比较,si-UVRAG-K562/ADM组对ADM的药敏性显著增加,差异有统计学意义(P<0.05),且其IC50值从UVRAG siRNA转染前的(4.67±0.25)μg·mL-1下降至(2.06±0.24)μg·mL-1,差异有统计学意义(P<0.05),这表明抑制UVRAG表达可降低K562/ADM耐药性。见图3。

图2 Western Blotting检测各组细胞UVRAG蛋白表达
A:K562组; B:K562/ADM组; C: NC-K562/ADM组; D: si-UVRAG-K562/ADM,24 h组;E: si-UVRAG-K562/ADM,48 h组

图3 抑制UVRAG表达对K562/ADM细胞药物敏感性的影响
转染UVRAGsiRNA或Srcamble siRNA48 h后,不同浓度ADM作用于K562组、K562/ADM组、NC-K562/ADM组、si-UVRAG-K562/ADM组细胞48 h,CCK-8法检测各组细胞活性率,设置对照组活性100%。
2.4抑制UVRAG表达对K562/ADM细胞自噬泡的影响普通显微镜下K562/ADM细胞作为典型的白血病耐药细胞,其增殖具有一定抱团性,UVRAG siRNA转染K562/ADM细胞前后细胞形态无明显变化;MDC染色后荧光显微镜下观察到与K562组比较,K562/ADM组被MDC染上的细胞数明显较多,且每个细胞中自噬泡的数量亦较多;与K562/ADM组比较,si-UVRAG-K562/ADM组仅见到很少量被MDC染上的细胞,且每个细胞中含的自噬泡数量很少,形从态学上提示K562/ADM具有较高自噬水平,抑制UVRAG表达能可能下调K562/ADM细胞自噬水平。见图4、5。
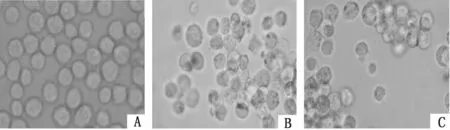
图4 光镜下观察各组细胞形态学
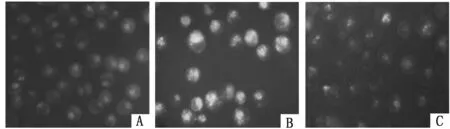
图5 MDC染色荧光显微镜观察细胞自噬泡
2.5抑制UVRAG表达对K562/ADM细胞Beclin-1、P62、P-gp蛋白表达的影响Western Blotting显示:K562/ADM组自噬标志蛋白Beclin-1、多药耐药蛋白P-gp表达及自噬底物蛋白P62降解显著高于K562组,差异有统计学意义(P均<0.05);与K562/ADM组及NC-K562/ADM组细胞比较,si-UVRAG-K562/ADM组细胞Beclin-1、P-gp表达及P62降解显著下降,差异有统计学意义(P均<0.05),K562/ADM组与NC-K562/ADM组细胞比较,两者Beclin-1、P-gp蛋白表达及P62降解差异无统计学意义(P>0.05),这些提示了K562/ADM细胞具有较高自噬水平及P-gp高表达,抑制UVRAG表达可降低自噬水平及下调P-gp表达。见图6。

图6 Western Blotting检测各组细胞Beclin-1、P62、P-gp蛋白表达
3讨论
白血病细胞MDR机制涉及膜蛋白介导的药物外排机制、药物作用靶点改变、凋亡受抑及自噬上调等各个方面[6-13]。K562/ADM细胞是具有MDR1/P-gp高表达属性的人白血病耐药细胞,是MDR机制研究的典型细胞模型[7]。
UVRAG最初是在对着色性干皮病细胞紫外线照射敏感性的基因筛查中发现的,是一个与自噬相关的肿瘤抑制基因,并且在紫外线照射导致DNA损伤修复中扮演着不可缺如的角色[8]。本研究发现UVRAG表达水平与白血病MDR有关。首先,本研究检测了K562及K562/ADM细胞中UVRAG蛋白表达水平,结果显示UVRAG在白血病K562/ADM耐药细胞中高表达,提示UVRAG可能参与了白血病MDR发生。随后采用UVRAG siRNA转染K562/ADM细胞,通过Western Blotting从蛋白表达层面检测UVRAG siRNA介导的RNA干扰能高效抑制UVRAG表达,本课题组前期通过实时荧光定量PCR从mRNA层面检测UVRAG siRNA能抑制K562细胞UVRAG mRNA表达水平[9],这说明了UVRAG siRNA能成功沉默UVRAG基因,继而发现抑制UVRAG表达可增加K562/ADM细胞对ADM的药敏性,显著降低K562/ADM细胞耐药性。上述结果表明UVRAG蛋白在K562/ADM细胞中高表达,与白血病MDR密切相关。
UVRAG如何参与白血病K562/ADM细胞MDR形成,本研究通过2个方面去探讨UVRAG参与MDR可能机制:1)Wang等[10]报道P-gp介导的MDR在肿瘤化疗抵抗中的发挥着关键作用, 抑制PI3K/Akt信号途径可逆转K562/ADM细胞P-gp介导的MDR。P-gp介导的药物外排机制是肿瘤细胞MDR一种经典机制,也是研究时间最长、最广泛的耐药机制。P-gp是由多药耐药基因1(MDR1)编码的跨膜耐药蛋白,是一种能量依赖型非特异性外排泵,可主动将药物从细胞内泵出细胞外,降低抗肿瘤药物在细胞内聚集,从而使药物的抗肿瘤效应减弱甚至消失,已证实是一种广泛存在的肿瘤细胞的耐药机制,其过表达将导致肿瘤细胞产生MDR,抑制P-gp往往能有效的逆转肿瘤细胞MDR[11]。本研究发现K562/ADM细胞P-gp表达显著多于K562细胞,抑制K562/ADM细胞UVRAG表达可下调P-gp表达,提示UVRAG参与MDR形成一个可能机制是通过影响P-gp表达来发挥作用;2)大多数相关研究已表明,自噬可促进细胞清除受损的大分子和线粒体等结构,阻断凋亡信号通路,赋予细胞应激耐受及化疗抵抗,是一种促进肿瘤细胞存活的耐药机制[3,12],K562/ADM细胞MDR与自噬增强密切相关[13]。Yang等[14]发现酪氨酸激酶抑制剂促进白血病细胞凋亡的同时可诱导保护性自噬,氯喹与TKIs共同作用于耐酪氨酸激酶抑制剂的慢性粒细胞性白血病细胞后细胞耐药性显著下降。Beclin-1蛋白是自噬活性正调节因子,参与自噬前体形成,引导自噬相关蛋白定位于自噬体膜,其表达与自噬水平正相关[15];泛肽结合蛋白P62与LC3结合,作为自噬底物,整合入自噬泡最终被溶酶体降解,抑制细胞自噬时,P62蛋白降解减少[16],因此P62、Beclin-1蛋白可作为自噬分子标志用于检测自噬水平。本研究通过MDC染色及Western Blotting检测从细胞形态学及自噬分子标志物检测上发现K562/ADM细胞具有较高自噬活性,提示自噬可能与K562/ADM细胞MDR形成有关,抑制K562/ADM细胞UVRAG表达后,细胞自噬水平也随之下降。结合上述抑制UVRAG表达可下调P-gp表达,以及Cheng等[13]报道在饥饿诱导K562/ADM自噬中,抑制自噬后K562/ADM细胞MDR1/P-gp表达也显著下降,证实了自噬参与了K562/ADM细胞MDR形成,因此UVRAG参与MDR形成的另一个可能机制是通过介导自噬来发挥作用。
本课题组前期研究[4]报道基因毒性或代谢应激可诱导肿瘤细胞自噬发生,同时上调UVRAG表达,抑制自噬能下调UVRAG表达,进一步发现UVRAG通过参与UVRAG-Beclin-1-PI3KC3复合体形成,增强Beclin-1与Vps34相互作用,促进自噬体形成[15],介导Bif-1与Beclin-1相互作用,增强PI3KC3活性,促进细胞自噬[17]。这些表明UVRAG是一个自噬正调节蛋白。此外,UVRAG也是一种抗凋亡蛋白,UVRAG可通过C2结构域与bax相互结合,抑制bax介导的凋亡发生[4]。因此下调UVRAG表达后,K562/ADM细胞自噬水平受制与Bax介导的凋亡增多是否共同促进化疗药物诱导细胞死亡有待进一步探讨。
综上所述,UVRAG蛋白在K562/ADM及K562细胞中高表达,与白血病MDR密切相关;UVRAG siRNA下调UVRAG表达可降低K562/ADM细胞耐药性,其机制可能与降低自噬水平及下调P-gp表达有关。细胞自噬与细胞膜P-gp两者都具有促瘤、促存活作用,细胞自噬水平受PI3K-I/Akt/mTOR信号通路[18]、UVRAG/ Beclin-1/PI3K-Ⅲ复合体[15]等调控,K562/ADM细胞P-gp表达受PI3K/Akt通路调控[10],两者之间存在交互作用,其机制值得进一步探讨。
参考文献:
[1]Valera ET, Scrideli CA, Queiroz RG, et al. Multiple drug resistance protein (MDR-1), multidrug resistance-related protein (MRP) and lung resistance protein (LRP) gene expression in childhood acute lymphoblastic leukemia[J]. Sao Paulo Med J, 2004,122(4):166-171.
[2]Puri P, Chandra A. Autophagy modulation as a potential therapeutic target for liver diseases[J]. J Clin Exp Hepatol, 2014,4(1):51-9.
[3]Rubinsztein DC, Codogno P, Levine B. Autophagy modulation as a potential therapeutic target for diverse diseases[J].Nat Rev Drug Discov,2012,11(9):709-730.
[4]Yin X, Cao L, Kang R, et al. UV irradiation resistance-associated gene suppresses apoptosis by interfering with BAX activation[J].EMBO Rep, 2011,12(7):727-734.
[5]Li CL, Liu HB, Zhang M, et al. Mechanism for clofarabine inducing autophagic death of acute myelocytic leukemia cell U937[J].Zhongguo Shi Yan Xue Ye Xue Za Zhi, 2013,21(2):347-350.
[6]Apetoh L, Ghiringhelli F, Tesniere A, et al. The interaction between HMGB1 and TLR4 dictates the outcome of anticancer chemotherapy and radiotherapy[J].Imm-unol Rev, 2007,220:47-59.
[7]Cheng J, Cheng L, Chen B, et al. Effect of magnetic nanoparticles of Fe3O4 and wogonin on the reversal of multidrug resistance in K562/A02 cell line[J]. Int J Nanomedicine, 2012,7:2843-2852.
[8]Yang Y, He S, Wang Q, et al. Autophagic UVRAG Promotes UV-Induced Photolesion Repair by Activation of the CRL4(DDB2) E3 Ligase[J].Mol Cell, 2016,62(4):507-519.
[9]肖艳芳, 殷小成, 彭艳辉, 等.沉默UVRAG基因在二烯丙基二硫诱导K562细胞中caspase3的表达[J].现代生物医学进展, 2015, 15(22):4268-4271.
[10]Wang H, Jia XH, Chen JR, et al. Osthole shows the potential to overcome P-glycoprotein?mediated multidrug resistance in human myelogenous leukemia K562/ADM cells by inhibiting the PI3K/Akt signaling pathway[J]. Oncol Rep, 2016,35(6):3659-3668.
[11]Kuo MT. Roles of multidrug resistance genes in breast cancer chemoresistance [J].Adv Exp Med Biol,2007,608:23-30.
[12]Hu YL, Jahangiri A, Delay M, et al. Tumor cell autophagy as an adaptive response mediating resistance to treatments such as antiangiogenic therapy [J]. Cancer Res,2012,72(17):4294-9.
[13]Cheng J, Chen J, Xie B, et al. Acquired multidrug resistance in human K562 /ADM cells is associated with enhanced autophagy[J].Toxicol Mech Methods, 2013,23(9):678-683.
[14]Yang L, Yu Y, Kang R, et al. Up-regulated autophagy by endogenous high mobility group box-1 promotes chemoresistance in leukemia cells[J].Leuk Lymphoma, 2012,53(2):315-322.
[15]Russell RC, Tian Y, Yuan H, et al. ULK1 induces autophagy by phosphorylating Beclin-1 and activating VPS34 lipid kinase[J].Nat Cell Biol, 2013,15(7):741-750.
[16]Donohue E, Balgi AD, Komatsu M, et al. Induction of Covalently Crosslinked p62 Oligomers with Reduced Binding to Polyubiquitinated Proteins by the Autophagy Inhibitor Verteporfin[J]. PLoS One, 2014,9(12):e114964.
[17]He S, Ni D, Ma B, et al. PtdIns(3)P-bound UVRAG coordinates Golgi-ER retrograde and Atg9 transport by differential interactions with the ER tether and the Beclin-1 complex[J]. Nat Cell Biol, 2013,15(10):1206-1219.
[18]Li P, Shi J, He Q, et al. Streptococcus pneumoniae induces autophagy through the inhibition of the PI3K-I/Akt/mTOR pathway and ROS hypergeneration in A549 cells [J].PLos One, 2015,10(3):e0122753.
Role of UVRAG on Autophagy and Drug Resistance in the K562/ADM Cells
Cao Qiangqiang1, Yin Xiaocheng1, Xiao Liang1, Xiao Zhengxiang2
(1.DepartmentofPediatrics,theFirstAffiliatedHospitalofUniversityofSouthChina,Hengyang421001,China;2.DepartmentofPediatrics,theCentralHospitalofXiangtan,Xiangtan411100,China)
[Abstract]ObjectiveTo investigate the role of UV radiation resistance-associated gene (UVRAG) on autophagy and drugs sensitivity by down-regulation of the expression UVRAG in K562/ADM cells.MethodsThe UVRAG protein levels were measured by Western Blotting in the K562 cells and the K562/ADM cells. Specificity siRNA and Scramble siRNA without any gene homology were designed and synthesised aiming at UVRAG gene, K562/ADM cells were transfected by LipofectamineTM2000 mediated siRNA. In different ce1ls groups, the chemotherapy sensitivity of adriamycin (ADM) were determined by CCK-8 kit, the autophagic vacuoles were observed by MDC staining and fluorescence microscope, the autophagy-related protein and P-gp protein expression were measured by Western Blotting.ResultsThe expression of UVRAG in K562/ADM cells was higher than K562 cells (P<0.05). In comparison with K562/ADM cells group and NC-K562/ADM cells group,the UVRAG protein expression level of K562/ADM cells group was obviously decreased after transfection with UVRAG siRNA(P<0.05), with 48 h working best; In comparison with K562/ADM cells group and NC-K562/ADM cells group, the sensibility of si-UVRAG-K562/ADM cells group to ADM was increased while IC50obviously decreased(P<0.05). Autophagic vacuoles in endochylema determined by MDC staining and fluorescence microscope were significantly reduced after UVRAG siRNA transfection. Further findings showed that the expression levels of Beclin-1 and P-gp and the degradation of P62 were higher than K562 cells, the expression of Beclin-1 and P-gp were significantly decreased and the degradation of P62 was reduced after inhibition expression of UVRAG gene (P all<0.05).ConclusionThe expression of UVRAG gene in K562/ADM cells was higher than K562 cells, suggesting that UVRAG may be closely involved in the multiple drug resistance in K562/ADM cells. Down-regulation of the expression UVRAG in K562/ADM cells can reduce drug resistance to chemotherapeutic adriamycin. It may be related to the down-regulation of autophagy and the expression of P-gp.
[Key words]UV radiation resistance-associated gene; K562/ADM cells; autophagy; drug resistance
基金项目:国家自然科学基金资助项目(编号:31271482)
作者简介:曹强强(1987-),男,硕士,住院医师,主要从事小儿白血病基础研究。E-mail: 1418277361@qq.com 通信作者:殷小成(1969-),男,教授,主任医师,主要从事小儿白血病基础与临床研究。E-mail:xcyin108@sina.com
DOI:10.3969/j.issn.1673-5412.2016.03.001
[中图分类号]R733.7; R730.23
[文献标识码]A
[文章编号]1673-5412(2016)03-0183-06
(收稿日期:2016-04-05)
