初中化学“酸碱盐”微型实验箱研制初步探索
2016-06-29卢再生
卢再生

【摘 要】 酸碱盐之间反应实验箱具有小巧便携、不易破碎、液体试剂在多用滴管中不易流出,反应现象明显的特点等优点,使每个学生装备自己的化学实验箱成为可能。这就为改革化学课堂教学提供了方便与可能,常规实验和微型实验相结合,两者取长补短,更好的发挥教学效果。
【关键词】 微型化学实验;复分解反应;酸碱盐之间反应实验箱
【中图分类号】G63.22 【文献标识码】A 【文章编号】2095-3089(2016)13-0-02
复分解反应是重要的四种基本化学反应类型之一,是酸、碱、盐相互反应的核心内容,是教材的重点和难点,是初中化学的核心和灵魂,同时也是初中化学教师最难教,学生最难学的章节。复分解反应之所以难教难学的原因主要有:1、酸、碱、盐相互反应的规律多;2、生成同一种物质的规律灵活多变;3、复分解反应是否能够发生对反应物和生成物都有要求;4、学习复分解反应必须首先掌握酸、碱、盐的溶解性规律。5、复分解反应的是否掌握直接影响学生对鉴别物质、物质的相互转化、除杂问题、推断物质的组成等的学习。因此如何突破对复分解反应的教学成为摆在每一个教育工作者面前的亟需解决的问题,在长期的教学实践中发现化学实验对学习、认识理解复分解反应的的定义、特点、条件、本质非常有帮助,可促使学生形成对复分解反应的系统完整的认识,能够顺利的判断复分解反应的发生,为学生学习鉴别物质、物质的相互转化、除杂问题、推断物质的组成等打下坚实的基础。
面对以上的诸多矛盾和困惑,我们尝试用微型化学实验突破对复分解反应的教学。微型化学实验在中学化学教学中的主要优点:
(1)可使绝大多数学生都有动手做实验的机会,改变过去那种"一人做、大家看"的局面;使学生由过去被动"等待"和"接受式"的学习方式,变为"主动"和"探索式"的学习方式;使多年来提倡的"启发式"、"学生为主体、教师为主导"的教学方法得以实验。
(2)极大地培养了学生学习化学的兴趣。由于微型实验既安全又节约,教师可以放心地让学生一人一组做实验。通过亲手做实验,以可帮助学生理解和形成化学概念,可以培养观察和实验能力,同时,有效地激发了学生学习化学的兴趣。学生盼着上微型化学实验课,做作业、复习或预习等,根本不用教师督促。
(3)使随堂实验、实验室分组实验、家庭小实验和课外活动实验等都得以开展。
(4)有利于培养学生既动脑又动手、理论联系实际和解决实际问题的能力。
(5)有利于培养学生关心自然、关心社会的情感和创新精神。
(6)对办学条件较差,缺少仪器药品和实验设备的农村中学,可促进了其对化学实验代用仪器药品的开发和推广。
(7)能改善实验室环境。可大幅度地减少实验室空气和水体排放污染,有益于师生的健康。由此可见微型化学实验可为我们突破对复分解反应的教学提供了可能性和必备的实验条件,成为我们突破对复分解反应教学的首选。
经过我们的多年努力,我们成功的研制酸碱盐之间反应的演示实验箱,经过使用证明具有试剂用量很少,每个学生都可以动手做,尤其是实验效果极佳。现将研制的过程总结如下:
一、药品盛装容器、反应容器和实验箱的选择
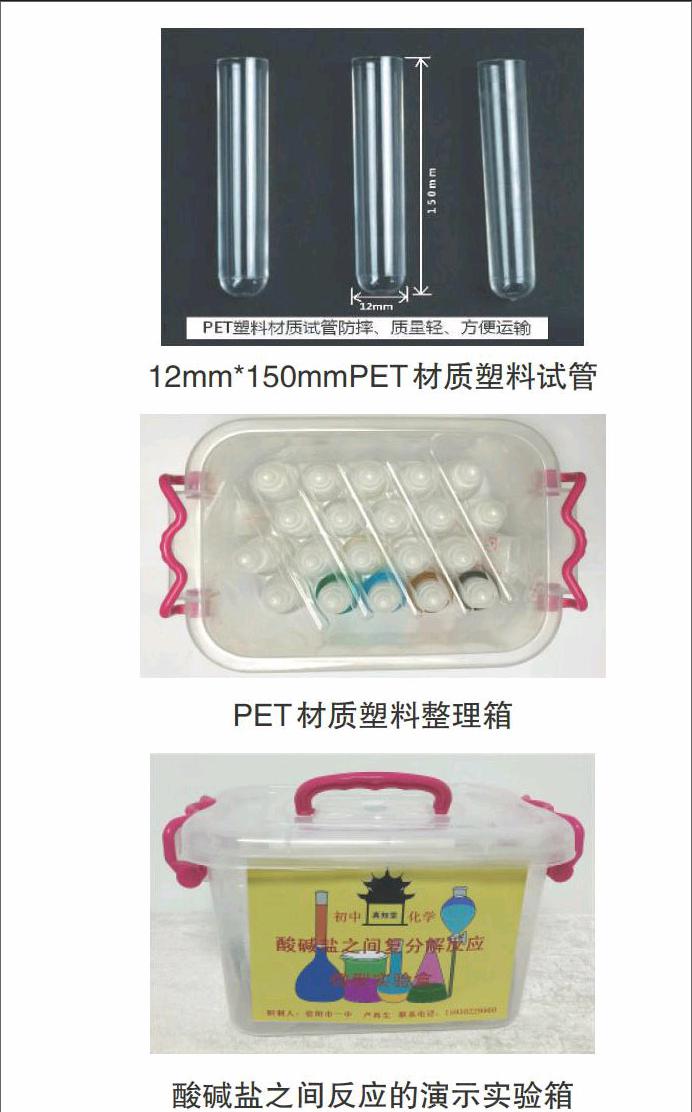
我们研制酸碱盐之间反应的演示实验箱,选用50mlPET材质塑料瓶和12mm*150mmPET材质塑料试管,PET材质塑料整理箱。PET材质塑料硬度大具有抗挤压、抗撞击、质轻的特点,可方便实验箱的运输和携带。PET材质塑料瓶设有旋转螺纹瓶口密闭性强,防渗漏;瓶内置高品质滴管精准、便捷;瓶外设有全密闭盖子可防滴管乳胶头被挤压、防药品挥发。
50mlPET材质塑料瓶
12mm*150mmPET材质塑料试管
PET材质塑料整理箱
酸碱盐之间反应的演示实验箱
二、药品的选择和实验的设计
复分解反应:由两种化合物互相交换成分,生成另外两种化合物的反应。复分解反应的本质:溶液中的离子结合成水或难溶的物质或挥发性气体,而使复分解反应趋于完成。复分解反应发生的条件:复分解反应发生的条件分反应物和生成物两方面.一方面是对反应物的要求:酸盐、酸碱一般行,盐盐、盐碱都需溶;另一方面是对生成物的要求:生成物中有沉淀析出或有气体放出或有水生成。
1、本实验盒可做实验共52个。
2、本实验盒配备药品20种,固体药品2种。液体药品:氢氧化钠溶液、氢氧化钡溶液、稀硝酸、稀硫酸、稀盐酸、酚酞试液、硝酸银溶液、氯化钠溶液、氯化钾溶液、氯化钡溶液、氯化钙溶液、氯化镁溶液、氯化铜溶液、氯化铁溶液、硫酸钠溶液、硫酸镁溶液、硫酸铜溶液、碳酸钾溶液、碳酸钠溶液、变质的氢氧化钠溶液。固体药品:碳酸钙、变质的氢氧化钙粉末样品。
酸+碱—→盐+水(本实验盒可做实验18个)
酸和碱中和反应如果无明显现象,需借助指示剂酚酞试液
经典实验1:氢氧化钠溶液与稀盐酸反应
NaOH+HCl=NaCl+H2O
经典实验2:新制氢氧化铜与稀硫酸反应
酸和碱中和反应如果有明显现象,不需借助指示剂
H2SO4+Cu(OH)2=CuSO4+2H2O,现象:蓝色沉淀溶解,溶液呈蓝色;
经典实验3:新制氢氧化铁铜与稀盐酸反应
酸和碱中和反应如果有明显现象,不需借助指示剂
Fe(OH)3+3HCl=FeCl3+3H2O现象:红褐色沉淀溶解,溶液变呈黄色;
酸+盐—→新酸+新盐(本实验盒可做实验8个)
经典实验4:稀盐酸与碳酸钠溶液反应
2HCl+Na2CO3=2NaCl+CO2↑+H2O现象:有气泡产生
经典实验5:稀盐酸与碳酸钙钠溶液反应
CaCO3+2HCl=CaCl2+H2O+CO2↑现象:有气泡产生
经典实验6:稀盐酸与硝酸银溶液反应
AgNO3+HCl=AgCl↓+HNO3现象:有不溶于稀硝酸的白色沉淀生成
经典实验7:稀硫酸与氯化钡溶液反应
H2SO4+BaCl2=2HCl+BaSO4↓现象:有不溶于稀硝酸的白色沉淀生成
盐+盐—→两种新盐(本实验盒可做实验13个)
经典实验8:氯化钠溶液与硝酸银溶液反应
AgNO3+NaCl=AgCl↓+NaNO3现象:有不溶于稀硝酸的白色沉淀生成
经典实验9:硫酸钠溶液与氯化钡溶液反应
Na2SO4+BaCl2=2NaCl+BaSO4↓现象:有不溶于稀硝酸的白色沉淀生成
经典实验10:碳酸钠溶液与氯化钡溶液反应
Na2CO3+BaCl2=2NaCl+BaCO3↓现象:有白色沉淀生成
经典实验11:碳硫酸钠溶液与氯化钙溶液反应
Na2CO3+CaCl2=2NaCl+CaCO3↓现象:有白色沉淀生成
盐+碱—→新盐+新碱(本实验盒可做实验13个)
经典实验12:氢氧化钠溶液与氯化镁溶液反应
2NaOH+MgCl2=Mg(OH)2↓+2NaCl现象:白色沉淀生成
经典实验13:氢氧化钠溶液与硫酸铜溶液反应
2NaOH+CuSO4=Na2SO4+Cu(OH)2↓现象:蓝色沉淀生成
经典实验14:氢氧化钠溶液与氯化铁钡溶液反应
FeCl3+2NaOH=Fe(OH)3↓+3NaCl现象:红褐沉淀生成
经典实验15:氢氧化钡溶液与硫酸钠溶液反应
Ba(OH)2+Na2SO4=BaSO4↓+2NaOH现象:白色沉淀生成
经典实验16:氢氧化钡溶液与碳硫酸钠溶液反应
Ba(OH)2+Na2CO3=BaCO3↓+2NaOH现象:白色沉淀生成
本实验盒可做综合实验2个
探究综合实验17:氢氧化钠溶液是否变质
探究综合实验18:氢氧化钙粉末样品是否变质程度
三、酸碱盐之间反应的演示实验箱具有以下一些特点:
1.选用50mlPET材质塑料瓶和12mm*150mmPET材质塑料试管,PET材质塑料整理箱。PET材质塑料硬度大具有抗挤压、抗撞击、质轻的特点,可方便实验箱的运输和携带。PET材质塑料瓶设有旋转螺纹瓶口密闭性强,防渗漏;瓶内置高品质滴管精准、便捷;瓶外设有全密闭盖子可防滴管乳胶头被挤压、防药品挥发。
2.该实验箱实验效果极佳,对学生认识理解复分解反应的的定义、特点、条件、本质非常有帮助,可促使学生形成对复分解反应的系统完整的认识,能够顺利的判断复分解反应的发生,为学生学习鉴别物质、物质的相互转化、除杂问题、推断物质的组成等打下坚实的基础。
3..该实验箱的试剂用量比常规实验节省90%,且采用代用品作实验,在仪器上花费也很少,故可大大节省了实验经费。
4.该实验箱,具有仪器简单、用剂量少、反应速率快、现象明显的特点。所以,该实验箱能节省实验时间,提高课堂教学的质量。
5.该实验箱可以做到人手一套。教学中,教师只要积极引导,就能实现人人动手的目标。学生通过自制仪器和动手做实验,既训练了动手能力,培养了创新思维,大大地激发了学生进行化学实验的兴趣。
6.该实验箱对办学条件较差,缺少仪器药品和实验设备的农村中学开展化学实验有重大的推广和应用价值。
主要参考文献:
[1]基础教育课程改革纲要(试行).中国教育报,2001年7月27日第2版
[2]贺梅.中学化学微型化实验研究[D].长春:长春师范学院,2011
[3]臧春涛.基础教育课程改革背景下的微型化学实验研究[D].南京:南京师范大学,2004
