信阳市斑点叉尾鮰爆发性疾病病原的分离鉴定
2016-06-28林伟信阳农林学院水产学院河南信阳464000
林伟(信阳农林学院水产学院,河南信阳464000)
信阳市斑点叉尾鮰爆发性疾病病原的分离鉴定
林伟(信阳农林学院水产学院,河南信阳464000)
通过对患病斑点叉尾鮰进行细菌分离鉴定,发现信阳市某养殖场的斑点叉尾鮰爆发性疾病病原为维氏气单胞菌,菌株对庆大霉素、美福仙和卡那霉素敏感,对强力霉素、四环素等9种药物不敏感。
斑点叉尾鮰;维氏气单胞菌;爆发性;致病菌
斑点叉尾鮰,属于鲶形目科,原产美国,是美国最主要的淡水养殖和食用鱼类。肉质鲜美,营养价值高,具有很好的降血脂、健脑益智、补肾明目、减肥抗衰老、增强免疫力功能。生长快,易捕捞,养殖经济效益高,深受养殖者和消费者的喜爱,斑点叉尾鮰成鱼抗病力强,较少患病,但苗种阶段易感染细菌性、病毒性、寄生虫类疾病及其它并发症[1],导致大量死亡,每年给斑点叉尾鮰殖户造成巨大损失。
2014年7月,河南省信阳市某养殖户水泥培育池一批孵化出膜6-7d的斑点叉尾鮰稚鱼出现爆发性死亡。对养殖水体进行检测,水质并无异常。患病斑点叉尾鮰主要症状为不摄食、头部出血、腹部肿胀有腹水、肝脏出血。同时,该养殖场稍大规格鱼苗也出现类似症状,但死亡率较这批小规格鱼苗低。由于发病快、死亡率高,造成很大损失。本研究对发病斑点叉尾鮰稚鱼进行常规临床诊断、细菌分离鉴定、动物回归感染试验、药物敏感性试验等一系列方法,确定此次爆发性死亡的斑点叉尾鮰稚鱼病原为维氏气单胞菌,为科学防治斑点叉尾鮰鱼种培养期爆发性疾病提供指导依据。
1 材料及方法
1.1 材料
患病斑点叉尾鮰稚鱼于2014年7月27日采自信阳市某养殖户水泥培育池,体长12-25mm。健康斑点叉尾鮰体重为(120±5)g,购自河南省信阳市水产品贸易市场。普通肉汤、营养琼脂平板、LB平板、LB肉汤、MH肉汤、鲜血平板等按常规方法制备。标准药敏试纸和微量生化试管购自杭州微生物试剂有限公司。
1.2 临床诊断
观察病鱼体表症状,在解剖显微镜下观察送检鱼的体表及内脏器官,拍照记录。
1.3 病原菌分离鉴定
选取有明显发病症状的病鱼,无菌条件下在解剖显微镜下进行操作:送检鱼体表消毒后用手术剪将头部和躯干部分离,使用解剖针将鳃和肠道去掉;用灭菌生理盐水分别清洗头部和躯干部,再用75%酒精浸泡30s;用镊子将头部、躯干部分别放入加有适量灭菌生理盐水的灭菌离心管中,将组织匀浆后2000r/min离心2min,取上清液涂布接种至LB平板置28℃培养24h。
挑取优势菌单菌落接种至LB平板,28℃培养24h后以革兰氏染色法检验菌落纯度,纯化后的细菌石蜡封存于LB斜面,4℃冰箱保存备用。
取单菌落,划线接种于LB琼脂平板,28℃培养24h。用接种环挑取单菌落,进行革兰氏染色,使用油镜观察细菌形态,并拍照记录。参照《常见细菌系统鉴定手册》进行病原菌相关生理生化鉴定。
1.4 动物回归感染试验
试验方法参照房海等和Wise等的方法[2-3]进行,用接种环挑取已纯化菌株,接种于LB肉汤中,28℃振荡培养24h,菌液用灭菌生理盐水稀释至7.0× 107cfu/mL。将健康的斑点叉尾鮰分为3组,每组5尾,其中1组作为对照组,饲养1周无异常后进行试验。试验组腹腔注射菌液,剂量为0.3mL/尾,注射两组,对照组每尾腹腔注射等量的灭菌生理盐水,注射后饲养于水温约25℃的水族箱,试验期间连续曝气,观察7d,每天记录试验鱼症状和死亡数,并进行死鱼的细菌分离鉴定。
1.5 细菌药物敏感性试验
采用Kirby—Bauer纸片法对常用药物进行敏感性试验,试验参照管远志[4]等的方法进行。用游标卡尺量取抑菌圈直径,并根据CLSI相关标准判定结果。
2 结果
2.1 临床诊断结果
部分斑点叉尾鮰在水中游动失衡,少量在水中串游或者挣扎状游动;部分病鱼可见尾鳍及其它鳍条末端发白、缺损。病鱼内脏器官发红、出血,腹部膨大、有腹水,头部有出血现象,肠道未见有明显变化。2.2 细菌分离鉴定结果
2.2.1 菌株菌落形态及革兰氏染色结果
分离的两株细菌均为革兰氏阴性菌,近似椭圆状,菌落边缘整齐,表面光滑,乳白色,呈半透明,菌落直径0.6-3mm。
2.2.2 病原菌生理生化鉴定结果
用生化鉴定管测定分离菌株的生化特性,结果显示:氧化酶、鸟氨酸脱羧酶、氨基酸脱羧酶试验阳性;精氨酸双水解酶、乙酰胺酶、苯丙氨酸脱氨酶试验阴性;西蒙氏枸橼酸盐、七叶苷、吲哚阳性;氰化钾、肌醇、水杨素、丙二酸盐、卫茅醇阴性;产甘露糖、半乳糖和麦芽糖;不产蔗糖、果糖、鼠李糖和硫化氢。根据该结果在《常见细菌系统鉴定手册》中查找,发现与维氏气单胞菌生化特性较为一致,初步断定分离菌株为维氏气单胞菌。
2.2.3 动物回归感染试验结果
人工感染后连续观察7d,分离菌死亡率达90%,发病鱼表现出与自然发病相似症状,主要为鳍条基部充血,鳍条末端腐烂,体表出血,腹部肿大,有腹水,肝脏肿大充血。对病鱼无菌操作分离得到优势菌落,经细菌学鉴定为维氏气单胞菌,可确定维氏气单胞菌为致病菌。
2.2.4 药物敏感性试验
分离的维氏气单胞菌对常见12种抗生素的药物敏感试验结果见表1,试验结果显示,所分离菌株对庆大霉素、卡那霉素、美福仙敏感、强力霉素、四环素、氟哌酸等9种药物耐药。
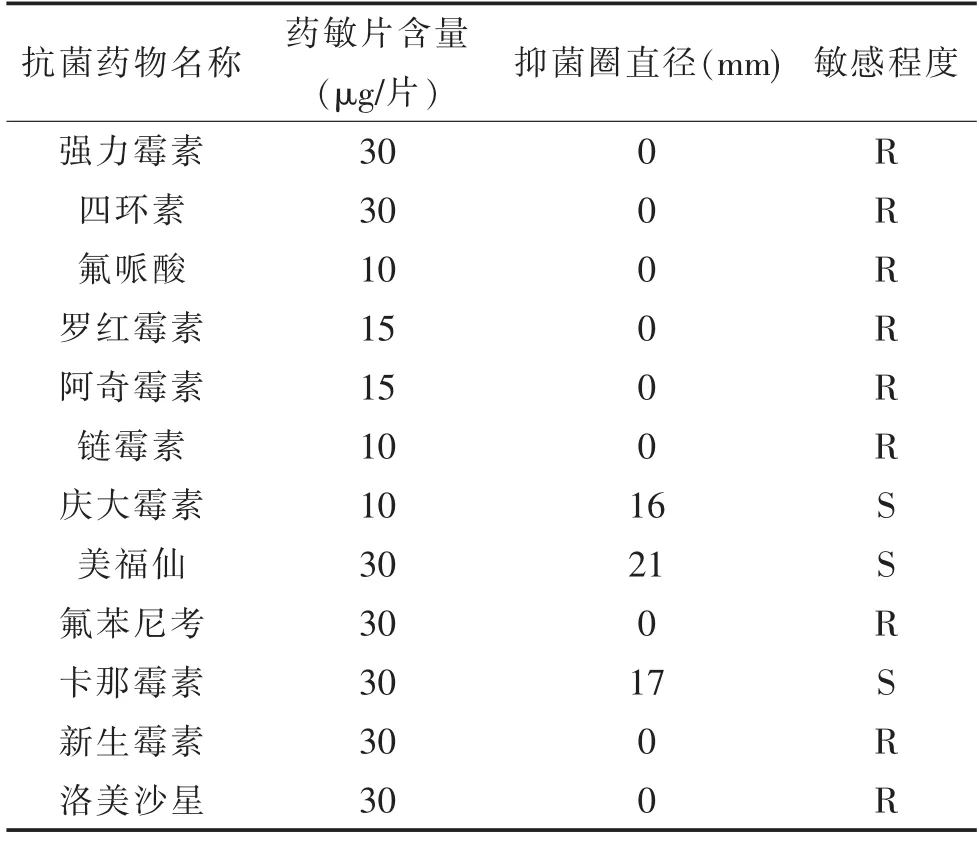
表1 分离菌株药物敏感性试验结果
3 讨论
随着斑点叉尾鮰养殖面积的扩大,密度的提高以及药物的滥用,疾病的发生也越来越多,制约斑点叉尾鮰养殖业的发展。本研究在病鱼身上分离出了致病性的维氏气单胞菌,表明这批稚鱼感染了维氏气单胞菌。维氏气单胞菌是一种人畜共患条件致病菌,并能感染多种鱼类,包括罗非鱼、日本鳗鲡、南方大口鲶等,给水产养殖造成严重经济损失[5-6]。12种常用药物药敏试验结果显示分离出的菌株对庆大霉素、卡那霉素和美福仙敏感,可以采用内服敏感药物,同时外用消毒药物相结合的方法进行治疗,但对链霉素、氟哌酸、四环素等耐药。为确保养殖水产品的食品安全,我国将红霉素、氯霉素、环丙沙星、杆菌肽锌和泰乐菌素等抗生素列为水产违禁药品 (中华人民共和国农业行业标准NY5071—2002)。因此要有针对性的使用敏感药物进行维氏气单胞菌感染的防治,也要严格遵守有关食品安全法规。
此次斑点叉尾鮰稚鱼爆发性死亡率高,病程短,未能及时得出致病阶段的环境因子作用、致病病原详细的生物特性,及致病菌潜伏期和爆发期的监测。因此维氏气单胞菌物理、生物特性及与环境变化的关系有待进一步研究,以期为维氏气单胞菌引起的鱼病防治提供参考依据。
[1]夏春.水产动物疾病学[M].北京:中国农业大学出版社,2004:102-103.
[2]房海,陈翠珍,张晓君.水产养殖动物病原细菌学[M].北京:中国农业出版社,2010:147-150.
[3]Wise J A,Harrell S F,Busch R L,et a1.Vertical transm -ission of channel catfish virus[J].Am J Vet Res,1988, 49(9):1506-1509.
[4]管远志,王艾琳,李坚.医学微生物学实验技术[M].北京:化学工业出版社,2006:111.
[5]黎炯,叶星,卢迈新,等.罗非鱼维氏气单胞菌的分离鉴定和药敏试验[J].水生态学杂志,2011,32(3): 132-136.
[6]杨求华,郭松林,关瑞章,等.鳗鲡病原性维氏气单胞菌的分离与鉴定[J].生物技术通报,2012,28(7): 134-139.
Isolation and identification of pathogenic bacteriumAeromonas veronii from channel catfish(Letalurus punetaus)in Xinyang City
Lin Wei
(Fisheries Science Department,Xinyang College of Agriculture and forestry,Xinyang 464000,Henan,China)
Isolation ofAeromonas veroniiwas isolated from affected channel catfish in Xinyang City during an outbreak in 2014.According to the morphology,biochemistry and agglutination test,the strain was identified to be kanamycin.By sensitivity testing to antibiotics,the results showed that itwas hypersensitive to gentamicin, kanamycin,mefoxin,but resistant to 9 antibiotics including doxycycline and tetracycline.
channel catfish;Aeromonas veronii;paroxysmal;pathogenicity
河南省现代农业产业技术体系建设专项资金资助(S-2014-10-G01)
林伟(1980-),男,汉族,讲师,硕士,研究方向为鱼类养殖、观赏鱼业、鱼病防治,E-mail:linwei0924@sohu.com
